需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用 3D 血管造影量化体内绵羊模型中的下腔静脉顺应性和扩张性
* 这些作者具有相同的贡献
摘要
该方案允许使用导管插入术和 3D 血管造影作为生存程序对静脉顺应性和扩张性进行 体内 量化,从而允许各种潜在应用。
摘要
合成血管移植物克服了同种异体移植物、自体移植物和异种移植物的一些挑战,但通常比植入它们的天然血管更坚硬且顺应性更差。与原生血管的合规性匹配正在成为移植成功的关键属性。目前评估船舶合规性的黄金标准涉及船舶切除和 离体 双轴机械测试。我们开发了一种 体内 方法来评估静脉顺应性和扩张性,该方法更好地反映了自然生理学,并考虑了由流血和存在的任何形态变化引起的压力变化的影响。
这种方法被设计为一种生存程序,便于纵向研究,同时可能减少对动物的使用需求。我们的方法包括将 20 mL/kg 生理盐水推注到静脉脉管系统中,然后采集推注前后的 3D 血管造影,以观察推注诱导的变化,同时在目标区域进行血管内压测量。然后,我们能够测量推注前后血管的周长和横截面积。
凭借这些数据和血管内压,我们能够计算出特定方程的顺应性和扩张性。该方法用于比较天然未手术绵羊与植入长期膨化聚四氟乙烯 (PTFE) 移植物的绵羊导管的下腔静脉的顺应性和扩张性。发现天然血管在所有测量位置都比 PTFE 移植物更顺应和可伸展。我们得出结论,这种方法安全地提供了静脉顺应性和扩张性的 体内 测量。
引言
患有严重心脏畸形的患者需要重建手术。大多数重建手术需要使用假体材料,包括血管移植物。弥合这一领域的潜在渠道包括合成或生物材料。最初,同种移植物被用作 Fontan 导管,但由于钙化和急性期事件的高发生率而被放弃1。目前,使用源自无机聚合物的合成血管移植物。仍然存在一个挑战,即这些移植物的顺应性不如植入它们的天然血管,并且具有长期并发症,例如狭窄、闭塞和钙化 1,2,3,4,5。
合成血管移植物的结构使其具有机械抗拉强度,导致与天然组织相比,它们的顺应性总是较低2。血管顺应性定义了血管体积随压力变化的变化,是血管对机械负荷反应性的指标。移植物材料和天然血管特性之间的差异会产生顺应性不匹配,这已被证明会破坏血流模式,导致再循环和血流分离区域 2,6,7,8,9。这种现象改变了内皮壁上的剪切应力并诱导内膜增生 2,7,8,9。这种反应可导致与移植物相关的并发症,需要移植物更换或再次干预6。
由于血管顺应性在决定移植物结果方面起着关键作用,因此准确测量这一特性至关重要。目前测量血管顺应性的黄金标准是 离体 管状双轴力学测试。该方法包括切除感兴趣的移植物或血管,将其连接到乳胶管,并对其进行加压以评估各种压力下的圆周应力-拉伸行为。通过将压力与内径10 的测量值进行比较来确定柔度。然而, 离体 方法有一些缺点。当使用 离体 方法评估植入移植物的功能时,牺牲动物并移植物是必要的,因此无法进行长时间的检查。因此,我们开发了一种 体内 顺应性测量方案。
我们小组专注于开发组织工程血管移植物 (TEVG),用于 Fontan 手术,以改善先天性心脏缺陷左心发育不良综合征 (HLHS)。先天性心脏手术领域的最新发展改善了术后结局,从而延长了预期寿命。这使得植入血管导管的长期特性和成功变得越来越重要。目前,尚不存在 HLHS 的动物模型,因此我们在加速的大型动物下腔静脉 (IVC) 插入移植模型中评估我们的移植物。虽然该模型并不试图创建 Fontan 环流的流动,但它有效地概括了独特的血流动力学条件。我们最近使用这种 体内方案 表明,我们的 TEVG 和传统的发泡聚四氟乙烯 (PTFE) 接枝物之间的接枝顺应性存在显着差异11。由于之前的研究并不关注方法,因此我们进行了额外的实验来详细介绍这种新颖 的体内方法 。
我们将目前作为护理标准的合成移植物植入多塞特绵羊研究动物中,该移植物由发泡聚四氟乙烯 (PTFE) 组成,并将其与手术初治对照动物的天然 IVC 进行了比较。该方案是在 PTFE 导管植入后 5-7 年的 PTFE 组和不同年龄的未手术对照动物上进行的。因此,在描述方案和代表性结果的后续部分中,我们偶尔会将感兴趣的区域称为,例如,IVC 插入移植物的移植物(中移植物)区域的中间。
该协议使我们能够分析 PTFE 导管的体内柔顺性,已知在长期时间点不合规,与天然静脉。我们选择将临床标准材料 PTFE 与天然未手术静脉进行比较。我们选择了一个长期时间点,因为已知 PTFE 导管仍然不合规并且容易钙化,从而进一步降低其柔顺性11。我们选择在体内进行所有比较,因为全身血流动力学变化准确反映在通过体内方法获得的测量值中。从这种比较中,我们发现该方案能够确认 PTFE 的不合规性,并以安全和可重复的方式获得体内静脉柔顺性的测量。该方法已在一项已发表的研究中成功实施,以证明 PTFE 导管和组织工程血管移植物 (TEVG) 在体内具有统计学意义 11 差异。
该方案的总体目标是使用存活程序的 体内 测量来计算绵羊大型动物模型中胸部 IVC 的顺应性和扩张性。为此,我们可视化并测量了胸腔静脉周长和横截面积对液体推注的变化。我们同时测量了血管内压力的变化,并使用这些测量值来计算顺应性和扩张性。使用 3D 血管造影成像为我们带来了多种优势,包括能够在捕获后调整图像视图,以确保我们的测量是从静脉的横截面进行的,以及允许我们测量沿血管的多个位置。本研究中感兴趣的三个区域是中移植区域,以及 PTFE 移植物的两个相邻吻合部位,以及天然 IVC 中的类似区域。通过进行 体内实验,在评估移植物在实际血液流动中并被组织和器官包围的功能方面具有优势。通过这种方法获得的测量值被认为反映了生物体中移植物的实际功能。
该方案分为六个主要部分,包括绵羊的术前准备、导管插入术、基线推注前数据的收集、研究数据的收集、动物恢复和数据分析。在动物准备部分,我们讨论了镇静、开始麻醉以及导管插入术中使用的监测设备的放置。在第二部分中,我们解释了放置数据采集所需的两个导管护套的过程。对于该方案,两个护套都放置在右颈内静脉 (IJV) 中,以允许将两个多轨导管引入血管。一个将放置在感兴趣区域以记录压力变化,另一个将放置在静脉的较低位置以进行造影剂注射。放置导管后,进行基线推注前 3D 血管造影进行比较。研究数据收集从在加压袋系统中准备生理盐水推注进行给药开始,为生理盐水推注提供记录血管内压,并进行推注后 3D 血管造影。然后,我们描述了在协议后促进绵羊恢复的过程。最后,我们讨论了获得正确图像和横截面测量值以进行分析和统计比较的方法。
Access restricted. Please log in or start a trial to view this content.
研究方案
该研究方案得到了全国儿童医院 Abigail Wexner 研究所 (AR22-0004) 机构动物护理和使用委员会的批准。所有动物都按照美国国立卫生研究院出版的《实验动物护理和使用指南》接受了人道照顾。
1. 动物准备
- 在导管插入术前 1 周让兽医团队对绵羊进行评估,包括体格检查和生命体征分析,以确保动物能够安全地接受麻醉。
- 将动物禁食过夜,或在手术前 12 小时,以限制麻醉诱导后吸入胃内容物的风险。
- 按下 控制面板 上的打开按钮以打开 C 臂和 3D 血管造影系统(图 1A)。等待系统完全加载。
注意:确保透视暂停,直到准备好成像并且所有人员都佩戴了保护导线。 - 向 1 mL 0.9% 生理盐水中加入 1 mL 肝素(1,000 USP 单位/mL 浓度)中,制备用于手术的肝素化盐水。
- 剃掉左侧脖子,用酒精擦洗。通过将氯胺酮 (4 mg/kg)、布托啡诺 (0.1 mg/kg) 和地西泮 (0.5 mg/kg) 的组合注射到左颈静脉中来施用镇静剂。
- 将镇静的绵羊放在医院病床上,并将其置于胸骨卧位进行插管。根据绵羊的大小,用 9-14 毫米气管插管 (ET) 插管,用喉镜压下舌头和会厌,然后将 ET 管插入气管。
- 将绵羊置于右侧位置。将 ET 管连接到呼吸机上,并以 100-100% 的 3 L/min 速度进行机械通气。
- 用 1-3% 吸入异氟醚维持麻醉。将呼吸频率设置为 15-30 次呼吸/分钟,呼气末量为 8-10 mL/kg。
- 放置标准监测设备,包括右前腿上的血压袖带、右耳上用于监测氧饱和度的耳夹、食管温度探头和 ET 管上的呼气末 CO2 监测仪。从露爪和脚跟之间的每只蹄子的尾部刮羊毛。放置心电图 (ECG) 节点并用胶带固定 ECG 节点。
- 通过涂抹眼药膏润滑双眼,并插入口胃管以确保气体和食物排出。
- 在左侧 IJV 中建立一条静脉输注管,以允许给予异丙酚恒定速率输注 (CRI) (20-40 mg∙kg-1∙h-1)、维持液 (10 mL∙kg-1∙h-1) 和生理盐水推注。
- 将绵羊置于左侧卧位。剃掉颈部的右侧以进入导管插入部位(图 2A)。用洗必泰磨砂膏和酒精擦拭该区域。
- 断开与监测设备和呼吸机的连接,将绵羊移至导管室检查台。再次,将动物置于左侧卧位(图 3A)。
- 重新连接呼吸机和监测设备(心电图导联、温度探头、血压袖带、脉搏血氧仪)。
- 通过施用吸入的 1-3% 异氟醚和 100% O2 和/或异丙酚 CRI (20-40 mg∙kg-1∙h-1) 在手术过程中保持麻醉。
注意:通过测量动物运动、对疼痛刺激的反应、呼吸频率、脉搏率和血压来评估麻醉平面。酌情调整镇静剂,例如使用 5-10 mL 异丙酚推注以诱导更深的麻醉平面。 - 使用大卡尺测量绵羊在心脏区域的宽度。将宽度除以 2 以设置压力传感器。
- 无菌清洁手术部位并以无菌方式覆盖(图 2B、C)。
2. 导管插入术
- 将 C 形臂从停放位置移动到羊的胸部,并根据需要抬高桌子。按下控制面板上的按钮 7 和 3,然后按住开始按钮,使用预编程的设置自动定位工作台和 C 形臂在工作台左侧(图 1A)。
- 使用 21 G 微型穿刺针和 10 cc 鲁尔滑针注射器进入右侧 IJV;通过皮肤沿颅/尾方向接触 IJV,同时向后拉注射器柱塞。确保抽吸血液以确认针头在血管中(图 2A、B)。
- 小心地断开注射器,同时保持针头稳定。
- 将 0.018 英寸不锈钢 (SS) 导丝器穿过针头插入容器,大约一半。从 SS 线上拔下针。
- 将 5-French (Fr) 扩张器放在 SS 丝上并放入容器中。拆下扩张器的内件和 SS 线。将 0.038 英寸导丝穿过扩张器送入血管中约一半,然后取下扩张器。
- 使用 11 刀片手术刀切开金属丝进入的静脉上方的皮肤。将 9-Fr 护套穿过导丝并送入血管中。拆下内护套部分和导丝。
- 通过抽吸血液,然后用肝素化盐水冲洗护套来确认护套位置正确。
- 重复步骤 2.2-2.7,使右侧 IJV 中有两个 9-Fr 护套。
- 通过 IV 给药 150 U/kg 肝素以防止凝血。
- 使用脚踏板开始透视(图 1B)。将 Judkins 右 (JR) 导管穿过护套,沿着胸腔静脉穿过隔膜进入腹部下腔静脉。
- 将 Rosen 钢丝穿过 JR 导管,直到它到达腹部下腔,尖端从 JR 导管中伸出。在将 Rosen 线固定到位的同时,轻轻取出 JR 导管。
- 对第二个护套重复步骤 2.10-2.11。
- 在每根 Rosen 导线上穿一根 7-Fr Multitrack 导管。
- 在透视引导下,在腹部 IVC 中放置一根多轨血管造影导管进行造影剂注射。
- 使用透视,将另一根多轨血管造影导管放入特定感兴趣区域(例如,移植物的中心)进行压力测量(图 2C)。

图 1:控制面板。(A) 3D 血管造影系统控制面板 (B) 透视脚踏板 请单击此处查看此图的较大版本。
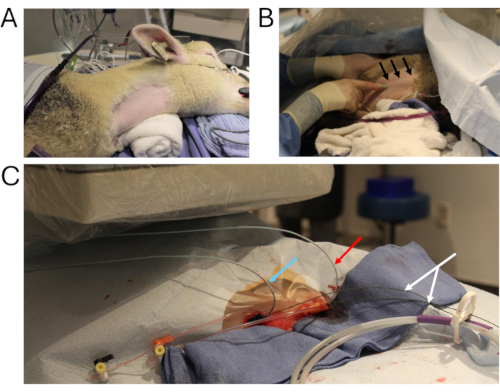
图 2:动物导管插入术。 (A) 关键手术部位,为导管插入术做准备。(B) 可视化右颈内静脉的技术(黑色箭头)。(C) 通过右颈内静脉放置两根多轨血管造影导管(蓝色箭头:移植物中的压力测量;红色箭头:造影剂注射到腹部 IVC;白色箭头:硬丝)。缩写:IVC = 下腔静脉。 请单击此处查看此图的较大版本。
3. 收集 predata
- 使用三通旋塞阀将以感兴趣区域为中心的多轨连接到压力传感器。在旋塞阀打开到多轨的情况下,用 10 mL 注射器向后拉,直到去除气泡并看到血液。
- 将 10 mL 注射器倒置,小心将血液返回给绵羊,不要将任何空气推回多轨。用肝素化盐水冲洗多轨。
- 将旋塞阀的关闭位置翻转到注射器上,使压力传感器和多轨相互打开。
- 通过添加造影剂来准备造影剂注射器。3D 血管造影的最小体积为 60 mL,总造影剂不能超过 5 mL/kg 或 250 mL。
- 将造影剂注射器连接到以腹部 IVC 为中心的多轨。使用造影剂注射器,逆时针缓慢转动旋钮,从多轨中拉出气泡,直到看到血液。顺时针转动旋钮,将对比度缓慢向前推入多轨。
- 使用透视确认造影剂何时到达多轨尖端。
- 取用于 3D 血管造影的总造影剂,然后除以 5 得到 mL/s。将速率上升设置为 0 和 600 psi。
- 通过单击屏幕右上角的 "程序 "按钮和 3D DSA 110 8 英寸 按钮(SID 为 110 厘米且视野为 8 英寸的 3D 血管造影),将 C 型臂设置为预编程模式。
- 将所有对象和人员从桌子的正面或侧面移开。通过单击控制面板上编号为 3 的按钮启动 C 型臂程序。将目标区域(例如,中移植物)定位在 xy 平面的中心(图 3A-C)。
- 单击控制面板上编号为 4 的按钮,进入第二个程序。相应地调整表格的高度,使感兴趣区域居中。
- 按下编号为 5 的按钮并拍摄测试图像。
- 通过单击 Confirm Conditions 按钮 |开始(图 3D,E)。
- 让麻醉师保持通气,并通过使用 中间采集踏板启动程序来进行 3D 旋转血管造影和造影剂注射。同时测量并记录目标区域的平均压力。
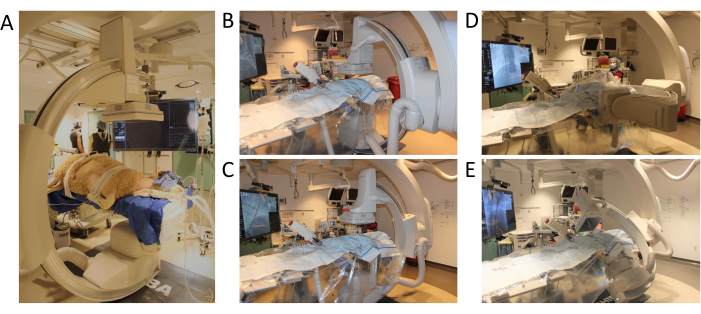
图 3:C 臂定位和运动范围。 (A) 手术开始时的绵羊定位 (B) 3D 血管造影程序的第一个位置 (C) C 臂沿 xy 轴移动 (D) C 臂沿 z 轴移动 (E) C 臂以全范围运动完成测试旋转。 请单击此处查看此图的较大版本。
4. 给予生理盐水推注并收集数据
- 制备 20 mL/kg 的 0.9% 生理盐水。
- 要制备推注加压袋,请将 1,000 mL 的 0.9% 盐水袋添加到加压袋装置中。如有必要,使用第二个单位以达到要给药的总体积。
- 挤压充气球,直到压力表上升到红线(压力 250-300 mmHg)之前的绿色区域。通过管线冲洗盐水并去除气泡。
- 将加压盐水袋连接到 9-Fr 护套并保持 250-300 mmHg 以保持推注速度恒定。让它流动,直到绵羊接受相当于 20 mL/kg 的推注或平均压力达到 15 mmHg。
- 当推注流动时,每分钟记录目标区域的血管内压。
- 通过重复步骤 3.9-3.12,让 C 臂准备好进行第二次 3D 旋转血管造影。一旦推注结束,在压力开始下降之前,按照步骤 3.13 中的说明开始进行第二次 3D 血管造影和同时进行血管内压测量。
5. 恢复
- 成像完成后,输入数字 77 并按住 "开始 "按钮,直到 C 臂自行定位,将 C 型臂放回预编程的停放位置。
- 拆下多轨血管造影导管和 Rosen 钢丝。
- 取下两个护套,同时用止血贴在插入部位直接加压至少 7 分钟以止血。
- 在贴片和颈部缠绕一卷无菌纱布,使包裹物牢固以保持压力,但不要太紧,以免切断血液循环或妨碍呼吸。
- 关闭麻醉剂(异氟醚和/或异丙酚 CRI)。
- 让绵羊使用呼吸机,保持 100% O2 ,直到它们持续自主呼吸。
注意:绵羊醒来的迹象包括运动、眨眼、对疼痛刺激的反应、下巴张力或咀嚼尝试,以及在没有呼吸机帮助的情况下呼吸。 - 一旦绵羊能够自行呼吸,拔除(移除 ET 管)并取出口胃管。
- 移除所有监测设备,将绵羊转移到医院病床上。把它移回住房房间。
- 帮助绵羊保持胸骨卧位或尝试站立,直到绵羊能够自己保持平衡。防止他们撞墙。
- 一旦它们看起来足够清醒,就给它们少量的干草或谷物。
6. 数据分析
- 从血管造影成像软件中以 DICOM 文件格式导出原始 3D 血管造影数据。
- 启动 DICOM 查看器软件。将 3D 血管造影文件拖放到查看器中以打开(图 4A)。
- 在 DICOM 查看器软件中,选择 3D MPR(多平面重建)工具 以生成血管造影数据的 3D 重建视图。这将从三个不同的角度呈现三个不同的 2D 视图:轴向、矢状面(图 4B)和冠状面(图 4C)。
- 通过将目标区域放置在中心并使用手动工具旋转每个平面上参考线的方向,调整目标区域在矢状面和冠状面中的位置和方向,以实现所需的垂直位置(图 4D)。
- 利用 DICOM 查看器中的铅笔工具在目标区域的轴向视图中勾勒出血管壁的轮廓(图 4E)。软件会自动计算并显示轴向视图中间区域的面积和周长(周长)。
- 利用等式 (1) 计算柔度,其中 A 是横截面积 (cm2),P 是压力 (mmHg):
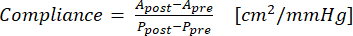 (1)
(1) - 使用公式 (2) 计算膨胀率,其中 C 是周长 (cm),P 是压力 (mmHg):
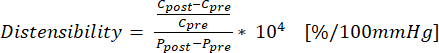 (2)
(2)
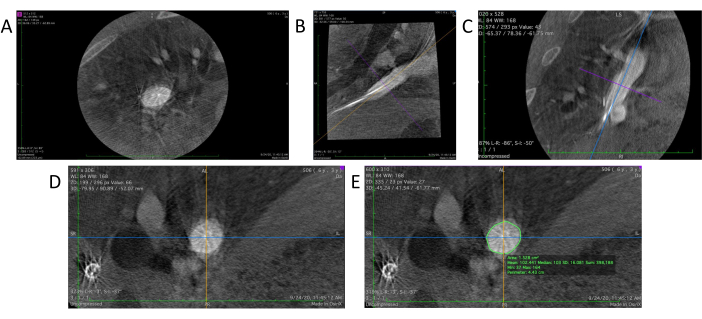
图 4:DICOM 查看器中的数据分析。 (A) 加载到 DICOM 查看器中的 3D 血管造影的原始数据。(B) 移植物的矢状部分。(C) 冠状切片。(D) 调整矢状面和冠状面的角度后,可以看到真实的横截面。(E) 使用铅笔工具勾勒出目标血管的轮廓,以进行周长和横截面积测量。 请单击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
结果
我们已经成功地对超过 25 只绵羊进行了这项手术。重要的是,没有与该手术相关的发病率和死亡率实例。所有的羊都表现出简单的恢复。这些代表性结果取自三只植入 PTFE 移植物的绵羊和三只未手术的本地绵羊。 图 5 提供了在方案期间从两组研究动物采集的血管内压测量值。这些值对于顺应性和扩张性计算很重要,但也证明了该方案的安全性,因为我们将血管内压的变化?...
Access restricted. Please log in or start a trial to view this content.
讨论
顺应性和扩张性是血管功能的关键特性,是潜在并发症和干预措施的指标。精确量化和比较这些参数的变化对于评估移植物疗效非常重要。我们的 体内方法 克服了 离体 分析的局限性并保持了可比的结果。将我们的 体内 数据与 Blum 等人提供的 离体 数据进行比较,两种方法都表明感兴趣的合成接枝材料和天然静脉之间存在显着差异10。我们的统计显着...
Access restricted. Please log in or start a trial to view this content.
披露声明
这项研究部分由 Gunze Ltd. 赞助。
致谢
这项工作得到了 R01 HL163065 和 W81XWH1810518 的支持。我们感谢动物研究核心的敬业工作人员。我们还要感谢 Carmen Arsuaga 在整个研究过程中提供的宝贵专业知识和警惕的照顾。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
参考文献
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3(2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187(2024).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。