A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כימות תאימות ויכולת הרחבה של Vena Cava נחותה במודל שחלות in vivo באמצעות אנגיוגרפיה תלת-ממדית
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מאפשר כימות in vivo של ציות ורידי ויכולת הרחבה באמצעות צנתור ואנגיוגרפיה תלת ממדית כהליך הישרדות המאפשר מגוון יישומים פוטנציאליים.
Abstract
שתלי כלי דם סינתטיים מתגברים על כמה אתגרים של allografts, autografts, ו xenografts, אבל הם לעתים קרובות נוקשים יותר פחות תואם מאשר כלי הדם המקורי שבו הם מושתלים. התאמת תאימות עם כלי השיט המקורי מסתמנת כמאפיין מפתח להצלחת השתל. תקן הזהב הנוכחי להערכת תאימות כלי השיט כולל כריתה של כלי השיט ובדיקה מכנית דו-צדדית ex vivo . פיתחנו שיטת in vivo להערכת היענות ורידים והתפשטות המשקפת טוב יותר את הפיזיולוגיה הטבעית ולוקחת בחשבון את ההשפעה של שינוי לחץ הנגרם על ידי זרימת דם ועל ידי כל שינוי מורפולוגי קיים.
שיטה זו מתוכננת כהליך הישרדותי, המאפשר מחקרי אורך תוך הפחתת הצורך בשימוש בבעלי חיים. השיטה שלנו כוללת הזרקת בולוס מלח 20 מ"ל / ק"ג לתוך כלי הדם הוורידים, ולאחר מכן רכישת אנגיוגרמות תלת ממדיות לפני ואחרי בולוס כדי לצפות בשינויים המושרים על ידי הבולוס, במקביל למדידות לחץ תוך וסקולרי באזורי היעד. לאחר מכן אנו מסוגלים למדוד את ההיקף ואת שטח החתך של כלי הדם לפני ואחרי בולוס.
בעזרת נתונים אלה והלחץ התוך-וסקולרי, אנו מסוגלים לחשב את התאימות וההרחבה עם משוואות ספציפיות. שיטה זו שימשה להשוואת התאימות וההתפשטות של הווריד הנבוב התחתון בכבשים מקומיות שלא נותחו לצינור של כבשים שהושתלו עם שתל פוליטטרפלואוראתילן מורחב לטווח ארוך (PTFE). הכלי המקורי נמצא תואם יותר וניתן להרחבה מאשר שתל PTFE בכל המקומות שנמדדו. אנו מסיקים כי שיטה זו מספקת בבטחה מדידות in vivo של תאימות ורידים והרחבה.
Introduction
חולים עם מומים קריטיים בלב זקוקים לניתוח שחזור. רוב פעולות השחזור דורשות שימוש בחומרים תותבים, כולל שתלים וסקולריים. צינורות פוטנציאליים לגישור על מרחב זה כוללים חומרים סינתטיים או ביולוגיים. בתחילה, הומוגרפטים שימשו כצינור פונטן אך מאז ננטשו עקב שכיחות גבוהה של הסתיידות ואירועי פאזה חריפים1. כיום משתמשים בשתלי כלי דם סינתטיים שמקורם בפולימרים אנאורגניים. נותר אתגר ששתלים אלה פחות תואמים מכלי הדם המקורי שבו הם מושתלים ויש להם סיבוכים ארוכי טווח, כגון היצרות, חסימה והסתיידות 1,2,3,4,5.
המבנה של שתלי כלי דם סינתטיים משאיל את עצמו לחוזק מתיחה מכני, מה שמוביל לתאימות נמוכה יותר שלהם תמיד בהשוואה לרקמה טבעית2. תאימות כלי הדם, המגדירה את שינוי הנפח של כלי השיט על פני שינוי בלחץ, משמשת אינדיקטור לתגובת כלי השיט לעומסים מכניים. ההבדל בין חומר השתל לבין תכונות כלי הדם המקוריים יוצר אי התאמה לתאימות, אשר הוכחה כמשבשת את דפוסי זרימת הדם, וכתוצאה מכך אזורים של מחזור והפרדת זרימה 2,6,7,8,9. תופעה זו משנה את לחץ הגזירה על דופן האנדותל וגורמת להגדלה אינטימית 2,7,8,9. תגובות כאלה יכולות להוביל לסיבוכים הקשורים לשתל, המחייבים החלפת שתל או התערבות חוזרת6.
מכיוון שתאימות כלי הדם תופסת תפקיד מפתח בקביעת תוצאות השתל, המדידה המדויקת של תכונה זו היא חיונית. תקן הזהב הנוכחי למדידת תאימות כלי דם הוא בדיקות מכניות צינוריות ex vivo . שיטה זו כוללת כריתה של שתל או כלי דם מעניין, חיבורו לצינורות לטקס ולחץ עליו כדי להעריך התנהגות מתיחה של מתח היקפי על פני לחצים שונים. התאימות נקבעת על ידי השוואת הלחץ עם מדידה של הקוטר הפנימי10. עם זאת, שיטות ex vivo יש כמה חסרונות. בעת הערכת הפונקציונליות של שתלים מושתלים בשיטת ex vivo , יש צורך להקריב את בעלי החיים ולשתול את השתלים, מה שלא מאפשר לבצע בדיקות ממושכות. לכן, פיתחנו פרוטוקול מדידת תאימות in vivo .
הקבוצה שלנו מתמקדת בפיתוח שתלי כלי דם מהונדסים רקמות (TEVGs) לשימוש בניתוח פונטן לשיפור מום לב מולד תסמונת לב שמאל היפופלסטית (HLHS). ההתפתחויות האחרונות בתחום ניתוחי הלב המולדים שיפרו את התוצאות לאחר הניתוח, והובילו לתוחלת חיים ארוכה יותר. זה הופך את התכונות ארוכות הטווח וההצלחה של צינור כלי הדם המושתל לקריטיות יותר ויותר. נכון לעכשיו, לא קיים מודל של HLHS בבעלי חיים, ולכן אנו מעריכים את השתלים שלנו במודל מואץ של שתל ורידי נבוב נחות (IVC). בעוד מודל זה אינו מנסה ליצור את זרימת פונטן, הוא למעשה משחזר את התנאים המודינמיים הייחודיים. השימוש האחרון שלנו בפרוטוקול in vivo זה הדגים הבדלים משמעותיים בתאימות השתל בין TEVG שלנו לבין שתלי פוליטטרה-פלואוראתילן מורחבים קונבנציונליים (PTFE)11. מכיוון שמחקר קודם זה לא התמקד במתודולוגיה, ערכנו ניסויים נוספים המפרטים את שיטת in vivo חדשנית זו.
שתלנו את השתל הסינתטי המשמש כיום כסטנדרט הטיפול, המורכב מפוליטטרה-פלואוראתילן מורחב (PTFE), בחיות מחקר של כבשי דורסט והשווינו אותו ל-IVC המקומי בחיות בקרה נאיביות כירורגית. פרוטוקול זה בוצע בקבוצת PTFE 5-7 שנים לאחר ההשתלה של צינור PTFE וחיות ביקורת לא מנותחות בגילאים שונים. כך, בסעיפים הבאים המתארים את הפרוטוקול ואת התוצאות המייצגות, נתייחס לעיתים לאזור העניין כמו, למשל, אמצע אזור השתל (אמצע השתל) של שתל אינטרפוזיציית IVC.
פרוטוקול זה מאפשר לנו לנתח את תאימות in vivo של צינור PTFE, הידוע כלא תואם בנקודת זמן ארוכת טווח, עם הווריד המקורי. בחרנו להשוות את החומר הסטנדרטי הקליני, PTFE, עם הווריד המקורי שלא נותח. בחרנו נקודת זמן ארוכת טווח מכיוון שצינור ה-PTFE ידוע כלא תואם ונוטה להסתייד, מה שמפחית עוד יותר את התאימות שלו11. בחרנו לערוך את כל ההשוואות in vivo מכיוון ששינויים המודינמיים מערכתיים משתקפים במדויק במדידות המתקבלות בשיטות in vivo. מהשוואה זו, מצאנו כי פרוטוקול זה מסוגל לאשר את אי הציות של PTFE ולקבל מדידות של ציות ורידי in vivo באופן בטוח וניתן לשחזור. שיטה זו יושמה בהצלחה במחקר שפורסם כדי להדגים הבדלים מובהקים סטטיסטית בין צינורות PTFE לבין שתלי כלי דם מהונדסים רקמות (TEVGs) in vivo11.
המטרה הכוללת של פרוטוקול זה היא לחשב תאימות והרחבה של IVC החזה במודל של בעלי חיים גדולים באמצעות מדידות in vivo מהליך הישרדות. לשם כך, דמיינו ומדדנו את השינויים בהיקף ובאזור החתך של IVC בית החזה לבולוס נוזלי. מדדנו בו זמנית את השינוי התוך-כלי בלחץ והשתמשנו במדידות אלה כדי לחשב תאימות והרחבה. שימוש בהדמיה אנגיוגרפית תלת ממדית מאפשר לנו יתרונות רבים, כולל היכולת להתאים את התצוגה של התמונה לאחר צילום כדי להבטיח שהמדידות שלנו נלקחות מחתך רוחב של הווריד, כמו גם לאפשר לנו למדוד מיקומים מרובים לאורך כלי השיט. שלושת תחומי העניין במחקר זה היו אזור השתל האמצעי, כמו גם שני אתרי האנסטומוזה הסמוכים של השתל PTFE, והאזורים המקבילים ב- IVC הילידי. על ידי ביצוע ניסויים in vivo, ישנם יתרונות בהערכת הפונקציונליות של שתלים בתוך זרימת הדם בפועל מוקף רקמות ואיברים. המדידות המתקבלות בשיטה זו משקפות את הפונקציונליות בפועל של השתלים באורגניזם חי.
הפרוטוקול מחולק לשישה חלקים עיקריים הכוללים הכנה מוקדמת של הכבשים, צנתור, איסוף נתוני טרום בולוס בסיסיים, איסוף נתוני מחקר, התאוששות בעלי חיים וניתוח נתונים. בחלק של הכנת בעלי חיים, אנו דנים בטשטוש, התחלת הרדמה ומיקום ציוד ניטור המשמש במהלך הליך הצנתור. בחלק השני, נסביר את תהליך הצבת שני נדן הצנתר הדרוש לאיסוף נתונים. עבור פרוטוקול זה, שני הנדן ממוקמים בווריד הצוואר הפנימי הימני (IJV) כדי לאפשר הכנסת שני צנתרים רב-מסלוליים לכלי. אחד ימוקם באזור העניין כדי לרשום את השינוי בלחץ, והשני ימוקם נמוך יותר בווריד להזרקת ניגוד. לאחר הצנתרים ממוקמים, נלקח אנגיוגרף תלת ממדי טרום בולוס בסיסי להשוואה. איסוף נתוני המחקר מתחיל בהכנת בולוס המלח במערכת שקית לחץ למתן, מתן בולוס המלח עם רישום לחצים תוך וסקולריים, ולקיחת אנגיוגרף תלת ממדי פוסט בולוס. לאחר מכן אנו מתארים את התהליך כדי להקל על התאוששות הכבשים לאחר הפרוטוקול. לבסוף, נדון בשיטה להשגת התמונות הנכונות ומדידות חתך לניתוח והשוואה סטטיסטית.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקול המחקר אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של בית החולים הארצי לילדים אביגיל וקסנר מכון המחקר (AR22-0004). כל בעלי החיים קיבלו טיפול הומני בהתאם למדריך לטיפול ושימוש בחיות מעבדה, שפורסם על ידי המכונים הלאומיים לבריאות.
1. הכנת בעלי חיים
- בקש מצוות וטרינרי להעריך את הכבשה שבוע לפני הצנתור, כולל בדיקה גופנית וניתוח סימנים חיוניים, כדי להבטיח שבעל החיים יוכל לקבל הרדמה בבטחה.
- יש לצום את בעל החיים למשך הלילה, או עד 12 שעות לפני ההליך, כדי להגביל את הסיכון לשאיפה של תוכן הקיבה עם השראת ההרדמה.
- לחצו על כפתור ההפעלה בלוח הבקרה כדי להפעיל את C-arm ואת מערכת האנגיוגרפיה התלת-ממדית (איור 1A). המתן עד שהמערכת תיטען במלואה.
הערה: ודא שהפלואורוסקופיה מושהית עד שהיא מוכנה לצילום וכל אנשי הצוות לובשים עופרת מגן. - הכינו מי מלח מקופחים לשימוש בהליך על ידי הוספת 1 מ"ל הפרין (ריכוז של 1,000 יחידות USP / מ"ל) ל-1,000 מ"ל של 0.9% מלוחים.
- לגלח את הצד השמאלי של הצוואר ולשפשף עם אלכוהול. מתן טשטוש על ידי הזרקת שילוב של קטמין (4 מ"ג/ק"ג), בוטורפנול (0.1 מ"ג/ק"ג) ודיאזפם (0.5 מ"ג/ק"ג) לווריד הצוואר השמאלי.
- הניחו את הכבשה המורדמת על מיטת בית חולים ומקמו אותה בשכיבה עצם החזה לצורך אינטובציה. אינטובט עם צינור אנדוטרכאלי (ET) 9-14 מ"מ, המבוסס על גודל הכבש, על ידי דיכוי הלשון והאפיגלוטיס עם לרינגוסקופ והחדרת צינור החוצן לקנה הנשימה.
- מקם את הכבשה במצב צדדי ימני. חבר את צינור ה- ET למכונת הנשמה ואוורר מכנית עם 100% חמצן ב- 1-3 ליטר לדקה.
- יש לשמור על הרדמה עם איזופלורן בשאיפה של 1-3%. הגדר את קצב הנשימה על 15-30 נשימות / דקה ואת נפח הגאות לסיים על 8-10 מ"ל / ק"ג.
- הניחו ציוד ניטור סטנדרטי, כולל שרוול לחץ דם ברגל הקדמית הימנית, אטב אוזניים לניטור ריווי חמצן באוזן ימין, בדיקת טמפרטורה לוושט ומוניטור CO2 בקצה צינור החוצן. מגלחים את הצמר מהאספקט הקאודלי של כל פרסה בין ציפורני הטל לעקב. מקם בלוטות אלקטרוקרדיוגרמה (ECG) ואבטח את בלוטות האק"ג באמצעות קלטת.
- לשמן את שתי העיניים על ידי מריחת משחה אופתלמית ולהכניס צינור orogastric כדי להבטיח גז ופינוי מזון.
- קבע קו IV ב- IJV השמאלי כדי לאפשר מתן עירוי קצב קבוע פרופופול (CRI) (20-40 מ"ג∙kg-1∙h-1), נוזלי תחזוקה (10 מ"ל∙kg-1∙h-1), ובולוס מלוחים.
- מקם את הכבשה בשכיבה צידית שמאלית. גלחו את הצד הימני של הצוואר כדי לקבל גישה לאתר הצנתור (איור 2A). מקללו את האזור עם קרצוף כלורהקסידין ואלכוהול.
- התנתקו מציוד הניטור וממכונת ההנשמה והעבירו את הכבשים לשולחן מעבדת הצנתורים. שוב, מקמו את החיה בתנוחת שכיבה צידית שמאלית (איור 3A).
- חבר מחדש למכונת ההנשמה ולציוד הניטור (מוליכי אק"ג, בדיקת טמפרטורה, שרוול לחץ דם, אוקסימטר דופק).
- שמור על הרדמה במהלך ההליך על ידי מתן איזופלורן בשאיפה 1-3% עם 100% O2, ו / או propofol CRI (20-40 מ"ג∙kg-1∙h-1).
הערה: הערך את מישור ההרדמה על ידי מדידת תנועת בעלי חיים, תגובה לגירויים כואבים, קצב נשימה, קצב דופק ולחץ דם. בצע התאמות בטשטוש לפי הצורך, כגון באמצעות בולוס 5-10 מ"ל של פרופופול כדי לגרום למישור עמוק יותר של הרדמה. - מדדו את רוחב הכבשים באזור הלב באמצעות קליפרים גדולים. חלק את הרוחב ב- 2 כדי להגדיר את מתמר הלחץ.
- נקו את אתר הניתוח ועטפו אותו בצורה סטרילית (איור 2B,C).
2. צנתור
- הזיזו את זרוע C ממצב חונה לחזה הכבשה והרימו את השולחן לפי הצורך. לחץ על לחצנים 7 ו- 3 בלוח הבקרה, ולאחר מכן החזק את לחצן התחל כדי להשתמש בהגדרות שתוכנתו מראש כדי למקם אוטומטית את הטבלה ואת C-Arm בצד שמאל של הטבלה (איור 1A).
- גישה ל- IJV הימני באמצעות מחט מיקרו ניקוב 21 G ומזרק Luer Slip 10 סמ"ק; גישה ל-IJV בכיוון גולגולתי/קאודלי דרך העור תוך משיכה לאחור של בוכנת המזרק. ודאו שהדם נשאף כדי לאשר שהמחט נמצאת בכלי הדם (איור 2A, B).
- נתק בזהירות את המזרק תוך החזקת המחט יציבה.
- הכנס מדריך חוט נירוסטה (SS) בגודל 0.018 אינץ 'דרך המחט לתוך הכלי בערך באמצע הדרך. הסר את המחט מעל חוט האס אס.
- מניחים מרחיב 5-צרפתי (Fr) מעל חוט האס אס לתוך הכלי. הסר את החלק הפנימי של המרחיב ואת חוט SS. הזינו חוט מנחה בקוטר 0.038 אינץ' דרך המרחיב לתוך הכלי בערך באמצע הדרך והוציאו את המרחיב.
- השתמש באזמל בן 11 להבים כדי לחתוך את העור מעל הווריד שבו החוט נכנס. יש להאכיל נדן 9-Fr מעל חוט ההנחיה ולתוך הכלי. הסר את קטע הנדן הפנימי ואת חוט ההנחיה.
- אשר מיקום נדן תקין על ידי שאיפת דם ולאחר מכן שטיפת הנדן עם מלוחים heparinized.
- חזור על שלבים 2.2-2.7 כך שיהיו שני נדן 9-Fr ב- IJV הימני.
- יש לתת 150 U/kg של הפרין דרך העירוי כדי למנוע קרישה.
- השתמשו בדוושת הרגל כדי להתחיל פלואורוסקופיה (איור 1B). יש להחדיר צנתר Judkins Right (JR) דרך הנדן, בעקבות IVC בית החזה על פני הסרעפת לתוך IVC הבטן.
- משחילים חוט רוזן דרך צנתר JR עד שהוא מגיע ל-IVC הבטני והקצה יוצא מצנתר JR. תוך כדי החזקת חוט רוזן במקומו, הוציאו בעדינות את צנתר JR.
- חזור על שלבים 2.10-2.11 עם הנדן השני.
- יש להשחיל צנתר מולטיטראק 7-Fr מעל כל חוט רוזן.
- בהנחיית פלואורוסקופיה יש להניח צנתר אנגיוגרפי רב-מסלולי אחד בבטן IVC להזרקת חומר ניגוד.
- באמצעות פלואורוסקופיה, הכניסו צנתר אנגיוגרפי רב-מסלולי נוסף לאזור העניין הספציפי (למשל, מרכז השתל) לצורך מדידת לחץ (איור 2C).

איור 1: לוח הבקרה. (A) לוח בקרה של מערכת אנגיוגרפיה תלת-ממדית (B) דוושות רגל פלואורוסקופיות לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
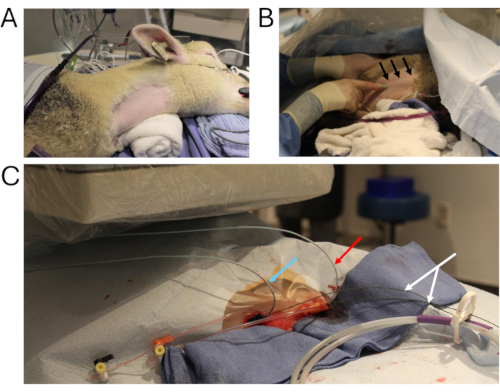
איור 2: צנתור בעלי חיים. (A) אתר הניתוח המרכזי, מוכן לצנתור. (B) טכניקה לדמיין את וריד הצוואר הפנימי הימני (חצים שחורים). (C) שני צנתרים אנגיוגרפיים רב-מסלוליים ממוקמים דרך וריד הצוואר הפנימי הימני (חץ כחול: מדידת לחץ בשתל; חץ אדום: הזרקת ניגוד לתוך IVC בטני; חץ לבן: חוטים נוקשים). קיצור: IVC = נבוב ורידי נחות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. איסוף הנתונים המוקדמים
- חבר את המסלול המרוכז באזור העניין למתמר הלחץ באמצעות סטופקוק תלת-כיווני. כאשר הסטופקוק פתוח לרב-מסלול, משוך לאחור עם מזרק 10 מ"ל עד להסרת בועות האוויר ונראה דם.
- עם מזרק 10 מ"ל הפוך, להחזיר את הדם לכבשים בזהירות לא לדחוף שום אוויר בחזרה לתוך multitrack. שטפו את המולטי-טראק במי מלח מופרינים.
- הפוך את המיקום הכבוי של הסטופקוק למזרק כך שמתמר הלחץ והמולטי-טראק פתוחים זה לזה.
- הכינו את מזרק הניגוד על ידי הוספת חומר ניגוד. הנפח המינימלי עבור אנגיוגרמה תלת-ממדית הוא 60 מ"ל והניגודיות הכוללת אינה יכולה לחרוג מ-5 מ"ל/ק"ג או 250 מ"ל.
- חברו את מזרק הניגוד למולטי-טראק שמרכזו ב-IVC הבטני. באמצעות מזרק הניגוד, סובב את הידית נגד כיוון השעון באיטיות כדי למשוך בועות אוויר מהמולטי-טראק עד שיראה דם. סובב את הידית בכיוון השעון כדי לדחוף את הניגודיות קדימה באיטיות לתוך המולטי-טראק.
- השתמש פלואורוסקופיה כדי לאשר כאשר הניגודיות הגיעה לקצה של multitrack.
- קח את הניגודיות הכוללת המשמשת לאנגיוגרמה התלת-ממדית וחלק ב- 5 כדי לקבל mL/s. הגדר את עליית התעריף ל- 0 ו- 600 psi.
- הגדר את זרוע C למצב מתוכנת מראש על ידי לחיצה על לחצן תוכנית בחלק העליון הימני של המסך וכפתור 3D DSA 110 8 אינץ ' (אנגיוגרפיה תלת ממדית עם SID של 110 ס"מ ותצוגת שדה בגודל 8 אינץ').
- הרחק את כל החפצים והאנשים מהחזית או מהצדדים של השולחן. הפעל את תוכנית C-Arm על ידי לחיצה על הלחצן שמספרו 3 בלוח הבקרה. מקמו את אזור המטרה (למשל, אמצע השתל) במרכז מישור x-y (איור 3A-C).
- התקדמות לתוכנית השנייה על ידי לחיצה על הלחצן שמספרו 4 בלוח הבקרה. התאימו את גובה הטבלה בהתאם למרכז אזור העניין.
- לחץ על הלחצן שמספרו 5 וצלם את תמונת הבדיקה.
- בדוק מראש את טווח התנועה של C-Arm על ידי לחיצה על הלחצן Confirm Conditions | התחלה (איור 3D,E).
- בקשו מהרופא המרדים להחזיק את ההנשמה ולבצע אנגיוגרמה סיבובית תלת ממדית עם הזרקת ניגוד על ידי הפעלת התוכנית עם דוושת הרכישה האמצעית. במקביל, למדוד ולתעד את הלחץ הממוצע של אזור היעד.
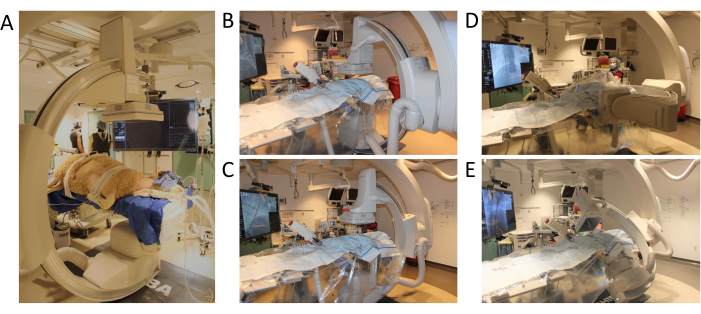
איור 3: מיקום זרוע C וטווח תנועה. (A) מיקום כבשים לתחילת ההליך (B) מיקום ראשון לתוכנית אנגיוגרמה תלת-ממדית (C) זרוע C נעה בציר xy (D) זרוע C נעה בציר z (E) זרוע C משלימה סיבוב בדיקה עם טווח תנועה מלא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. מתן בולוס מי מלח ואיסוף נתונים
- הכנה: 20 מ"ל/ק"ג של 0.9% מלוחים.
- להכנת שקית הבולוס בלחץ, הוסיפו שקית של 1,000 מ"ל של 0.9% מלח ליחידת שקית בלחץ. השתמש ביחידה שנייה במידת הצורך כדי להשיג את הנפח הכולל שיש לנהל.
- לחץ את נורת הניפוח עד שמד הלחץ יעלה לאזור הירוק, מיד לפני הקו האדום (לחץ 250-300 מ"מ כספית). שוטפים מי מלח דרך הקו ומסירים בועות אוויר.
- חברו את שקית המלח בלחץ לנדן 9-Fr ושמרו על 250-300 מ"מ כספית כדי לשמור על מהירות קבועה של הבולוס. תנו לו לזרום עד שהכבשה קיבלה בולוס שווה ערך ל-20 מ"ל/ק"ג או שהלחץ הממוצע מגיע ל-15 מ"מ כספית.
- בזמן שהבולוס זורם, רשמו לחצים תוך-וסקולריים של אזור המטרה בכל דקה.
- הכינו את ה-C-Arm לאנגיוגרפיה סיבובית תלת-ממדית שנייה על ידי חזרה על שלבים 3.9-3.12. ברגע שהבולוס מסתיים, לפני שהלחץ מתחיל לרדת, קח את האנגיוגרפיה התלת-ממדית השנייה ואת מדידת הלחץ התוך-כלי השני במקביל על ידי ייזום כמתואר בשלב 3.13.
5. התאוששות
- לאחר השלמת ההדמיה, החזירו את ה-C-Arm למצב חניה מתוכנת מראש על ידי הזנת מספר 77 והחזקת לחצן Start עד שה-C-Arm ימקם את עצמו.
- הסר את צנתרי האנגיוגרפיה הרב-מסלולית ואת חוטי רוזן.
- יש להסיר את שני הנדן תוך הפעלת לחץ ישיר על אתרי החדרה עם מדבקת המוסטזיס למשך 7 דקות לפחות כדי לעצור את הדימום.
- עטפו גליל סטרילי של גזה סביב טלאים וצוואר כך שהעטיפה תהיה בטוחה לשמירה על לחץ, אך לא הדוקה מדי כדי להסתכן בניתוק זרימת הדם או במניעת נשימה.
- כבו את חומרי ההרדמה (איזופלורן ו/או פרופופול CRI).
- שמור על הכבשים על מכונת ההנשמה עם 100% O2 עד שהם נושמים באופן עקבי בכוחות עצמם.
הערה: סימנים לכך שהכבשה מתעוררת כוללים תנועה, מצמוץ, תגובה לגירויים כואבים, טונוס לסת או ניסיונות ללעוס, ונשימה ללא סיוע של מכונת הנשמה. - ברגע שהכבשים מסוגלות לנשום בכוחות עצמן, אקסטובט (להסיר את צינור החוצן) ולהסיר את הצינור האורוגסטרי.
- הוציאו את כל ציוד הניטור והעבירו את הכבשים למיטת בית חולים. החזירו אותו לחדר הדיור.
- סייעו לכבשים להישאר בשכיבה עצם החזה או כאשר הן מנסות לעמוד עד שהכבשים מסוגלות לשמור על שיווי משקל בכוחות עצמן. מנעו מהם להיתקל בקירות.
- ברגע שהם נראים ערים מספיק, לתת כמויות קטנות של חציר או תבואה.
6. ניתוח נתונים
- יצא את נתוני האנגיוגרפיה התלת-ממדית הגולמיים המקוריים מתוכנת דימות האנגיוגרפיה בתבנית קובץ DICOM.
- הפעל את תוכנת מציג DICOM. גרור ושחרר את קובץ האנגיוגרפיה התלת-ממדית לתוך המציג כדי לפתוח אותו (איור 4A).
- בתוך תוכנת מציג DICOM, בחר בכלי 3D MPR (Multi-Planar Reconstruction) כדי ליצור תצוגה משוחזרת תלת-ממדית של נתוני האנגיוגרפיה. זה יציג שלוש תצוגות דו-ממדיות נפרדות משלוש זוויות שונות: מישור צירית, מישור קשת (איור 4B) ומישור העטרה (איור 4C).
- התאימו את המיקום והכיוון של אזור המטרה במישור הקשת והעטרה כדי להשיג את המיקום האנכי הרצוי על-ידי הצבת אזור המטרה במרכז וסיבוב כיוון קווי הייחוס בכל מישור בעזרת כלי ידני (איור 4D).
- השתמשו בכלי העיפרון במציג DICOM כדי לשרטט את דופן הכלי במבט צירית של אזור המטרה (איור 4E). התוכנה מחשבת באופן אוטומטי ומציגה הן את השטח והן את ההיקף (היקף) של האזור באמצע התצוגה הצירית.
- השתמש במשוואה (1) כדי לחשב תאימות, כאשר A הוא שטח החתך (cm2) ו- P הוא הלחץ (mmHg):
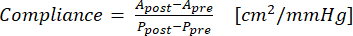 (1)
(1) - השתמש במשוואה (2) כדי לחשב יכולת הרחבה כאשר C הוא ההיקף (cm) ו- P הוא הלחץ (mmHg):
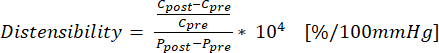 (2)
(2)
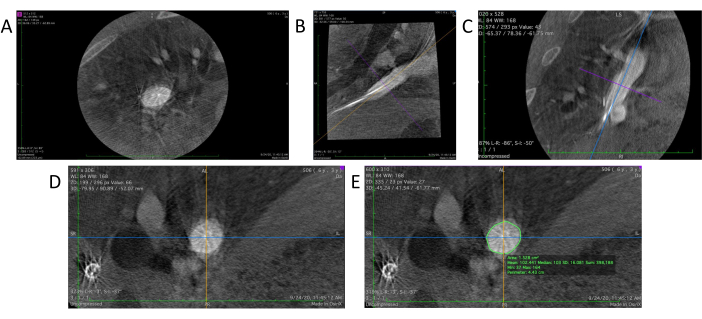
איור 4: ניתוח נתונים במציג DICOM. (A) נתונים גולמיים של אנגיוגרמה תלת-ממדית שנטענו במציג DICOM. (B) החלק הסגיטלי של השתל. (ג) החלק העטרתי. (D) מדמיינים חתך רוחב אמיתי לאחר התאמת הזווית על חתכי הקשת והעטרה. (E) כלי העיפרון משמש לשרטוט כלי המטרה לביצוע מדידות היקף ושטח חתך. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ביצענו הליך זה בהצלחה עם למעלה מ-25 כבשים. חשוב לציין כי לא היו מקרים של תחלואה ותמותה הקשורים להליך זה. כל הכבשים הציגו התאוששות לא מסובכת. תוצאות מייצגות אלה נלקחו משלוש כבשים שהושתלו בהן שתלי PTFE ומשלוש כבשים מקומיות שלא נותחו. איור 5 מספק את מדידות הלחץ התוך-וסקולרי שנלקחו ...
Access restricted. Please log in or start a trial to view this content.
Discussion
תאימות ויכולת הרחבה הן תכונות מפתח לתפקוד כלי הדם, ומשמשות כאינדיקטורים לסיבוכים והתערבויות פוטנציאליים. כימות והשוואה מדויקים של שינויים בפרמטרים אלה חשובים להערכת יעילות השתל. שיטת in vivo שלנו מתגברת על המגבלות של ניתוח ex vivo ושומרת על תוצאות דומות. השוואת נתוני in vivo שלנו לנ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
מחקר זה מומן בחלקו על ידי חברת Gunze Ltd.
Acknowledgements
עבודה זו נתמכה על ידי R01 HL163065 ו-W81XWH1810518. אנו מביעים את הערכתנו לצוות המסור בליבת המחקר בבעלי חיים. ברצוננו גם להביע את תודתנו לכרמן ארסואגה על מומחיותה שלא תסולא בפז ועל הטיפול הערני שלה לאורך כל המחקר.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
References
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3(2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187(2024).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved