È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Quantificazione della compliance e della distensibilità della vena cava inferiore in un modello ovino in vivo mediante angiografia 3D
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo consente la quantificazione in vivo della compliance venosa e della distensibilità utilizzando il cateterismo e l'angiografia 3D come procedura di sopravvivenza, consentendo una varietà di potenziali applicazioni.
Abstract
Gli innesti vascolari sintetici superano alcune sfide di allotrapianti, autotrapianti e xenotrapianti, ma sono spesso più rigidi e meno cedevoli rispetto al vaso nativo in cui vengono impiantati. La corrispondenza della conformità con il vaso nativo sta emergendo come una proprietà chiave per il successo dell'innesto. L'attuale gold standard per la valutazione della conformità delle navi prevede l'escissione delle navi e i test meccanici biassiali ex vivo . Abbiamo sviluppato un metodo in vivo per valutare la compliance venosa e la distensibilità che riflette meglio la fisiologia naturale e prende in considerazione l'impatto di una variazione di pressione causata dal flusso sanguigno e da eventuali cambiamenti morfologici presenti.
Questo metodo è concepito come una procedura di sopravvivenza, che facilita gli studi longitudinali e riduce potenzialmente la necessità di utilizzo da parte degli animali. Il nostro metodo prevede l'iniezione di un bolo salino da 20 ml/kg nel sistema vascolare venoso, seguito dall'acquisizione di angiogrammi 3D pre e post bolo per osservare le alterazioni indotte dal bolo, in concomitanza con le misurazioni della pressione intravascolare nelle regioni target. Siamo quindi in grado di misurare la circonferenza e l'area della sezione trasversale del vaso prima e dopo il bolo.
Con questi dati e la pressione intravascolare, siamo in grado di calcolare la compliance e la distensibilità con specifiche equazioni. Questo metodo è stato utilizzato per confrontare la compliance e la distensibilità della vena cava inferiore nelle pecore autoctone non operate con il condotto delle pecore impiantate con un innesto di politetrafluoroetilene espanso (PTFE) a lungo termine. Il vaso nativo è risultato essere più cedevole e distensibile rispetto all'innesto di PTFE in tutte le posizioni misurate. Concludiamo che questo metodo fornisce in modo sicuro misurazioni in vivo della compliance e della distensibilità delle vene.
Introduzione
I pazienti con anomalie cardiache critiche richiedono un intervento di chirurgia ricostruttiva. La maggior parte delle operazioni ricostruttive richiede l'uso di materiali protesici, compresi gli innesti vascolari. I potenziali condotti per colmare questo spazio includono materiali sintetici o biologici. Inizialmente, gli omotrapianti erano usati come condotto di Fontan, ma da allora sono stati abbandonati a causa di un'alta incidenza di calcificazioni e incidenti di fase acuta1. Attualmente vengono utilizzati innesti vascolari sintetici derivati da polimeri inorganici. Rimane il problema che questi innesti sono meno cedevoli del vaso nativo in cui vengono impiantati e presentano complicanze a lungo termine, come stenosi, occlusione e calcificazione 1,2,3,4,5.
La struttura degli innesti vascolari sintetici si presta alla resistenza meccanica alla trazione, portando alla loro compliance invariabilmente inferiore rispetto al tessuto nativo2. La compliance vascolare, che definisce la variazione di volume del recipiente rispetto a una variazione di pressione, funge da indicatore della reattività di un recipiente ai carichi meccanici. La differenza tra il materiale dell'innesto e le proprietà dei vasi nativi crea una discrepanza di conformità, che ha dimostrato di interrompere i modelli di flusso sanguigno, con conseguente area di ricircolo e separazione del flusso 2,6,7,8,9. Questo fenomeno altera lo sforzo di taglio sulla parete endoteliale e induce iperplasia intimale 2,7,8,9. Tali risposte possono portare a complicanze correlate al trapianto, che richiedono la sostituzione del trapianto o un nuovo intervento6.
Poiché la compliance vascolare assume un ruolo chiave nel determinare i risultati del trapianto, la misurazione accurata di questa proprietà è essenziale. L'attuale gold standard per la misurazione della compliance vascolare è il test meccanico biassiale tubolare ex vivo . Questo metodo prevede l'asportazione di un innesto o di un vaso di interesse, il collegamento a tubi di lattice e la pressurizzazione per valutare il comportamento di allungamento dello stress circonferenziale a varie pressioni. La conformità è determinata confrontando la pressione con una misurazione del diametro interno10. Tuttavia, i metodi ex vivo presentano alcuni svantaggi. Quando si valuta la funzionalità degli innesti impiantati con il metodo ex vivo , è necessario sacrificare gli animali ed espiantare gli innesti, rendendo impossibile condurre esami prolungati. Pertanto, abbiamo sviluppato un protocollo di misurazione della conformità in vivo .
Il nostro gruppo si concentra sullo sviluppo di innesti vascolari di ingegneria tissutale (TEVG) da utilizzare nella chirurgia Fontan per migliorare la sindrome del cuore sinistro ipoplasico (HLHS) con difetto cardiaco congenito. I recenti sviluppi nel campo della cardiochirurgia congenita hanno migliorato gli esiti postoperatori, portando a un'aspettativa di vita più lunga. Ciò rende sempre più cruciali le proprietà a lungo termine e il successo del condotto vascolare impiantato. Attualmente, non esiste un modello animale di HLHS, quindi valutiamo i nostri innesti in un modello di innesto accelerato di vena cava inferiore (IVC) di grandi dimensioni. Sebbene questo modello non tenti di creare il flusso della circolazione di Fontan, ricapitola efficacemente le condizioni emodinamiche uniche. Il nostro recente utilizzo di questo protocollo in vivo ha dimostrato differenze significative nella compliance dell'innesto tra i nostri innesti TEVG e gli innesti convenzionali in politetrafluoroetilene espanso (PTFE)11. Poiché questo studio precedente non si è concentrato sulla metodologia, abbiamo condotto ulteriori esperimenti che descrivono in dettaglio questo nuovo metodo in vivo .
Abbiamo impiantato l'innesto sintetico attualmente in uso come standard di cura, composto da politetrafluoroetilene espanso (PTFE), negli animali di studio delle pecore del Dorset e lo abbiamo confrontato con l'IVC nativo negli animali di controllo naïve chirurgicamente. Questo protocollo è stato eseguito sul gruppo PTFE 5-7 anni dopo l'impianto di un condotto in PTFE e su animali di controllo non operati di varie età. Pertanto, nelle sezioni successive che descrivono il protocollo e i risultati rappresentativi, ci riferiremo occasionalmente alla regione di interesse come, ad esempio, la regione centrale dell'innesto (midgraft) dell'innesto di interposizione IVC.
Questo protocollo ci permette di analizzare la conformità in vivo del condotto in PTFE, noto per essere non conforme a lungo termine, con la vena nativa. Abbiamo scelto di confrontare il materiale clinico standard, il PTFE, con la vena nativa non operata. Abbiamo scelto un punto temporale a lungo termine perché è noto che il condotto in PTFE rimane non conforme ed è incline a calcificarsi, riducendo ulteriormente la sua conformità11. Abbiamo scelto di condurre tutti i confronti in vivo poiché i cambiamenti emodinamici sistemici si riflettono accuratamente nelle misurazioni ottenute attraverso metodi in vivo. Da questo confronto, abbiamo scoperto che questo protocollo è in grado di confermare la non conformità del PTFE e ottenere misure di conformità venosa in vivo in modo sicuro e riproducibile. Questo metodo è stato implementato con successo in uno studio pubblicato per dimostrare differenze statisticamente significative tra i condotti in PTFE e gli innesti vascolari di ingegneria tissutale (TEVG) in vivo11.
L'obiettivo generale di questo protocollo è calcolare la conformità e la distensibilità dell'IVC toracico in un modello animale di grandi dimensioni ovino utilizzando misurazioni in vivo da una procedura di sopravvivenza. A tal fine, abbiamo visualizzato e misurato i cambiamenti nella circonferenza e nell'area della sezione trasversale dell'IVC toracico in un bolo fluido. Abbiamo misurato simultaneamente la variazione intravascolare della pressione e abbiamo utilizzato queste misurazioni per calcolare la compliance e la distensibilità. L'utilizzo dell'imaging angiografico 3D ci offre molteplici vantaggi, tra cui la possibilità di regolare la visualizzazione dell'immagine dopo l'acquisizione per garantire che le nostre misurazioni vengano effettuate da una sezione trasversale della vena, oltre a consentirci di misurare più posizioni lungo il vaso. Le tre aree di interesse in questo studio erano la regione dell'innesto medio, nonché i due siti di anastomosi adiacenti dell'innesto di PTFE e le aree comparabili nell'IVC nativo. Conducendo esperimenti in vivo, si hanno vantaggi nel valutare la funzionalità degli innesti all'interno del flusso di sangue effettivo e circondati da tessuti e organi. Si ritiene che le misurazioni ottenute con questo metodo riflettano l'effettiva funzionalità degli innesti in un organismo vivente.
Il protocollo è suddiviso in sei sezioni principali, tra cui la preparazione pre-procedura delle pecore, il cateterismo, la raccolta dei dati pre-bolo di base, la raccolta dei dati dello studio, il recupero degli animali e l'analisi dei dati. Nella sezione relativa alla preparazione degli animali, discutiamo della sedazione, dell'avvio dell'anestesia e del posizionamento delle apparecchiature di monitoraggio utilizzate durante la procedura di cateterizzazione. Nella seconda sezione, spieghiamo il processo di posizionamento delle due guaine del catetere necessarie per l'acquisizione dei dati. Per questo protocollo, entrambe le guaine vengono posizionate nella vena giugulare interna destra (IJV) per consentire l'introduzione di due cateteri multitraccia nel vaso. Uno sarà posizionato nella regione di interesse per registrare la variazione di pressione e l'altro sarà posizionato più in basso nella vena per l'iniezione di contrasto. Una volta posizionati i cateteri, viene eseguito un angiografo 3D pre-bolo di base per il confronto. La raccolta dei dati dello studio inizia con la preparazione del bolo salino in un sistema di sacca pressurizzata per la somministrazione, fornendo al bolo salino la registrazione delle pressioni intravascolari e l'esecuzione dell'angiografo 3D post bolo. Descriviamo quindi il processo per facilitare il recupero delle pecore dopo il protocollo. Infine, discutiamo il metodo per ottenere le immagini corrette e le misure della sezione trasversale per l'analisi e il confronto statistico.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il protocollo di studio è stato approvato dall'Institutional Animal Care and Use Committee del Nationwide Children's Hospital Abigail Wexner Research Institute (AR22-0004). Tutti gli animali hanno ricevuto cure umanitarie in conformità con la Guida per la cura e l'uso degli animali da laboratorio, pubblicata dal National Institutes of Health.
1. Preparazione degli animali
- Chiedi a un team veterinario di valutare le pecore 1 settimana prima del cateterismo, incluso un esame fisico e l'analisi dei segni vitali, per garantire che l'animale possa ricevere l'anestesia in sicurezza.
- Digiunare l'animale durante la notte, o fino a 12 ore prima della procedura, per limitare il rischio di aspirazione del contenuto dello stomaco dopo l'induzione dell'anestesia.
- Premere il pulsante di accensione sul pannello di controllo per accendere l'arco a C e il sistema di angiografia 3D (Figura 1A). Attendere che il sistema sia completamente caricato.
NOTA: Assicurarsi che la fluoroscopia sia in pausa fino a quando non è pronta per l'immagine e che tutto il personale indossi un elettrocatetere protettivo. - Preparare la soluzione salina eparinizzata da utilizzare nella procedura aggiungendo 1 ml di eparina (concentrazione di 1.000 unità USP/ml) a 1.000 ml di soluzione fisiologica allo 0,9%.
- Radere il lato sinistro del collo e strofinare con alcool. Somministrare la sedazione iniettando una combinazione di ketamina (4 mg/kg), butorfanolo (0,1 mg/kg) e diazepam (0,5 mg/kg) nella vena giugulare sinistra.
- Posizionare la pecora sedata su un letto d'ospedale e posizionarla in decubito sternale per l'intubazione. Intubare con un tubo endotracheale (ET) da 9-14 mm, in base alle dimensioni della pecora, premendo la lingua e l'epiglottide con un laringoscopio e inserendo il tubo ET nella trachea.
- Posizionare la pecora in posizione laterale destra. Collegare il tubo ET a un ventilatore e ventilare meccanicamente con ossigeno al 100% a 1-3 L/min.
- Mantenere l'anestesia con l'1-3% di isoflurano inalato. Impostare la frequenza respiratoria a 15-30 respiri/min e il volume corrente finale a 8-10 mL/kg.
- Posizionare un'apparecchiatura di monitoraggio standard, tra cui un bracciale per la pressione sanguigna sulla zampa anteriore destra, una clip per l'orecchio per monitorare la saturazione di ossigeno sull'orecchio destro, una sonda di temperatura nell'esofago e un monitor di CO2 di fine espirazione sul tubo ET. Rasare la lana dall'aspetto caudale di ogni zoccolo tra gli speroni e il tallone. Posizionare i nodi dell'elettrocardiogramma (ECG) e fissare i nodi ECG con del nastro adesivo.
- Lubrificare entrambi gli occhi applicando un unguento oftalmico e inserire un sondino orogastrico per garantire l'evacuazione di gas e cibo.
- Stabilire una linea IV nell'IJV sinistro per consentire la somministrazione di propofol per infusione a velocità costante (CRI) (20-40 mg∙kg-1∙h-1), liquidi di mantenimento (10 mL∙kg-1∙h-1) e bolo salino.
- Posizionare la pecora in decubito laterale sinistro. Radere il lato destro del collo per accedere al sito di cateterizzazione (Figura 2A). Tamponare l'area con scrub alla clorexidina e alcool.
- Scollegare l'apparecchiatura di monitoraggio e il ventilatore e spostare le pecore sul tavolo del laboratorio di cateterismo. Anche in questo caso, posizionare l'animale in posizione sdraiata laterale sinistra (Figura 3A).
- Ricollegare al ventilatore e all'apparecchiatura di monitoraggio (derivazioni ECG, sonda di temperatura, bracciale per la pressione sanguigna, pulsossimetro).
- Mantenere l'anestesia durante la procedura somministrando isoflurano per via inalatoria all'1-3% con O2 al 100% e/o propofol CRI (20-40 mg∙kg-1∙h-1).
NOTA: Valutare il piano dell'anestesia misurando il movimento dell'animale, la risposta agli stimoli dolorosi, la frequenza respiratoria, la frequenza cardiaca e la pressione sanguigna. Apportare le modifiche appropriate alla sedazione, ad esempio utilizzando un bolo da 5-10 ml di propofol per indurre un piano di anestesia più profondo. - Misura la larghezza della pecora nell'area del cuore usando un calibro grande. Dividere la larghezza per 2 per impostare il trasduttore di pressione.
- Pulire asetticamente il sito chirurgico e drappeggiarlo in modo sterile (Figura 2B, C).
2. Cateterismo
- Spostare l'arco a C dalla posizione di parcheggio al petto delle pecore e sollevare il tavolo secondo necessità. Premere i pulsanti 7 e 3 sul pannello di controllo, quindi tenere premuto il pulsante Start per utilizzare le impostazioni preprogrammate per posizionare automaticamente il tavolo e l'arco a C sul lato sinistro del tavolo (Figura 1A).
- Accedi all'IJV corretto utilizzando un ago per micropuntura da 21 G e una siringa Luer Slip da 10 cc; accedere all'IJV in direzione cranica/caudale attraverso la pelle tirando indietro lo stantuffo della siringa. Assicurarsi che il sangue sia aspirato per confermare che l'ago sia nel vaso (Figura 2A, B).
- Scollegare con cautela la siringa tenendo fermo l'ago.
- Inserire una guida del filo in acciaio inossidabile (SS) da 0,018 pollici attraverso l'ago nel recipiente a circa metà corsa. Rimuovere l'ago da sopra il filo SS.
- Posizionare un dilatatore da 5 francesi (Fr) sul filo SS e nel recipiente. Rimuovere la parte interna del dilatatore e il filo SS. Inserire un filo guida da 0,038 pollici attraverso il dilatatore nel recipiente a circa metà e rimuovere il dilatatore.
- Usa un bisturi a 11 lame per tagliare la pelle sopra la vena in cui entra il filo. Inserire una guaina da 9 Fr sul filo guida e nel recipiente. Rimuovere la sezione della guaina interna e il filo guida.
- Confermare il corretto posizionamento della guaina aspirando il sangue e quindi lavando la guaina con soluzione fisiologica eparinizzato.
- Ripetere i passaggi 2.2-2.7 in modo che ci siano due guaine 9-Fr nell'IJV destro.
- Somministrare 150 U/kg di eparina attraverso la flebo per prevenire la coagulazione.
- Utilizzare il pedale per avviare la fluoroscopia (Figura 1B). Inserire un catetere Judkins destro (JR) attraverso la guaina, seguendo l'IVC toracico attraverso il diaframma nell'IVC addominale.
- Infilare un filo di Rosen attraverso il catetere JR fino a raggiungere l'IVC addominale e la punta emerge dal catetere JR. Tenendo il filo di Rosen in posizione, rimuovere delicatamente il catetere JR.
- Ripetere i passaggi 2.10-2.11 con la seconda guaina.
- Infilare un catetere multitraccia 7-Fr su ciascun filo di Rosen.
- Sotto la guida della fluoroscopia, posizionare un catetere angiografico multitraccia nell'IVC addominale per l'iniezione di contrasto.
- Utilizzando la fluoroscopia, posizionare un altro catetere angiografico multitraccia nella regione specifica di interesse (ad esempio, il centro dell'innesto) per la misurazione della pressione (Figura 2C).

Figura 1: Pannello di controllo. (A) Pannello di controllo del sistema di angiografia 3D (B) Pedali per fluoroscopia Fare clic qui per visualizzare una versione più grande di questa figura.
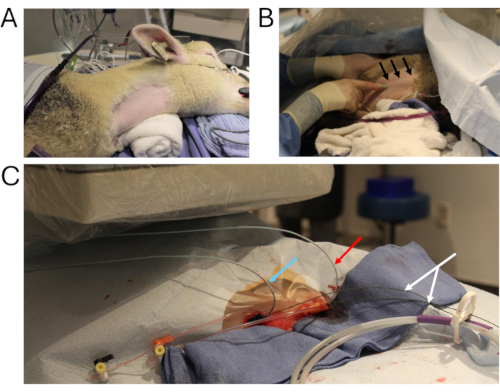
Figura 2: Cateterismo animale. (A) Il sito chirurgico chiave, preparato per il cateterismo. (B) Tecnica per visualizzare la vena giugulare interna destra (frecce nere). (C) Due cateteri angiografici multitraccia vengono posizionati attraverso la vena giugulare interna destra (freccia blu: misurazione della pressione nell'innesto; freccia rossa: iniezione di contrasto nell'IVC addominale; freccia bianca: fili rigidi). Abbreviazione: IVC = vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.
3. Raccolta dei dati preliminari
- Collegare il multitraccia centrato nella regione di interesse al trasduttore di pressione utilizzando un rubinetto a tre vie. Con il rubinetto aperto sul multitraccia, tirare indietro con una siringa da 10 ml fino a rimuovere le bolle d'aria e vedere il sangue.
- Con la siringa da 10 ml capovolta, restituire il sangue alle pecore facendo attenzione a non respingere l'aria nel multitraccia. Lavare il multitraccia con soluzione fisiologica eparinizzato.
- Spostare la posizione off del rubinetto verso la siringa in modo che il trasduttore di pressione e il multitraccia siano aperti l'uno all'altro.
- Preparare l'iniettore di contrasto aggiungendo un mezzo di contrasto. Il volume minimo per un angiogramma 3D è di 60 mL e il contrasto totale non può superare 5 mL/kg o 250 mL.
- Collegare l'iniettore di contrasto al multitraccia centrato nell'IVC addominale. Utilizzando l'iniettore di contrasto, ruotare lentamente la manopola in senso antiorario per estrarre le bolle d'aria dal multitraccia fino a quando non si vede il sangue. Ruotare la manopola in senso orario per spingere lentamente in avanti il contrasto nel multitraccia.
- Utilizzare la fluoroscopia per confermare quando il contrasto ha raggiunto la punta del multitraccia.
- Prendi il contrasto totale utilizzato per l'angiogramma 3D e dividi per 5 per ottenere mL/s. Impostare l'aumento della velocità su 0 e 600 psi.
- Impostare l'arco a C sulla modalità preprogrammata facendo clic sul pulsante Programma nella parte superiore destra dello schermo e sul pulsante 3D DSA 110 8'' (angiografia 3D con SID di 110 cm e Field View a 8 pollici).
- Allontana tutti gli oggetti e le persone dalla parte anteriore o laterale del tavolo. Avviare il programma C-Arm facendo clic sul pulsante numerato 3 sul pannello di controllo. Posizionare la regione target (ad esempio, l'innesto centrale) al centro del piano x-y (Figura 3A-C).
- Passa al secondo programma facendo clic sul pulsante numerato 4 sul pannello di controllo. Regolare l'altezza della tabella di conseguenza per centrare la regione di interesse.
- Premere il pulsante numerato 5 e scattare l'immagine di prova.
- Verifica in anticipo il raggio di movimento dell'arco a C facendo clic sul pulsante Conferma condizioni | Avvio (Figura 3D,E).
- Chiedere all'anestesista di sospendere la ventilazione ed eseguire un angiogramma rotazionale 3D con iniezione di contrasto avviando il programma con il pedale di acquisizione centrale. Misurare e registrare contemporaneamente la pressione media della regione target.
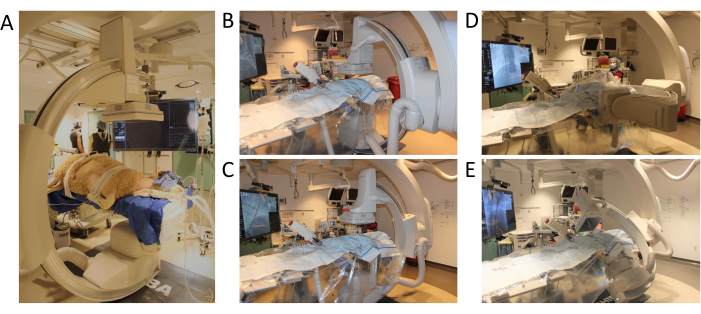
Figura 3: Posizionamento dell'arco a C e raggio di movimento. (A) Posizionamento delle pecore per l'inizio della procedura (B) Prima posizione per il programma di angiografia 3D (C) Arco a C spostato sull'asse xy (D) Braccio a C spostato sull'asse z (E) Braccio a C che completa il test-spin con l'intera gamma di movimento. Clicca qui per visualizzare una versione più grande di questa figura.
4. Somministrazione del bolo salino e raccolta dei dati
- Preparare 20 mL/kg di soluzione fisiologica allo 0,9%.
- Per preparare la sacca pressurizzata in bolo, aggiungere una sacca da 1.000 ml di soluzione fisiologica allo 0,9% in un'unità sacca pressurizzata. Se necessario, utilizzare una seconda unità per raggiungere il volume totale da somministrare.
- Premere il bulbo di gonfiaggio fino a quando il manometro non sale nella zona verde, immediatamente prima della linea rossa (pressione 250-300 mmHg). Sciacquare la soluzione salina attraverso la linea e rimuovere le bolle d'aria.
- Collegare la sacca salina pressurizzata a una guaina da 9 Fr e mantenere 250-300 mmHg per mantenere una velocità costante del bolo. Lasciarlo fluire fino a quando la pecora non ha ricevuto un bolo equivalente a 20 mL/kg o la pressione media raggiunge i 15 mmHg.
- Mentre il bolo scorre, registrare le pressioni intravascolari della regione target ogni minuto.
- Tenere l'arco a C pronto per una seconda angiografia rotazionale 3D ripetendo i passaggi 3.9-3.12. Non appena il bolo termina, prima che la pressione inizi a scendere, eseguire la seconda angiografia 3D e la misurazione della pressione intravascolare concomitante iniziando come descritto al punto 3.13.
5. Recupero
- Dopo il completamento dell'imaging, riposizionare l'arco a C nella posizione di parcheggio preprogrammata inserendo il numero 77 e tenendo premuto il pulsante di avvio finché l'arco a C non si posiziona.
- Rimuovere i cateteri per angiografia multitraccia e i fili di Rosen.
- Rimuovere entrambe le guaine applicando una pressione diretta sui siti di inserimento con un cerotto per emostasi per almeno 7 minuti per fermare l'emorragia.
- Avvolgi un rotolo sterile di garza attorno ai cerotti e al collo in modo che l'involucro sia sicuro per mantenere la pressione, ma non troppo stretto da rischiare di interrompere la circolazione o impedire la respirazione.
- Interrompere gli anestetici (isoflurano e/o propofol CRI).
- Mantieni le pecore attaccate al ventilatore con il 100% di O2 fino a quando non respirano costantemente da sole.
NOTA: I segni che la pecora si sta svegliando includono movimento, battito delle palpebre, risposta a stimoli dolorosi, tono della mascella o tentativi di masticare e respirazione senza l'assistenza di un ventilatore. - Una volta che la pecora è in grado di respirare da sola, estubare (rimuovere il sondino ET) e rimuovere il sondino orogastrico.
- Rimuovere tutte le apparecchiature di monitoraggio e trasferire le pecore in un letto d'ospedale. Spostalo di nuovo nella stanza dell'alloggio.
- Aiuta le pecore a rimanere in decubito sternale o quando tentano di stare in piedi fino a quando le pecore non sono in grado di mantenere l'equilibrio da sole. Evita che vadano a sbattere contro i muri.
- Una volta che sembrano abbastanza svegli, date piccole quantità di fieno o grano.
6. Analisi dei dati
- Esporta i dati originali dell'angiografia 3D grezza dal software di imaging angiografico in formato file DICOM.
- Avviare il software del visualizzatore DICOM. Trascinare e rilasciare il file dell'angiografia 3D nel visualizzatore per aprirlo (Figura 4A).
- All'interno del software di visualizzazione DICOM, selezionare lo strumento 3D MPR (Multi-Planar Reconstruction) per generare una vista ricostruita in 3D dei dati angiografici. Questo presenterà tre distinte viste 2D da tre diverse angolazioni: piani assiale, sagittale (Figura 4B) e coronale (Figura 4C).
- Regolare il posizionamento e l'orientamento della regione target nei piani sagittale e coronale per ottenere la posizione verticale desiderata posizionando la regione target al centro e ruotando la direzione delle linee di riferimento su ciascun piano con uno strumento manuale (Figura 4D).
- Utilizzare lo strumento matita all'interno del visualizzatore DICOM per delineare la parete del recipiente nella vista assiale della regione target (Figura 4E). Il software calcola e mostra automaticamente sia l'area che il perimetro (circonferenza) della regione al centro della vista assiale.
- Utilizza l'equazione (1) per calcolare la conformità, dove A è l'area della sezione trasversale (cm2) e P è la pressione (mmHg):
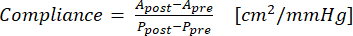 (1)
(1) - Impiega l'equazione (2) per calcolare la distensibilità dove C è la circonferenza (cm) e P è la pressione (mmHg):
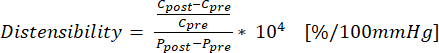 (2)
(2)
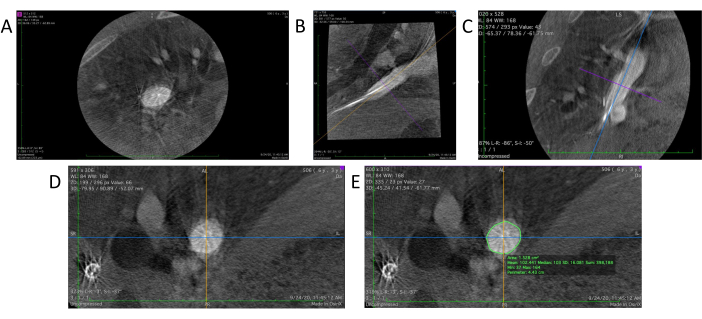
Figura 4: Analisi dei dati nel visualizzatore DICOM. (A) Dati grezzi dell'angiogramma 3D caricati nel visualizzatore DICOM. (B) La sezione sagittale dell'innesto. (C) La sezione coronale. (D) Una vera sezione trasversale viene visualizzata dopo aver regolato l'angolo sulle sezioni sagittale e coronale. (E) Lo strumento matita viene utilizzato per delineare il vaso bersaglio per effettuare misurazioni della circonferenza e dell'area della sezione trasversale. Clicca qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Abbiamo eseguito con successo questa procedura con oltre 25 pecore. È importante sottolineare che non ci sono stati casi di morbilità e mortalità correlati a questa procedura. Tutte le pecore hanno mostrato recuperi senza complicazioni. Questi risultati rappresentativi sono stati presi da tre pecore impiantate con innesti di PTFE e tre pecore autoctone non operate. La Figura 5 fornisce le misurazioni della pressione intravascolare effettuate da entrambi i gruppi di animali in studio duran...
Access restricted. Please log in or start a trial to view this content.
Discussione
La compliance e la distensibilità sono proprietà chiave per la funzione dei vasi sanguigni, che fungono da indicatori di potenziali complicanze e interventi. Quantificare e confrontare con precisione le variazioni di questi parametri è importante per valutare l'efficacia del trapianto. Il nostro metodo in vivo supera i limiti dell'analisi ex vivo e mantiene risultati comparabili. Confrontando i nostri dati in vivo con i dati ex vivo presentati da Blum et al., entrambi i metodi dimos...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Questo studio è stato sponsorizzato in parte da Gunze Ltd.
Riconoscimenti
Questo lavoro è stato supportato da R01 HL163065 e W81XWH1810518. Estendiamo il nostro apprezzamento al personale dedicato del Nucleo di Ricerca Animale. Desideriamo anche esprimere la nostra gratitudine a Carmen Arsuaga per la sua inestimabile competenza e la sua cura vigile durante lo studio.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
Riferimenti
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3(2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187(2024).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon