Method Article
手术造成体积肌损失 (VML) 损伤后大鼠咬肌的体内功能评估
摘要
体积肌损失 (VML) 损伤超过内源性再生能力,导致永久性功能缺陷。目前的 VML 研究主要集中在肢体和躯干肌肉上。为了将 VML 的机制研究扩展到颅面肌,本文描述了一种用于纵向评估 VML 损伤前后咬肌功能的 体内 方法。
摘要
体积肌损失 (VML) 在平民和军人中普遍存在,代表着一种超过身体自然再生能力的使人衰弱的骨骼肌损伤。这些损伤不仅会破坏肌肉纤维,还会破坏神经、血管和细胞外基质,破坏骨骼肌的再生能力,导致严重的纤维化和肌肉结构和功能的永久性缺陷。目前的临床管理有很多局限性,因此,正在进行研究以开发更有效的治疗方法。然而,值得注意的是,对 VML 损伤的大部分临床前强调都集中在肢体和躯干肌肉上,对颅面肌的研究有限。颅面肌肉和肢体/躯干肌肉之间发育生物学和再生能力的差异可能提供重要的见解,从而推动更多针对损伤的 VML 治疗方案。此外,功能恢复的评估对于确定治疗效果至关重要。在这方面,通过经皮神经刺激对肌肉收缩进行 体内 测试是一种微创方法,允许在研究过程中对同一只动物进行重复功能评估。鉴于这些考虑,本文描述了一种在 VML 损伤前后对大鼠咬肌肌肉功能进行 体内 评估的方法。该协议是第一个已发表的实例,详细说明了大鼠生物学相关的颅面 VML 损伤的创建和功能评估。
引言
涉及底层骨骼肌的软组织的创伤和手术损伤仍然是平民和受伤战士组织重建的最大挑战之一1。事实上,近 20% 的战场受伤也发生在受伤战士的颅面区域(头部和面部)2。包括在最近的冲突中,肢体创伤和头颈部损伤占战斗伤害的 >80%2。尽管骨骼肌在受伤后具有相当众所周知的修复、再生和重塑能力,但这些更严重的损伤(涉及大部分肌肉组织的损失)无法自行愈合,被称为体积肌肉损失 (VML) 损伤。根据定义,VML 会导致受伤肌肉或肌肉单位的永久性美学和功能缺陷3。
有趣的是,尽管颅面 VML 损伤普遍存在 2,4,但迄今为止的大部分研究都集中在肢体5、6、7、8 和躯干9、10、11 肌肉上,只有少数关于颅面肌 VML 损伤的报道 12,13,14.这带来了一个潜在的重要转化研究空白,因为现有文献表明,颅面和肢体与躯干肌肉之间的发育生物学以及再生能力存在显着差异15,16。事实上,面部两侧有 20 多块肌肉——这反映了颅面区域参与执行许多基本任务的事实,如眨眼、吞咽和咀嚼15。此外,即使在颅面肌之间,在再生能力方面也存在差异。例如,眼外肌似乎比肢体肌肉再生得更快17。相比之下,咬肌的再生反应比胫骨前肌 (TA) 慢18。这些差异可能至少部分是由于肌肉的起源是鳃异体还是体节来源的——导致卫星细胞的数量不同,以及常驻卫星细胞群的不同基因表达谱19。考虑颅面肌肉以及相对于肢体和躯干肌肉的独特特征,可能会为改进解决肌肉特异性 VML 损伤的定制治疗方案的治疗开发提供重要的机制见解。这些肌肉特异性差异也可以解释片状肌肉(例如背阔肌)作为头颈部重建手术的供体肌肉组织转移选择的已知局限性 20,21,22。
无论 VML 损伤的位置如何,目前都没有可以恢复完整形式和功能的治疗方法。金标准临床管理包括自体组织转移和康复;然而,前者通常不会提高力量,并可能导致供体部位发病率 3,23,而后者改善了肌肉的运动范围,对肌肉的功能恢复或收缩力量的恢复影响最小 1,6。由于所有这些原因,正在进行研究,以开发更有效的治疗方法来治疗 VML 损伤后功能性肌肉组织的再生。最近的一项分析强调了 VML 损伤大鼠模型的临床前研究对于推进 VML 修复的再生技术解决方案至关重要1.
如之前的工作 5,8,9,10,24,25 所述,评估 VML 后的功能恢复对于评估治疗干预的有效性至关重要。具体来说,虽然伤口愈合和体积恢复是 VML 修复的关键特征,但测量受伤和治疗后的力恢复有助于阐明导致 VML 缺陷的多尺度生物力学机制,以及驱动功能恢复的机制。因此,在组织修复、体积恢复和增强肌肉力量之间建立联系是确定 VML 修复最有效的再生解决方案的绝对要求9。
在这方面,有三种主要方法可以进行这些功能测量:(1) 体外,(2) 原位和 (3) 体内测试 — 每种方法都有自己的优点和缺点8。例如,体外测试涉及检查生物体外的孤立肌肉功能,并提供了一个机会,可以使用影响肌肉兴奋性和收缩的各种药物和化学物质更直接/特异性地纵肌肉刺激26。尽管这种方法允许对肌肉功能和恢复的细胞和分子方面进行详细研究27,但它会去除血液供应和神经支配,这限制了它对真实肌肉功能的概括程度 8,26。原位测试评估肌肉功能,而肌肉仍处于其自然解剖位置但与周围组织隔离25,28。虽然这种方法维持了神经支配和血液供应,但肌肉的分离仍然会限制研究结果对体内环境的适用性。此外,也许最重要的是,原位和体外测试都是排除纵向测试的最终程序——这对于跟踪同一动物的功能随时间推移的恢复是必要的。相比之下,体内测试涉及在其天然环境中评估肌肉功能,可以更全面地了解生理环境中的肌肉表现29。体内研究也是侵入性最小的技术,可以在研究的时间过程中重复进行29。使用经皮神经电刺激,可以收集特定肌肉的功能测量值,同时保持肌腱、脉管系统和神经支配完好无损30。这些纵向评估可以深入了解同一只动物在不同愈合阶段发生的细微但重要的变化。这种方法通常用于小型啮齿动物模型 8,31,32,33;然而,它也被用于猪30 和狗34 的大型动物模型中。
目前有三项已发表的关于颅面 VML 损伤后功能恢复评估的研究。Rodriguez 等人报告了一种修复绵羊颧骨大肌颅面 VML 损伤模型的方法。他们的方法详细说明了只能在最终研究时间点实施的 原位 测试方案,因此不允许在单个动物内进行纵向评估13。Kim 等人描述了一种使用纳米膜电子学跟踪 VML 损伤后小鼠咀嚼的连续肌电图数据的方法。他们报告说,与对照组相比,受伤小鼠的信号明显较低,但是,他们还指出,运动伪影会影响信号分析,并且小鼠偶尔会尝试刮擦电路。此外,无胸腺裸鼠被用来允许纳米膜安全地附着在皮肤上,这目前阻止了这种方法在更常用(且具有成本效益)的动物模型中更广泛地使用12。最后,Zhao 等人描述了小鼠咬肌中一个临界大小的 VML 缺陷,它损害了动物的营养,这反映在体重增加显着减少上,作为功能结果14。考虑到这些研究,本文描述了一种通用且微创的方法,用于通过皮下电极刺激三叉神经来对大鼠下颌损伤前后大鼠颌骨的收缩功能进行 体内 纵向评估。当测试通过一系列不断增加的模拟频率 (20-200 Hz) 运行时,传感器会测量肌肉产生的力。这些测量可以确定肌肉僵硬和最大破伤风等。以下方案旨在评估创伤性 VML 损伤后同侧咬合力的功能恢复,因此,还包括用于手术创建经过验证的 VML 损伤的方案。这种方法可以很容易地在各种各样的大鼠和小鼠身上实施——并且,通过适当的设备修改,也适用于更大的动物模型和 VML 损伤30。
研究方案
所有动物处理和程序均已根据弗吉尼亚大学机构动物护理和使用委员会 (IACUC) 指南获得批准和完成。这些实验中使用的大鼠是 12-14 周龄的雄性 Lewis 大鼠,手术时体重为 324.8 ± 12.72 g。所用试剂和设备的详细信息列在 材料表中。
1. 咬肌 VML 损伤
- 设备准备
- 手术前,确保所有必需的器械都已适当消毒:手术单、手术刀、镊子、微剪刀、止血钳、缝合线和纱布。
- 打开加热平台的电源并将其设置为 37 °C。
- 将无菌眼药膏涂抹在双眼上,以防止麻醉下眼睛干涩。将动物放入麻醉诱导室中并输送 2%-3% 异氟醚(遵循机构批准的方案)。
- VML 损伤的手术创建
- 在将动物从腔室中取出之前,请确保动物已正确麻醉。
注意:如果动物对脚趾捏没有反应,可以确定这一点。 - 称重并将动物放在左侧侧向位置的手术板上,将其鼻子牢固地放在鼻锥中,以便继续施用异氟醚。
- 通过提供适当的镇痛药、剃掉面部右侧并通过三次更换碘和酒精拭子对该区域进行消毒,为动物做好手术准备。在这些研究中,缓释丁丙诺啡用于镇痛 (0.65 mg/kg 体重)。
- 沿着大鼠的颊侧区域做一个大约 2 cm 的切口开始手术。切口应与动物的鼻子和耳朵成一直线。使用钝器解剖将皮肤和筋膜分开。
- 沿着筋膜做一个类似的切口,轻轻地将其从下面的咬肌上解剖开来。
- 找到颊神经和边缘神经(图 1A)。使用无菌手术记号笔和尺子标记要去除的区域。该区域应为位于面神经之间的暴露咬肌中心的 10 毫米 x 5 毫米矩形(图 1B)。
- 小心地使用微型剪刀开始去除组织。确保最终损伤达到约 4 毫米的深度,并切除 150 毫克组织(图 1C)。去除的组织将来自浅表咬肌的整个厚度,并将部分进入深咬肌。
注:在这些实验中去除的组织的平均质量为 146.1 毫克±1.16 毫克。 - 分别使用可吸收 (6-0) 和不可吸收 (5-0) 间断缝合线闭合筋膜和皮肤。
- 在将动物从腔室中取出之前,请确保动物已正确麻醉。
- 清理和监控
- 缝合后,关闭麻醉气体,将动物保持在加热的表面上,以监测其恢复意识。一旦老鼠开始恢复意识,将动物放回笼子里并继续监测,直到它醒来并可以走动。
- 手术后 3 天,检查动物并评估是否有任何疼痛或不适的迹象。
- 手术后 7 天,为动物提供软食,以减少下巴的压力并保持动物水分/喂养良好。
- 手术后 7-10 天移除中断的缝合线,确保在移除前伤口完全闭合。
- 在研究的终点之后,根据 IACUC 指南对动物实施安乐死。将咬肌浸入液氮或液氮冷却的异戊烷中,取出咬肌并快速冷冻。
注:冷冻组织样品可在 -80 °C 下长期储存,以备将来组织学评估。
2. 颌骨 体内 功能评估
- 设备准备
- 检查并确保所有设备的正确连接。
- 按顺序打开 (1) 台电脑,(2) 双相刺激器,(3) 双模杠杆系统,最后 (4) 加热平台,将其加热至 37 °C。
注意: 用户手册规定刺激器和杠杆系统的预热时间为 1 分钟,以产生准确的读数。此外,在测试任何动物之前,让平台完全加热 10-15 分钟。 - 将无菌眼药膏涂抹在双眼上,以防止麻醉下眼睛干涩。将待测动物置于麻醉诱导室中,供应 2%-3% 异氟醚。
- 将聚四氟乙烯涂层的电极尖端置于 70% 乙醇中,对其进行消毒。
- 找到并打开 Dynamic Muscle Control (DMC) 软件。这将是执行功能评估所必需的。
- 软件设置
- 在 DMC 软件中,在设置菜单中找到 Instant Stim 并将参数更改为所需的值。在这项研究中,没有参数从其预设中更改(图 2A)。
- 在 Setup 菜单下,创建并选择用于存储数据的 autosave 文件夹。
- 在软件屏幕底部附近,找到一个名为 Autosave Base 的框。将其更改为特定于被测试动物的标题,例如“rat#-timepoint”(图 2B)。
- 选择 软件屏幕顶部的 Sequencer 。在打开的新窗口中,选择 Open Sequence 在屏幕底部。在打开的文件资源管理器中选择预制序列。这将使用 Sequence 窗口填充参数列表,例如频率、刺激持续时间和休息时间(图 2C)。
- 点击 加载序列 其次是 关闭窗口.
注意:本协议中使用的序列由 9 个步骤(抽搐、20 Hz、40 Hz、50 Hz、60 Hz、80 Hz、100 Hz、150 Hz、200 Hz)组成,每个步骤之间休息 20 秒。除了抽搐刺激外,所有步骤的持续时间均为 500 毫秒。应根据每个实验室的特定检测目标调整序列方案。
- 点击 加载序列 其次是 关闭窗口.
- 要打开新窗口并启用实时数据采集的查看,请选择 File > Live Data Monitor。
- 在 Live Data Monitor (实时数据监控器 ) 窗口中,手动设置 时间刻度、最小值 y 值和 y 值最大值 ,或者通过选中复选框来启用自动缩放。
- 动物准备
- 在将动物从麻醉室中取出之前,请确保动物处于正确的麻醉平面内。
- 将动物置于仰卧位,将鼻子牢固地放在鼻锥中,以便继续施用异氟醚。在老鼠下巴的上半部分放置一个固定环,将其鼻子牢牢地固定在平台上。
- 在下巴的实验侧剃掉动物的脖子和脸。
- 通过在动物的手臂和胸部放置并系上一条带子来固定动物的上半部分。
- 使用位于钻机平台附近的三个旋转旋钮调整咬合杆位置,以控制 X、Y 和 Z 平面(图 3A)。使用顶部旋钮,将咬合杆向下拉向动物,然后使用其他两个旋钮将咬合杆的末端调整到刚好在动物的下巴上方。
- 用镊子将挂环钩在动物的下牙上,以固定头部并防止其移动(图 3B)。
注意: 该环位于距离力传感器 3 厘米的咬合杆上钻的孔中。首次使用前应校准系统。 - 调整杠杆的高度以增加钳口的张力。这些实验中使用的可重复基线张力为 ~0.5 N。
- 电极放置
- 触诊动物的下颌并找到下颌骨的后角。将电极皮下放置在角落的两侧,相距约 2-3 毫米。电极应插入 3-5 mm 的深度。使用鳄鱼夹和支架将电极固定到位。
- 在 Live Data Monitor 窗口中,单击标记为 Instant Stim 的橙色大按钮以将其激活。
- 在每次刺激期间,监视器应开始显示向上的峰值。根据需要使用旋钮调整电极位置和杠杆臂位置。只应观察到下颌同侧的激活(图4)。
- 在高功率双相刺激器上,中心附近有两个旋钮,分别标记为 “Range” 和 “Adjust”。开始转动 Range 旋钮以调制安培数。随着安培数的增加,瞬时刺激峰值将开始增加幅度,直到它们趋于稳定 - 确定为三个连续刺激导致相同收缩反应的水平。
- 避免将安培数调得太高,即不超过观察到最大峰值的安培数的 20% - 因为这会导致相邻肌肉的募集和力读数不准确。
- 转动 Adjust 旋钮以调制当前 “Range” 用于刺激下巴的百分比。可能需要增加或减少电流以优化抽搐响应。
- 确认电极仍牢固就位并停止 即时刺激。
- 在实时数据监视器中橙色的“Instant Stim”按钮下方,找到灰色的 Start Sequence 按钮并单击它。
- 在整个刺激方案的持续时间内继续监测曲线。随着刺激频率的增加,产生的最大力也会增加。一旦达到破伤风,力曲线就会趋于平稳(图 5A)。
- 清理
- 完成功能刺激序列后,取出电极并用 70% 乙醇擦拭干净。如果这是最后要测试的动物,则可以将电极放回其盖子中。
- 关闭麻醉气体,但将动物保持在加热的表面上,以监测其恢复意识。一旦老鼠开始恢复意识,将其放回笼子中并继续监测,直到动物醒来并可以走动。
- 关闭用于数据采集的设备并擦拭所有表面。
3. 数据分析
注意:该方法之前已被描述为记录大鼠 TA8 体内功能测试的方法。数据分析旨在确定本研究的意图,协议可能会根据用户的目标而改变。
- 找到并打开 Dynamic Muscle Analysis 软件。
- 单击 High Throughput 菜单并选择 Force Frequency Analysis 以同时分析多个样品。
- 选择 Pick Files 并突出显示所需数量的数据文件以进行分析。如果在文件系统中明确命名了样本,也可以使用 “Pick Folder” 按钮。
- 选中 Remove Baseline 复选框。这将自动从每次试验记录的最大力中删除基线力,从而提供绝对最大值。
- 单击 “分析” 按钮,然后单击 “将表格导出到 Excel ”,其中数据可以保存为电子表格。确保 “Start Cursor” 和 “End Cursor” 值准确捕获刺激的时间戳。如果需要,可以手动设置这些值。
- 打开保存的电子表格。
注意: 使用 “Maximum” 列,用户可以计算在所有频率下产生的最大力。还可以生成力-频率曲线(图 5)。
结果
正如先前出版物中所述,手足搓曲线可用于区分最佳结果和次优结果8。当肌肉被刺激到其最大力量并在整个破伤风性收缩期间保持该最大力量时,可以获得理想的结果。单个抽搐的总和变成强直曲线通常会在 100 Hz 或之后开始出现。图 5A 证明了这一点,因为 150 Hz 的理想曲线在刺激开始时具有急剧上升,在最大力值处处于平坦的平台期,振荡最小,当刺激停止时,急剧的垂直下降。非理想的破伤风曲线可能在平台期显示振荡,并可能显示负斜率或正斜率(图 5C,D)。
根据研究人员的目标和研究的实验设计,该功能测试方案的结果可能会有所不同。在该协议的情况下,绝对最大力是根据所有刺激频率凭经验确定的,并在每个时间点绘制成图表以进行测试。这允许在咬肌中产生所述 VML 损伤后每 4 周比较基线最大力产生与最大力产生(图 1D)。为了进行比较,还在每个时间点测试了一组未受伤的动物 (n = 4) (图 1E)。还比较了每个时间点的动物体重(图 1F)。在 VML 后 4、 8 和 12 周,大鼠分别产生 7.958 N ±1.797 N、7.183 N ±1.450 N 和 7.823 N ± 0.626 N 的平均最大力。单向重复测量方差分析 (ANOVA) 与 Fisher 最小显著性差异 (LSD) 事后成对比较确定,在 VML 损伤后的任何时间点,这些值之间没有统计学上的显着差异, 然而,它们都与 10.031 N ±0.564 N 的平均基线力显著不同。
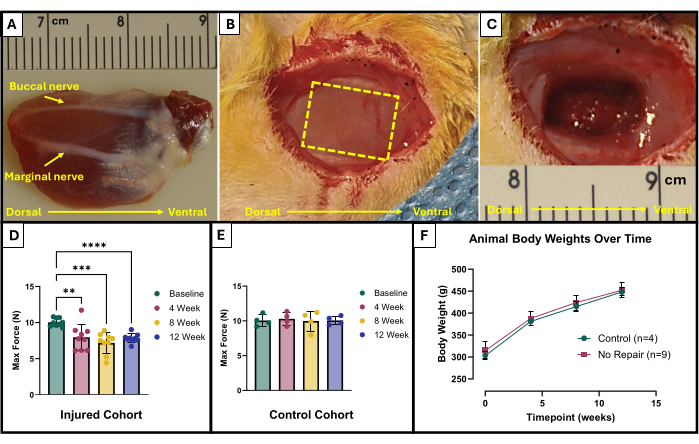
图 1:VML 损伤咬肌的手术示意图和功能结果。外植的咬肌显示解剖方向以及造成损伤的神经标志 (A)。VML 损伤产生之前和 (C) 手术后的动物。图像都以与 (A) 相同的方向呈现肌肉。黄色虚线表示要切除肌肉的区域。在咬肌 (D) 受到 VML 损伤 (n = 9) 的大鼠以及未受伤的年龄匹配的对照大鼠 (n = 4) (E) 中,在基线和时间上产生的最大力。大鼠体重随时间变化的图表 (F)。(D) 表示具有 Fisher LSD 事后成对比较的单向重复测量方差分析,其中 **= p < 0.01,***= p < 0.001,****= p < 0.0001。(A) 和 (C) 中的标尺以厘米为单位,刻度以毫米为单位。请单击此处查看此图的较大版本。
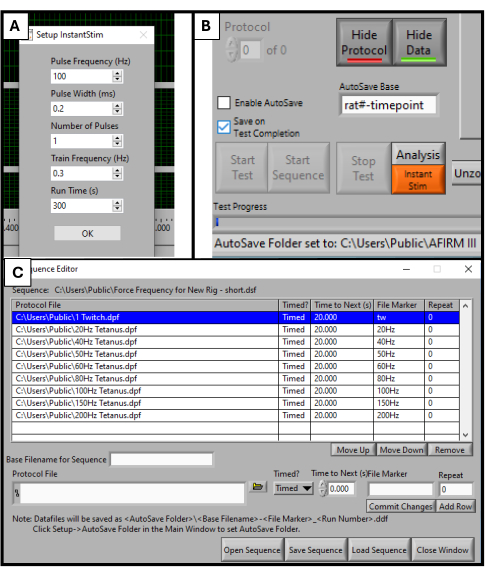
图 2:用于功能测试的软件初始化。 DMC 软件的参数设置。将 Instant Stim 设置为所需的值 (A)。软件图形用户界面和“自动保存基本”设置框 (B) 的位置。选择用于测试的 9 步方案序列 (C)。此处显示的值是用于本研究的示例值,但可能需要根据其他特定用例对其进行优化和调整。 请单击此处查看此图的较大版本。
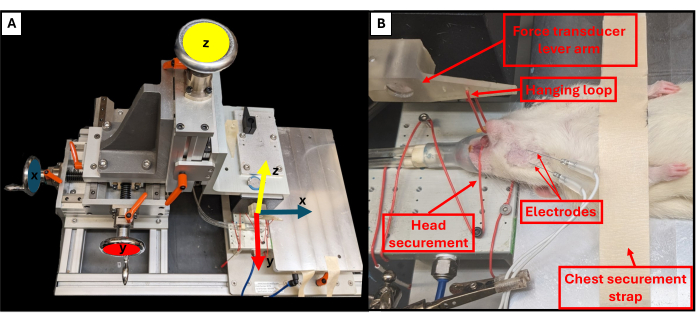
图 3:功能性装置运动轴和正确的动物定位。 示意图说明了功能测试台上三个调节轮中的每一个与杠杆臂 (A) 的相应运动轴之间的关系。大鼠进行功能测试的示例图像,显示动物在平台上的正确仰卧位和其他重要的钻机组件 (B)。 请单击此处查看此图的较大版本。
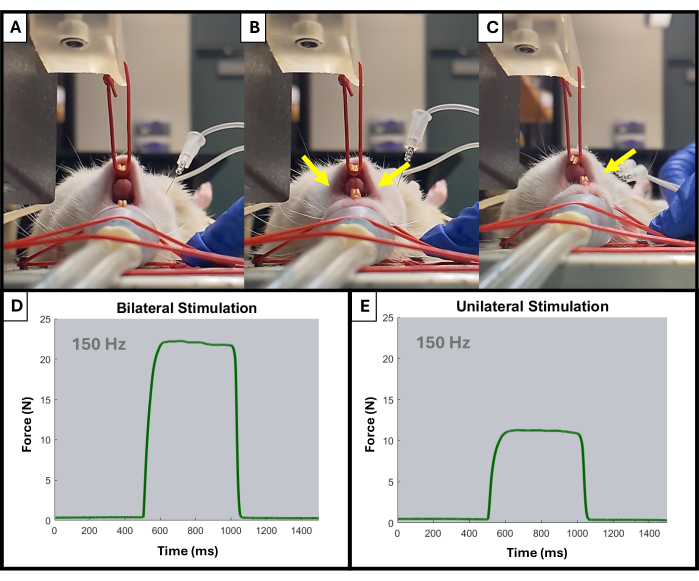
图 4:测试期间单侧和双侧下颌激活的示例。 (A) 显示大鼠的下巴在受到任何刺激之前处于静止状态。电极放置不当会导致双侧下颌收缩,如黄色箭头 (B) 所示,而电极放置正确会导致所需的同侧收缩 (C)。黄色箭头表示下巴的收缩点。还显示了双侧 (D) 和单侧 (E) 肌肉激活的 150 Hz 力-时间曲线示例。 请单击此处查看此图的较大版本。
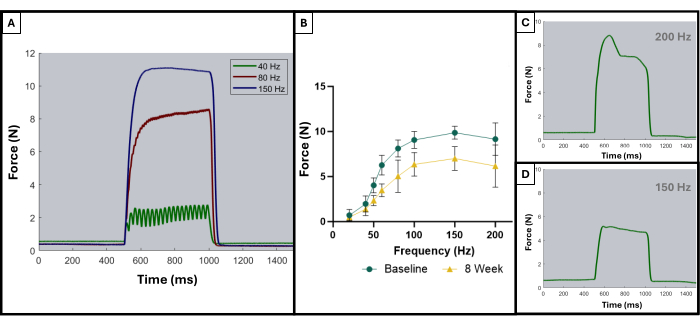
图 5:可接受和不可接受的试验的代表性刺激-反应曲线。 40、80 和 150 Hz (A) 的刺激曲线示例,用于演示在强直性收缩之前和期间要寻找什么。随着刺激频率的增加,记录的峰值张力也更高,这可以在力-频率曲线 (B) 中观察到,该曲线显示了受伤动物 (n = 9) 在基线和 VML 创建后 8 周的平均值。(C,D) 展示了力响应形状的代表性示例,这些示例表明由于破伤风不当而需要调整电极。 请单击此处查看此图的较大版本。
讨论
该协议描述了一种简单而可靠的方法,用于对大鼠下颌中产生的同侧咬合力进行体内功能测试。还描述了一种在大鼠咬肌中手术造成 VML 损伤的方法。这些方法结合起来,提供了一个生物学相关的动物模型,用于对创伤性颅面损伤前后的功能恢复进行纵向评估。虽然其他测试方法,如体外和原位,也可以提供有价值的信息,但它们需要隔离肌腱并从其天然环境中去除组织,从而限制了它们对更好地了解体内功能结果的适用性 8,25,26,27,28 .通过适当的培训和练习,研究人员将能够快速定位动物进行测试,并进行必要的调整以实现最大的肌肉力量产生。
应为每只动物验证一些技术细节,以确保正确的电极放置和刺激。首先,应固定上门牙,使大鼠的头部与加热的平台完全接触。这也将使大鼠的鼻子保持在鼻锥中,以便连续施用吸入麻醉剂。如果头部没有保持在正确的位置,当基线张力偏离时,力读数会出现不一致。此外,动物的身体应该是仰卧的,它的脊椎应该是直的。将动物保持在正确的位置将有助于将电极放置在正确的位置和维护。最后,电极的放置可能很困难,因为它们必须放置在适当的深度和间距,以仅刺激下颌的实验侧。警惕和实践对于熟练放置电极以获得可重复和可靠的结果有关。电极会很快变钝,因此需要经常更换。电极放置不良的标志是辅助肌肉激活、正/负斜率的力读数(刺激过程中电极的运动)或未融合/振荡的强直波形8 (图 5C、D)。
此外,这种方法存在一些局限性,值得在此系统的未来应用中提及和考虑。首先,虽然对于本研究中所做的测量来说已经足够了,但用于固定上颌的环可能不是最刚性的系统。相反,使用耳杆的立体定位方法可以更好地固定大鼠的上颌。此外,使用被动张力值作为使用该方法进行测试的设定位置,如果肌肉位于最佳长度 (Lo),这可能不会产生最大的力。事实上,LO 可以通过按照本文所述定位动物,然后在运行抽搐刺激时以小 (0.5-1 mm) 的增量纵下颌咬合来确定 -LO 确定为产生最大抽搐力的最佳测试位置。然而,咬肌具有相当独特的几何形状和运动能力 35,36,因此,其活动长度范围比肢体肌肉(通常在 Lo 周围活动)的特征要宽得多。然而,与咬人相比,咀嚼发生在狭窄的范围内。因此,这个问题没有完美的方法。因此,尽管设定基线张力不是解决这个问题的唯一方法,但这样做是有逻辑的科学依据的,因为下颌肌肉的最佳长度超出了下巴的自然张开。无论如何,在给定的被动张力下的最大力仍然为函数的各个方面提供了重要的见解 - 即使它们与 Lo 处的最大力不同。显然,有必要进一步研究咬肌的力-长关系。最后,该方法着眼于大鼠对三叉神经的刺激,该神经分为三个分支:V1-V3。虽然 V3 或下颌神经是唯一具有运动成分的分支,但它确实支配多块肌肉,包括咬肌、颞肌、翼状肌和髓舌骨37。这一点很重要,因为这意味着该方法并不专门报告咬肌力,这可能与其他研究调查有关。
尽管存在这些技术方面和限制,但这种方法被证明是稳健且一致的。虽然本文仅描述了同侧测试,但可以轻松修改该方案以包括对下巴另一侧的额外测试。咬肌收缩/功能的双侧测试将允许在单只动物内进行健康/受伤的比较,也许可以阐明受伤和/或控制侧(未受伤侧)的重要代偿变化。总体而言,该模型为以微创方式评估纵向肌肉功能以及功能恢复提供了强大的工具。因此,该系统将适用于评估参与 VML 介导的功能缺陷的生物力学机制,以及测试各种疗法修复颅面区域 VML 损伤的疗效。
披露声明
作者没有什么可披露的。
致谢
Myologica LLC 共享用于执行功能评估的设备。此出版物中报告的研究得到了国立卫生研究院国家牙科与颅面研究所的支持,奖项编号为U24 DE029463。内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
参考文献
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。