Method Article
Valutazione funzionale in vivo del muscolo massetere del ratto dopo la creazione chirurgica di una lesione da perdita muscolare volumetrica (VML)
In questo articolo
Riepilogo
Le lesioni da perdita muscolare volumetrica (VML) superano la capacità rigenerativa endogena, con conseguente deficit funzionale permanente. L'attuale ricerca VML si concentra principalmente sui muscoli degli arti e del tronco. Per estendere gli studi meccanicistici della VML ai muscoli craniofacciali, questo articolo descrive un metodo in vivo per la valutazione longitudinale della funzione del muscolo massetere pre e post-lesione VML.
Abstract
La perdita muscolare volumetrica (VML) è prevalente nelle popolazioni civili e militari e rappresenta una lesione muscolare scheletrica debilitante che supera la naturale capacità rigenerativa del corpo. Queste lesioni distruggono non solo le fibre muscolari, ma anche i nervi, i vasi sanguigni e la matrice extracellulare, travolgendo la capacità rigenerativa del muscolo scheletrico e portando a grave fibrosi e carenze permanenti nella struttura e nella funzione muscolare. L'attuale gestione clinica ha molti limiti e, pertanto, la ricerca è in corso per sviluppare approcci terapeutici più efficaci. In particolare, tuttavia, gran parte dell'enfasi preclinica sulle lesioni VML si è concentrata sui muscoli degli arti e del tronco, con un'indagine limitata sui muscoli craniofacciali. Le differenze nella biologia dello sviluppo e nella capacità rigenerativa tra i muscoli craniofacciali e quelli degli arti/tronchi possono fornire informazioni cruciali che guidano opzioni di trattamento VML più specifiche per lesione. Inoltre, la valutazione del recupero funzionale è fondamentale per stabilire l'efficacia terapeutica. A questo proposito, il test in vivo della contrazione muscolare con la stimolazione nervosa percutanea è un metodo minimamente invasivo che consente una valutazione funzionale ripetuta nel corso di uno studio, nello stesso animale. Alla luce di queste considerazioni, questo articolo descrive un metodo per la valutazione in vivo della funzione muscolare nel muscolo massetere di ratto prima e dopo una lesione VML. Questo protocollo è il primo caso pubblicato a dettagliare la creazione e la valutazione funzionale di una lesione VML craniofacciale biologicamente rilevante nel ratto.
Introduzione
Le lesioni traumatiche e chirurgiche dei tessuti molli che coinvolgono il muscolo scheletrico sottostante rimangono una delle maggiori sfide per la ricostruzione dei tessuti sia per i civili che per i guerrieri feriti1. Infatti, quasi il 20% delle lesioni sul campo di battaglia si verifica anche nelle regioni craniofacciali dei guerrieri feriti (testa e viso)2. Complessivamente, i traumi alle estremità e le lesioni alla testa e al collo rappresentano il >80% delle lesioni da combattimento nei recenti conflitti2. Nonostante la capacità piuttosto nota del muscolo scheletrico di riparare, rigenerarsi e rimodellarsi dopo un infortunio, queste lesioni più gravi, che comportano la perdita di una parte sostanziale del tessuto muscolare, non sono in grado di guarire da sole e sono indicate come lesioni da perdita muscolare volumetrica (VML). Per definizione, la VML provoca deficit estetici e funzionali permanenti del muscolo lesionato o dell'unità muscolare3.
È interessante notare che, nonostante la prevalenza di lesioni VML craniofacciali 2,4, gran parte della ricerca fino ad oggi si è concentrata sui muscoli degli arti 5,6,7,8 e del tronco 9,10,11, con solo una manciata di segnalazioni su lesioni VML nei muscoli craniofacciali 12,13,14. Ciò presenta una lacuna potenzialmente importante nella ricerca traslazionale, poiché la letteratura esistente suggerisce che ci sono differenze significative sia nella biologia dello sviluppo, sia nella capacità rigenerativa tra i muscoli craniofacciali e quelli degli arti e del tronco15,16. In effetti, ci sono più di 20 muscoli su ciascun lato del viso, riflettendo il fatto che la regione craniofacciale è coinvolta nell'esecuzione di molte attività essenziali diverse come sbattere le palpebre, deglutire e masticare15. Inoltre, anche tra i muscoli craniofacciali, sorgono differenze rispetto alla capacità rigenerativa. Ad esempio, i muscoli extraoculari sembrano rigenerarsi più rapidamente dei muscoli degli arti17. Al contrario, il massetere mostra una risposta rigenerativa più lenta rispetto al tibiale anteriore (TA)18. Queste differenze possono essere dovute, almeno in parte, al fatto che le origini dei muscoli siano branchiomeriche o derivate dai somiti, risultando sia in diverse quantità di cellule satelliti, sia in profili di espressione genica distinti delle popolazioni di cellule satelliti residenti19. La considerazione delle caratteristiche uniche tra i muscoli craniofacciali, così come rispetto ai muscoli degli arti e del tronco, può fornire importanti intuizioni meccanicistiche per migliorare lo sviluppo terapeutico di opzioni di trattamento personalizzate che affrontano le lesioni VML muscolo-specifiche. Queste differenze muscolo-specifiche possono anche spiegare le limitazioni note dei muscoli simili a fogli, come il gran dorsale, come le opzioni di trasferimento del tessuto muscolare del donatore per gli interventi di chirurgia ricostruttiva della testa e del collo 20,21,22.
Indipendentemente dalla posizione della lesione VML, attualmente non esistono trattamenti in grado di ripristinare la piena forma e funzione. La gestione clinica gold standard comprende il trasferimento di tessuto autologo e la riabilitazione; Tuttavia, il primo in genere non migliora la forza e può provocare morbilità nel sito donatore 3,23, mentre il secondo migliora la gamma di movimento, con un impatto minimo sul recupero funzionale o sul ritorno della forza contrattile, nel muscolo 1,6. Per tutti questi motivi, è in corso la ricerca per sviluppare approcci terapeutici più efficaci per la rigenerazione del tessuto muscolare funzionale a seguito di lesione VML. Una recente analisi ha evidenziato l'importanza critica degli studi preclinici su modelli di ratto di lesione VML per l'avanzamento di soluzioni tecnologiche rigenerative per la riparazione VML1.
Come notato in lavori precedenti 5,8,9,10,24,25, la valutazione del recupero funzionale dopo VML è fondamentale per valutare l'efficacia degli interventi terapeutici. In particolare, mentre la guarigione delle ferite e il recupero del volume sono caratteristiche chiave della riparazione VML, la misurazione del recupero della forza dopo l'infortunio e il trattamento aiuta a far luce sui meccanismi biomeccanici multiscala responsabili dei deficit VML, nonché su quei meccanismi che guidano il recupero funzionale. Pertanto, stabilire un legame tra riparazione tissutale, recupero del volume e maggiore forza muscolare è un requisito assoluto per identificare le soluzioni rigenerative più efficaci per la riparazione VML9.
A questo proposito, esistono tre metodi principali per effettuare queste misurazioni funzionali: (1) test in vitro, (2) test in situ e (3) test in vivo, ognuno dei quali offre i propri vantaggi e svantaggi8. Ad esempio, i test in vitro comportano l'esame della funzione muscolare isolata al di fuori dell'organismo vivente e offrono l'opportunità di manipolare in modo più diretto/specifico la stimolazione muscolare con una varietà di farmaci e sostanze chimiche che influenzano l'eccitabilità e la contrazione muscolare26. Sebbene questo metodo consenta indagini dettagliate sugli aspetti cellulari e molecolari della funzione muscolare e del recupero27, rimuove l'afflusso di sangue e l'innervazione, il che limita la capacità di ricapitolare la vera funzione muscolare 8,26. I test in situ valutano la funzione muscolare mentre il muscolo è ancora nella sua posizione anatomica naturale ma isolato dai tessuti circostanti25,28. Sebbene questo metodo mantenga l'innervazione e l'afflusso di sangue, la separazione del muscolo può ancora limitare l'applicabilità dei risultati all'ambiente in vivo. Inoltre, e forse la cosa più importante, sia i test in situ che quelli in vitro sono procedure terminali che precludono i test longitudinali, necessari per consentire di monitorare il recupero funzionale nel tempo sullo stesso animale. Al contrario, i test in vivo, che comportano la valutazione della funzione muscolare nel suo ambiente nativo, consentono una comprensione più completa delle prestazioni muscolari in un contesto fisiologico29. Gli studi in vivo sono anche la tecnica meno invasiva e possono essere eseguiti ripetutamente nel corso del tempo di uno studio29. Utilizzando la stimolazione nervosa elettrica percutanea, è possibile raccogliere misurazioni funzionali in muscoli specifici lasciando intatti tendini, vascolarizzazione e innervazione30. Queste valutazioni longitudinali possono fornire informazioni su cambiamenti sottili, ma importanti, che si verificano durante le diverse fasi di guarigione nello stesso animale. Questo metodo è comunemente impiegato nei piccoli modelli di roditori 8,31,32,33; Tuttavia, è stato utilizzato anche in modelli animali più grandi di Pig30 e Dog34.
Attualmente sono pubblicati tre studi sulla valutazione del recupero funzionale a seguito di lesioni da VML craniofacciale. Rodriguez et al. riportano un metodo per riparare un modello di lesione VML craniofacciale nel muscolo zigomatico maggiore ovino. Il loro metodo descrive in dettaglio un protocollo di test in situ che può essere implementato solo al momento dello studio terminale e, quindi, non consente una valutazione longitudinale all'interno di un singolo animale13. Kim et al. descrivono un metodo per l'uso dell'elettronica a nanomembrana per tracciare i dati dell'elettromiogramma continuo della masticazione del topo a seguito di una lesione VML. Hanno riportato un segnale significativamente più basso dai topi feriti rispetto al controllo, tuttavia, hanno anche notato che gli artefatti di movimento influenzavano l'analisi del segnale e che i topi cercavano occasionalmente di grattare via il circuito. Inoltre, sono stati utilizzati topi atimici nudi per consentire un fissaggio sicuro della nanomembrana alla pelle, il che attualmente impedisce un più ampio utilizzo di questo metodo nei modelli animali più comunemente usati (ed economici)12. Infine, Zhao et al. descrivono un difetto di VML di dimensioni critiche nel massetere del topo, che compromette la nutrizione negli animali, come riflesso in un aumento di peso corporeo significativamente ridotto, come risultato funzionale14. Tenendo conto di questi studi, questo articolo descrive un metodo versatile e minimamente invasivo per la valutazione longitudinale in vivo della funzione contrattile nella mascella di ratto prima e dopo una lesione VML tramite stimolazione del nervo trigemino con elettrodi sottocutanei. Mentre il test viene eseguito attraverso una serie di frequenze di simulazione crescenti (20-200 Hz), un trasduttore misura la forza generata dal muscolo. Queste misurazioni possono consentire di determinare, tra l'altro, la rigidità muscolare e il tetano massimale. Il protocollo seguente è progettato per valutare il recupero funzionale della forza del morso omolaterale a seguito di una lesione traumatica VML e, come tale, include anche un protocollo per la creazione chirurgica di una lesione VML convalidata. Questo metodo può essere facilmente implementato su un'ampia varietà di ratti e topi e, con le opportune modifiche dell'attrezzatura, è applicabile anche a modelli animali più grandi e lesioni VML30.
Protocollo
Tutte le procedure e le procedure di gestione degli animali sono state approvate ed eseguite in conformità con le linee guida del Comitato istituzionale per la cura e l'uso degli animali (IACUC) dell'Università della Virginia. I ratti utilizzati in questi esperimenti erano ratti Lewis maschi di 12-14 settimane del peso di 324,8 g ± 12,72 g al momento dell'intervento chirurgico. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei materiali.
1. Lesione VML del muscolo massetere
- Preparazione dell'attrezzatura
- Prima dell'intervento, assicurarsi che tutti gli strumenti necessari siano stati sterilizzati in modo appropriato: teli chirurgici, bisturi, pinze, microforbici, emostatici, suture e garze.
- Accendere una piattaforma riscaldata e impostarla a 37 °C.
- Applicare un unguento oftalmico sterile su entrambi gli occhi per prevenire la secchezza oculare in anestesia. Mettere l'animale nella camera di induzione dell'anestesia e somministrare isoflurano al 2%-3% (seguendo i protocolli approvati istituzionalmente).
- Creazione chirurgica della lesione VML
- Assicurarsi che l'animale sia adeguatamente anestetizzato prima di rimuoverlo dalla camera.
NOTA: Questo può essere determinato se l'animale non risponde a un pizzicamento delle dita. - Pesare e posizionare l'animale su una tavola chirurgica in posizione laterale sul lato sinistro, con il naso saldamente nel cono del naso per consentire la somministrazione continua di isoflurano.
- Preparare l'animale per l'intervento chirurgico somministrando l'analgesico appropriato, radendo il lato destro del viso e sterilizzando l'area attraverso tre cambi di tamponi di iodio e alcol. Per questi studi, per l'analgesia è stata utilizzata buprenorfina a rilascio prolungato (0,65 mg/kg di peso corporeo).
- Inizia l'intervento praticando un'incisione di circa 2 cm lungo la regione buccale del ratto. L'incisione deve essere in linea con il naso e l'orecchio dell'animale. Utilizzare la dissezione smussata per separare la pelle e la fascia.
- Fai un'incisione simile lungo la fascia e sezionala delicatamente lontano dal massetere sottostante.
- Localizzare i nervi buccale e marginale (Figura 1A). Utilizzare un pennarello chirurgico sterile e un righello per contrassegnare l'area da rimuovere. L'area dovrebbe essere un rettangolo di 10 mm x 5 mm al centro del massetere esposto che si trova tra i nervi facciali (Figura 1B).
- Utilizzare con cautela le microforbici per iniziare la rimozione dei tessuti. Assicurarsi che la lesione finale raggiunga una profondità di circa 4 mm con 150 mg di tessuto asportato (Figura 1C). Il tessuto rimosso proverrà dall'intero spessore del massetere superficiale e andrà parzialmente nel massetere profondo.
NOTA: La massa media di tessuto rimosso in questi esperimenti è stata di 146,1 mg ±1,16 mg. - Chiudere la fascia e la pelle utilizzando rispettivamente suture interrotte riassorbibili (6-0) e non assorbibili (5-0).
- Assicurarsi che l'animale sia adeguatamente anestetizzato prima di rimuoverlo dalla camera.
- Pulizia e monitoraggio
- Dopo la sutura, spegnere il gas di anestesia e tenere l'animale sulla superficie riscaldata per monitorare il suo ritorno alla coscienza. Una volta che il ratto inizia a riprendere conoscenza, rimetti l'animale nella gabbia e continua a monitorare fino a quando non è sveglio e deambulante.
- Per 3 giorni dopo l'intervento, controllare l'animale e valutare eventuali segni di dolore o disagio.
- Per 7 giorni dopo l'intervento, fornire all'animale cibo morbido per ridurre lo sforzo sulla mascella e mantenere gli animali ben idratati/nutriti.
- Rimuovere i punti di sutura interrotti 7-10 giorni dopo l'intervento, assicurandosi che la ferita sia completamente chiusa prima della rimozione.
- Dopo il punto temporale terminale dello studio, sopprimere gli animali secondo le linee guida IACUC. Espiantare i muscoli masseteri e congelare rapidamente immergendolo in azoto liquido o isopentano raffreddato con azoto liquido.
NOTA: I campioni di tessuto congelati possono essere conservati a lungo termine a -80 °C per una futura valutazione istologica.
2. Valutazione funzionale in vivo della mandibola
- Preparazione dell'attrezzatura
- Controllare e garantire il corretto collegamento di tutte le apparecchiature.
- Nell'ordine, accendere (1) computer, (2) stimolatore bifase, (3) sistema di leve a doppia modalità e, infine, (4) una piattaforma riscaldata per riscaldarlo a 37 °C.
NOTA: Il manuale dell'utente indica un tempo di riscaldamento di 1 minuto per lo stimolatore e il sistema di leve per produrre letture accurate. Inoltre, attendere 10-15 minuti affinché la piattaforma si riscaldi completamente prima di testare qualsiasi animale. - Applicare un unguento oftalmico sterile su entrambi gli occhi per prevenire la secchezza oculare in anestesia. Posizionare l'animale da testare nella camera di induzione dell'anestesia e fornire isoflurano al 2%-3%.
- Sterilizzare le punte degli elettrodi rivestite in politetrafluoroetilene immergendole in etanolo al 70%.
- Individua e apri il software Dynamic Muscle Control (DMC). Ciò sarà necessario per eseguire la valutazione funzionale.
- Configurazione del software
- Nel software DMC, trova Instant Stim nel menu di configurazione e modifica i parametri ai valori desiderati. In questo studio, nessun parametro viene modificato rispetto alle loro preimpostazioni (Figura 2A).
- Nel menu Configurazione , creare e selezionare una cartella di salvataggio automatico per archiviare i dati.
- Nella parte inferiore della schermata del software, individuare una casella intitolata Base di salvataggio automatico. Modificarlo con un titolo specifico per l'animale sottoposto a test, ad esempio "rat#-timepoint" (Figura 2B).
- Seleziona Sequencer nella parte superiore della schermata del software. Nella nuova finestra che si apre, seleziona Apri sequenza nella parte inferiore dello schermo. Seleziona la sequenza predefinita in Esplora file che si apre. In questo modo la finestra Sequenza verrà popolata con un elenco di parametri come la frequenza, la durata degli stimoli e il tempo di riposo (Figura 2C).
- Fare clic su Sequenza di caricamento e quindi su Chiudi finestra.
NOTA: La sequenza utilizzata in questo protocollo è composta da 9 passaggi (contrazione, 20 Hz, 40 Hz, 50 Hz, 60 Hz, 80 Hz, 100 Hz, 150 Hz, 200 Hz) con 20 s di riposo tra ciascuno. A parte la stimolazione delle contrazioni, tutti i passaggi hanno una durata di 500 ms. Il protocollo di sequenza deve essere adattato agli obiettivi di test specifici di ciascun laboratorio.
- Fare clic su Sequenza di caricamento e quindi su Chiudi finestra.
- Per aprire una nuova finestra e abilitare la visualizzazione dell'acquisizione dei dati in tempo reale, selezionare File > Live Data Monitor.
- Nella finestra Live Data Monitor impostare la scala cronologica, il valore y minimo e il valore y massimo manualmente o selezionando la casella per abilitare la scalabilità automatica.
- Preparazione degli animali
- Assicurarsi che l'animale si trovi nel piano di anestesia corretto prima di rimuoverlo dalla camera di anestesia.
- Posizionare l'animale in posizione supina con il naso saldamente nel cono del naso per consentire la somministrazione continua di isoflurano. Posiziona un anello di sicurezza sulla metà superiore della mascella del ratto per tenere saldamente il naso sulla piattaforma.
- Radere il collo e il viso dell'animale sul lato sperimentale della mascella.
- Fissa la metà superiore dell'animale posizionando e allacciando una cinghia sulle braccia e sul petto.
- Regolare la posizione della leva del morso utilizzando le tre manopole rotanti situate vicino alla piattaforma del rig per controllare i piani X, Y e Z (Figura 3A). Usando la manopola superiore, abbassa la leva del morso verso l'animale e usa le altre due manopole per regolare l'estremità della leva in modo che sia appena sopra il mento dell'animale.
- Usa una pinzetta per agganciare l'anello di sospensione attorno ai denti inferiori dell'animale per fissare la testa e impedirne il movimento (Figura 3B).
NOTA: L'anello si trova attraverso un foro praticato nella leva del morso a 3 cm di distanza dal trasduttore di forza. Il sistema deve essere calibrato prima del primo utilizzo. - Regolare l'altezza della leva per aumentare la tensione sulla ganascia. La tensione di base riproducibile utilizzata in questi esperimenti era di ~0,5 N.
- Posizionamento degli elettrodi
- Palpare la mascella dell'animale e individuare l'angolo posteriore della mandibola. Posizionare gli elettrodi per via sottocutanea attorno a entrambi i lati dell'angolo a circa 2-3 mm di distanza. Gli elettrodi devono essere inseriti a una profondità di 3-5 mm. Utilizzare una clip a coccodrillo e un supporto per tenere gli elettrodi in posizione.
- Nella finestra Live Data Monitor , fare clic sul grande pulsante arancione con l'etichetta Instant Stim per attivarlo.
- Il monitor dovrebbe iniziare a mostrare picchi verso l'alto durante ogni stimolazione. Regolare il posizionamento dell'elettrodo e la posizione del braccio di leva utilizzando le manopole secondo necessità. Deve essere osservata solo l'attivazione del lato omolaterale della mascella (Figura 4).
- Sullo stimolatore bifase ad alta potenza, ci sono due manopole vicino al centro, etichettate "Range" e "Adjust". Iniziare a ruotare la manopola Range per modulare l'amperaggio. All'aumentare dell'amperaggio, i picchi istantanei dello stimolo inizieranno ad aumentare di entità fino a stabilizzarsi, determinato come il livello al quale tre stimolazioni consecutive producono risposte contrattili identiche.
- Evitare di alzare troppo l'amperaggio, cioè non più del 20% al di sopra dell'amperaggio in cui sono stati osservati i picchi massimi, poiché ciò può comportare il reclutamento dei muscoli vicini e letture imprecise della forza.
- Ruotare la manopola di regolazione per modulare la percentuale della corrente "Range" utilizzata per stimolare la mascella. Potrebbe essere necessario un aumento o una diminuzione della corrente per ottimizzare la risposta di contrazione.
- Verificare che gli elettrodi siano ancora saldamente in posizione e arrestare lo stimolo istantaneo.
- Sotto il pulsante arancione "Instant Stim" nel monitor dei dati in tempo reale, individua il pulsante grigio Avvia sequenza e fai clic su di esso.
- Continuare a monitorare le curve per tutta la durata del protocollo di stimolazione. All'aumentare della frequenza di stimolazione, aumenterà anche la forza massima prodotta. Una volta raggiunto il tetano, le curve di forza si stabilizzeranno (Figura 5A).
- Pulizia
- Dopo aver completato la sequenza di stimolazione funzionale, rimuovere gli elettrodi e pulirli con etanolo al 70%. Se questo è l'ultimo animale ad essere testato, gli elettrodi possono essere rimessi nelle loro coperture.
- Spegni il gas anestetico ma tieni l'animale sulla superficie riscaldata per monitorare il suo ritorno alla coscienza. Una volta che il ratto inizia a riprendere conoscenza, rimettilo nella gabbia e continua a monitorare fino a quando l'animale non è sveglio e deambulante.
- Spegnere l'apparecchiatura utilizzata per l'acquisizione dei dati e pulire tutte le superfici.
3. Analisi dei dati
NOTA: Questo metodo è stato precedentemente descritto come la documentazione di un metodo per il test funzionale in vivo del TA8 del ratto. L'analisi dei dati è progettata per determinare le intenzioni di questo studio e i protocolli possono cambiare a seconda degli obiettivi dell'utente.
- Individua e apri il software Dynamic Muscle Analysis .
- Fare clic sul menu High Throughput e selezionare Analisi della frequenza di forza per analizzare più campioni contemporaneamente.
- Selezionare Seleziona file ed evidenziare tutti i file di dati desiderati per l'analisi. Il pulsante "Scegli cartella" può essere utilizzato anche se i campioni sono chiaramente nominati all'interno del file system.
- Selezionare la casella Rimuovi linea di base. In questo modo si rimuoverà automaticamente la forza di base dalla forza massima registrata per ogni prova, fornendo i valori massimi assoluti.
- Fare clic sul pulsante Analizza e quindi fare clic su Esporta tabella in Excel dove i dati possono essere salvati come foglio di calcolo. Assicurarsi che i valori "Cursore iniziale" e "Cursore finale" acquisiscano accuratamente il timestamp della stimolazione. Questi valori possono essere impostati manualmente, se necessario.
- Apri il foglio di calcolo salvato.
NOTA: Utilizzando la colonna "Massimo", l'utente può calcolare la forza massima prodotta su tutte le frequenze. È possibile generare anche la curva forza-frequenza (Figura 5).
Risultati
Come descritto in una precedente pubblicazione, le curve tetaniche possono essere utilizzate per distinguere i risultati ottimali dai risultati sub-ottimali8. Un risultato ideale si ottiene quando il muscolo viene stimolato alla sua massima forza e mantiene quel massimo per tutta la durata della contrazione tetanica. La somma delle singole contrazioni in curve tetaniche di solito inizia ad apparire a 100 Hz o dopo. La Figura 5A dimostra questo punto in quanto la curva ideale a 150 Hz ha una brusca ripresa all'inizio della stimolazione, una fase di plateau piatta al valore massimo della forza con oscillazione minima e una brusca oscillazione verticale verso il basso quando la stimolazione cessa. Le curve tetaniche non ideali possono mostrare oscillazioni durante la fase di plateau e possono mostrare una pendenza negativa o positiva (Figura 5C, D).
I risultati di questo protocollo di test funzionale possono essere rappresentati in modo diverso a seconda degli obiettivi dei ricercatori e del disegno sperimentale per lo studio. Nel caso di questo protocollo, la forza massima assoluta è determinata empiricamente da tutte le frequenze di stimolazione e rappresentata graficamente in ogni momento per il test. Ciò consente di confrontare la produzione di forza massima di base con la produzione di forza massima ogni 4 settimane dopo la creazione della lesione VML descritta nel massetere (Figura 1D). Per confronto, è stata testata anche una coorte di animali non feriti (n = 4) in ogni punto temporale (Figura 1E). Sono stati confrontati anche i pesi degli animali in ogni momento (Figura 1F). A 4, 8 e 12 settimane dopo la VML, rispettivamente, i ratti hanno prodotto una forza massima media di 7,958 N ±1,797 N, 7,183 N ±1,450 N e 7,823 N ± 0,626 N. L'analisi della varianza a misure ripetute unidirezionali (ANOVA) con la differenza meno significativa di Fisher (LSD) ha determinato che non c'erano differenze statisticamente significative tra questi valori in nessun punto temporale dopo la lesione VML, tuttavia, erano tutti significativamente diversi dalla forza media di base di 10,031 N ±0,564 N.
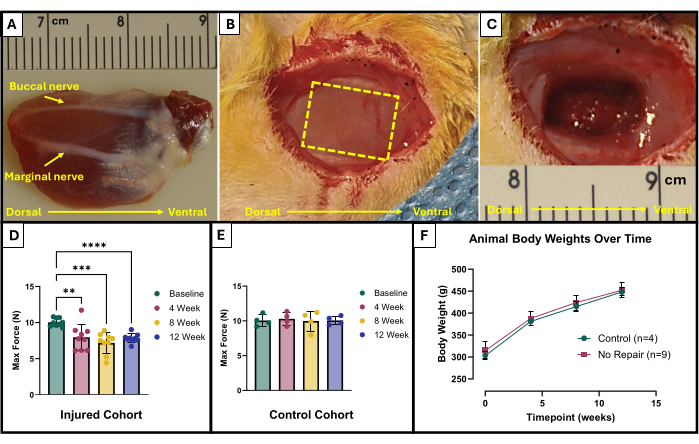
Figura 1: Schema chirurgico e risultati funzionali per il muscolo massetere con lesione VML. Muscolo massetere espiantato che mostra orientamento anatomico e punti di riferimento nervosi per la creazione di lesioni (A). Animale durante l'intervento chirurgico prima (B) e dopo (C) la creazione di lesioni VML. Le immagini sono tutte presentate con i muscoli con lo stesso orientamento di (A). La linea tratteggiata gialla indica la regione in cui il muscolo deve essere asportato. Produzione massima di forza al basale e nel tempo nei ratti che hanno ricevuto una lesione VML (n = 9) al massetere (D) e nei ratti di controllo di pari età che sono rimasti illesi (n = 4) (E). Un grafico del peso corporeo del ratto nel tempo (F). (D) rappresenta un'ANOVA a misure ripetute unidirezionale con confronti a coppie post hoc LSD di Fisher, dove **= p < 0,01, ***= p < 0,001, ****= p < 0,0001. I righelli in (A) e (C) sono in centimetri, con graduazioni in millimetri. Clicca qui per visualizzare una versione più grande di questa figura.
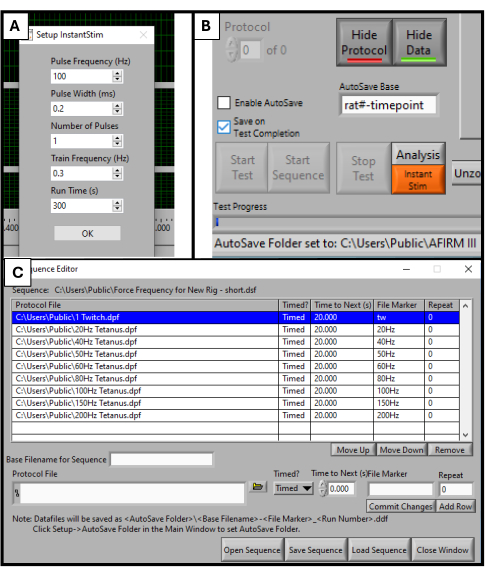
Figura 2: Inizializzazione del software per il test funzionale. Impostazione dei parametri per il software DMC. Impostazione di Instant Stim sui valori desiderati (A). Interfaccia utente grafica del software e posizione della casella di impostazione della base di salvataggio automatico (B). Selezione della sequenza di protocollo in 9 fasi utilizzata per il test (C). I valori visualizzati qui sono valori di esempio utilizzati per questo studio, ma potrebbe essere necessario ottimizzarli e regolarli a seconda dei casi d'uso specifici di altri. Clicca qui per visualizzare una versione più grande di questa figura.
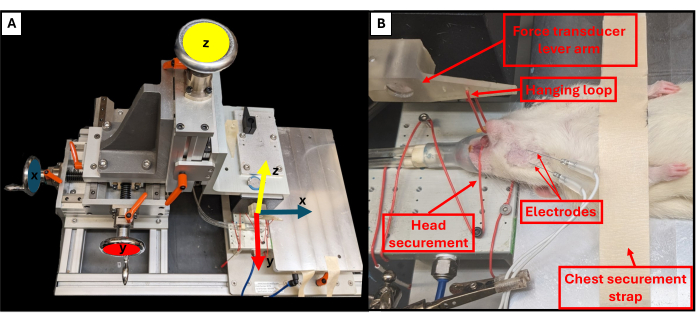
Figura 3: Assi di movimento funzionali del rig e corretto posizionamento degli animali. Lo schema illustra la relazione tra ciascuna delle tre rotelle di regolazione sul banco di prova funzionale e i corrispondenti assi di movimento per il braccio di leva (A). Immagine di esempio di un ratto sottoposto a test funzionali, che mostra il corretto posizionamento supino dell'animale sulla piattaforma e altri importanti componenti del rig (B). Clicca qui per visualizzare una versione più grande di questa figura.
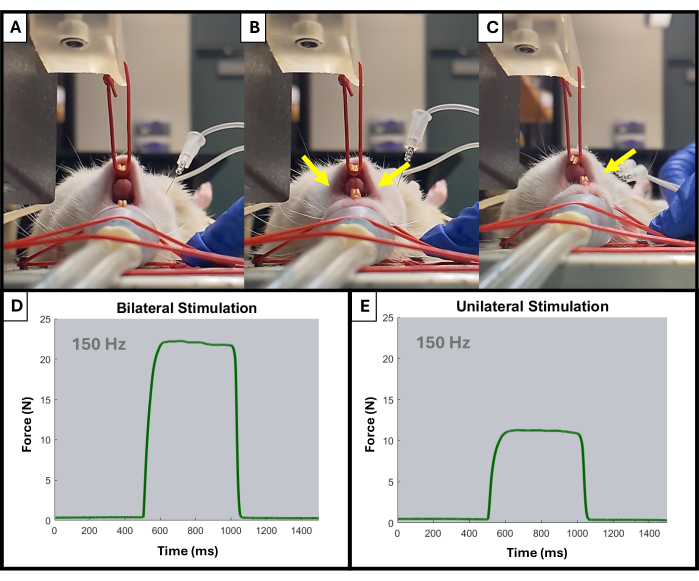
Figura 4: Esempio di attivazione unilaterale e bilaterale della mandibola durante il test. (A) mostra la mascella del ratto a riposo prima di qualsiasi stimolazione. Gli elettrodi posizionati in modo errato possono provocare una contrazione bilaterale della mascella, come indicato dalle frecce gialle (B), mentre gli elettrodi posizionati correttamente provocheranno la contrazione omolaterale desiderata (C). Le frecce gialle indicano i punti di contrazione nella mascella. Vengono mostrate anche alcune curve forza-tempo a 150 Hz per l'attivazione muscolare bilaterale (D) e unilaterale (E). Clicca qui per visualizzare una versione più grande di questa figura.
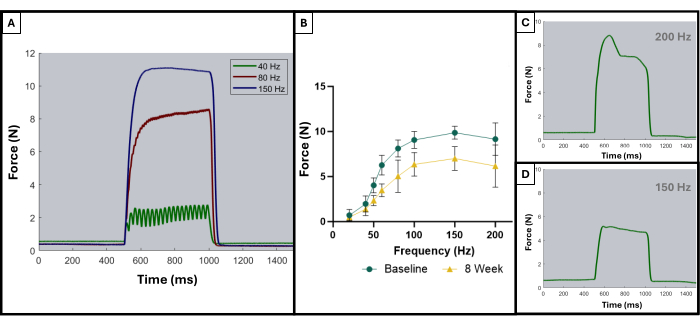
Figura 5: Curve rappresentative di stimolazione-risposta per studi accettabili e inaccettabili. Esempi di curve di stimolazione a 40, 80 e 150 Hz (A) per dimostrare cosa cercare prima e durante una contrazione tetanica. All'aumentare della frequenza di stimolazione, anche la tensione di picco registrata è più elevata, il che può essere osservato nelle curve forza-frequenza (B) che mostrano la media degli animali feriti (n = 9) al basale e a 8 settimane dopo la creazione della VML. (C,D) dimostrare esempi rappresentativi della forma di una risposta alla forza che indicherebbe la necessità di una regolazione dell'elettrodo a causa di un tetano improprio. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo descrive un metodo semplice e affidabile per il test funzionale in vivo della forza del morso omolaterale prodotta nella mascella del ratto. Viene anche descritto un metodo per la creazione chirurgica di una lesione VML nel muscolo massetere del ratto. In combinazione, questi metodi forniscono un modello animale biologicamente rilevante per condurre una valutazione longitudinale del recupero funzionale prima e dopo una lesione craniofacciale traumatica. Sebbene altri metodi di test, come quelli in vitro e in situ, possano fornire informazioni preziose, richiedono l'isolamento del tendine e la rimozione del tessuto dal suo ambiente nativo, limitando la loro applicabilità a una migliore comprensione dei risultati funzionali in vivo 8,25,26,27,28 . Con un addestramento e una pratica adeguati, un ricercatore sarà in grado di posizionare rapidamente un animale per i test e apportare le modifiche necessarie per ottenere la massima produzione di forza muscolare.
Ci sono dettagli tecnici che dovrebbero essere verificati per ogni animale per garantire il corretto posizionamento e stimolazione degli elettrodi. Innanzitutto, gli incisivi superiori devono essere fissati in modo che la testa del ratto sia completamente a contatto con la piattaforma riscaldata. Ciò manterrà anche il naso del ratto posizionato nel cono nasale per la somministrazione continua di anestetico per via inalatoria. Se la testa non viene mantenuta nella posizione corretta, ci saranno incongruenze nelle letture della forza poiché la tensione di base devia. Inoltre, il corpo dell'animale dovrebbe essere supino e la sua colonna vertebrale dovrebbe essere dritta. Mantenere l'animale nella posizione corretta aiuterà con il posizionamento e la manutenzione degli elettrodi nella posizione corretta. Infine, il posizionamento degli elettrodi può essere difficile, in quanto devono essere posizionati alla profondità e alla spaziatura adeguate per stimolare solo il lato sperimentale della mascella. La vigilanza e la pratica sono pertinenti per diventare abili nel posizionamento degli elettrodi per ottenere risultati riproducibili e affidabili. Gli elettrodi diventeranno opachi piuttosto rapidamente, quindi è necessario cambiarli spesso. I segni distintivi di un cattivo posizionamento degli elettrodi sono l'attivazione dei muscoli accessori, le letture della forza inclinate positivamente/negativamente (movimento degli elettrodi durante la stimolazione) ouna forma d'onda tetanica 8 non fusa/oscillante (Figura 5C, D).
Inoltre, ci sono alcune limitazioni a questo metodo che meritano di essere menzionate e prese in considerazione nelle future applicazioni di questo sistema. In primo luogo, sebbene sufficiente per le misurazioni effettuate in questo studio, l'anello utilizzato per fissare la mascella superiore potrebbe non essere il sistema più rigido. Invece, un approccio stereotassico che utilizza le barre auricolari potrebbe creare una migliore presa della mascella superiore del ratto. Inoltre, è stato utilizzato un valore di tensione passiva come posizione impostata per i test con questo metodo, che potrebbe non comportare la generazione di forza massima che si otterrebbe se il muscolo fosse posizionato alla sua lunghezza ottimale (Lo). In effetti, il Lo potrebbe essere determinato posizionando l'animale come descritto nel presente documento e quindi manipolando l'occlusione della mascella con piccoli incrementi (0,5-1 mm) durante l'esecuzione delle stimolazioni a contrazione - con Lo determinata come posizione di test ottimale in cui è stata generata la forza massima di contrazione. Tuttavia, il muscolo massetere ha una geometria e una locomozione piuttosto uniche35,36 e, quindi, opera su una gamma di lunghezze molto più ampia rispetto a quella caratteristica, ad esempio, dei muscoli degli arti (che tipicamente operano intorno a Lo). Tuttavia, la masticazione avviene in un intervallo ristretto rispetto al morso. Pertanto, non esiste un approccio perfetto a questo problema. Quindi, anche se l'impostazione di una tensione di base non è l'unico modo per affrontare questo problema, esiste una logica logica scientifica per farlo, poiché la lunghezza ottimale dei muscoli della mascella va oltre l'apertura naturale della mascella. Indipendentemente da ciò, la forza massima a una data tensione passiva fornisce comunque importanti informazioni sugli aspetti della funzione, anche se sono diversi dalla forza massima a Lo. Chiaramente, sono necessarie ulteriori indagini sulla relazione forza-lunghezza del muscolo massetere. Infine, questo metodo esamina la stimolazione del nervo trigemino nel ratto, che è diviso in tre rami: V1-V3. Mentre V3, o nervo mandibolare, è l'unico ramo con una componente motoria, innerva più muscoli, tra cui il massetere, il temporale, gli pterigoidei e il miloioideo37. Questo è importante da considerare in quanto significa che questo metodo non riporta esclusivamente la forza massetere, che potrebbe essere rilevante per altre indagini di ricerca.
Nonostante questi aspetti tecnici e limitazioni, questo metodo si dimostra robusto e coerente. Sebbene nel presente documento sia descritto solo il test omolaterale, il protocollo potrebbe essere facilmente modificato per includere ulteriori test dell'altro lato della mascella. I test bilaterali della contrazione/funzione del massetere consentirebbero di effettuare confronti sani/feriti all'interno di un singolo animale, forse chiarendo importanti cambiamenti compensatori sul lato ferito e/o di controllo (lato non ferito). Nel complesso, questo modello fornisce un potente strumento per valutare la funzione muscolare longitudinale, nonché il recupero funzionale, in modo minimamente invasivo. In quanto tale, questo sistema sarà applicabile alla valutazione dei meccanismi biomeccanici che accompagnano i deficit funzionali mediati da VML, nonché per testare l'efficacia di varie terapie per la riparazione delle lesioni da VML nella regione craniofacciale.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Myologica LLC per la condivisione delle apparecchiature utilizzate per eseguire valutazioni funzionali. La ricerca riportata in questa pubblicazione è stata supportata dal National Institute of Dental & Craniofacial Research del National Institutes of Health con il numero di premio U24 DE029463. Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni ufficiali del National Institutes of Health.
Materiali
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Riferimenti
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon