Method Article
Функциональная оценка жевательной мышцы крысы in vivo после хирургического создания травмы с объемной потерей мышечной массы (VML)
В этой статье
Резюме
Травмы при объемной потере мышечной массы (ВМТ) превышают эндогенную регенеративную способность, что приводит к постоянному функциональному дефициту. Современные исследования VML в основном сосредоточены на мышцах конечностей и туловища. Чтобы расширить механистические исследования ВМЛ на черепно-лицевые мышцы, в данной статье описывается метод in vivo для продольной оценки функции жевательных мышц до и после травмы ВМЛ.
Аннотация
Объемная мышечная потеря (ВМТ) широко распространена среди гражданского и военного населения и представляет собой изнурительную травму скелетных мышц, превышающую естественную регенеративную способность организма. Эти повреждения разрушают не только мышечные волокна, но и нервы, кровеносные сосуды и внеклеточный матрикс, подавляя регенеративную способность скелетных мышц и приводя к тяжелому фиброзу и постоянным недостаткам в структуре и функции мышц. Современное клиническое ведение имеет много ограничений, и поэтому продолжаются исследования по разработке более эффективных терапевтических подходов. Примечательно, однако, что большая часть доклинического акцента на травмах VML была сосредоточена на мышцах конечностей и туловища, с ограниченными исследованиями черепно-лицевых мышц. Различия в биологии развития и регенеративной способности между черепно-лицевыми мышцами и мышцами конечностей / туловища могут дать важные сведения, которые обуславливают больше вариантов лечения VML, специфичных для травм. Кроме того, оценка функционального восстановления имеет решающее значение для установления терапевтической эффективности. В связи с этим тестирование in vivo мышечного сокращения с помощью чрескожной стимуляции нервов является минимально инвазивным методом, позволяющим проводить повторную функциональную оценку в ходе исследования на одном и том же животном. В свете этих соображений в данной статье описывается метод оценки in vivo мышечной функции в жевательной мышце крысы до и после травмы VML. Этот протокол является первым опубликованным случаем, в котором подробно описывается создание и функциональная оценка биологически значимого черепно-лицевого повреждения VML у крыс.
Введение
Травматические и хирургические повреждения мягких тканей, которые затрагивают нижележащие скелетные мышцы, остаются одной из самых больших проблем для реконструкции тканей как для гражданских лиц, так и для раненых воинов. На самом деле, почти 20% травм на поле боя также происходят в черепно-лицевой области раненых воинов (голова и лицо)2. В том числе травмы конечностей и травмы головы и шеи составляют >80% боевых травм в недавних конфликтах2. Несмотря на довольно хорошо известную способность скелетных мышц к восстановлению, регенерации и ремоделированию после травмы, эти более серьезные травмы, которые включают потерю значительной части мышечной ткани, не способны заживать сами по себе и называются травмами объемной мышечной потери (VML). По определению, ВМЛ приводит к постоянному эстетическому и функциональному дефициту либо поврежденной мышцы, либо мышечной единицы3.
Интересно, что, несмотря на распространенность черепно-лицевой травмы ВМЛ 2,4, большая часть исследований на сегодняшний день сосредоточена на мышцах конечностей 5,6,7,8 и туловища 9,10,11, с небольшим количеством сообщений о травмах ВМЛ в черепно-лицевых мышцах 12,13,14. Это представляет собой потенциально важный пробел в трансляционных исследованиях, поскольку существующая литература предполагает, что существуют значительные различия как в биологии развития, так и в регенеративной способности между черепно-лицевой областью и мышцами конечностей и туловища15,16. На самом деле, с каждой стороны лица имеется более 20 мышц, что отражает тот факт, что черепно-лицевая область участвует в выполнении многих важных задач, таких как моргание, глотаниеи жевание. Кроме того, даже среди черепно-лицевых мышц возникают различия в отношении регенеративной способности. Например, экстраокулярные мышцы, по-видимому, регенерируются быстрее, чем мышцы конечностей17. Напротив, жевательная мышца демонстрирует более медленную регенеративную реакцию, чем передняя большеберцовая кость (ТА)18. Эти различия могут быть обусловлены, по крайней мере частично, тем, являются ли мышцы бранхиомерными или сомитными, что приводит как к различному количеству сателлитных клеток, так и к различным профилям экспрессии генов популяций резидентных сателлитныхклеток19. Рассмотрение уникальных особенностей черепно-лицевых мышц, а также мышц конечностей и туловища может пролить свет на важную механистическую информацию для улучшения терапевтической разработки индивидуальных вариантов лечения, направленных на мышечные травмы VML. Эти мышечно-специфические различия также могут объяснить известные ограничения листовидных мышц, таких как широчайшая мышца спины, в качестве вариантов переноса донорской мышечной ткани для реконструктивных операций на голове и шее 20,21,22.
Независимо от локализации травмы VML, в настоящее время не существует методов лечения, которые могут полностью восстановить форму и функцию. Золотой стандарт клинического ведения включает в себя трансплантацию аутологичных тканей, а также реабилитацию; Тем не менее, первый обычно не улучшает силу и может привести к заболеваемости донорского участка 3,23, в то время как второй улучшает диапазон движений с минимальным влиянием на функциональное восстановление или возвращение сократительной силы в мышце 1,6. По всем этим причинам продолжаются исследования по разработке более эффективных терапевтических подходов для регенерации функциональной мышечной ткани после травмы VML. Недавний анализ подчеркнул критическую важность доклинических исследований на крысовых моделях повреждения ВМЛ для продвижения регенеративных технологических решений для восстановления ВМЛ1.
Как отмечалось в предыдущей работе 5,8,9,10,24,25, оценка функционального восстановления после ВМЛ имеет решающее значение для оценки эффективности терапевтических вмешательств. В частности, в то время как заживление ран и восстановление объема являются ключевыми особенностями восстановления ВМЛ, измерение восстановления силы после травмы и лечения помогает пролить свет на многомасштабные биомеханические механизмы, ответственные за дефицит ВМЛ, а также на те механизмы, которые способствуют функциональному восстановлению. Таким образом, установление связи между восстановлением тканей, восстановлением объема и увеличением мышечной силы является абсолютным требованием для определения наиболее эффективных регенеративных решенийдля восстановления VML.
В связи с этим существует три основных метода проведения этих функциональных измерений: (1) in vitro, (2) in situ и (3) тестирование in vivo — каждый из них имеет свои преимуществаи недостатки. Например, тестирование in vitro включает в себя исследование изолированной мышечной функции вне живого организма и дает возможность более непосредственно/конкретно манипулировать стимуляцией мышц с помощью различных препаратов и химических веществ, влияющих на возбудимость и сокращениемышц. Несмотря нато, что этот метод позволяет проводить детальные исследования клеточных и молекулярных аспектов мышечной функции и восстановления, он устраняет кровоснабжение и иннервацию, что ограничивает его способность восстанавливать истинную мышечную функцию 8,26. Тестирование in situ оценивает мышечную функцию, пока мышца все еще находится в своем естественном анатомическом месте, но изолирована от окружающих тканей25,28. В то время как этот метод поддерживает иннервацию и кровоснабжение, отделение мышцы все еще может ограничить применимость результатов к окружающей среде in vivo. Кроме того, и, возможно, самое важное, как in situ, так и in vitro испытания являются терминальными процедурами, которые исключают продольное тестирование, которое необходимо для отслеживания функционального восстановления с течением времени на одном и том же животном. В отличие от этого, тестирование in vivo, которое включает в себя оценку функции мышц в их естественной среде, позволяет получить более полное представление о работе мышц в физиологическом контексте. Исследования in vivo также являются наименее инвазивным методом и могут выполняться многократно в течениевсего периода исследования. Используя чрескожную электрическую стимуляцию нервов, можно собирать функциональные измерения в конкретных мышцах, оставляя сухожилия, сосуды и иннервациюнетронутыми. Эти продольные оценки могут дать представление о тонких, но важных изменениях, происходящих на разных стадиях заживления у одного и того же животного. Этот метод обычно используется на небольших моделях грызунов 8,31,32,33; Тем не менее, он также использовался в более крупных животных моделях Pig30 и Dog34.
В настоящее время опубликованы три исследования по оценке функционального восстановления после черепно-лицевых травм VML. Rodriguez et al. сообщают о методе восстановления черепно-лицевой модели повреждения VML в большой скуловой мышце овцы. Их метод детализирует протокол испытаний in situ, который может быть реализован только в момент окончания исследования и, таким образом, не позволяет проводить продольную оценку в пределах одного животного13. Kim et al. описывают метод использования наномембранной электроники для отслеживания непрерывных данных электромиограммы жевания мышей после травмы VML. Они сообщили о значительно более низком сигнале от раненых мышей по сравнению с контрольной группой, однако они также отметили, что артефакты движения влияют на анализ сигнала и что мыши иногда пытаются содрать цепь. Кроме того, для обеспечения надежного прикрепления наномембраны к коже использовались атимические голые мыши, что в настоящее время препятствует более широкому использованию этого метода в более часто используемых (и экономически эффективных) животных моделях. Наконец, Zhao et al. описывают дефект VML критического размера у мышиного массажиста, который ухудшает питание животных, что отражается в значительном снижении прироста массы тела, как функциональный исход14. Учитывая эти исследования, в данной статье описывается универсальный и минимально инвазивный метод продольной оценки сократительной функции челюсти крысы in vivo до и после травмы VML путем стимуляции тройничного нерва подкожными электродами. По мере того, как тест проходит через серию увеличивающихся частот моделирования (20-200 Гц), датчик измеряет создаваемую силу мышцы. Эти измерения могут позволить, среди прочего, определить мышечную ригидность и максимальный столбняк. Приведенный ниже протокол предназначен для оценки функционального восстановления ипсилатеральной силы укуса после травматического повреждения VML и, как таковой, также включает протокол хирургического создания валидированной травмы VML. Этот метод может быть легко реализован на самых разных крысах и мышах, а при соответствующих модификациях оборудования применим и к более крупным моделям животных и травмам VML.
протокол
Все процедуры обращения с животными были одобрены и выполнены в соответствии с руководящими принципами Комитета по уходу за животными и их использованию (IACUC) Университета Вирджинии. В этих экспериментах использовались крысы мужского пола Льюиса в возрасте 12-14 недель весом 324,8 г ± 12,72 г на момент операции. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Травма жевательной мышцы VML
- Подготовка оборудования
- Перед операцией убедитесь, что все необходимые инструменты были надлежащим образом стерилизованы: хирургические простыни, скальпель, щипцы, микроножницы, гемостатики, швы и марля.
- Включите нагретую платформу и установите ее на 37 °C.
- Нанесите стерильную офтальмологическую мазь на оба глаза, чтобы предотвратить сухость глаз под наркозом. Поместите животное в индукционную камеру для анестезии и введите 2%-3% изофлуран (в соответствии с утвержденными в учреждении протоколами).
- Хирургическое создание травмы ВМЛ
- Убедитесь, что животное должным образом обезболито, прежде чем извлекать его из камеры.
ПРИМЕЧАНИЕ: Это можно определить, если животное не реагирует на щипывание пальца ноги. - Взвесьте и положите животное на операционную доску в боковом положении на левом боку, плотно прижав нос к носовому конусу, чтобы можно было продолжать введение изофлурана.
- Подготовьте животное к операции, введя соответствующее обезболивающее, побрив правую сторону морды и стерилизуя область с помощью трех замен йодных и спиртовых тампонов. В этих исследованиях для анальгезии использовали бупренорфин с пролонгированным высвобождением (0,65 мг/кг массы тела).
- Начните операцию с разреза примерно на 2 см вдоль щечной области крысы. Разрез должен находиться на одной линии с носом и ухом животного. Используйте тупое рассечение, чтобы отделить кожу и фасцию.
- Сделайте аналогичный разрез вдоль фасции и аккуратно рассеките его в сторону от основного массажиста.
- Найдите щечный и маргинальный нервы (рисунок 1A). Используйте стерильный хирургический маркер и линейку, чтобы отметить область, которую необходимо удалить. Область должна представлять собой прямоугольник размером 10 мм х 5 мм в центре обнаженной жевательной мышцы, лежащей между лицевыми нервами (рис. 1В).
- Осторожно используйте микроножницы, чтобы начать удаление тканей. Убедитесь, что окончательная травма достигает глубины примерно 4 мм с помощью 150 мг иссеченной ткани (Рисунок 1C). Удаленная ткань будет из полной толщины поверхностной жевательной мышцы и частично перейдет в глубокий массажер.
Примечание: Средняя масса ткани, удаленной в этих экспериментах, составила 146,1 мг ±1,16 мг. - Закройте фасцию и кожу с помощью рассасывающихся (6-0) и нерассасывающихся (5-0) прерывистых швов соответственно.
- Убедитесь, что животное должным образом обезболито, прежде чем извлекать его из камеры.
- Очистка и мониторинг
- После наложения швов выключите анестезиологический газ и держите животное на нагретой поверхности, чтобы следить за его приходом в сознание. Как только крыса начнет приходить в сознание, поместите животное обратно в клетку и продолжайте наблюдение, пока оно не придет в себя и не сможет передвигаться.
- В течение 3 дней после операции осматривайте животное и оценивайте наличие признаков боли или дискомфорта.
- В течение 7 дней после операции обеспечьте животное мягкой пищей, чтобы уменьшить нагрузку на челюсть и обеспечить хорошее увлажнение/кормление животных.
- Снимите прерванные швы через 7-10 дней после операции, убедившись, что рана полностью закрыта перед удалением.
- После окончания исследования усыпьте животных в соответствии с рекомендациями IACUC. Эксплантируйте жевательные мышцы и мгновенно заморозьте, погрузив в жидкий азот или изопентан, охлаждаемый жидким азотом.
ПРИМЕЧАНИЕ: Замороженные образцы тканей можно хранить в течение длительного времени при температуре -80 °C для будущей гистологической оценки.
2. Функциональная оценка челюсти in vivo
- Подготовка оборудования
- Проверьте и убедитесь в правильности подключения всего оборудования.
- Для этого включите (1) компьютер, (2) двухфазный стимулятор, (3) двухрежимную рычажную систему и, наконец, (4) нагретую платформу, чтобы нагреть ее до 37 °C.
ПРИМЕЧАНИЕ: В руководстве пользователя указано время прогрева стимулятора и рычажной системы в 1 минуту для получения точных показаний. Кроме того, подождите 10-15 минут, чтобы платформа полностью нагрелась, прежде чем тестировать животных. - Нанесите стерильную офтальмологическую мазь на оба глаза, чтобы предотвратить сухость глаз под наркозом. Поместите испытуемое животное в индукционную камеру для анестезии и введите 2%-3% изофлуран.
- Простерилизуйте наконечники электродов, покрытые политетрафторэтиленом, поместив их в 70% этанол.
- Найдите и откройте программное обеспечение Dynamic Muscle Control (DMC). Это потребуется для проведения функциональной оценки.
- Настройка программного обеспечения
- В программном обеспечении DMC найдите Instant Stim в меню настройки и измените параметры на нужные значения. В этом исследовании никакие параметры не изменяются по сравнению с их предустановками (рис. 2A).
- В меню «Настройка » создайте и выберите папку автосохранения для хранения данных.
- В нижней части экрана программного обеспечения найдите поле под названием «База автосохранения». Измените его на название, относящееся к тестируемому животному, например, "rat#-timepoint" (рисунок 2B).
- Выберите «Секвенсор» в верхней части экрана программного обеспечения. В открывшемся новом окне выберите «Открыть последовательность» в нижней части экрана. Выберите готовую последовательность в открывшемся проводнике. Это заполнит окно Последовательность списком параметров, таких как частота, продолжительность стимулов и время отдыха (Рисунок 2C).
- Нажмите « Последовательность загрузки », а затем «Закрыть окно».
ПРИМЕЧАНИЕ: Последовательность, используемая в этом протоколе, состоит из 9 этапов (подергивание, 20 Гц, 40 Гц, 50 Гц, 60 Гц, 80 Гц, 100 Гц, 150 Гц, 200 Гц) с 20 секундами отдыха между каждым. За исключением стимуляции подергиванием, все этапы длятся 500 мс. Протокол секвенирования должен быть адаптирован к конкретным целям тестирования каждой лаборатории.
- Нажмите « Последовательность загрузки », а затем «Закрыть окно».
- Чтобы открыть новое окно и включить просмотр сбора данных в режиме реального времени, выберите «Файл > монитор данных в реальном времени».
- В окне Монитор динамических данных задайте временную шкалу, минимальное и максимальное значения y-вручную или установив флажок, чтобы включить автомасштабирование.
- Подготовка животных
- Убедитесь, что животное находится в правильной плоскости анестезии, прежде чем извлекать его из анестезиологической камеры.
- Поместите животное в положение лежа на спине, надежно прижав носовой конус к носовому конусу, чтобы можно было продолжить введение изофлурана. Наденьте фиксирующую петлю на верхнюю половину челюсти крысы, чтобы надежно удерживать ее нос на платформе.
- Побрейте шею и морду животного с экспериментальной стороны челюсти.
- Закрепите верхнюю половину животного, поместив и закрепив ремень на его руках и груди.
- Отрегулируйте положение рычага поклевки с помощью трех вращающихся ручек, расположенных рядом с платформой оснастки, для управления плоскостями X, Y и Z (Рисунок 3A). Используя верхнюю ручку, опустите рычаг укуса вниз по направлению к животному и с помощью двух других ручек отрегулируйте конец рычага так, чтобы он находился прямо над подбородком животного.
- Используйте пинцет, чтобы зацепить петлю для подвешивания вокруг нижних зубов животного, чтобы закрепить голову и предотвратить ее движение (рисунок 3B).
ПРИМЕЧАНИЕ: Петля расположена через отверстие, просверленное в рычаге прикуса на расстоянии 3 см от датчика силы. Система должна быть откалибрована перед первым использованием. - Отрегулируйте высоту рычага, чтобы увеличить натяжение челюсти. Воспроизводимое базовое напряжение, используемое в этих экспериментах, составляло ~0,5 Н.
- Установка электродов
- Пальпируйте челюсть животного и найдите задний угол нижней челюсти. Расположите электроды подкожно по обе стороны от угла на расстоянии примерно 2-3 мм друг от друга. Электроды следует вводить на глубину 3-5 мм. Используйте зажим из кожи аллигатора и подставку, чтобы удерживать электроды на месте.
- В окне Live Data Monitor нажмите на большую оранжевую кнопку с надписью Instant Stim , чтобы активировать его.
- Монитор должен начать отображать восходящие скачки во время каждой стимуляции. При необходимости отрегулируйте положение электродов и положение рычага с помощью ручек. Следует наблюдать только активацию ипсилатеральной стороны челюсти (рис. 4).
- На мощном двухфазном стимуляторе есть две ручки ближе к центру, с надписями «Range» и «Adjust». Начните поворачивать ручку диапазона , чтобы модулировать силу тока. По мере увеличения силы тока пики мгновенных стимулов начнут увеличиваться по величине до тех пор, пока они не выйдут на плато, определяемое как уровень, при котором три последовательные стимуляции приводят к идентичным сократительным реакциям.
- Избегайте слишком высоких поворотов силы тока, то есть не более чем на 20% выше силы тока, где наблюдались максимальные пики — так как это может привести к задействованию соседних мышц и неточным показаниям силы.
- Поверните ручку регулировки , чтобы модулировать процентное соотношение текущего «Диапазона», используемого для стимуляции челюсти. Для оптимизации реакции на подергивание может потребоваться увеличение или уменьшение тока.
- Убедитесь, что электроды все еще надежно закреплены, и остановите мгновенный стимулятор.
- Под оранжевой кнопкой «Instant Stim» на мониторе данных в реальном времени найдите серую кнопку Start Sequence и нажмите на нее.
- Продолжайте следить за кривыми на протяжении всего протокола стимуляции. По мере увеличения частоты стимуляции будет увеличиваться и максимальная создаваемая сила. Как только столбняк будет достигнут, силовые кривые выйдут на плато (Рисунок 5А).
- Уборка
- После завершения последовательности функциональной стимуляции снимите электроды и протрите их 70% этанолом. Если это последнее животное, которое будет испытываться, электроды можно поместить обратно в их чехлы.
- Выключите газ для анестезии, но держите животное на нагретой поверхности, чтобы следить за его возвращением в сознание. Как только крыса начнет приходить в сознание, поместите ее обратно в клетку и продолжайте наблюдение, пока животное не придет в себя и не сможет передвигаться.
- Выключите оборудование, используемое для сбора данных, и протрите все поверхности.
3. Анализ данных
Примечание: Этот метод ранее был описан как документирование метода функционального тестирования in vivo крысы TA8. Анализ данных предназначен для определения намерений данного исследования, а протоколы могут меняться в зависимости от целей пользователя.
- Найдите и откройте программное обеспечение для динамического анализа мышц .
- Нажмите на меню «Высокая пропускная способность» и выберите «Частотно-силовой анализ», чтобы анализировать несколько образцов одновременно.
- Выберите «Выбрать файлы» и выделите необходимое количество файлов данных для анализа. Кнопка "Выбрать папку" также может быть использована, если сэмплы четко названы в файловой системе.
- Установите флажок Удалить базовую линию. Это автоматически удалит базовую силу из максимальной силы, зарегистрированной для каждого испытания, предоставляя абсолютные максимальные значения.
- Нажмите на кнопку «Анализ», а затем на «Экспорт таблицы» в Excel , где данные можно сохранить в виде электронной таблицы. Убедитесь, что значения «Начальный курсор» и «Конечный курсор» точно отражают временную метку стимуляции. При необходимости эти значения можно установить вручную.
- Откройте сохраненную таблицу.
ПРИМЕЧАНИЕ: Используя столбец «Максимум», пользователь может рассчитать максимальную силу, создаваемую на всех частотах. Также может быть построена кривая сила-частота (рис. 5).
Результаты
Как описано в предыдущей публикации, тетанические кривые могут быть использованы для различения оптимальных результатов и неоптимальных результатов8. Идеальный результат достигается, когда мышца стимулируется до максимальной силы и поддерживает этот максимум на протяжении всего периода тетанического сокращения. Суммирование отдельных подергиваний в тетанические кривые обычно начинает проявляться при частоте 100 Гц или после нее. Рисунок 5А показывает эту точку зрения, поскольку идеальная кривая на частоте 150 Гц имеет резкий подъем в начале стимуляции, плоскую фазу плато при максимальном значении силы с минимальным колебанием и резкий вертикальный спад, когда стимуляция прекращается. Неидеальные тетанические кривые могут показывать колебания во время фазы плато и могут демонстрировать отрицательный или положительный наклон (рис. 5C, D).
Результаты данного протокола функционального тестирования могут быть представлены по-разному в зависимости от целей исследователей и экспериментального плана исследования. В случае этого протокола абсолютная максимальная сила определяется эмпирически по всем частотам стимуляции и отображается на графике в каждой временной точке для тестирования. Это позволяет сравнивать исходное максимальное усилие с максимальным усилием каждые 4 недели после создания описанного повреждения VML в жевательной мышце (Рисунок 1D). Для сравнения, когорта нетравмированных животных (n = 4) также была протестирована в каждый момент времени (рисунок 1E). Также сравнивали вес животных в каждый момент времени (рис. 1F). Через 4, 8 и 12 недель после ВМЛ соответственно крысы проявляли среднюю максимальную силу 7,958 Н ±1,797 Н, 7,183 Н ±1,450 Н, и 7,823 Н ± 0,626 Н. Односторонний повторный анализ дисперсии (ANOVA) с наименьшей значимой разницей Фишера (НСД) после специального попарного сравнения определил, что статистически значимых различий между этими значениями не было ни в один момент времени после повреждения ВМЛ. однако все они значительно отличались от средней исходной силы 10,031 с.ш. ±0.564 с.ш.
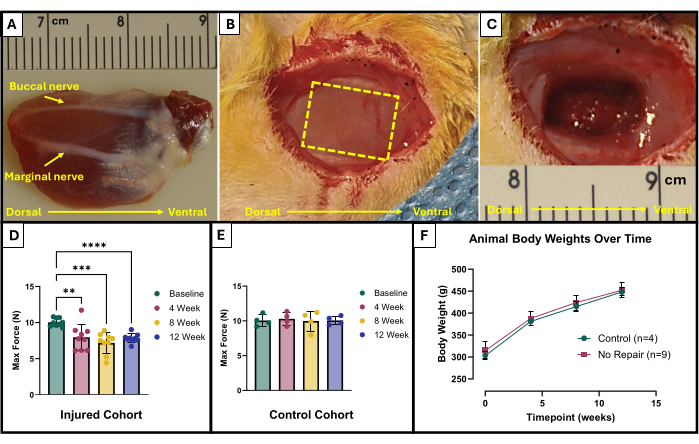
Рисунок 1: Схематические и функциональные результаты хирургического лечения жевательной мышцы, поврежденной VML. Эксплантированная жевательная мышца с анатомической ориентацией, а также нервными ориентирами для создания травмы (А). Животное во время операции до (В) и после (В) создания травмы ВМЛ. Все изображения представлены с мышцами в той же ориентации, что и на рисунке (А). Желтой пунктирной линией обозначена область, где мышца должна быть иссечена. Максимальная выработка силы на исходном уровне и с течением времени у крыс, получивших травму VML (n = 9) жевательной мышцы (D), а также у контрольных крыс того же возраста, которые остались нетравмированными (n = 4) (E). График массы тела крысы с течением времени (F). (D) представляет собой одностороннюю повторяющуюся меру ANOVA с апостериорными парными сравнениями ЛСД Фишера, где **= p < 0,01, ***= p < 0,001, ****= p < 0,0001. Линейки в (A) и (C) указаны в сантиметрах, а градуировки — в миллиметрах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
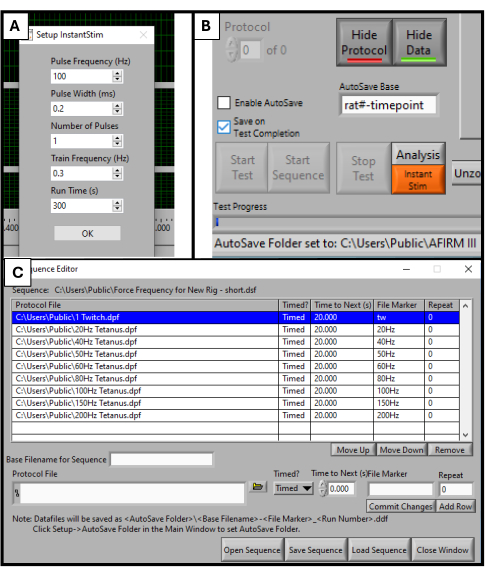
Рисунок 2: Инициализация программного обеспечения для функционального тестирования. Параметр, настроенный для программного обеспечения DMC. Настройка Instant Stim на желаемые значения (A). Программный графический интерфейс пользователя и расположение поля настройки базы автосохранения (B). Выбор 9-ступенчатой последовательности протокола, используемой для тестирования (С). Отображаемые здесь значения являются примерами значений, использованных в данном исследовании, но их может потребоваться оптимизировать и скорректировать в зависимости от конкретных вариантов использования других исследований. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
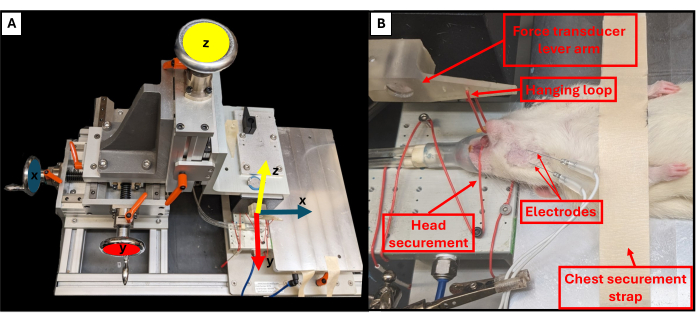
Рисунок 3: Функциональные оси движения осей оси и правильное позиционирование животного. На схеме показано соотношение между каждым из трех регулировочных колес на стенде для функциональных испытаний и соответствующими осями движения рычага (А). Пример изображения крысы, проходящей функциональное испытание, показывающее правильное положение животного на спине на платформе и других важных компонентах буровой установки (B). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
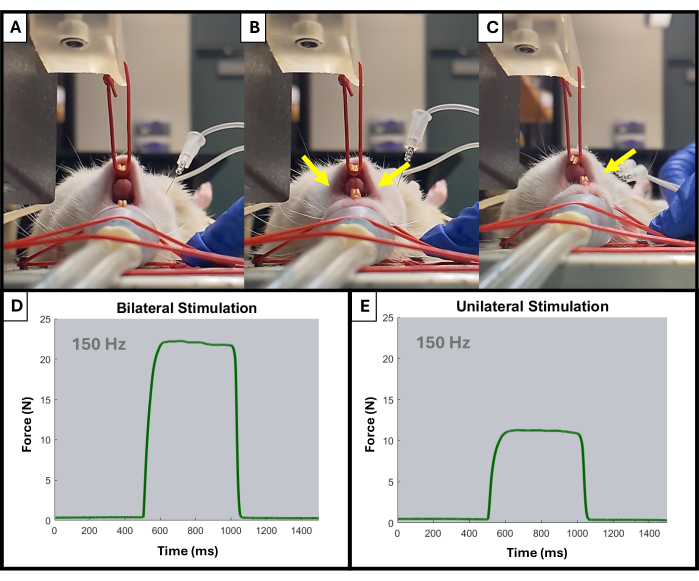
Рисунок 4: Пример односторонней и двусторонней активации челюсти во время тестирования. (А) показывает челюсть крысы в состоянии покоя перед любой стимуляцией. Неправильно размещенные электроды могут привести к двустороннему сокращению челюсти, как показано желтыми стрелками (B), в то время как правильно расположенные электроды приведут к желаемому ипсилатеральному сокращению (C). Желтыми стрелками обозначены точки сокращения челюсти. Также показаны примеры кривых сила-время при частоте 150 Гц для двусторонней (D) и односторонней (E) активации мышц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
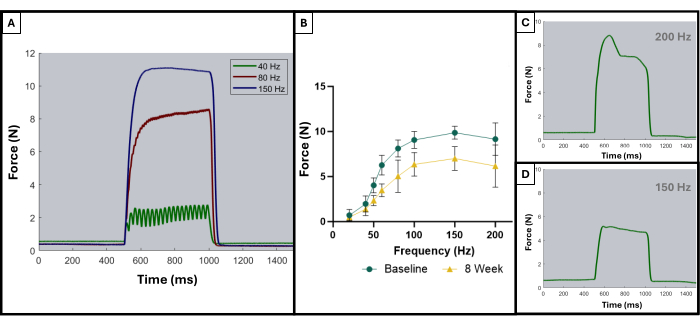
Рисунок 5: Репрезентативные кривые стимуляции-реакции для приемлемых и неприемлемых испытаний. Пример кривых стимуляции на частотах 40, 80 и 150 Гц (А), чтобы продемонстрировать, на что следует обращать внимание до и во время тетанического сокращения. По мере увеличения частоты стимуляции регистрируемое пиковое напряжение также становится выше, что можно наблюдать на кривых сила-частота (В), показывающих среднее значение травмированных животных (n = 9) на исходном уровне и через 8 недель после создания ВМЛ. (C,D) демонстрируют репрезентативные примеры формы силовой реакции, которая указывает на необходимость регулировки электродов из-за неправильного столбняка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Этот протокол описывает простой и надежный метод функционального тестирования in vivo ипсилатеральной силы укуса, создаваемой в челюсти крысы. Также описан метод хирургического создания повреждения VML в жевательной мышце крысы. В сочетании эти методы обеспечивают биологически значимую животную модель для проведения продольной оценки функционального восстановления до и после травматической черепно-лицевой травмы. В то время как другие методы тестирования, такие как in vitro и in situ, также могут предоставить ценную информацию, они требуют выделения сухожилия и удаления ткани из ее естественной среды, ограничивая их применимость для лучшего понимания функциональных результатов in vivo 8,25,26,27,28. При надлежащем обучении и практике исследователь сможет быстро расположить животное для тестирования и внести необходимые коррективы для достижения максимальной выработки мышечной силы.
Существуют технические детали, которые должны быть проверены для каждого животного, чтобы обеспечить правильное размещение электродов и стимуляцию. Во-первых, верхние резцы должны быть закреплены так, чтобы голова крысы полностью соприкасалась с нагретой платформой. Это также позволит сохранить нос крысы в носовом конусе для непрерывного введения ингаляционного анестетика. Если головка не удерживается в правильном положении, в показаниях силы будут возникать несоответствия, поскольку базовое напряжение отклоняется. Кроме того, тело животного должно лежать на спине, а его позвоночник – прямым. Удержание животного в правильном положении поможет при размещении электродов и обслуживании в правильном месте. Наконец, размещение электродов может быть затруднено, так как они должны быть размещены на правильной глубине и на правильном расстоянии, чтобы стимулировать только экспериментальную сторону челюсти. Бдительность и практика необходимы для того, чтобы стать экспертом в установке электродов для получения воспроизводимых и надежных результатов. Электроды довольно быстро затупятся, поэтому менять их необходимо часто. Признаками плохого расположения электродов являются активация вспомогательных мышц, положительно/отрицательно наклоненные показания силы (движение электродов во время стимуляции) или нерасплавленная/колеблющаяся тетаническая форма волны8 (рис. 5C, D).
Кроме того, существует несколько ограничений этого метода, которые заслуживают упоминания и рассмотрения в будущих приложениях этой системы. Во-первых, несмотря на то, что петля, используемая для фиксации верхней челюсти, достаточна для измерений, она может быть не самой жесткой системой. Вместо этого, стереотаксический подход с использованием ушных планок может обеспечить лучшую фиксацию верхней челюсти крысы. Кроме того, в качестве заданного положения для тестирования с помощью этого метода использовалось значение пассивного напряжения, которое может не привести к максимальному приработке силы, которое было бы получено, если бы мышца была расположена на своей оптимальной длине (Lo). На самом деле, Lo может быть определен путем позиционирования животного, как описано в настоящем документе, а затем манипулирования окклюзией челюсти с небольшим шагом (0,5-1 мм) во время проведения стимуляции подергиванием, при этом Lo определяется как оптимальная тестовая позиция, в которой была создана максимальная сила подергивания. Тем не менее, жевательная мышца имеет довольно уникальную геометрию и локомоцию35,36, и, следовательно, оперирует в гораздо более широком диапазоне длин, чем это характерно, например, для мышц конечностей (которые обычно работают околоLo). Однако жевание происходит в узком диапазоне по сравнению с кусанием. Таким образом, идеального подхода к этой проблеме не существует. Таким образом, несмотря на то, что установление базового напряжения не является единственным способом решения этой проблемы, для этого есть логическое научное обоснование, поскольку оптимальная длина мышц челюсти находится за пределами естественного раскрытия челюсти. Как бы то ни было, максимальная сила при данном пассивном напряжении все же дает важное представление о функциональных аспектах, даже если они отличаются от максимальной силы при Lo. Очевидно, что дальнейшее исследование соотношения силы и длины жевательной мышцы оправдано. Наконец, этот метод рассматривает стимуляцию тройничного нерва у крысы, который делится на три ветви: V1-V3. В то время как V3, или нижнечелюстной нерв, является единственной ветвью с моторным компонентом, он иннервирует множество мышц, включая массажную, височную, крыловидную и милоподъязычнуюмышцу 37. Это важно учитывать, так как это означает, что этот метод не сообщает исключительно о жевательной силе, которая может иметь отношение к другим исследованиям.
Несмотря на эти технические аспекты и ограничения, этот метод оказался надежным и последовательным. Несмотря на то, что здесь описано только ипсилатеральное тестирование, протокол может быть легко изменен для включения дополнительного тестирования другой стороны челюсти. Двустороннее тестирование сокращения/функции жевательной мышцы позволило бы провести сравнение здоровых/травмированных животных в пределах одного животного, возможно, прояснив важные компенсаторные изменения на поврежденной и/или контрольной стороне (неповрежденной стороне). В целом, эта модель предоставляет мощный инструмент для оценки продольной мышечной функции, а также функционального восстановления минимально инвазивным способом. Таким образом, эта система будет применима для оценки биомеханических механизмов, сопровождающих ВМЛ-опосредованный функциональный дефицит, а также для проверки эффективности различных терапевтических средств для восстановления повреждений ВМЛ в черепно-лицевой области.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
ООО «Миологика» за совместное использование оборудования, используемого для проведения функциональных оценок. Исследование, представленное в этой публикации, было поддержано Национальным институтом стоматологических и черепно-лицевых исследований Национальных институтов здравоохранения под номером U24 DE029463. Ответственность за содержание лежит исключительно на авторах и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Ссылки
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены