Method Article
Hacimsel Kas Kaybı (VML) Yaralanmasının Cerrahi Olarak Oluşturulmasını Takiben Sıçan Masseter Kasının İn vivo Fonksiyonel Değerlendirmesi
Bu Makalede
Özet
Hacimsel kas kaybı (VML) yaralanmaları endojen rejeneratif yeteneği aşarak kalıcı fonksiyonel eksikliklere neden olur. Mevcut VML araştırması öncelikle uzuv ve gövde kaslarına odaklanmaktadır. VML'nin mekanik çalışmalarını kraniyofasiyal kaslara genişletmek için, bu makale, VML hasarı öncesi ve sonrası masseter kas fonksiyonunun uzunlamasına değerlendirilmesi için in vivo bir yöntemi açıklamaktadır.
Özet
Hacimsel Kas Kaybı (VML) sivil ve askeri popülasyonlarda yaygındır ve vücudun doğal rejeneratif kapasitesini aşan zayıflatıcı bir iskelet kası yaralanmasını temsil eder. Bu yaralanmalar sadece kas liflerini değil, aynı zamanda sinirleri, kan damarlarını ve hücre dışı matrisi de bozar, iskelet kasının rejeneratif kapasitesini ezer ve kas yapısı ve fonksiyonunda ciddi fibrozis ve kalıcı eksikliklere yol açar. Mevcut klinik yönetimin birçok sınırlılığı vardır ve bu nedenle daha etkili terapötik yaklaşımlar geliştirmek için araştırmalar devam etmektedir. Bununla birlikte, özellikle, VML yaralanmalarına yapılan klinik öncesi vurgunun çoğu, kraniyofasiyal kaslar hakkında sınırlı araştırma ile uzuv ve gövde kaslarına odaklanmıştır. Kraniyofasiyal ve ekstremite/gövde kasları arasındaki gelişimsel biyoloji ve rejeneratif kapasitedeki farklılıklar, yaralanmaya özgü VML tedavi seçeneklerini daha fazla yönlendiren önemli bilgiler sağlayabilir. Ayrıca, fonksiyonel iyileşmenin değerlendirilmesi, terapötik etkinliğin belirlenmesi için kritik öneme sahiptir. Bu bağlamda, perkütan sinir stimülasyonu ile kas kasılmasının in vivo testi, aynı hayvanda bir çalışma boyunca tekrarlanan fonksiyonel değerlendirmeye izin veren minimal invaziv bir yöntemdir. Bu hususlar ışığında, bu yazıda VML yaralanmasından önce ve sonra sıçan masseter kasındaki kas fonksiyonunun in vivo değerlendirmesi için bir yöntem açıklanmaktadır. Bu protokol, sıçanlarda biyolojik olarak ilgili bir kraniyofasiyal VML hasarının oluşturulmasını ve fonksiyonel değerlendirmesini detaylandıran ilk yayınlanmış örnektir.
Giriş
Altta yatan iskelet kasını içeren yumuşak dokunun travmatik ve cerrahi yaralanmaları, hem siviller hem de yaralı savaşçılar için doku rekonstrüksiyonunun önündeki en büyük zorluklardan biri olmaya devam etmektedir1. Aslında, savaş alanı yaralanmalarının yaklaşık% 20'si yaralı savaşçıların kraniyofasiyal bölgelerinde (baş ve yüz) de meydana gelir2. Ayrıca, ekstremite travması ve baş ve boyun yaralanmaları, son çatışmalardaki çatışma yaralanmalarının %>80'ini oluşturmaktadır2. İskelet kasının yaralanmayı takiben onarma, yenilenme ve yeniden şekillenme konusunda oldukça iyi bilinen kapasitesine rağmen, kas dokusunun önemli bir bölümünün kaybını içeren bu daha ciddi yaralanmalar kendi başlarına iyileşme yeteneğine sahip değildir ve Hacimsel Kas Kaybı (VML) yaralanmaları olarak adlandırılır. Tanım olarak, VML, yaralanan kasın veya kas ünitesinin3 kalıcı estetik ve fonksiyonel eksikliklerine neden olur.
İlginç bir şekilde, kraniyofasiyal VML yaralanmasının 2,4 prevalansına rağmen, bugüne kadar yapılan araştırmaların çoğu uzuv 5,6,7,8 ve gövde 9,10,11 kaslarına odaklanmıştır ve kraniyofasiyal kaslardaki VML yaralanmaları hakkında sadece bir avuç rapor bulunmaktadır 12,13,14 . Mevcut literatür, hem gelişimsel biyolojide hem de kraniyofasiyal ile ekstremite ve gövde kasları arasında rejeneratif kapasitede önemli farklılıklar olduğunu öne sürdüğünden, bu potansiyel olarak önemli bir translasyonel araştırma boşluğu sunmaktadır15,16. Aslında, yüzün her iki tarafında 20'den fazla kas vardır - bu, kraniyofasiyal bölgenin göz kırpma, yutma ve çiğneme gibi birçok temel görevi yerine getirmede rol oynadığı gerçeğini yansıtır15. Ayrıca, kraniyofasiyal kaslar arasında bile, rejeneratif yetenek açısından farklılıklar ortaya çıkar. Örneğin, göz dışı kaslar, uzuv kaslarından daha hızlı yenileniyor gibi görünmektedir17. Buna karşılık, masseter tibialis anteriorundan (TA) daha yavaş bir rejeneratif yanıt gösterir18. Bu farklılıklar, en azından kısmen, kasların kökenlerinin dallıyomerik mi yoksa somit kaynaklı mı olduğuna bağlı olabilir - bu da hem farklı miktarlarda uydu hücresi hem de yerleşik uydu hücresi popülasyonlarının farklı gen ekspresyon profilleri ile sonuçlanır19. Kraniyofasiyal kaslar arasındaki benzersiz özelliklerin yanı sıra ekstremite ve gövde kaslarına göre göz önünde bulundurulması, kasa özgü VML yaralanmalarını ele alan özelleştirilmiş tedavi seçeneklerinin daha iyi terapötik gelişimi için önemli mekanik bilgiler sağlayabilir. Kaslara özgü bu farklılıklar, baş ve boyun rekonstrüktif ameliyatları için donör kas dokusu transfer seçenekleri olarak latissimus dorsi gibi tabaka benzeri kasların bilinen sınırlamalarını da açıklayabilir 20,21,22.
VML yaralanmasının yeri ne olursa olsun, şu anda tam form ve işlevi geri kazandırabilecek herhangi bir tedavi yoktur. Altın standart klinik yönetim, rehabilitasyonun yanı sıra otolog doku transferini de içerir; Bununla birlikte, birincisi tipik olarak gücü iyileştirmez ve donör bölge morbiditesi 3,23 ile sonuçlanabilirken, ikincisi kaslarda fonksiyonel iyileşme veya kasılma kuvvetinin geri dönüşü üzerinde minimum etki ile hareket açıklığını iyileştirir 1,6. Tüm bu nedenlerden dolayı, VML yaralanmasını takiben fonksiyonel kas dokusunun rejenerasyonu için daha etkili terapötik yaklaşımlar geliştirmek için araştırmalar devam etmektedir. Yakın zamanda yapılan bir analiz, VML hasarının sıçan modellerinde yapılan klinik öncesi çalışmaların, VML onarımı1 için rejeneratif teknoloji çözümlerini geliştirmek için kritik önemini vurguladı.
Önceki çalışma 5,8,9,10,24,25'te belirtildiği gibi, VML sonrası fonksiyonel iyileşmenin değerlendirilmesi, terapötik müdahalelerin etkinliğini değerlendirmek için kritik öneme sahiptir. Spesifik olarak, yara iyileşmesi ve hacim iyileşmesi VML onarımının temel özellikleri olsa da, yaralanma ve tedavi sonrası kuvvet iyileşmesinin ölçülmesi, VML eksikliklerinden sorumlu çok ölçekli biyomekanik mekanizmaların yanı sıra fonksiyonel iyileşmeyi sağlayan mekanizmalara ışık tutmaya yardımcı olur. Bu nedenle, doku onarımı, hacim geri kazanımı ve gelişmiş kas gücü arasında bir bağlantı kurmak, VML onarımı9 için en etkili rejeneratif çözümleri belirlemek için mutlak bir gerekliliktir.
Bu bağlamda, bu fonksiyonel ölçümleri yapmak için üç ana yöntem vardır: (1) in vitro, (2) in situ ve (3) in vivo test - her biri kendi avantaj ve dezavantajlarını sunar8. Örneğin, in vitro test, canlı organizma dışında izole edilmiş kas fonksiyonunun incelenmesini içerir ve kas uyarılabilirliğini ve kasılmasını etkileyen çeşitli ilaçlar ve kimyasallarla kas stimülasyonunu daha doğrudan/spesifik olarak manipüle etme fırsatı sağlar26. Bu yöntem, kas fonksiyonunun ve iyileşmesinin27 hücresel ve moleküler yönleri hakkında ayrıntılı araştırmalara izin vermesine rağmen, gerçek kas fonksiyonunu ne kadar iyi özetlediğinisınırlayan kan akışını ve innervasyonu ortadan kaldırır 8,26. Yerinde test, kas hala doğal anatomik konumundayken ancak çevre dokulardan izole edilmişken kas fonksiyonunu değerlendirir25,28. Bu yöntem innervasyon ve kan akışını korurken, kasın ayrılması bulguların in vivo ortama uygulanabilirliğini hala sınırlayabilir. Ek olarak ve belki de en önemlisi, hem yerinde hem de in vitro testler, aynı hayvanda zaman içinde fonksiyonel iyileşmenin izlenmesine izin vermek için gerekli olan uzunlamasına testleri engelleyen terminal prosedürlerdir. Buna karşılık, kas fonksiyonunun doğal ortamında değerlendirilmesini içeren in vivo test, fizyolojik bir bağlamda kas performansının daha eksiksiz bir şekilde anlaşılmasını sağlar29. İn vivo çalışmalar aynı zamanda en az invaziv tekniktir ve bir çalışmanın süresi boyunca tekrar tekrar gerçekleştirilebilir29. Perkütan elektriksel sinir stimülasyonu kullanılarak, tendonları, damar sistemini ve innervasyonu sağlam bırakırken belirli kaslarda fonksiyonel ölçümler toplanabilir30. Bu boylamsal değerlendirmeler, aynı hayvanda iyileşmenin farklı aşamalarında meydana gelen ince ama önemli değişiklikler hakkında fikir verebilir. Bu yöntem genellikle küçük kemirgen modellerindekullanılır 8,31,32,33; Bununla birlikte, Pig30 ve Dog34'ün daha büyük hayvan modellerinde de kullanılmıştır.
Kraniyofasiyal VML yaralanmalarını takiben fonksiyonel iyileşmenin değerlendirilmesi ile ilgili yayınlanmış üç çalışma bulunmaktadır. Rodriguez ve ark. küçükbaş zygomaticus majör kasında bir kraniyofasiyal VML yaralanma modelini onarmak için bir yöntem hakkında rapor vermektedir. Yöntemleri, yalnızca son çalışma zaman noktasında uygulanabilen ve bu nedenle tek bir hayvanda boylamsal değerlendirmeye izin vermeyen bir yerinde test protokolünü detaylandırır13. Kim ve ark. bir VML yaralanmasını takiben fare çiğnemesinin sürekli elektromiyogram verilerini izlemek için nanomembran elektroniğinin kullanımı için bir yöntem tanımlamaktadır. Yaralı farelerden kontrole kıyasla önemli ölçüde daha düşük sinyal bildirdiler, ancak hareket artefaktlarının sinyal analizini etkilediğini ve farelerin zaman zaman devreyi çizmeye çalışacaklarını da belirttiler. Ek olarak, nanomembranın cilde güvenli bir şekilde bağlanmasına izin vermek için atimik, çıplak fareler kullanıldı, bu da şu anda bu yöntemin daha yaygın olarak kullanılan (ve uygun maliyetli) hayvan modellerinde daha geniş kullanımını engellemektedir12. Son olarak, Zhao ve ark. fonksiyonel bir sonuç olarak, hayvanlarda beslenmeyi bozan, önemli ölçüde azalmış vücut ağırlığı artışına yansıyan fare masseterinde kritik boyutta bir VML kusurunu tanımlamaktadır14. Bu çalışmalar göz önünde bulundurularak, bu makale, trigeminal sinirin deri altı elektrotlarla uyarılması yoluyla bir VML yaralanmasından önce ve sonra sıçan çenesindeki kasılma fonksiyonunun in vivo longitudinal değerlendirmesi için çok yönlü ve minimal invaziv bir yöntemi açıklamaktadır. Test, bir dizi artan simülasyon frekansından (20-200 Hz) geçerken, bir dönüştürücü kasın üretilen kuvvetini ölçer. Bu ölçümler, diğerlerinin yanı sıra kas sertliğinin ve maksimal tetanozun belirlenmesine izin verebilir. Aşağıdaki protokol, travmatik bir VML yaralanmasını takiben ipsilateral ısırma kuvvetinin fonksiyonel iyileşmesini değerlendirmek için tasarlanmıştır ve bu nedenle, doğrulanmış bir VML yaralanmasının cerrahi olarak oluşturulması için bir protokol de içerir. Bu yöntem, çok çeşitli sıçanlar ve fareler üzerinde kolayca uygulanabilir ve uygun ekipman modifikasyonları ile daha büyük hayvan modellerine ve VML yaralanmalarına da uygulanabilir30.
Protokol
Tüm hayvan işleme ve prosedürleri, Virginia Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) Yönergelerine uygun olarak onaylanmış ve yapılmıştır. Bu deneylerde kullanılan sıçanlar, ameliyat sırasında 324.8 g ± 12.72 g ağırlığında 12-14 haftalık erkek Lewis sıçanlarıydı. Kullanılan reaktiflerin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir.
1. Masseter kasının VML yaralanması
- Ekipman hazırlığı
- Ameliyattan önce, gerekli tüm aletlerin uygun şekilde sterilize edildiğinden emin olun: cerrahi örtüler, neşter, forseps, mikromakas, kanama durdurucular, dikişler ve gazlı bez.
- Isıtılmış bir platforma güç verin ve 37 °C'ye ayarlayın.
- Anestezi altında göz kuruluğunu önlemek için her iki göze de steril oftalmik merhem sürün. Hayvanı anestezi indüksiyon odasına koyun ve% 2 -% 3 izofluran verin (kurumsal olarak onaylanmış protokolleri izleyerek).
- VML Yaralanmasının cerrahi olarak oluşturulması
- Hayvanı hazneden çıkarmadan önce uygun şekilde uyuşturulduğundan emin olun.
NOT: Bu, hayvanın ayak parmağının sıkışmasına tepki vermemesi durumunda belirlenebilir. - Hayvanı tartın ve sol tarafındaki yanal pozisyonda, burnu güvenli bir şekilde burun konisine gelecek şekilde bir ameliyat tahtasına yerleştirin ve izofluranın sürekli uygulanmasına izin verin.
- Uygun analjezik vererek, yüzün sağ tarafını tıraş ederek ve üç kez iyot ve alkollü sürüntü değişikliği ile alanı sterilize ederek hayvanı ameliyata hazırlayın. Bu çalışmalar için, analjezi için uzun süreli salınan buprenorfin kullanıldı (0.65 mg / kg vücut ağırlığı).
- Sıçanın bukkal bölgesi boyunca yaklaşık 2 cm'lik bir kesi yaparak ameliyata başlayın. Kesi, hayvanın burnu ve kulağı ile aynı hizada olmalıdır. Cildi ve fasyayı ayırmak için künt diseksiyon kullanın.
- Fasya boyunca benzer bir kesi yapın ve alttaki masseterden nazikçe inceleyin.
- Bukkal ve marjinal sinirleri bulun (Şekil 1A). Çıkarılacak alanı işaretlemek için steril bir cerrahi işaretleyici ve cetvel kullanın. Alan, fasiyal sinirler arasında uzanan açıkta kalan masseterin merkezinde 10 mm x 5 mm'lik bir dikdörtgen olmalıdır (Şekil 1B).
- Doku çıkarmaya başlamak için dikkatlice mikromakas kullanın. Son yaralanmanın 150 mg eksize edilmiş doku ile yaklaşık 4 mm derinliğe ulaştığından emin olun (Şekil 1C). Çıkarılan doku yüzeyel masseterin tam kalınlığından olacak ve kısmen derin masseterin içine gidecektir.
NOT: Bu deneylerde çıkarılan ortalama doku kütlesi 146.1 mg ±1.16 mg idi. - Sırasıyla emilebilir (6-0) ve emilmeyen (5-0) kesikli dikişler kullanarak fasyayı ve cildi kapatın.
- Hayvanı hazneden çıkarmadan önce uygun şekilde uyuşturulduğundan emin olun.
- Temizleme ve izleme
- Dikişten sonra, anestezi gazını kapatın ve bilincine geri dönüşünü izlemek için hayvanı ısıtılmış yüzeyde tutun. Sıçan bilincini geri kazanmaya başladığında, hayvanı kafese geri koyun ve uyanık ve yürüyene kadar izlemeye devam edin.
- Ameliyattan sonraki 3 gün boyunca hayvanı kontrol edin ve herhangi bir ağrı veya rahatsızlık belirtisi olup olmadığını değerlendirin.
- Ameliyattan sonraki 7 gün boyunca, çenedeki gerginliği azaltmak ve hayvanları iyi nemlendirmek/beslemek için hayvana yumuşak yiyecekler sağlayın.
- Kesilen dikişleri ameliyattan 7-10 gün sonra çıkarın ve çıkarılmadan önce yaranın tamamen kapandığından emin olun.
- Çalışmanın son zaman noktasını takiben, hayvanları IACUC yönergelerine göre ötenazi yapın. Masseter kaslarını eksplant edin ve sıvı nitrojen veya sıvı nitrojenle soğutulmuş izopentan içine daldırılarak flaş donar.
NOT: Dondurulmuş doku örnekleri, gelecekteki histolojik değerlendirme için -80 °C'de uzun süreli saklanabilir.
2. Çenenin in vivo fonksiyonel değerlendirmesi
- Ekipman hazırlığı
- Tüm ekipmanın doğru şekilde bağlandığını kontrol edin ve emin olun.
- Sırasıyla, (1) bilgisayarı, (2) iki fazlı stimülatörü, (3) çift modlu kol sistemini ve son olarak (4) 37 °C'ye ısıtmak için ısıtılmış bir platformu açın.
NOT: Kullanım kılavuzu, stimülatör ve kol sisteminin doğru okumalar üretmesi için 1 dakikalık bir ısınma süresi belirtir. Ek olarak, herhangi bir hayvanı test etmeden önce platformun tamamen ısınması için 10-15 dakika bekleyin. - Anestezi altında göz kuruluğunu önlemek için her iki göze de steril oftalmik merhem sürün. Test edilecek hayvanı anestezi indüksiyon odasına yerleştirin ve% 2 -% 3 izofluran sağlayın.
- Politetrafloroetilen kaplı elektrot uçlarını %70 etanol içine yerleştirerek sterilize edin.
- Dinamik Kas Kontrolü (DMC) Yazılımını bulun ve açın. Bu, işlevsel değerlendirmeyi gerçekleştirmek için gerekli olacaktır.
- Yazılım kurulumu
- DMC Yazılımında, kurulum menüsünde Instant Stim'i bulun ve parametreleri istediğiniz değerlere değiştirin. Bu çalışmada, ön ayarlarından hiçbir parametre değiştirilmemiştir (Şekil 2A).
- Kurulum menüsü altında, verileri depolamak için bir otomatik kaydetme klasörü oluşturun ve seçin.
- Yazılım ekranının alt kısmına yakın bir yerde, Otomatik Kaydetme Tabanı başlıklı bir kutu bulun. Bunu, test edilen hayvana özgü bir başlığa değiştirin, örneğin, "sıçan#-zaman noktası" (Şekil 2B).
- Yazılım ekranının üst kısmındaki Sequencer'ı seçin. Açılan yeni pencerede, ekranın alt kısmındaki Sırayı Aç'ı seçin. Açılan dosya gezgininde önceden hazırlanmış sırayı seçin. Bu, Dizi penceresini frekans, uyaranların süresi ve dinlenme süresi gibi parametrelerin bir listesiyle dolduracaktır (Şekil 2C).
- Yükleme Sırası'na ve ardından Pencereyi Kapat'a tıklayın.
NOT: Bu protokolde kullanılan dizi, her biri arasında 20 saniye dinlenme olan 9 adımdan (twitch, 20 Hz, 40 Hz, 50 Hz, 60 Hz, 80 Hz, 100 Hz, 150 Hz, 200 Hz) oluşur. Seğirme stimülasyonunun yanı sıra, tüm adımlar 500 ms sürelidir. Sekans protokolü, her laboratuvarın özel test hedeflerine göre ayarlanmalıdır.
- Yükleme Sırası'na ve ardından Pencereyi Kapat'a tıklayın.
- Yeni bir pencere açmak ve gerçek zamanlı veri alımının görüntülenmesini etkinleştirmek için Dosya > Canlı Veri İzleyicisi'ni seçin.
- Canlı Veri İzleyicisi penceresinde zaman ölçeğini, minimum y değerini ve maksimum y değerini manuel olarak veya otomatik ölçeklendirmeyi etkinleştirmek için kutuyu işaretleyerek ayarlayın.
- Hayvan hazırlama
- Anestezi odasından çıkarmadan önce hayvanın uygun anestezi düzleminde olduğundan emin olun.
- İzofluranın sürekli uygulanmasına izin vermek için hayvanı sırtüstü pozisyonda, burnu güvenli bir şekilde burun konisine yerleştirin. Burnunu platformda güvenli bir şekilde tutmak için farenin çenesinin üst yarısının üzerine bir sabitleme halkası yerleştirin.
- Çenenin deney tarafında hayvanın boynunu ve yüzünü tıraş edin.
- Hayvanın üst yarısını, kollarına ve göğsüne bir kayış yerleştirip bağlayarak sabitleyin.
- X, Y ve Z düzlemlerini kontrol etmek için teçhizat platformunun yanında bulunan üç döner düğmeyi kullanarak ısırma kolu konumunu ayarlayın (Şekil 3A). Üst düğmeyi kullanarak, ısırma kolunu hayvana doğru indirin ve kolun ucunu hayvanın çenesinin hemen üzerinde olacak şekilde ayarlamak için diğer iki düğmeyi kullanın.
- Kafayı sabitlemek ve hareket etmesini önlemek için asılı halkayı hayvanın alt dişlerinin etrafına asmak için cımbız kullanın (Şekil 3B).
NOT: Döngü, kuvvet dönüştürücüsünden 3 cm uzakta ısırma kolunda açılan bir delikten bulunur. Sistem ilk kullanımdan önce kalibre edilmelidir. - Çene üzerindeki gerilimi artırmak için kolun yüksekliğini ayarlayın. Bu deneylerde kullanılan tekrarlanabilir temel gerilim ~ 0.5 N idi.
- Elektrot yerleştirme
- Hayvanın çenesini palpe edin ve mandibulanın arka köşesini bulun. Elektrotları köşenin her iki tarafına yaklaşık 2-3 mm aralıklarla deri altından yerleştirin. Elektrotlar 3-5 mm derinlikte yerleştirilmelidir. Elektrotları yerinde tutmak için bir timsah klipsi ve stand kullanın.
- Canlı Veri Monitörü penceresinde, etkinleştirmek için Instant Stim etiketli büyük turuncu düğmeye tıklayın.
- Monitör, her stimülasyon sırasında yukarı doğru ani artışlar göstermeye başlamalıdır. Düğmeleri gerektiği gibi kullanarak elektrot yerleşimini ve kol kolu konumunu ayarlayın. Sadece çenenin ipsilateral tarafının aktivasyonu gözlenmelidir (Şekil 4).
- Yüksek güçlü iki fazlı stimülatörde, merkeze yakın "Aralık" ve "Ayarla" etiketli iki düğme vardır. Amperajı modüle etmek için Aralık düğmesini çevirmeye başlayın. Amper arttıkça, anlık stim zirveleri, art arda üç stimülasyonun aynı kasılma tepkileriyle sonuçlandığı seviye olarak belirlenen, plato haline gelene kadar büyüklük olarak artmaya başlayacaktır.
- Amperajı çok yükseğe çevirmekten kaçının, yani maksimum tepe noktalarının gözlemlendiği amperajın %20'den fazla olmamasına neden olun - çünkü bu, komşu kasların işe alınmasına ve yanlış kuvvet okumalarına neden olabilir.
- Çeneyi uyarmak için kullanılan mevcut "Aralık" yüzdesini modüle etmek için Ayar düğmesini çevirin. Seğirme yanıtını optimize etmek için akımda bir artış veya azalma gerekebilir.
- Elektrotların hala güvenli bir şekilde yerinde olduğunu onaylayın ve anlık uyarıyı durdurun.
- Canlı veri monitöründeki turuncu "Anında Stim" düğmesinin altında, gri Sırayı Başlat düğmesini bulun ve üzerine tıklayın.
- Stimülasyon protokolünün süresi boyunca eğrileri izlemeye devam edin. Stimülasyon frekansı arttıkça, üretilen maksimum kuvvet de artacaktır. Tetanoza ulaşıldığında, kuvvet eğrileri düzleşecektir (Şekil 5A).
- Temizleme
- Fonksiyonel stimülasyon dizisinin tamamlanmasının ardından, elektrotları çıkarın ve %70 etanol ile silerek temizleyin. Eğer bu test edilecek son hayvan ise, elektrotlar kapaklarına geri yerleştirilebilir.
- Anestezi gazını kapatın, ancak bilincine geri dönüşünü izlemek için hayvanı ısıtılmış yüzeyde tutun. Sıçan bilincini geri kazanmaya başladığında, onu kafese geri koyun ve hayvan uyanık ve yürüyene kadar izlemeye devam edin.
- Veri toplama için kullanılan ekipmanı kapatın ve tüm yüzeyleri silin.
3. Veri analizi
NOT: Bu yöntem daha önce sıçan TA8'in in vivo fonksiyonel testi için bir yöntemin belgelenmesi olarak tanımlanmıştır. Veri analizi, bu çalışmanın niyetlerini belirlemek için tasarlanmıştır ve protokoller, kullanıcının hedeflerine bağlı olarak değişebilir.
- Dinamik Kas Analizi yazılımını bulun ve açın.
- Yüksek Verim menüsüne tıklayın ve aynı anda birden fazla örneği analiz etmek için Kuvvet Frekansı Analizi'ni seçin.
- Dosyaları Seç'i seçin ve analiz için istediğiniz kadar veri dosyasını vurgulayın. "Klasör Seç" düğmesi, örnekler dosya sistemi içinde açıkça adlandırılmışsa da kullanılabilir.
- Taban Çizgisini Kaldır kutusunu işaretleyin. Bu, temel kuvveti her deneme için kaydedilen maksimum kuvvetten otomatik olarak kaldıracak ve mutlak maksimum değerleri sağlayacaktır.
- Analiz Et düğmesine tıklayın ve ardından verilerin bir elektronik tablo olarak kaydedilebileceği Tabloyu Excel'e Aktar'a tıklayın. "İmleci Başlat" ve "İmleci Bitir" değerlerinin stimülasyonun zaman damgasını doğru bir şekilde yakaladığından emin olun. Gerekirse bu değerler manuel olarak ayarlanabilir.
- Kaydedilen e-tabloyu açın.
NOT: Kullanıcı, "Maksimum" sütununu kullanarak tüm frekanslarda üretilen maksimum kuvveti hesaplayabilir. Kuvvet-frekans eğrisi de oluşturulabilir (Şekil 5).
Sonuçlar
Önceki bir yayında açıklandığı gibi, tetanik eğriler, optimal sonuçları optimal olmayan sonuçlardan ayırt etmek için kullanılabilir8. Kas maksimum kuvvetine uyarıldığında ve tetanik kasılma süresi boyunca bu maksimumu koruduğunda ideal bir sonuç elde edilir. Bireysel seğirmelerin tetanik eğriler halinde toplanması genellikle 100 Hz'de veya sonrasında görünmeye başlayacaktır. Şekil 5A, 150 Hz'deki ideal eğrinin stimülasyonun başlangıcında keskin bir yükselişe, minimum salınımla maksimum kuvvet değerinde düz bir plato fazına ve stimülasyon durduğunda keskin, dikey bir aşağı dönüşe sahip olduğu için bu noktayı göstermektedir. İdeal olmayan tetanik eğriler, plato fazı sırasında salınımlar gösterebilir ve negatif veya pozitif bir eğim gösterebilir (Şekil 5C,D).
Bu fonksiyonel test protokolünün sonuçları, araştırmacıların hedeflerine ve çalışmanın deneysel tasarımına bağlı olarak farklı şekilde temsil edilebilir. Bu protokol söz konusu olduğunda, mutlak maksimum kuvvet, tüm stimülasyon frekanslarından ampirik olarak belirlenir ve test için her zaman noktasında grafiklendirilir. Bu, masseterde tarif edilen VML yaralanmasının yaratılmasından sonra her 4 haftada bir temel maksimum kuvvet üretiminin maksimum kuvvet üretimi ile karşılaştırılmasına izin verir (Şekil 1D). Karşılaştırma için, yaralanmamış hayvanlardan oluşan bir kohort (n = 4) da her zaman noktasında test edildi (Şekil 1E). Her bir zaman noktasındaki hayvan ağırlıkları da karşılaştırıldı (Şekil 1F). VML'den sırasıyla 4, 8 ve 12 hafta sonra, sıçanlar ortalama 7.958 N ±1.797 N, 7.183 N ±1.450 N ve 7.823 N ± 0.626 N maksimum kuvvet üretti. Tek Yönlü Tekrarlanan Ölçümler Fisher'ın En Az Anlamlı Farkı (LSD) ile Varyans Analizi (ANOVA) post hoc ikili karşılaştırmalar, VML yaralanması sonrası herhangi bir zaman noktasında bu değerler arasında istatistiksel olarak anlamlı bir fark olmadığını belirledi, bununla birlikte, hepsi 10.031 N ±0.564 N'lik ortalama temel kuvvetten önemli ölçüde farklıydı.
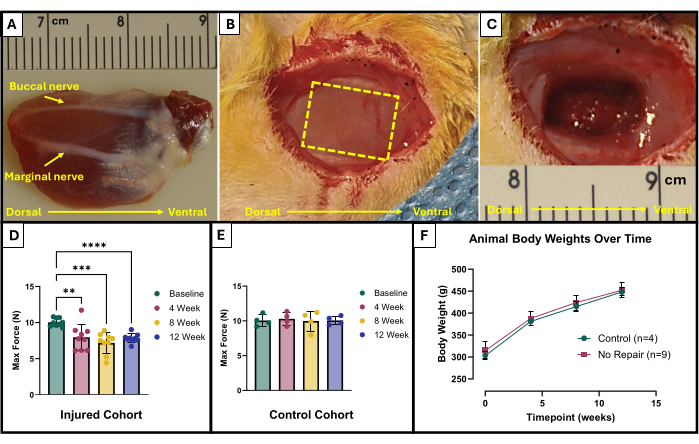
Şekil 1: VML yaralanmalı masseter kası için cerrahi şematik ve fonksiyonel sonuçlar. Anatomik yönelimi ve yaralanma oluşumu için sinir işaretlerini gösteren eksplante masseter kası (A). VML yaralanması oluşumundan önce (B) ve (C) sonrası ameliyat sırasında hayvan. Görüntülerin tümü (A) ile aynı yönde kaslarla sunulur. Sarı kesikli çizgi, kasın eksize edileceği bölgeyi gösterir. Massetere (D) VML yaralanması (n = 9) alan sıçanlarda ve ayrıca yaralanmamış bırakılan yaşa uygun kontrol sıçanlarında (n = 4) (E) başlangıçta ve zaman içinde maksimum kuvvet üretimi. Zaman içindeki sıçan vücut ağırlıklarının bir grafiği (F). (D), Fisher'ın LSD post hoc ikili karşılaştırmaları ile tek yönlü Tekrarlanan Ölçümler ANOVA'sını temsil eder, burada **= p < 0.01, ***= p < 0.001, ****= p < 0.0001. (A) ve (C) 'deki cetveller santimetre cinsindendir ve dereceler milimetre cinsindendir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
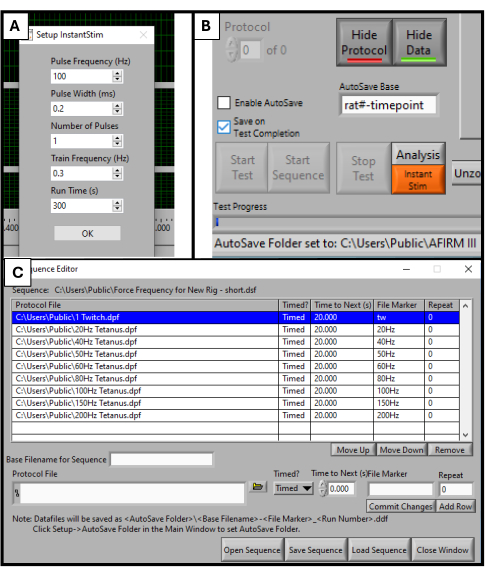
Şekil 2: İşlevsel test için yazılım başlatma. DMC yazılımı için parametre ayarı. Instant Stim'i istenen değerlere (A) ayarlama. Yazılım Grafiği Kullanıcı Arayüzü ve Otomatik Kaydetme Tabanı ayar kutusunun konumu (B). Test için kullanılan 9 adımlı protokol dizisinin seçimi (C). Burada görüntülenen değerler, bu etüt için kullanılan örnek değerlerdir, ancak diğerlerinin belirli kullanım durumlarına bağlı olarak optimize edilmeleri ve ayarlanmaları gerekebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
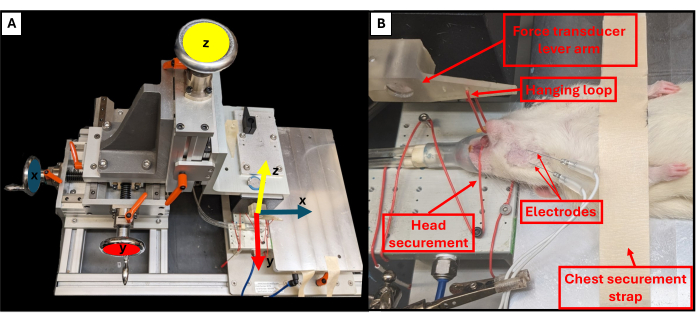
Şekil 3: Fonksiyonel teçhizat hareket eksenleri ve uygun hayvan konumlandırması. Şematik, fonksiyonel test donanımı üzerindeki üç ayar çarkının her biri ile kol kolu (A) için karşılık gelen hareket eksenleri arasındaki ilişkiyi göstermektedir. Fonksiyonel testlerden geçen, hayvanın platform ve diğer önemli teçhizat bileşenleri (B) üzerinde uygun sırtüstü pozisyonunu gösteren bir sıçanın örnek görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
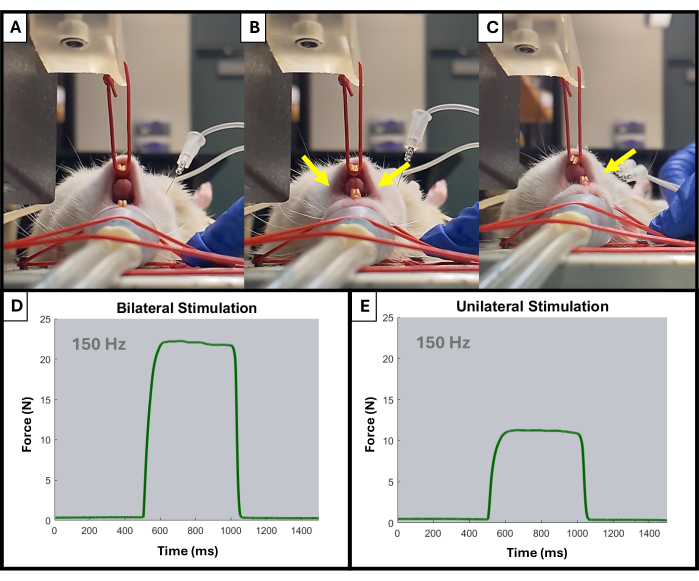
Şekil 4: Test sırasında tek taraflı ve iki taraflı çene aktivasyonu örneği. (A), herhangi bir stimülasyondan önce sıçanın çenesinin dinlendiğini gösterir. Yanlış yerleştirilmiş elektrotlar, sarı oklarla (B) gösterildiği gibi iki taraflı çene kasılmasına neden olabilirken, uygun şekilde yerleştirilmiş elektrotlar istenen ipsilateral kasılmaya (C) neden olur. Sarı oklar çenedeki kasılma noktalarını gösterir. Ayrıca, bilateral (D) ve tek taraflı (E) kas aktivasyonu için 150 Hz'de örnek kuvvet-zaman eğrileri de gösterilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
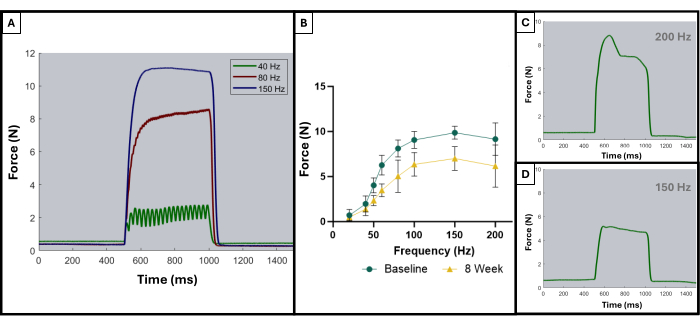
Şekil 5: Kabul edilebilir ve kabul edilemez denemeler için temsili stimülasyon-yanıt eğrileri. 40, 80 ve 150 Hz'de (A) örnek stimülasyon eğrileri, tetanik kasılmaya yol açan ve sırasında nelere dikkat edilmesi gerektiğini göstermek için. Stimülasyon frekansı arttıkça, kaydedilen tepe gerilimi de daha yüksektir, bu da başlangıçta ve VML'nin oluşturulmasından 8 hafta sonra yaralı hayvanların ortalamasını (n = 9) gösteren kuvvet-frekans eğrilerinde (B) gözlemlenebilir. (C,D), uygun olmayan tetanoz nedeniyle elektrot ayarlaması ihtiyacını gösterecek bir kuvvet tepkisinin şeklinin temsili örneklerini gösterin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, sıçan çenesinde üretilen ipsilateral ısırma kuvvetinin in vivo fonksiyonel testi için basit ve güvenilir bir yöntemi tanımlar. Ayrıca, sıçan masseter kasında bir VML yaralanmasının cerrahi olarak oluşturulması için bir yöntem de tarif edilmiştir. Kombinasyon halinde, bu yöntemler, travmatik bir kraniyofasiyal yaralanmadan önce ve sonra fonksiyonel iyileşmenin uzunlamasına bir değerlendirmesini yapmak için biyolojik olarak ilgili bir hayvan modeli sağlar. İn vitro ve in situ gibi diğer test yöntemleri de değerli bilgiler sağlayabilirken, tendonun izolasyonunu ve dokunun doğal ortamından çıkarılmasını gerektirir ve in vivo fonksiyonel sonuçların daha iyi anlaşılması için uygulanabilirliklerini sınırlar 8,25,26,27,28 . Uygun eğitim ve uygulama ile, bir araştırmacı bir hayvanı test için hızlı bir şekilde konumlandırabilecek ve maksimum kas kuvveti üretimini elde etmek için gerekli ayarlamaları yapabilecektir.
Uygun elektrot yerleşimini ve stimülasyonunu sağlamak için her hayvan için doğrulanması gereken teknik ayrıntılar vardır. İlk olarak, üst kesici dişler, farenin kafası ısıtılmış platformla tamamen temas halinde olacak şekilde sabitlenmelidir. Bu aynı zamanda inhale anesteziklerin sürekli uygulanması için sıçanın burnunu burun konisine yerleştirecektir. Kafa uygun konumda tutulmazsa, taban çizgisi gerilimi saptıkça kuvvet okumalarında tutarsızlıklar olacaktır. Ek olarak, hayvanın vücudu sırtüstü olmalı ve omurgası düz olmalıdır. Hayvanı uygun pozisyonda tutmak, elektrotun yerleştirilmesine ve doğru yerde bakımına yardımcı olacaktır. Son olarak, elektrotların yerleştirilmesi zor olabilir, çünkü çenenin sadece deneysel tarafını uyarmak için uygun derinlik ve aralıkta yerleştirilmeleri gerekir. Dikkat ve uygulama, tekrarlanabilir ve güvenilir sonuçlar için elektrot yerleştirmede usta olmakla ilgilidir. Elektrotlar oldukça hızlı bir şekilde donuklaşacaktır, bu nedenle onları sık sık değiştirmek gerekir. Kötü elektrot yerleşiminin ayırt edici özellikleri, aksesuar kasların aktivasyonu, pozitif/negatif eğimli kuvvet okumaları (stimülasyon sırasında elektrotların hareketi) veya kaynaşmamış/salınımlı bir tetanik dalga formudur8 (Şekil 5C,D).
Ayrıca, bu yöntemin, bu sistemin gelecekteki uygulamalarında bahsetmeyi ve dikkate almayı garanti eden birkaç sınırlaması vardır. İlk olarak, bu çalışmada yapılan ölçümler için yeterli olsa da, üst çeneyi sabitlemek için kullanılan halka en sert sistem olmayabilir. Bunun yerine, kulak çubuklarını kullanan stereotaksik bir yaklaşım, farenin üst çenesinin daha iyi tutulmasını sağlayabilir. Ek olarak, bu yöntemle test etmek için ayarlanan pozisyon olarak pasif bir gerilim değeri kullanıldı, bu da kasın optimal uzunluğunda (Lo) konumlandırılması durumunda elde edilecek maksimum kuvvet üretimi ile sonuçlanmayabilir. Aslında, Lo, hayvanın burada tarif edildiği gibi konumlandırılması ve ardından seğirme stimülasyonlarını çalıştırırken çene tıkanıklığının küçük (0,5-1 mm) artışlarla manipüle edilmesiyle belirlenebilir - Lo, maksimum seğirme kuvvetinin üretildiği optimal test pozisyonu olarak belirlenir. Bununla birlikte, masseter kası oldukça benzersiz bir geometriye ve hareketesahiptir 35,36 ve bu nedenle, örneğin uzuv kaslarının (tipik olarak Lo civarında çalışan) karakteristik özelliklerinden çok daha geniş bir uzunluk aralığında çalışır. Ancak çiğneme, ısırmaya göre daha dar bir aralıkta gerçekleşir. Bu nedenle, bu soruna mükemmel bir yaklaşım yoktur. Bu nedenle, bu soruna yaklaşmanın tek yolu temel bir gerilim belirlemek olmasa da, çene kaslarının optimal uzunluğu çenenin doğal açıklığının ötesinde olduğundan, bunu yapmak için mantıklı bir bilimsel gerekçe vardır. Ne olursa olsun, belirli bir pasif gerilimdeki maksimum kuvvet, Lo'daki maksimum kuvvetten farklı olsalar bile, fonksiyonun yönleri hakkında hala önemli bir fikir verir. Açıkçası, masseter kasının kuvvet-uzunluk ilişkisinin daha fazla araştırılması gerekmektedir. Son olarak, bu yöntem, sıçandaki trigeminal sinirin uyarılmasına bakar ve üç dala ayrılır: V1-V3. V3 veya mandibular sinir, motor bileşenli tek dal olsa da, masseter, temporalis, pterygoidler ve mylohyoid37 dahil olmak üzere birçok kası innerve eder. Bu, dikkate alınması önemlidir, çünkü bu yöntemin yalnızca diğer araştırma araştırmalarıyla ilgili olabilecek masseter kuvvetini rapor etmediği anlamına gelir.
Bu teknik yönlere ve sınırlamalara rağmen, bu yöntemin sağlam ve tutarlı olduğu kanıtlanmıştır. Burada sadece ipsilateral test açıklanmış olsa da, protokol çenenin diğer tarafının ek testlerini içerecek şekilde kolayca değiştirilebilir. Masseter kasılmasının/fonksiyonunun iki taraflı testi, tek bir hayvanda sağlıklı/yaralı karşılaştırmaların yapılmasına izin verecek ve belki de yaralı ve/veya kontrol tarafında (yaralanmamış taraf) önemli telafi edici değişiklikleri aydınlatacaktır. Genel olarak, bu model, uzunlamasına kas fonksiyonunun yanı sıra fonksiyonel iyileşmeyi minimal invaziv bir şekilde değerlendirmek için güçlü bir araç sağlar. Bu nedenle, bu sistem, VML aracılı fonksiyonel eksikliklere katılan biyomekanik mekanizmaların değerlendirilmesinin yanı sıra, kraniyofasiyal bölgedeki VML yaralanmalarının onarımı için çeşitli terapötiklerin etkinliğini test etmek için geçerli olacaktır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Fonksiyonel değerlendirmeler yapmak için kullanılan ekipmanı paylaşmak için Myologica LLC. Bu yayında rapor edilen araştırma, Ulusal Sağlık Enstitüleri Ulusal Diş ve Kraniyofasiyal Araştırma Enstitüsü tarafından U24 DE029463 ödül numarası altında desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Referanslar
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır