Method Article
Évaluation fonctionnelle in vivo du muscle masséter du rat suite à la création chirurgicale d’une lésion de perte musculaire volumétrique (VML)
Dans cet article
Résumé
Les lésions de perte musculaire volumétrique (VML) dépassent la capacité de régénération endogène, entraînant des déficits fonctionnels permanents. Les recherches actuelles sur la VML se concentrent principalement sur les muscles des membres et du tronc. Pour étendre les études mécanistes de la VML aux muscles cranio-faciaux, cet article décrit une méthode in vivo d’évaluation longitudinale de la fonction du muscle masséter avant et après une lésion de la VML.
Résumé
La perte musculaire volumétrique (VML) est répandue dans les populations civiles et militaires et représente une lésion musculaire squelettique débilitante dépassant la capacité de régénération naturelle du corps. Ces blessures perturbent non seulement les fibres musculaires, mais également les nerfs, les vaisseaux sanguins et la matrice extracellulaire, submergeant la capacité de régénération des muscles squelettiques et entraînant une fibrose sévère et des déficiences permanentes de la structure et de la fonction musculaires. La prise en charge clinique actuelle présente de nombreuses limites, et par conséquent, des recherches sont en cours pour développer des approches thérapeutiques plus efficaces. Cependant, il convient de noter qu’une grande partie de l’accent préclinique sur les lésions VML s’est concentrée sur les muscles des membres et du tronc, avec une étude limitée des muscles craniofaciaux. Les différences de biologie du développement et de capacité de régénération entre les muscles craniofaciaux et les muscles des membres/troncs peuvent fournir des informations cruciales qui conduisent à davantage d’options de traitement VML spécifiques aux blessures. De plus, l’évaluation de la récupération fonctionnelle est essentielle pour établir l’efficacité thérapeutique. À cet égard, l’essai in vivo de la contraction musculaire avec stimulation nerveuse percutanée est une méthode peu invasive qui permet une évaluation fonctionnelle répétée au cours d’une étude - chez le même animal. À la lumière de ces considérations, cet article décrit une méthode d’évaluation in vivo de la fonction musculaire dans le muscle masséter du rat avant et après une lésion VML. Ce protocole est le premier exemple publié détaillant la création et l’évaluation fonctionnelle d’une lésion craniofaciale VML biologiquement pertinente chez le rat.
Introduction
Les blessures traumatiques et chirurgicales des tissus mous qui impliquent des muscles squelettiques sous-jacents restent l’un des plus grands défis de la reconstruction tissulaire, tant pour les civils que pour les guerriers blessés1. En fait, près de 20 % des blessures sur le champ de bataille se produisent également dans les régions craniofaciales des guerriers blessés (tête et visage)2. Inclusivement, les traumatismes aux extrémités et les blessures à la tête et au cou représentent >80 % des blessures de combat dans les conflits récents2. Malgré la capacité plutôt bien connue des muscles squelettiques à se réparer, à se régénérer et à se remodeler après une blessure, ces blessures plus graves, qui impliquent la perte d’une partie substantielle du tissu musculaire, ne sont pas capables de guérir par elles-mêmes et sont appelées lésions de perte musculaire volumétrique (VML). Par définition, la VML entraîne des déficits esthétiques et fonctionnels permanents du muscle blessé ou de l’unité musculaire3.
Il est intéressant de noter que, malgré la prévalence des lésions VML craniofaciales 2,4, une grande partie de la recherche à ce jour se concentre sur les musclesdes membres 5, 6, 7, 8 et du tronc9, 10, 11, avec seulement une poignée de rapports sur les lésions VML dans les muscles craniofaciaux12,13,14. Il s’agit d’une lacune potentiellement importante dans la recherche translationnelle, car la littérature existante suggère qu’il existe des différences significatives à la fois dans la biologie du développement et la capacité de régénération entre les muscles craniofaciaux et les muscles des membres et du tronc15,16. En fait, il y a plus de 20 muscles de chaque côté du visage, ce qui reflète le fait que la région craniofaciale est impliquée dans l’exécution de nombreuses tâches essentielles aussi diverses que cligner des yeux, avaler et mâcher15. De plus, même entre les muscles cranio-faciaux, des différences apparaissent en ce qui concerne la capacité de régénération. Par exemple, les muscles extraoculaires semblent se régénérer plus rapidement que les muscles des membres17. En revanche, le masséter présente une réponse régénérative plus lente que le tibial antérieur (TA)18. Ces différences peuvent être dues, au moins en partie, au fait que les origines des muscles sont branchiomériques ou dérivées de somite, ce qui entraîne à la fois des quantités différentes de cellules satellites et des profils d’expression génique distincts des populations de cellules satellites résidentes19. La prise en compte des caractéristiques uniques des muscles craniofaciaux, ainsi que des muscles des membres et du tronc, peut apporter des connaissances mécanistes importantes pour améliorer le développement thérapeutique d’options de traitement personnalisées qui traitent les lésions VML spécifiques aux muscles. Ces différences spécifiques aux muscles peuvent également expliquer les limitations connues des muscles en forme de feuille, tels que le grand dorsal, en tant qu’options de transfert de tissu musculaire donneur pour les chirurgies reconstructives de la tête et du cou 20,21,22.
Quel que soit l’emplacement de la lésion VML, il n’existe actuellement aucun traitement permettant de restaurer la forme et la fonction complètes. La prise en charge clinique de référence comprend le transfert de tissus autologues ainsi que la réadaptation ; Cependant, le premier n’améliore généralement pas la force et peut entraîner une morbidité du site donneur 3,23, tandis que le second améliore l’amplitude des mouvements, avec un impact minimal sur la récupération fonctionnelle ou le retour de la force contractile, dans le muscle 1,6. Pour toutes ces raisons, des recherches sont en cours pour développer des approches thérapeutiques plus efficaces pour la régénération du tissu musculaire fonctionnel après une lésion VML. Une analyse récente a mis en évidence l’importance cruciale des études précliniques dans des modèles de lésions VML chez le rat pour faire progresser les solutions technologiques régénératives pour la réparation VML1.
Comme indiqué dans les travaux antérieurs 5,8,9,10,24,25, l’évaluation de la récupération fonctionnelle après VML est essentielle pour évaluer l’efficacité des interventions thérapeutiques. Plus précisément, alors que la cicatrisation des plaies et la récupération du volume sont des caractéristiques clés de la réparation de la VML, la mesure de la récupération de la force après une blessure et le traitement permet de faire la lumière sur les mécanismes biomécaniques multi-échelles responsables des déficits VML, ainsi que sur les mécanismes qui favorisent la récupération fonctionnelle. En tant que tel, l’établissement d’un lien entre la réparation tissulaire, la récupération du volume et l’amélioration de la force musculaire est une exigence absolue pour identifier les solutions régénératives les plus efficaces pour la réparation VML9.
À cet égard, il existe trois méthodes principales pour effectuer ces mesures fonctionnelles : (1) in vitro, (2) in situ et (3) tests in vivo – chacune offrant ses propres avantages et inconvénients8. Par exemple, les tests in vitro impliquent l’examen d’une fonction musculaire isolée à l’extérieur de l’organisme vivant et offrent la possibilité de manipuler plus directement/spécifiquement la stimulation musculaire avec une variété de médicaments et de produits chimiques qui affectent l’excitabilité et la contraction musculaires26. Bien que cette méthode permette des investigations détaillées sur les aspects cellulaires et moléculaires de la fonction musculaire et de la récupération27, elle supprime l’apport sanguin et l’innervation, ce qui limite la façon dont elle récapitule la véritable fonction musculaire 8,26. Les tests in situ évaluent la fonction musculaire alors que le muscle est encore à son emplacement anatomique naturel, mais isolé des tissus environnants25,28. Bien que cette méthode maintienne l’innervation et l’approvisionnement en sang, la séparation du muscle peut encore limiter l’applicabilité des résultats à l’environnement in vivo. De plus, et peut-être le plus important, les tests in situ et in vitro sont des procédures terminales qui excluent les tests longitudinaux - ce qui est nécessaire pour permettre le suivi de la récupération fonctionnelle au fil du temps sur le même animal. En revanche, les tests in vivo, qui consistent à évaluer la fonction musculaire dans son environnement d’origine, permettent une compréhension plus complète des performances musculaires dans un contextephysiologique29. Les études in vivo sont également la technique la moins invasive et peuvent être réalisées à plusieurs reprises au cours d’une étude29. En utilisant la stimulation nerveuse électrique percutanée, on peut collecter des mesures fonctionnelles dans des muscles spécifiques tout en laissant les tendons, le système vasculaire et l’innervation intacts30. Ces évaluations longitudinales peuvent donner un aperçu des changements subtils, mais importants, qui se produisent au cours des différentes étapes de la guérison chez le même animal. Cette méthode est couramment utilisée dans les modèles de petits rongeurs 8,31,32,33 ; Cependant, il a également été utilisé dans des modèles d’animaux plus grands de Pig30 et Dog34.
Il existe actuellement trois études publiées sur l’évaluation de la récupération fonctionnelle après des lésions craniofaciales VML. Rodriguez et al. rapportent une méthode de réparation d’un modèle de lésion VML craniofaciale dans le muscle principal zygomatique ovin. Leur méthode détaille un protocole d’essai in situ qui ne peut être mis en œuvre qu’au point final de l’étude et, par conséquent, ne permet pas d’évaluation longitudinale au sein d’un seul animal13. Kim et al. décrivent une méthode d’utilisation de l’électronique à nanomembrane pour suivre les données d’électromyogramme continu de la mastication de souris à la suite d’une lésion VML. Ils ont signalé un signal significativement plus faible des souris blessées par rapport au contrôle, cependant, ils ont également noté que les artefacts de mouvement affectaient l’analyse du signal et que les souris essayaient parfois de gratter le circuit. De plus, des souris nues athymiques ont été utilisées pour permettre une fixation sécurisée de la nanomembrane à la peau, ce qui empêche actuellement une utilisation plus large de cette méthode dans des modèles animaux plus couramment utilisés (et rentables)12. Enfin, Zhao et al. décrivent un défaut VML de taille critique dans le masséter de souris, qui altère la nutrition chez les animaux, comme en témoigne une diminution significative de la prise de poids corporel, comme résultat fonctionnel14. En gardant ces études à l’esprit, cet article décrit une méthode polyvalente et peu invasive pour l’évaluation longitudinale in vivo de la fonction contractile dans la mâchoire du rat avant et après une lésion VML via la stimulation du nerf trijumeau avec des électrodes sous-cutanées. Au fur et à mesure que le test s’exécute sur une série de fréquences de simulation croissantes (20-200 Hz), un transducteur mesure la force générée par le muscle. Ces mesures peuvent permettre de déterminer la rigidité musculaire et le tétanos maximal, entre autres. Le protocole ci-dessous est conçu pour évaluer la récupération fonctionnelle de la force de morsure ipsilatérale à la suite d’une lésion traumatique de la LMV et, à ce titre, comprend également un protocole pour la création chirurgicale d’une lésion validée de la LMV. Cette méthode peut être facilement mise en œuvre sur une grande variété de rats et de souris et, avec des modifications appropriées de l’équipement, elle s’applique également aux modèles d’animaux plus grands et aux lésions VML30.
Protocole
Toutes les manipulations et procédures d’animaux ont été approuvées et effectuées conformément aux directives du Comité institutionnel de protection et d’utilisation des animaux (IACUC) de l’Université de Virginie. Les rats utilisés dans ces expériences étaient des rats Lewis mâles âgés de 12 à 14 semaines pesant 324,8 g ± 12,72 g au moment de l’opération. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans la table des matériaux.
1. Lésion VML du muscle masséter
- Préparation de l’équipement
- Avant l’opération, assurez-vous que tous les instruments requis ont été stérilisés de manière appropriée : champs chirurgicaux, scalpel, pinces, microciseaux, hémostats, sutures et gaze.
- Allumez une plate-forme chauffée et réglez-la à 37 °C.
- Appliquez une pommade ophtalmique stérile sur les deux yeux pour prévenir la sécheresse oculaire sous anesthésie. Mettez l’animal dans la chambre d’induction de l’anesthésie et administrez de l’isoflurane à 2 % à 3 % (selon les protocoles approuvés par l’établissement).
- Création chirurgicale d’une lésion VML
- Assurez-vous que l’animal est correctement anesthésié avant de le retirer de la chambre.
REMARQUE : Cela peut être déterminé si l’animal ne répond pas à un pincement des orteils. - Pesez et placez l’animal sur une planche chirurgicale en position latérale sur son côté gauche, avec son nez bien dans le cône nasal pour permettre l’administration continue d’isoflurane.
- Préparez l’animal à la chirurgie en lui administrant l’analgésique approprié, en rasant le côté droit du visage et en stérilisant la zone à l’aide de trois tampons d’iode et d’alcool. Dans le cadre de ces études, la buprénorphine à libération prolongée a été utilisée pour l’analgésie (0,65 mg/kg de poids corporel).
- Commencez la chirurgie en faisant une incision d’environ 2 cm le long de la région buccale du rat. L’incision doit être alignée avec le nez et l’oreille de l’animal. Utilisez une dissection émoussée pour séparer la peau et le fascia.
- Faites une incision similaire le long du fascia et disséquez-la doucement loin du masséter sous-jacent.
- Localisez les nerfs buccal et marginal (Figure 1A). Utilisez un marqueur chirurgical stérile et une règle pour marquer la zone à enlever. La zone doit être un rectangle de 10 mm x 5 mm au centre du masséter exposé, situé entre les nerfs faciaux (Figure 1B).
- Utilisez soigneusement des microciseaux pour commencer l’ablation des tissus. S’assurer que la dernière blessure atteint une profondeur d’environ 4 mm avec 150 mg de tissu excisé (Figure 1C). Le tissu retiré proviendra de toute l’épaisseur du masséter superficiel et ira partiellement dans le masséter profond.
REMARQUE : La masse moyenne de tissu prélevé dans ces expériences était de 146,1 mg ±1,16 mg. - Fermez le fascia et la peau à l’aide de sutures interrompues résorbables (6-0) et non résorbables (5-0), respectivement.
- Assurez-vous que l’animal est correctement anesthésié avant de le retirer de la chambre.
- Nettoyage et surveillance
- Après la suture, coupez le gaz anesthésique et maintenez l’animal sur la surface chauffée pour surveiller son retour à la conscience. Une fois que le rat commence à reprendre conscience, remettez l’animal dans la cage et continuez à le surveiller jusqu’à ce qu’il soit éveillé et ambulatoire.
- Pendant les 3 jours suivant la chirurgie, vérifiez l’état de l’animal et évaluez s’il y a des signes de douleur ou d’inconfort.
- Pendant les 7 jours suivant l’opération, fournissez à l’animal de la nourriture molle pour réduire la tension sur la mâchoire et garder les animaux bien hydratés/nourris.
- Retirez les sutures interrompues 7 à 10 jours après la chirurgie, en vous assurant que la plaie est complètement fermée avant de l’enlever.
- Après le point temporel final de l’étude, euthanasier les animaux selon les directives de l’IACUC. Explantez les muscles masséters et congelez-les en les immergeant dans de l’azote liquide ou de l’isopentane refroidi à l’azote liquide.
REMARQUE : Les échantillons de tissus congelés peuvent être conservés à long terme à -80 °C pour une évaluation histologique future.
2. Évaluation fonctionnelle in vivo de la mâchoire
- Préparation de l’équipement
- Vérifiez et assurez-vous de la bonne connexion de tous les équipements.
- Dans l’ordre, allumez (1) un ordinateur, (2) un stimulateur biphasé, (3) un système de levier bimode, et enfin, (4) une plate-forme chauffée pour le réchauffer à 37 °C.
REMARQUE : Le manuel d’utilisation indique un temps de préchauffage de 1 min pour que le stimulateur et le système de levier produisent des lectures précises. De plus, attendez 10 à 15 minutes pour que la plate-forme chauffe complètement avant de tester les animaux. - Appliquez une pommade ophtalmique stérile sur les deux yeux pour prévenir la sécheresse oculaire sous anesthésie. Placez l’animal à tester dans la chambre d’induction de l’anesthésie et fournissez 2 à 3 % d’isoflurane.
- Stérilisez les pointes d’électrodes recouvertes de polytétrafluoroéthylène en les plaçant dans de l’éthanol à 70 %.
- Localisez et ouvrez le logiciel DMC ( Dynamic Muscle Control ). Celle-ci sera nécessaire pour effectuer l’évaluation fonctionnelle.
- Configuration du logiciel
- Dans le logiciel DMC, recherchez Instant Stim dans le menu de configuration et modifiez les paramètres aux valeurs souhaitées. Dans cette étude, aucun paramètre n’est modifié par rapport à leurs préréglages (Figure 2A).
- Dans le menu Configuration , créez et sélectionnez un dossier d’enregistrement automatique pour stocker les données.
- En bas de l’écran du logiciel, recherchez une case intitulée Base d’enregistrement automatique. Remplacez-le par un titre spécifique à l’animal testé, par exemple, « rat#-timepoint » (Figure 2B).
- Sélectionnez Séquenceur en haut de l’écran du logiciel. Dans la nouvelle fenêtre qui s’ouvre, sélectionnez Ouvrir la séquence en bas de l’écran. Sélectionnez la séquence prédéfinie dans l’explorateur de fichiers qui s’ouvre. La fenêtre Séquence est alors remplie d’une liste de paramètres tels que la fréquence, la durée des stimuli et le temps de repos (Figure 2C).
- Cliquez sur Charger la séquence puis sur Fermer la fenêtre.
REMARQUE : La séquence utilisée dans ce protocole se compose de 9 étapes (contraction, 20 Hz, 40 Hz, 50 Hz, 60 Hz, 80 Hz, 100 Hz, 150 Hz, 200 Hz) avec 20 s de repos entre chacune. Mis à part la stimulation par contraction, toutes les étapes durent 500 ms. Le protocole de séquence doit être adapté aux objectifs d’analyse spécifiques de chaque laboratoire.
- Cliquez sur Charger la séquence puis sur Fermer la fenêtre.
- Pour ouvrir une nouvelle fenêtre et activer l’affichage de l’acquisition de données en temps réel, sélectionnez Fichier > Moniteur de données en direct.
- Dans la fenêtre Live Data Monitor , définissez l’échelle de temps, la valeur y minimale et la valeur y maximale manuellement ou en cochant la case pour activer la mise à l’échelle automatique.
- Préparation des animaux
- Assurez-vous que l’animal est dans le bon plan d’anesthésie avant de le retirer de la chambre d’anesthésie.
- Placez l’animal en position couchée avec son nez bien dans le cône nasal pour permettre l’administration continue d’isoflurane. Placez une boucle de fixation sur la moitié supérieure de la mâchoire du rat pour maintenir son nez en toute sécurité sur la plate-forme.
- Rasez le cou et le visage de l’animal du côté expérimental de la mâchoire.
- Fixez la moitié supérieure de l’animal en plaçant et en attachant une sangle sur ses bras et sa poitrine.
- Ajustez la position du levier de morsure à l’aide des trois boutons rotatifs situés près de la plate-forme de l’appareil pour contrôler les plans X, Y et Z (Figure 3A). À l’aide du bouton supérieur, abaissez le levier de morsure vers l’animal et utilisez les deux autres boutons pour ajuster l’extrémité du levier de manière à ce qu’elle soit juste au-dessus du menton de l’animal.
- À l’aide d’une pince à épiler, accrochez la boucle de suspension autour des dents inférieures de l’animal afin de fixer la tête et de l’empêcher de bouger (figure 3B).
REMARQUE : La boucle est située à travers un trou percé dans le levier de morsure à 3 cm du capteur de force. Le système doit être calibré avant la première utilisation. - Ajustez la hauteur du levier pour augmenter la tension sur la mâchoire. La tension de base reproductible utilisée dans ces expériences était de ~0,5 N.
- Placement des électrodes
- Palpez la mâchoire de l’animal et localisez le coin postérieur de la mandibule. Placez les électrodes par voie sous-cutanée de chaque côté du coin à environ 2-3 mm de distance. Les électrodes doivent être insérées à une profondeur de 3 à 5 mm. Utilisez une pince crocodile et un support pour maintenir les électrodes en position.
- Dans la fenêtre du moniteur de données en direct , cliquez sur le gros bouton orange intitulé Instant Stim pour l’activer.
- Le moniteur doit commencer à afficher des pointes vers le haut à chaque stimulation. Ajustez le placement de l’électrode et la position du bras de levier à l’aide des boutons si nécessaire. Seule l’activation de la face ipsilatérale de la mâchoire doit être observée (Figure 4).
- Sur le stimulateur biphasé haute puissance, il y a deux boutons près du centre, étiquetés « Range » et « Adjust ». Commencez à tourner le bouton Range pour moduler l’ampérage. Au fur et à mesure que l’ampérage augmente, les pics instantanés de stim commenceront à augmenter en amplitude jusqu’à ce qu’ils atteignent un plateau - déterminé comme le niveau auquel trois stimulations consécutives entraînent des réponses contractiles identiques.
- Évitez de trop augmenter l’ampérage, c’est-à-dire de ne pas dépasser de plus de 20 % l’ampérage où les pics maximaux ont été observés, car cela peut entraîner le recrutement de muscles voisins et des lectures de force imprécises.
- Tournez le bouton Adjust pour moduler le pourcentage de la « Range » actuelle utilisée pour stimuler la mâchoire. Une augmentation ou une diminution du courant peut être nécessaire pour optimiser la réponse de contraction.
- Vérifiez que les électrodes sont toujours bien en place et arrêtez l’impulsion instantanée.
- Sous le bouton orange « Instant Stim » dans le moniteur de données en direct, localisez le bouton gris Démarrer la séquence et cliquez dessus.
- Continuez à surveiller les courbes pendant toute la durée du protocole de stimulation. Plus la fréquence de stimulation augmente, plus la force maximale produite augmente. Une fois le tétanos atteint, les courbes de force se stabilisent (figure 5A).
- Assainissement
- Une fois la séquence de stimulation fonctionnelle terminée, retirez les électrodes et essuyez-les avec de l’éthanol à 70 %. S’il s’agit du dernier animal à être testé, les électrodes peuvent être remises dans leurs couvercles.
- Éteignez le gaz anesthésique, mais gardez l’animal sur la surface chauffée pour surveiller son retour à la conscience. Une fois que le rat commence à reprendre conscience, remettez-le dans la cage et continuez à surveiller jusqu’à ce que l’animal soit éveillé et ambulatoire.
- Éteignez l’équipement utilisé pour l’acquisition de données et essuyez toutes les surfaces.
3. Analyse des données
REMARQUE : Cette méthode a déjà été décrite comme documentant une méthode pour les essais fonctionnels in vivo du rat TA8. L’analyse des données est conçue pour déterminer les intentions de cette étude, et les protocoles peuvent changer en fonction des objectifs de l’utilisateur.
- Localisez et ouvrez le logiciel d’analyse musculaire dynamique .
- Cliquez sur le menu Haut débit et sélectionnez Forcer l’analyse de fréquence pour analyser plusieurs échantillons simultanément.
- Sélectionnez Choisir des fichiers et mettez en surbrillance autant de fichiers de données que vous le souhaitez pour l’analyse. Le bouton « Choisir le dossier » peut également être utilisé si les échantillons sont clairement nommés dans le système de fichiers.
- Cochez la case Supprimer la ligne de base. Cela supprimera automatiquement la force de base de la force maximale enregistrée pour chaque essai, fournissant les valeurs maximales absolues.
- Cliquez sur le bouton Analyser , puis sur Exporter la table vers Excel où les données peuvent être enregistrées sous forme de feuille de calcul. Assurez-vous que les valeurs « Curseur de début » et « Curseur de fin » capturent avec précision l’horodatage de la stimulation. Ces valeurs peuvent être définies manuellement si nécessaire.
- Ouvrez la feuille de calcul enregistrée.
REMARQUE : À l’aide de la colonne « Maximum », l’utilisateur peut calculer la force maximale produite sur toutes les fréquences. La courbe force-fréquence peut également être générée (Figure 5).
Résultats
Comme décrit dans une publication antérieure, les courbes tétaniques peuvent être utilisées pour distinguer les résultats optimaux des résultats sous-optimaux8. Un résultat idéal est obtenu lorsque le muscle est stimulé à sa force maximale et maintient ce maximum pendant toute la durée de la contraction tétanique. La somme des contractions individuelles en courbes tétaniques commencera généralement à apparaître à 100 Hz ou après. La figure 5A illustre ce point car la courbe idéale à 150 Hz présente une forte montée au début de la stimulation, une phase de plateau plat à la valeur de force maximale avec une oscillation minimale et une forte descente verticale lorsque la stimulation cesse. Les courbes tétaniques non idéales peuvent présenter des oscillations pendant la phase de plateau et peuvent présenter une pente négative ou positive (Figure 5C,D).
Les résultats de ce protocole de test fonctionnel peuvent être représentés différemment en fonction des objectifs des chercheurs et de la conception expérimentale de l’étude. Dans le cas de ce protocole, la force maximale absolue est déterminée empiriquement à partir de toutes les fréquences de stimulation et représentée graphiquement à chaque point temporel pour les tests. Cela permet de comparer la production de force maximale de base à la production de force maximale toutes les 4 semaines après la création de la lésion VML décrite dans le masséter (Figure 1D). À titre de comparaison, une cohorte d’animaux non blessés (n = 4) a également été testée à chaque point temporel (figure 1E). Les poids des animaux à chaque point temporel ont également été comparés (figure 1F). À 4, 8 et 12 semaines après la VML, respectivement, les rats ont produit une force maximale moyenne de 7,958 N ±1,797 N, 7,183 N ±1,450 N et 7,823 N ± 0,626 N. L’analyse de variance à mesures répétées unidirectionnelles (ANOVA) avec la différence la moins significative de Fisher (LSD) a posteriori a déterminé qu’il n’y avait pas de différences statistiquement significatives entre ces valeurs à aucun moment après la lésion VML, cependant, ils étaient tous significativement différents de la force de base moyenne de 10,031 N ±0,564 N.
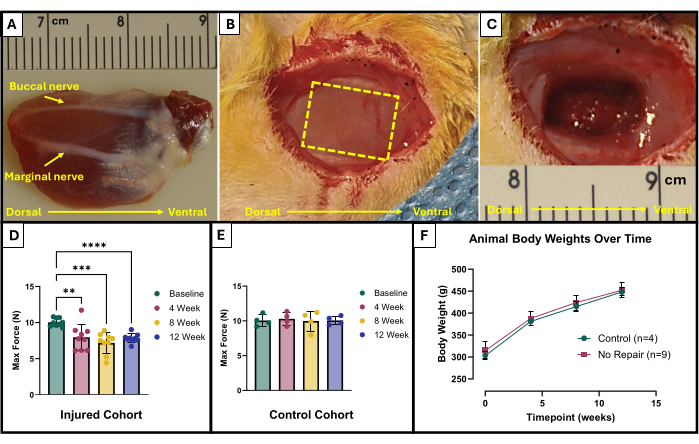
Figure 1 : Schéma chirurgical et résultats fonctionnels pour le muscle masséter blessé par VML. Muscle masséter explanté montrant l’orientation anatomique ainsi que les repères nerveux pour la création de blessures (A). Animal pendant la chirurgie avant (B) et après (C) la création d’une lésion VML. Les images sont toutes présentées avec des muscles dans la même orientation que (A). La ligne pointillée jaune indique la région où le muscle doit être excisé. Production maximale de force au départ et au fil du temps chez les rats qui ont subi une lésion VML (n = 9) au masséter (D) ainsi que chez les rats témoins du même âge qui n’ont pas été blessés (n = 4) (E). Un graphique du poids corporel des rats au fil du temps (F). (D) représente une ANOVA à mesures répétées unidirectionnelle avec les comparaisons par paires post-hoc LSD de Fisher, où **= p < 0,01, ***= p < 0,001, ****= p < 0,0001. Les règles en (A) et (C) sont en centimètres, avec des graduations en millimètres. Veuillez cliquer ici pour voir une version agrandie de cette figure.
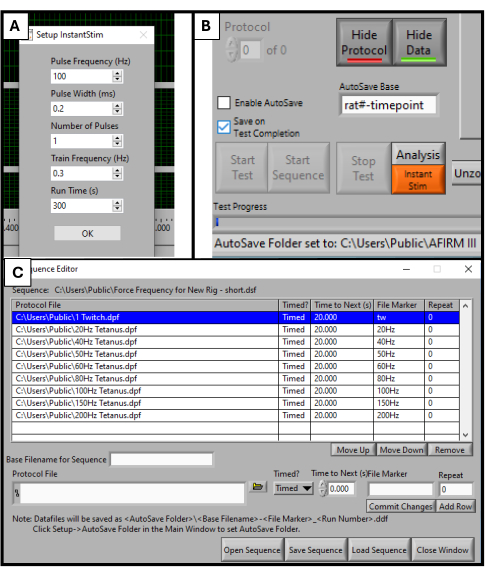
Figure 2 : Initialisation du logiciel pour les tests fonctionnels. Paramétrage paramétré pour le logiciel DMC. Configuration de l’Instant Stim aux valeurs souhaitées (A). Interface utilisateur graphique du logiciel et emplacement de la boîte de réglage de base AutoSave (B). Sélection de la séquence de protocole en 9 étapes utilisée pour le test (C). Les valeurs affichées ici sont des exemples de valeurs utilisées pour cette étude, mais elles peuvent avoir besoin d’être optimisées et ajustées en fonction des cas d’utilisation spécifiques d’autres utilisateurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
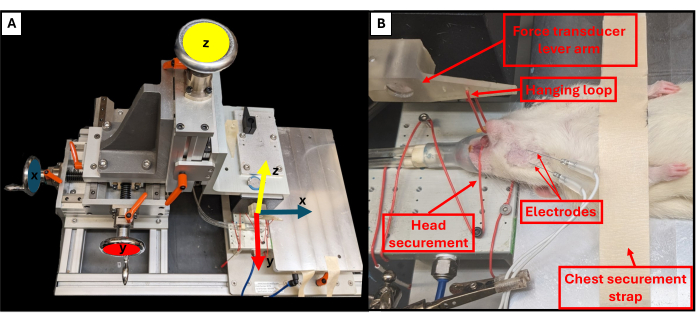
Figure 3 : Axes de mouvement fonctionnels de l’appareil de forage et positionnement correct de l’animal. Le schéma illustre la relation entre chacune des trois roues de réglage sur le banc d’essai fonctionnel et leurs axes de mouvement correspondants pour le bras de levier (A). Exemple d’image d’un rat subissant des tests fonctionnels, montrant le bon positionnement en décubitus dorsal de l’animal sur la plate-forme et d’autres composants importants de la plate-forme (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
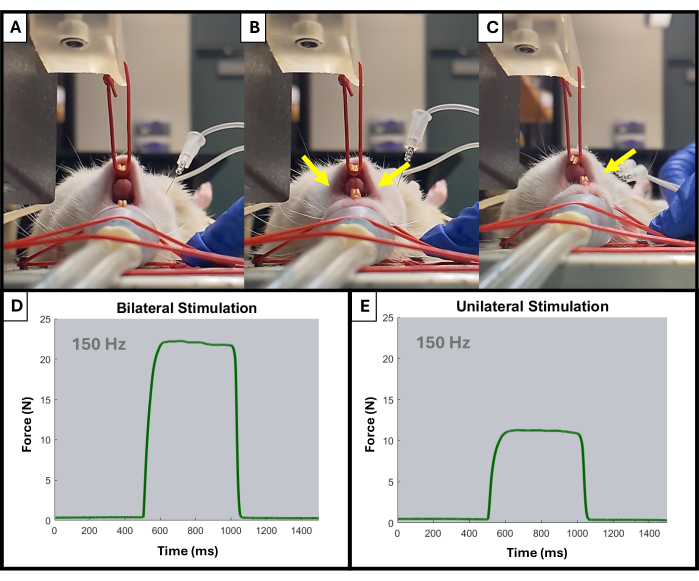
Figure 4 : Exemple d’activation unilatérale et bilatérale de la mâchoire pendant les tests. (A) montre la mâchoire du rat au repos avant toute stimulation. Les électrodes mal placées peuvent entraîner une contraction bilatérale de la mâchoire, comme l’indiquent les flèches jaunes (B), tandis que les électrodes correctement placées entraîneront la contraction ipsilatérale souhaitée (C). Les flèches jaunes indiquent les points de contraction de la mâchoire. Des exemples de courbes force-temps à 150 Hz pour l’activation musculaire bilatérale (D) et unilatérale (E) sont également présentés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
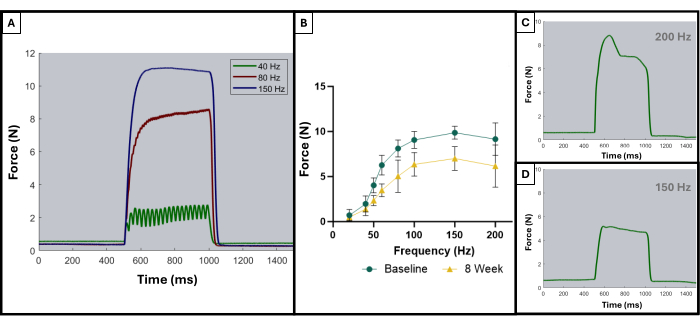
Figure 5 : Courbes représentatives de stimulation-réponse pour les essais acceptables et inacceptables. Exemple de courbes de stimulation à 40, 80 et 150 Hz (A) pour montrer ce qu’il faut rechercher avant et pendant une contraction tétanique. Au fur et à mesure que la fréquence de stimulation augmente, la tension maximale enregistrée est également plus élevée, ce qui peut être observé dans les courbes force-fréquence (B) montrant la moyenne des animaux blessés (n = 9) au départ et à 8 semaines après la création de VML. (C,D) démontrer des exemples représentatifs de la forme d’une réponse de force qui indiqueraient la nécessité d’un ajustement de l’électrode en raison d’un tétanos inadéquat. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole décrit une méthode simple et fiable pour les tests fonctionnels in vivo de la force de morsure ipsilatérale produite dans la mâchoire du rat. Une méthode pour la création chirurgicale d’une lésion VML dans le muscle masséter du rat est également décrite. Combinées, ces méthodes fournissent un modèle animal biologiquement pertinent pour effectuer une évaluation longitudinale de la récupération fonctionnelle avant et après une lésion craniofaciale traumatique. Bien que d’autres méthodes d’essai, telles que les tests in vitro et in situ, puissent également fournir des informations précieuses, elles nécessitent l’isolement du tendon et le retrait du tissu de son environnement d’origine, ce qui limite leur applicabilité à une meilleure compréhension des résultats fonctionnels in vivo 8,25,26,27,28 . Avec une formation et une pratique appropriées, un chercheur sera en mesure de positionner rapidement un animal pour les tests et d’effectuer les ajustements nécessaires pour atteindre une production maximale de force musculaire.
Il y a des détails techniques qui doivent être vérifiés pour chaque animal afin d’assurer un placement et une stimulation corrects des électrodes. Tout d’abord, les incisives supérieures doivent être fixées de manière à ce que la tête du rat soit entièrement en contact avec la plate-forme chauffée. Cela permettra également de maintenir le nez du rat placé dans le cône nasal pour l’administration continue d’anesthésique inhalé. Si la tête n’est pas maintenue dans la bonne position, il y aura des incohérences dans les lectures de force à mesure que la tension de base s’écarte. De plus, le corps de l’animal doit être couché sur le dos et sa colonne vertébrale doit être droite. Garder l’animal dans la bonne position aidera à placer les électrodes et à les maintenir au bon endroit. Enfin, le placement des électrodes peut être difficile, car elles doivent être placées à la bonne profondeur et à l’espacement approprié pour ne stimuler que le côté expérimental de la mâchoire. La vigilance et la pratique sont pertinentes pour devenir adepte du placement des électrodes afin d’obtenir des résultats reproductibles et fiables. Les électrodes s’émousseront assez rapidement, il est donc nécessaire de les changer souvent. Les caractéristiques d’un mauvais placement des électrodes sont l’activation des muscles accessoires, les lectures de force inclinées positivement/négativement (mouvement des électrodes pendant la stimulation) ou une forme d’onde tétanique non fusionnée/oscillante8 (Figure 5C,D).
De plus, il y a quelques limites à cette méthode qui méritent d’être mentionnées et prises en compte dans les applications futures de ce système. Tout d’abord, bien que suffisante pour les mesures effectuées dans cette étude, la boucle utilisée pour fixer la mâchoire supérieure n’est peut-être pas le système le plus rigide. Au lieu de cela, une approche stéréotaxique utilisant des barres d’oreille pourrait créer une meilleure prise de la mâchoire supérieure du rat. De plus, une valeur de tension passive a été utilisée comme position de consigne pour les tests avec cette méthode, ce qui peut ne pas entraîner la génération de force maximale qui serait obtenue si le muscle était positionné à sa longueur optimale (Lo). En fait, le Lo pourrait être déterminé en positionnant l’animal comme décrit ici, puis en manipulant l’occlusion de la mâchoire par petits incréments (0,5-1 mm) tout en exécutant des stimulations de contraction - Lo étant déterminé comme la position de test optimale où la force de contraction maximale a été générée. Cependant, le muscle masséter a une géométrie et une locomotion assez uniqueset, par conséquent, fonctionne sur une gamme de longueurs beaucoup plus large que les caractéristiques, par exemple, des muscles des membres (qui fonctionnent généralement autour de Lo). Cependant, la mastication se produit dans une gamme étroite par rapport à la morsure. En tant que tel, il n’y a pas d’approche parfaite à ce problème. Ainsi, même si l’établissement d’une tension de base n’est pas la seule façon d’aborder ce problème, il existe une justification scientifique logique à le faire, car la longueur optimale des muscles de la mâchoire est au-delà de l’ouverture naturelle de la mâchoire. Quoi qu’il en soit, la force maximale à une tension passive donnée donne toujours un aperçu important des aspects de la fonction - même s’ils sont différents de la force maximale à Lo. De toute évidence, une étude plus approfondie de la relation force-longueur du muscle masséter est justifiée. Enfin, cette méthode s’intéresse à la stimulation du nerf trijumeau chez le rat, qui est divisé en trois branches : V1-V3. Bien que la V3, ou le nerf mandibulaire, soit la seule branche dotée d’une composante motrice, elle innerve plusieurs muscles, notamment le masséter, le temporal, les ptérygoïdes et le mylohyoïde37. Ceci est important à prendre en compte car cela signifie que cette méthode ne rapporte pas exclusivement la force du masséter, ce qui peut être pertinent pour d’autres recherches scientifiques.
Malgré ces aspects techniques et ces limitations, cette méthode s’avère robuste et cohérente. Bien que seuls les tests ipsilatéraux soient décrits dans le présent document, le protocole pourrait être facilement modifié pour inclure des tests supplémentaires de l’autre côté de la mâchoire. Des tests bilatéraux de la contraction/fonction du masséter permettraient de faire des comparaisons entre les individus sains et blessés au sein d’un seul animal, ce qui permettrait peut-être d’élucider d’importants changements compensatoires du côté blessé et/ou du côté témoin (côté non blessé). Dans l’ensemble, ce modèle fournit un outil puissant pour évaluer la fonction musculaire longitudinale, ainsi que la récupération fonctionnelle, de manière peu invasive. En tant que tel, ce système sera applicable à l’évaluation des mécanismes biomécaniques qui accompagnent les déficits fonctionnels médiés par la VML, ainsi qu’à l’essai de l’efficacité de diverses thérapies pour la réparation des lésions VML dans la région craniofaciale.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Myologica LLC pour le partage de l’équipement utilisé pour effectuer des évaluations fonctionnelles. La recherche rapportée dans cette publication a été soutenue par le National Institute of Dental & Craniofacial Research des National Institutes of Health sous le numéro de bourse U24 DE029463. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Références
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon