Method Article
הערכה תפקודית in vivo של שריר מעסה חולדות לאחר יצירה כירורגית של פציעה באובדן שריר נפח (VML)
In This Article
Summary
פציעות אובדן שריר נפחי (VML) חורגות מיכולת ההתחדשות האנדוגנית, וכתוצאה מכך ליקויים תפקודיים קבועים. מחקר ה-VML הנוכחי מתמקד בעיקר בשרירי הגפיים והגזע. כדי להרחיב מחקרים מכניסטיים של VML לשרירי הגולגולת, מאמר זה מתאר שיטת in vivo להערכה אורכית של תפקוד שרירי המאסטר לפני ואחרי פציעת VML.
Abstract
אובדן שרירים נפחי (VML) נפוץ באוכלוסיות אזרחיות וצבאיות ומייצג פגיעה מתישה בשרירי השלד העולה על יכולת ההתחדשות הטבעית של הגוף. פציעות אלו משבשות לא רק את סיבי השריר אלא גם את העצבים, כלי הדם והמטריצה החוץ-תאית, ומכריעות את יכולת ההתחדשות של שרירי השלד ומובילות לפיברוזיס חמור ולליקויים קבועים במבנה השריר ובתפקודו. לניהול הקליני הנוכחי יש מגבלות רבות, ולכן נמשך המחקר לפיתוח גישות טיפוליות יעילות יותר. עם זאת, יש לציין שחלק ניכר מהדגש הפרה-קליני על פציעות VML התמקד בשרירי הגפיים והגזע, עם חקירה מוגבלת של שרירי הגולגולת. הבדלים בביולוגיה ההתפתחותית וביכולת ההתחדשות בין שרירי הגולגולת לשרירי הגפיים/תא המטען עשויים לספק תובנות מכריעות המניעות אפשרויות טיפול ספציפיות יותר לפציעה. יתר על כן, הערכת התאוששות תפקודית היא קריטית לביסוס יעילות טיפולית. בהקשר זה, בדיקת in vivo של התכווצות שרירים עם גירוי עצבי מלעורי היא שיטה זעיר פולשנית המאפשרת הערכה תפקודית חוזרת במהלך מחקר - באותה חיה. לאור שיקולים אלה, מאמר זה מתאר שיטה להערכה in vivo של תפקוד השרירים בשריר מעסה החולדה לפני ואחרי פציעת VML. פרוטוקול זה הוא המופע הראשון שפורסם המפרט את היצירה וההערכה התפקודית של פגיעת VML גולגולתית רלוונטית ביולוגית בחולדה.
Introduction
פציעות טראומטיות וכירורגיות של רקמות רכות המערבות את שרירי השלד הבסיסיים נותרו אחד האתגרים הגדולים ביותר לשיקום רקמות הן עבור אזרחים והן עבור לוחמים פצועים1. למעשה, כמעט 20% מהפציעות בשדה הקרב מתרחשות גם באזורי הגולגולת של לוחמים פצועים (ראש ופנים)2. כולל, טראומה בגפיים ופציעות ראש וצוואר מהוות >80% מפציעות הקרב בסכסוכים האחרונים2. למרות היכולת הידועה למדי של שרירי השלד לתקן, להתחדש ולעצב מחדש לאחר פציעה, פציעות חמורות יותר, הכרוכות באובדן חלק ניכר מרקמת השריר, אינן מסוגלות להחלים בעצמן ומכונות פציעות אובדן שרירים נפחי (VML). בהגדרה, VML מביא לליקויים אסתטיים ותפקודיים קבועים של השריר הפגוע או של יחידת השריר3.
מעניין לציין שלמרות השכיחות של פגיעות VML גולגולתיות 2,4, חלק גדול מהמחקר עד כה מתמקד בשרירי הגפה 5,6,7,8 ובשרירי תא המטען 9,10,11, עם רק קומץ דיווחים על פציעות VML בשרירי הגולגולת 12,13,14. זה מציג פער מחקר תרגומי חשוב פוטנציאלי, שכן הספרות הקיימת מצביעה על כך שיש הבדלים משמעותיים הן בביולוגיה התפתחותית, כמו גם ביכולת ההתחדשות בין שרירי הגולגולת והגפיים והגזע15,16. למעשה, ישנם יותר מ-20 שרירים בכל צד של הפנים - מה שמשקף את העובדה שאזור הגולגולת מעורב בביצוע משימות חיוניות רבות כמו מצמוץ, בליעה ולעיסה15. יתר על כן, גם בקרב שרירי הגולגולת מתעוררים הבדלים ביחס ליכולת ההתחדשות. לדוגמה, נראה כי שרירים חוץ-עיניים מתחדשים מהר יותר משרירי הגפיים17. לעומת זאת, המעסה מציג תגובה רגנרטיבית איטית יותר מאשר השוקה הקדמית (TA)18. הבדלים אלה עשויים לנבוע, לפחות בחלקם, מהשאלה אם מקורות השרירים הם מסועפים או נגזרים מסומיט - וכתוצאה מכך הן כמויות שונות של תאי לוויין, כמו גם פרופילי ביטוי גנים מובהקים של אוכלוסיות תאי הלוויין המקומיות19. התחשבות במאפיינים הייחודיים של שרירי הגולגולת, כמו גם ביחס לשרירי הגפיים והגזע, עשויה לשפוך תובנה מכניסטית חשובה לשיפור הפיתוח הטיפולי של אפשרויות טיפול מותאמות אישית המטפלות בפציעות VML ספציפיות לשרירים. הבדלים ספציפיים לשרירים אלה עשויים גם להסביר מגבלות ידועות של שרירים דמויי יריעה, כגון הלטיסימוס דורסי, כאפשרויות העברת רקמת שריר תורם לניתוחים משחזרים של ראש וצוואר 20,21,22.
ללא קשר למיקום הפגיעה ב-VML, אין כיום טיפולים שיכולים להחזיר את הצורה והתפקוד המלאים. ניהול קליני בתקן זהב כולל העברת רקמות אוטולוגיות כמו גם שיקום; עם זאת, הראשון בדרך כלל אינו משפר את הכוח ויכול לגרום לתחלואה באתר התורם 3,23, בעוד שהאחרון משפר את טווח התנועה, עם השפעה מינימלית על התאוששות תפקודית או החזרת כוח ההתכווצות, בשריר 1,6. מכל הסיבות הללו, נמשך המחקר לפיתוח גישות טיפוליות יעילות יותר להתחדשות רקמת שריר תפקודית לאחר פגיעה ב-VML. ניתוח שנערך לאחרונה הדגיש את החשיבות הקריטית של מחקרים פרה-קליניים במודלים של פגיעות VML בחולדות לקידום פתרונות טכנולוגיים רגנרטיביים לתיקון VML1.
כפי שצוין בעבודה קודמת 5,8,9,10,24,25, הערכת התאוששות תפקודית לאחר VML היא קריטית להערכת היעילות של התערבויות טיפוליות. באופן ספציפי, בעוד שריפוי פצעים והתאוששות נפח הם מאפיינים מרכזיים של תיקון VML, מדידת התאוששות הכוח לאחר פציעה וטיפול עוזרת לשפוך אור על המנגנונים הביומכניים הרב-ממדיים האחראים לגירעונות VML, כמו גם על המנגנונים המניעים התאוששות תפקודית. ככזה, יצירת קשר בין תיקון רקמות, התאוששות נפח וכוח שרירים משופר היא דרישה מוחלטת לזיהוי הפתרונות היעילים ביותר לתיקון VML9.
בהקשר זה, ישנן שלוש שיטות עיקריות לביצוע מדידות פונקציונליות אלו: (1) במבחנה, (2) באתר, ו-(3) בדיקות in vivo - כאשר כל אחת מציעה יתרונות וחסרונות משלה8. לדוגמה, בדיקה חוץ גופית כוללת בחינה של תפקוד שרירים מבודד מחוץ לאורגניזם החי ומספקת הזדמנות לתמרן באופן ישיר / ספציפי יותר את גירוי השרירים עם מגוון תרופות וכימיקלים המשפיעים על ריגוש והתכווצות השרירים26. למרות ששיטה זו מאפשרת חקירות מפורטות של היבטים תאיים ומולקולריים של תפקוד השרירים והתאוששות27, היא מסירה את אספקת הדם והעצבוב, מה שמגביל את מידת היכולת שלה לסכם את תפקוד השרירים האמיתי 8,26. בדיקה באתרה מעריכה את תפקוד השריר בזמן שהשריר עדיין במיקומו האנטומי הטבעי אך מבודד מהרקמות הסובבות 25,28. בעוד ששיטה זו שומרת על עצבוב ואספקת דם, הפרדת השריר עדיין יכולה להגביל את תחולת הממצאים על סביבת in vivo. בנוסף, ואולי החשוב ביותר, הן בדיקות באתרן והן במבחנה הן הליכים סופיים המונעים בדיקות אורך - הנחוצות כדי לאפשר מעקב אחר התאוששות תפקודית לאורך זמן באותו בעל חיים. לעומת זאת, בדיקת in vivo, הכוללת הערכת תפקוד השריר בסביבתו המקורית, מאפשרת הבנה מלאה יותר של ביצועי השרירים בהקשר פיזיולוגי29. מחקרי in vivo הם גם הטכניקה הכי פחות פולשנית וניתן לבצע אותם שוב ושוב במהלך המחקר29. באמצעות גירוי עצבי חשמלי מלעורית, ניתן לאסוף מדידות תפקודיות בשרירים ספציפיים תוך השארת הגידים, כלי הדם והעצבוב שלמים30. הערכות אורך אלה יכולות לספק תובנות לגבי שינויים עדינים, אך חשובים, המתרחשים בשלבים שונים של ריפוי באותה חיה. שיטה זו משמשת בדרך כלל בדגמי מכרסמים קטנים 8,31,32,33; עם זאת, הוא שימש גם בדגמי בעלי חיים גדולים יותר של חזיר30 וכלב34.
כיום פורסמו שלושה מחקרים על הערכת התאוששות תפקודית לאחר פגיעות VML גולגולתיות. רודריגז ועמיתיו מדווחים על שיטה לתיקון מודל פגיעת VML גולגולת בשריר הזיגומטי הגדול של הביצים. השיטה שלהם מפרטת פרוטוקול בדיקה באתרו שניתן ליישם רק בנקודת הזמן הסופית של המחקר, ולכן אינה מאפשרת הערכה אורכית בתוך בעל חיים בודד13. קים ועמיתיו מתארים שיטה לשימוש באלקטרוניקה ננו-ממברנה כדי לעקוב אחר נתוני אלקטרומיוגרמה רציפים של לעיסה של עכבר לאחר פגיעה ב-VML. הם דיווחו על אות נמוך משמעותית מעכברים פצועים בהשוואה לביקורת, עם זאת, הם גם ציינו כי חפצי תנועה השפיעו על ניתוח האותות וכי העכברים ניסו מדי פעם לגרד את המעגל. בנוסף, נעשה שימוש בעכברים אתימיים ועירומים כדי לאפשר הצמדה בטוחה של הננו-ממברנה לעור, מה שמונע כיום שימוש נרחב יותר בשיטה זו במודלים נפוצים יותר (וחסכוניים) של בעלי חיים12. לבסוף, Zhao et al. מתארים פגם VML בגודל קריטי במעסה העכברים, הפוגע בתזונה בבעלי החיים, כפי שבא לידי ביטוי בירידה משמעותית בעלייה במשקל הגוף, כתוצאה תפקודית14. בהתחשב במחקרים אלה, מאמר זה מתאר שיטה רב-תכליתית וזעיר פולשנית להערכת אורך in vivo של תפקוד ההתכווצות בלסת החולדה לפני ואחרי פגיעה ב-VML באמצעות גירוי של העצב הטריגמינלי עם אלקטרודות תת עוריות. כאשר הבדיקה עוברת סדרה של תדרי סימולציה הולכים וגדלים (20-200 הרץ), מתמר מודד את הכוח שנוצר של השריר. מדידות אלו יכולות לאפשר קביעת נוקשות שרירים וטטנוס מקסימלי, בין היתר. הפרוטוקול שלהלן נועד להעריך את ההתאוששות התפקודית של כוח הנשיכה המקביל לאחר פציעת VML טראומטית, וככזה, כולל גם פרוטוקול ליצירה כירורגית של פציעת VML מאומתת. ניתן ליישם שיטה זו בקלות על מגוון רחב של חולדות ועכברים - ועם שינויים מתאימים בציוד, היא ישימה גם למודלים גדולים יותר של בעלי חיים ופציעות VML30.
Protocol
כל הטיפול והנהלים בבעלי חיים אושרו ונעשו בהתאם להנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת וירג'יניה (IACUC). החולדות ששימשו בניסויים אלה היו חולדות לואיס זכרות בנות 12-14 שבועות במשקל 324.8 גרם ±-12.72 גרם בזמן הניתוח. פרטים על הריאגנטים והציוד המשמשים מפורטים בטבלת החומרים.
1. פציעת VML של שריר המעסה
- הכנת ציוד
- לפני הניתוח, ודא שכל המכשירים הנדרשים עוקרו כראוי: וילונות כירורגיים, אזמל, מלקחיים, מיקרומספריים, המוסטטים, תפרים וגזה.
- הפעל פלטפורמה מחוממת והגדר אותה ל -37 מעלות צלזיוס.
- יש למרוח משחת עיניים סטרילית על שתי העיניים כדי למנוע יובש בעיניים בהרדמה. הכניסו את בעל החיים לתא ההרדמה והעבירו 2%-3% איזופלורן (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
- יצירה כירורגית של פציעת VML
- ודא שהחיה מורדמת כראוי לפני הוצאתה מהחדר.
הערה: ניתן לקבוע זאת אם החיה אינה מגיבה לצביטה בבוהן. - שקלו והניחו את בעל החיים על לוח ניתוח במצב רוחבי בצד שמאל שלו, כשאפו בטוח בחרוט האף כדי לאפשר המשך מתן איזופלורן.
- הכינו את בעל החיים לניתוח על ידי מתן משכך כאבים מתאים, גילוח הצד הימני של הפנים ועיקור האזור באמצעות שלושה החלפות של ספוגיות יוד ואלכוהול. במחקרים אלה, בופרנורפין בשחרור מושהה שימש לשיכוך כאבים (0.65 מ"ג/ק"ג משקל גוף).
- התחל את הניתוח על ידי ביצוע חתך של כ-2 ס"מ לאורך האזור הבוקאלי של החולדה. החתך צריך להיות בקו אחד עם האף והאוזן של החיה. השתמש בדיסקציה קהה כדי להפריד בין העור לפאשיה.
- בצע חתך דומה לאורך הפאשיה ונתח אותו בעדינות הרחק מהמעסה הבסיסי.
- אתר את העצבים הבוקאליים והשוליים (איור 1A). השתמש בטוש כירורגי וסרגל סטרילי כדי לסמן את האזור שיש להסיר. האזור צריך להיות מלבן בגודל 10 מ"מ על 5 מ"מ במרכז המעסה החשוף שנמצא בין עצבי הפנים (איור 1B).
- השתמש בזהירות במספריים כדי להתחיל בהסרת רקמות. ודא שהפציעה הסופית מגיעה לעומק של כ-4 מ"מ עם 150 מ"ג של רקמה שנכרתה (איור 1C). הרקמה שהוסרה תהיה מהעובי המלא של המעסה השטחי ותיכנס חלקית למעסה העמוק.
הערה: המסה הממוצעת של רקמה שהוסרה בניסויים אלה הייתה 146.1 מ"ג ±1.16 מ"ג. - סגור את הפאשיה והעור באמצעות תפרים קטועים נספגים (6-0) ולא נספגים (5-0), בהתאמה.
- ודא שהחיה מורדמת כראוי לפני הוצאתה מהחדר.
- ניקוי וניטור
- לאחר התפירה, כבה את גז ההרדמה והשאיר את החיה על המשטח המחומם כדי לעקוב אחר חזרתה להכרה. ברגע שהחולדה מתחילה לחזור להכרה, החזירו את החיה לכלוב והמשיכו במעקב עד שהיא ערה וניידת.
- במשך 3 ימים לאחר הניתוח, בדוק את בעל החיים והעריך אם יש סימני כאב או אי נוחות.
- במשך 7 ימים לאחר הניתוח, ספק לבעל החיים מזון רך כדי להפחית את העומס על הלסת ולשמור על לחות/האכלה טובה של בעלי החיים.
- הסר את התפרים המופרעים 7-10 ימים לאחר הניתוח, וודא שהפצע סגור לחלוטין לפני ההסרה.
- לאחר נקודת הזמן הסופית של המחקר, המתת חסד של בעלי חיים בהתאם להנחיות IACUC. השתל את שרירי המאסטר והקפיא בזק על ידי טבילה בחנקן נוזלי או איזופנטן מקורר חנקן נוזלי.
הערה: ניתן לאחסן דגימות רקמה קפואות לטווח ארוך בטמפרטורה של -80 מעלות צלזיוס לצורך הערכה היסטולוגית עתידית.
2. הערכה תפקודית in vivo של הלסת
- הכנת ציוד
- בדוק וודא חיבור תקין של כל הציוד.
- לפי הסדר, הפעל (1) מחשב, (2) ממריץ דו-פאזי, (3) מערכת מנוף דו-מצבית, ולבסוף, (4) פלטפורמה מחוממת לחימום ל-37 מעלות צלזיוס.
הערה: המדריך למשתמש מציין זמן חימום של דקה אחת למערכת הממריץ והמנוף כדי לייצר קריאות מדויקות. בנוסף, אפשר 10-15 דקות לחימום מלא של הפלטפורמה לפני בדיקת בעלי חיים. - מרחו משחה אופתלמית סטרילית על שתי העיניים כדי למנוע יובש בעיניים בהרדמה. הנח את בעל החיים לבדיקה בתא האינדוקציה של ההרדמה וספק 2%-3% איזופלורן.
- עקר את קצות האלקטרודות המצופות פוליטטרפלואורואתילן על ידי הנחתם ב-70% אתנול.
- אתר ופתח את תוכנת בקרת השרירים הדינמית (DMC). זה יידרש לביצוע ההערכה התפקודית.
- הגדרת תוכנה
- בתוכנת DMC, מצא את Instant Stim בתפריט ההגדרות ושנה את הפרמטרים לערכים הרצויים. במחקר זה, לא משתנים פרמטרים מההגדרות המוגדרות מראש שלהם (איור 2A).
- בתפריט הגדרות , צור ובחר תיקיית שמירה אוטומטית לאחסון הנתונים.
- בסמוך לתחתית מסך התוכנה, אתר תיבה שכותרתה בסיס שמירה אוטומטית. שנו את זה לכותרת ספציפית לחיה שנבדקה, לדוגמה, "rat#-timepoint" (איור 2B).
- בחר Sequencer בחלק העליון של מסך התוכנה. בחלון החדש שנפתח, בחר פתח רצף בתחתית המסך. בחר את הרצף המוכן מראש בסייר הקבצים שנפתח. זה יאכלס את חלון הרצף ברשימה של פרמטרים כגון תדירות, משך גירויים וזמן מנוחה (איור 2C).
- לחץ על טען רצף ואחריו סגור חלון.
הערה: הרצף המשמש בפרוטוקול זה מורכב מ-9 שלבים (עווית, 20 הרץ, 40 הרץ, 50 הרץ, 60 הרץ, 80 הרץ, 100 הרץ, 150 הרץ, 200 הרץ) עם מנוחה של 20 שניות בין כל אחד מהם. מלבד גירוי העוויתות, כל השלבים נמשכים 500 אלפיות השנייה. יש להתאים את פרוטוקול הרצף ליעדי הבדיקה הספציפיים של כל מעבדה.
- לחץ על טען רצף ואחריו סגור חלון.
- כדי לפתוח חלון חדש ולאפשר תצוגה של רכישת נתונים בזמן אמת, בחר File > Live Data Monitor.
- בחלון Live Data Monitor , קבעו ידנית את ציר הזמן, את המינימום של ערך y ואת הערך המרבי של ערך y, או באמצעות סימון התיבה כדי לאפשר שינוי גודל אוטומטי.
- הכנת בעלי חיים
- ודא שהחיה נמצאת במישור ההרדמה המתאים לפני הוצאתה מתא ההרדמה.
- הנח את החיה במצב שכיבה עם אפה היטב בקונוס האף כדי לאפשר המשך מתן איזופלורן. הנח לולאת אבטחה מעל החצי העליון של לסת החולדה כדי להחזיק את אפה היטב על הרציף.
- לגלח את הצוואר והפנים של החיה בצד הניסיוני של הלסת.
- אבטח את החצי העליון של החיה על ידי הנחת והידוק רצועה על זרועותיו וחזהו.
- כוונן את מיקום ידית הנשיכה באמצעות שלושת הכפתורים המסתובבים הממוקמים ליד פלטפורמת המתקן כדי לשלוט במישורי X, Y ו-Z (איור 3A). בעזרת הכפתור העליון, הורידו את ידית הנשיכה כלפי מטה לכיוון החיה והשתמשו בשני הכפתורים האחרים כדי לכוונן את קצה הידית כך שיהיה ממש מעל הסנטר של החיה.
- השתמשו בפינצטה כדי לחבר את לולאת התלייה סביב השיניים התחתונות של החיה כדי לאבטח את הראש ולמנוע ממנו לזוז (איור 3B).
הערה: הלולאה ממוקמת דרך חור שנקדח בידית הנשיכה במרחק של 3 ס"מ ממתמר הכוח. יש לכייל את המערכת לפני השימוש הראשון. - כוונן את גובה הידית כדי להגביר את המתח על הלסת. מתח הבסיס הניתן לשחזור ששימש בניסויים אלה היה ~0.5 N.
- מיקום אלקטרודות
- משש את הלסת של החיה ואתר את הפינה האחורית של הלסת התחתונה. מקם אלקטרודות תת עוריות סביב שני צידי הפינה במרחק של כ-2-3 מ"מ זה מזה. יש להכניס אלקטרודות בעומק של 3-5 מ"מ. השתמש בקליפ תנין ועמד כדי להחזיק את האלקטרודות במקומן.
- בחלון Live Data Monitor , לחץ על הכפתור הכתום הגדול שכותרתו Instant Stim כדי להפעיל אותו.
- המוניטור אמור להתחיל להציג קוצים כלפי מעלה במהלך כל גירוי. התאם את מיקום האלקטרודה ואת מיקום זרוע הידית באמצעות הכפתורים לפי הצורך. יש להבחין רק בהפעלה של הצד המקביל של הלסת (איור 4).
- על הממריץ הדו-פאזי בעל ההספק הגבוה, ישנם שני כפתורים ליד המרכז, המסומנים "טווח" ו"כוונון". התחל לסובב את כפתור הטווח כדי לווסת את הזרם. ככל שהזרם גדל, שיאי הגירוי המיידיים יתחילו לעלות בעוצמתם עד שהם יתייצבו - נקבעים כרמה שבה שלושה גירויים רצופים מביאים לתגובות התכווצות זהות.
- הימנע מסיבוב הזרם גבוה מדי, כלומר לא יותר מ-20% מעל הזרם שבו נצפו שיאים מקסימליים - מכיוון שהדבר עלול לגרום לגיוס שרירים שכנים ולקריאות כוח לא מדויקות.
- סובב את כפתור הכוונון כדי לווסת את אחוז ה"טווח" הנוכחי המשמש לגירוי הלסת. ייתכן שתידרש עלייה או ירידה בזרם כדי לייעל את תגובת העווית.
- ודא שהאלקטרודות עדיין במקומן היטב ועצור את הגירוי המיידי.
- מתחת לכפתור הכתום "Instant Stim" בצג הנתונים החי, אתר את כפתור התחל רצף האפור ולחץ עליו.
- המשך לעקוב אחר העקומות לאורך כל פרוטוקול הגירוי. ככל שתדירות הגירוי עולה, כך גם הכוח המקסימלי שנוצר. ברגע שמגיעים לטטנוס, עקומות הכוח יתייצבו (איור 5A).
- ניקוי
- לאחר השלמת רצף הגירוי התפקודי, הסר אלקטרודות ונגב אותן עם 70% אתנול. אם זו החיה האחרונה שנבדקה, ניתן להחזיר את האלקטרודות לכיסויים שלהן.
- כבו את גז ההרדמה אך השאירו את החיה על המשטח המחומם כדי לעקוב אחר חזרתה להכרה. ברגע שהחולדה מתחילה לחזור להכרה, החזירו אותה לכלוב והמשיכו לעקוב עד שהחיה תהיה ערה וניידת.
- כבה את הציוד המשמש לרכישת נתונים ונגב את כל המשטחים.
3. ניתוח נתונים
הערה: שיטה זו תוארה בעבר כמתעדת שיטה לבדיקה פונקציונלית in vivo של החולדה TA8. ניתוח נתונים נועד לקבוע את כוונות המחקר הזה, והפרוטוקולים עשויים להשתנות בהתאם למטרות המשתמש.
- אתר ופתח את תוכנת ניתוח השרירים הדינמי .
- לחץ על תפריט תפוקה גבוהה ובחר ניתוח תדר כוח כדי לנתח מספר דגימות בו זמנית.
- בחר בחר קבצים וסמן כמה קבצי נתונים שתרצה לניתוח. ניתן להשתמש בכפתור "בחר תיקיה" גם אם דוגמאות נקראות בבירור בתוך מערכת הקבצים.
- סמן את התיבה כדי להסיר תוכנית בסיסית. פעולה זו תסיר אוטומטית את הכוח הבסיסי מהכוח המרבי שנרשם עבור כל ניסיון, ותספק את הערכים המקסימליים המוחלטים.
- לחץ על כפתור ניתוח ולאחר מכן לחץ על ייצוא טבלה לאקסל שם ניתן לשמור את הנתונים כגיליון אלקטרוני. ודא שהערכים "סמן התחל" ו"סמן סיום" לוכדים במדויק את חותמת הזמן של הגירוי. ניתן להגדיר ערכים אלה באופן ידני במידת הצורך.
- פתח את הגיליון האלקטרוני השמור.
הערה: באמצעות העמודה "מקסימום", המשתמש יכול לחשב את הכוח המרבי המופק בכל התדרים. ניתן גם ליצור את עקומת הכוח-תדר (איור 5).
תוצאות
כפי שתואר בפרסום קודם, ניתן להשתמש בעקומות הטטניקה כדי להבחין בין תוצאות אופטימליות לתוצאות תת-אופטימליות8. תוצאה אידיאלית מתקבלת כאשר השריר מגורה לכוחו המרבי ושומר על המקסימום הזה לאורך כל ההתכווצות הטטנית. סיכום העוויתות הבודדות לעקומות טטניות יתחיל בדרך כלל להופיע ב-100 הרץ או אחריו. איור 5A מדגים נקודה זו מכיוון שלעקומה האידיאלית ב-150 הרץ יש עלייה חדה בתחילת הגירוי, שלב מישור שטוח בערך הכוח המקסימלי עם תנודה מינימלית, וירידה חדה ואנכית כאשר הגירוי מפסיק. עקומות טטניות לא אידיאליות עשויות להראות תנודות במהלך שלב הרמה ועשויות להציג שיפוע שלילי או חיובי (איור 5C,D).
התוצאות של פרוטוקול בדיקה פונקציונלי זה עשויות להיות מיוצגות באופן שונה בהתאם למטרות החוקרים ולתכנון הניסוי למחקר. במקרה של פרוטוקול זה, הכוח המקסימלי המוחלט נקבע באופן אמפירי מכל תדרי הגירוי ומשורטט בכל נקודת זמן לבדיקה. זה מאפשר להשוות את ייצור הכוח המקסימלי הבסיסי לייצור הכוח המקסימלי כל 4 שבועות לאחר יצירת פגיעת ה-VML המתוארת במעסה (איור 1D). לשם השוואה, קבוצה של חיות לא פצועות (n = 4) נבדקה גם היא בכל נקודת זמן (איור 1E). משקלי החיות בכל נקודת זמן הושוו גם הם (איור 1F). ב-4, 8 ו-12 שבועות לאחר ה-VML, בהתאמה, החולדות הפיקו כוח מקסימלי ממוצע של 7.958 N ±1.797 N, 7.183 N ±1.450 N, ו-7.823 N ±-0.626 N. ניתוח מדידות חוזרות חד-כיווניות של שונות (ANOVA) עם ההבדל הפחות משמעותי של פישר (LSD) השוואות זוגיות פוסט-הוק קבעו כי לא היו הבדלים מובהקים סטטיסטית בין ערכים אלה בשום נקודת זמן לאחר פגיעה ב-VML, עם זאת, כולם היו שונים באופן משמעותי מהכוח הבסיסי הממוצע של 10.031 N ±0.564 N.
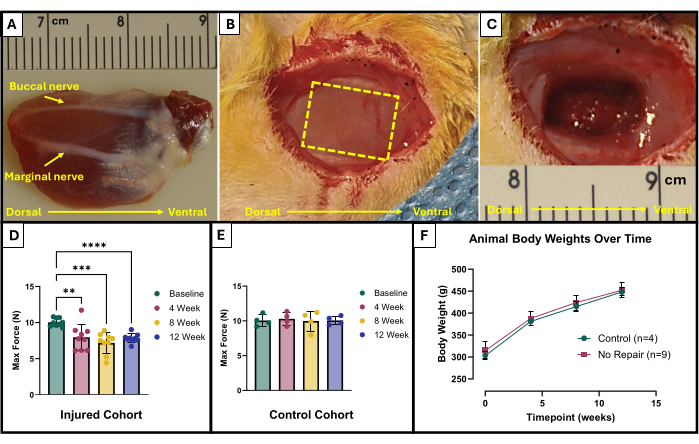
איור 1: תוצאות סכמטיות ותפקודיות כירורגיות עבור שריר מאסטר שנפגע מ-VML. שריר מאסטר מושתל המראה אוריינטציה אנטומית כמו גם ציוני דרך עצביים ליצירת פציעה (A). בעל חיים במהלך ניתוח לפני (B) ואחרי (C) יצירת פציעת VML. כל התמונות מוצגות עם שרירים באותו כיוון כמו (A). הקו המקווקו הצהוב מציין את האזור בו יש לכרות את השריר. ייצור כוח מקסימלי בנקודת ההתחלה ולאורך זמן בחולדות שקיבלו פגיעה ב-VML (n = 9) למעסה (D) וכן בחולדות ביקורת תואמות גיל שנותרו ללא פגיעה (n = 4) (E). גרף של משקלי גוף של חולדות לאורך זמן (F). (D) מייצג ANOVA של מדידות חוזרות חד-כיווניות עם השוואות זוגות פוסט-הוק של פישר, כאשר **= p < 0.01, ***= p < 0.001, ****= p < 0.0001. סרגלים ב-(A) ו-(C) הם בסנטימטרים, עם סימונים במילימטרים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
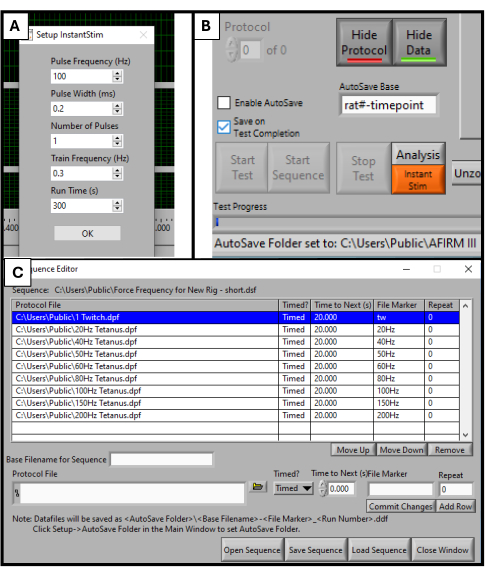
איור 2: אתחול תוכנה עבור בדיקות פונקציונליות. פרמטר שהוגדר עבור תוכנת DMC. הגדרת Instant Stim לערכים הרצויים (A). ממשק משתמש גרפי של תוכנה ומיקום תיבת ההגדרה של בסיס שמירה אוטומטית (B). בחירת רצף פרוטוקול בן 9 שלבים המשמש לבדיקה (C). הערכים המוצגים כאן הם ערכים לדוגמה המשמשים למחקר זה, אך ייתכן שיהיה צורך לייעל אותם ולהתאים אותם בהתאם למקרי השימוש הספציפיים של אחרים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
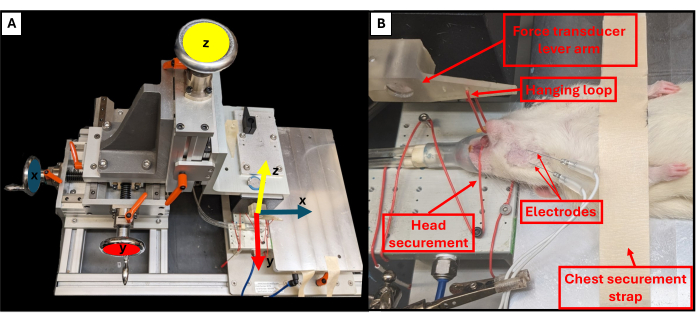
איור 3: צירי תנועה פונקציונליים של אסדה ומיקום נכון של בעלי חיים. סכמטי ממחיש את הקשר בין כל אחד משלושת גלגלי הכוונון במתקן הבדיקה הפונקציונלי וצירי התנועה המתאימים להם עבור זרוע המנוף (A). תמונה לדוגמה של חולדה שעוברת בדיקות פונקציונליות, המציגה את המיקום הנכון של החיה על הפלטפורמה ורכיבי אסדה חשובים אחרים (B). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
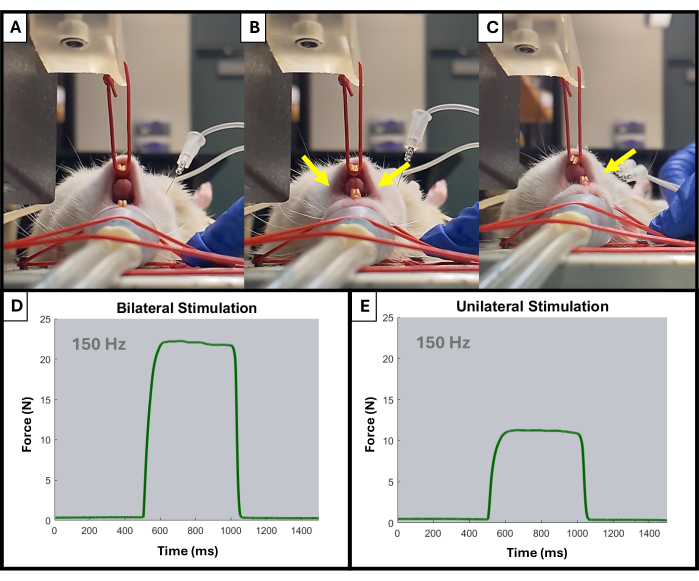
איור 4: דוגמה להפעלה חד-צדדית ודו-צדדית של הלסת במהלך הבדיקה. (A) מראה את הלסת של החולדה במנוחה לפני כל גירוי. אלקטרודות הממוקמות בצורה לא נכונה עלולות לגרום להתכווצות לסת דו-צדדית, כפי שמצוין על ידי החצים הצהובים (B), בעוד שאלקטרודות הממוקמות כהלכה יביאו להתכווצות המקבילה הרצויה (C). חיצים צהובים מציינים נקודות התכווצות בלסת. כמו כן מוצגות דוגמאות לעקומות כוח-זמן ב-150 הרץ להפעלת שרירים דו-צדדית (D) וחד צדדית (E). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
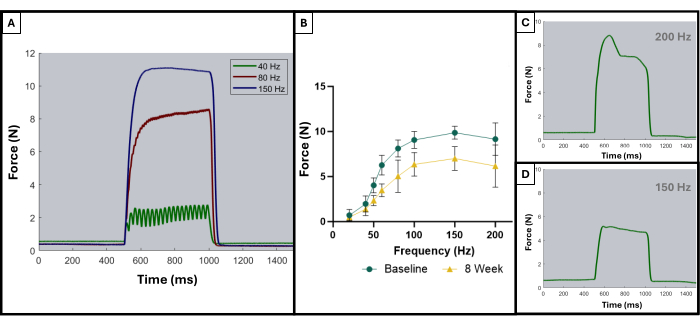
איור 5: עקומות גירוי-תגובה מייצגות עבור ניסויים מקובלים ולא מקובלים. דוגמה לעקומות גירוי ב-40, 80 ו-150 הרץ (A) כדי להדגים מה לחפש לקראת התכווצות טטניקה ובמהלכה. ככל שתדירות הגירוי עולה, גם מתח השיא שנרשם גבוה יותר, וניתן לראות זאת בעקומות תדר הכוח (B) המציגות את הממוצע של בעלי החיים הפצועים (n = 9) בנקודת ההתחלה וב-8 שבועות לאחר יצירת VML. (C,D) הדגימו דוגמאות מייצגות לצורת תגובת כוח שיצביעו על הצורך בהתאמת אלקטרודות עקב טטנוס לא תקין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר שיטה פשוטה ואמינה לבדיקה פונקציונלית in vivo של כוח הנשיכה המקביל המיוצר בלסת החולדה. כמו כן מתוארת שיטה ליצירה כירורגית של פציעת VML בשריר מעסה העכברושים. בשילוב, שיטות אלו מספקות מודל בעלי חיים רלוונטי מבחינה ביולוגית לביצוע הערכה אורכית של התאוששות תפקודית לפני ואחרי פגיעה טראומטית בגולגולת. בעוד ששיטות בדיקה אחרות, כגון in vitro ו-in-situ, יכולות גם הן לספק מידע בעל ערך, הן מחייבות בידוד של הגיד והוצאת הרקמה מסביבתה המקורית, מה שמגביל את תחולתן להבנה טובה יותר של תוצאות תפקודיות in vivo 8,25,26,27,28 . עם אימון ותרגול נאותים, חוקר יוכל למקם בעל חיים במהירות לבדיקה ולבצע את ההתאמות הנדרשות כדי להשיג ייצור כוח שריר מקסימלי.
ישנם פרטים טכניים שיש לאמת עבור כל בעל חיים כדי להבטיח מיקום וגירוי אלקטרודות נאותים. ראשית, יש לאבטח את החותכות העליונות כך שראש החולדה יהיה במגע מלא עם הפלטפורמה המחוממת. זה גם ישמור על האף של החולדה ממוקם בקונוס האף למתן רציף של חומר הרדמה בשאיפה. אם הראש לא נשמר במצב הנכון, יהיו חוסר עקביות בקריאות הכוח כאשר המתח הבסיסי סוטה. בנוסף, גוף החיה צריך להיות שוכב, ועמוד השדרה שלו צריך להיות ישר. שמירה על החיה במצב הנכון תעזור במיקום האלקטרודות ותחזוקה במיקום הנכון. לבסוף, מיקום האלקטרודות יכול להיות קשה, מכיוון שיש למקם אותן בעומק ובמרווח המתאימים כדי לעורר רק את הצד הניסיוני של הלסת. ערנות ותרגול רלוונטיים כדי להיות מיומן במיקום אלקטרודות לתוצאות הניתנות לשחזור ואמינות. האלקטרודות יהפכו משעממות די מהר, ולכן יש צורך להחליף אותן לעתים קרובות. סימני ההיכר של מיקום אלקטרודות לקוי הם הפעלה של שרירי אביזרים, קריאות כוח בשיפוע חיובי/שלילי (תנועת אלקטרודות במהלך גירוי), או צורת גל טטנית לא מאוחדת/מתנודדת8 (איור 5C,D).
יתר על כן, ישנן מספר מגבלות לשיטה זו המצדיקות אזכור והתייחסות ביישומים עתידיים של מערכת זו. ראשית, בעוד שהלולאה המשמשת לאבטחת הלסת העליונה אינה המערכת הנוקשה ביותר. במקום זאת, גישה סטריאוטקסית באמצעות מוטות אוזניים יכולה ליצור אחיזה טובה יותר של הלסת העליונה של החולדה. בנוסף, ערך מתח פסיבי שימש כמיקום שנקבע לבדיקה בשיטה זו, מה שעשוי שלא לגרום לייצור הכוח המקסימלי שהיה מתקבל אם השריר היה ממוקם באורכו האופטימלי (Lo). למעשה, ניתן לקבוע את ה-L o על ידי מיקום החיה כמתואר כאן ולאחר מכן מניפולציה של חסימת הלסת במרווחים קטנים (0.5-1 מ"מ) תוך הפעלת גירוי עווית - כאשר Lo נקבע כעמדת הבדיקה האופטימלית שבה נוצר כוח העווית המרבי. עם זאת, לשריר המעסה יש גיאומטריה ותנועה ייחודיים למדי35,36, ולכן הוא פועל בטווח אורכים רחב בהרבה ממה שמאפיין, למשל, שרירי גפיים (הפועלים בדרך כלל סביב Lo). עם זאת, הלעיסה מתרחשת בטווח צר בהשוואה לנשיכה. ככזה, אין גישה מושלמת לבעיה זו. לכן, למרות שקביעת מתח בסיסי אינה הדרך היחידה לגשת לבעיה זו, יש רציונל מדעי הגיוני לעשות זאת, שכן האורך האופטימלי של שרירי הלסת הוא מעבר לפתיחה הטבעית של הלסת. בלי קשר, כוח מקסימלי במתח פסיבי נתון עדיין נותן תובנה חשובה לגבי היבטים של תפקוד - גם אם הם שונים מהכוח המקסימליב-Lo. ברור שיש צורך בחקירה נוספת של יחסי הכוח-אורך של שריר המעסה. לבסוף, שיטה זו בוחנת את הגירוי של העצב הטריגמינלי בחולדה, המחולק לשלושה ענפים: V1-V3. בעוד ש-V3, או עצב הלסת התחתונה, הוא הענף היחיד עם מרכיב מוטורי, הוא כן מעצבב שרירים מרובים, כולל המעסה, הטמפורליס, הפטריגואידים והמילוהיואיד37. חשוב לקחת זאת בחשבון מכיוון שמשמעות הדבר היא ששיטה זו אינה מדווחת באופן בלעדי על כוח מעסים, שעשוי להיות רלוונטי לחקירות מחקר אחרות.
למרות ההיבטים והמגבלות הטכניות הללו, שיטה זו מוכיחה את עצמה כחזקה ועקבית. בעוד שרק בדיקות מקבילות מתוארות כאן, ניתן לשנות את הפרוטוקול בקלות כך שיכלול בדיקות נוספות של הצד השני של הלסת. בדיקות דו-צדדיות של התכווצות/תפקוד המעסה יאפשרו לבצע השוואות בריאות/פצועות בתוך בעל חיים בודד, ואולי להבהיר שינויים מפצים חשובים בצד הפגוע ו/או הביקורת (הצד הלא פגוע). בסך הכל, מודל זה מספק כלי רב עוצמה להערכת תפקוד שרירי האורך, כמו גם התאוששות תפקודית, בצורה זעיר פולשנית. ככזו, מערכת זו תהיה ישימה להערכת מנגנונים ביומכניים המטפלים בליקויים תפקודיים בתיווך VML, כמו גם לבדיקת יעילותם של טיפולים שונים לתיקון פגיעות VML באזור הגולגולת.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
Myologica LLC לשיתוף הציוד המשמש לביצוע הערכות פונקציונליות. המחקר המדווח בפרסום זה נתמך על ידי המכון הלאומי לחקר שיניים וגולגולת של המכונים הלאומיים לבריאות תחת פרס מספר U24 DE029463. התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את העמדות הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
References
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved