Method Article
Avaliação funcional in vivo do músculo masseter de rato após a criação cirúrgica de uma lesão de perda muscular volumétrica (VML)
Neste Artigo
Resumo
As lesões de perda muscular volumétrica (VML) excedem a capacidade regenerativa endógena, resultando em déficits funcionais permanentes. A pesquisa atual do VML se concentra principalmente nos músculos dos membros e troncos. Para estender os estudos mecanísticos do VML aos músculos craniofaciais, este artigo descreve um método in vivo para avaliação longitudinal da função do músculo masseter pré e pós-lesão do VML.
Resumo
A Perda Muscular Volumétrica (VML) é prevalente em populações civis e militares e representa uma lesão muscular esquelética debilitante que supera a capacidade regenerativa natural do corpo. Essas lesões rompem não apenas as fibras musculares, mas também os nervos, vasos sanguíneos e a matriz extracelular, sobrecarregando a capacidade regenerativa do músculo esquelético e levando a fibrose grave e deficiências permanentes na estrutura e função muscular. O manejo clínico atual tem muitas limitações e, portanto, pesquisas estão em andamento para desenvolver abordagens terapêuticas mais eficazes. Notavelmente, no entanto, grande parte da ênfase pré-clínica nas lesões do VML se concentrou nos músculos dos membros e do tronco, com investigação limitada nos músculos craniofaciais. As diferenças na biologia do desenvolvimento e na capacidade regenerativa entre os músculos craniofaciais e dos membros/tronco podem fornecer informações cruciais que impulsionam mais opções de tratamento de VML específicas para lesões. Além disso, a avaliação da recuperação funcional é fundamental para estabelecer a eficácia terapêutica. Nesse sentido, o teste in vivo da contração muscular com estimulação nervosa percutânea é um método minimamente invasivo que permite a avaliação funcional repetida ao longo de um estudo - no mesmo animal. À luz dessas considerações, este artigo descreve um método para a avaliação in vivo da função muscular no músculo masseter de ratos antes e depois de uma lesão de VML. Este protocolo é a primeira instância publicada a detalhar a criação e avaliação funcional de uma lesão craniofacial VML biologicamente relevante no rato.
Introdução
Lesões traumáticas e cirúrgicas de tecidos moles que envolvem músculo esquelético subjacente continuam sendo um dos maiores desafios para a reconstrução de tecidos para civis e guerreiros feridos1. De fato, quase 20% das lesões no campo de batalha também ocorrem nas regiões craniofaciais de guerreiros feridos (cabeça e face)2. Inclusive, traumas de extremidades e lesões de cabeça e pescoço são responsáveis por >80% das lesões de combate em conflitos recentes2. Apesar da capacidade bastante conhecida do músculo esquelético de reparar, regenerar e remodelar após uma lesão, essas lesões mais graves, que envolvem a perda de uma porção substancial do tecido muscular, não são capazes de curar por conta própria e são chamadas de lesões de Perda Muscular Volumétrica (VML). Por definição, a VML resulta em déficits estéticos e funcionais permanentes do músculo lesionado ou da unidade muscular3.
Curiosamente, apesar da prevalência de lesão craniofacial do VML 2,4, grande parte da pesquisa até o momento está focada nos músculos do membro 5,6,7,8 e do tronco 9,10,11, com apenas um punhado de relatos sobre lesões do VML nos músculos craniofaciais 12,13,14. Isso apresenta uma lacuna de pesquisa translacional potencialmente importante, pois a literatura existente sugere que existem diferenças significativas tanto na biologia do desenvolvimento, quanto na capacidade regenerativa entre os músculos craniofaciais e dos membros e troncos 15,16. Na verdade, existem mais de 20 músculos em cada lado do rosto – refletindo o fato de que a região craniofacial está envolvida na realização de muitas tarefas essenciais tão diversas quanto piscar, engolir emastigar. Além disso, mesmo entre os músculos craniofaciais, surgem diferenças em relação à capacidade regenerativa. Por exemplo, os músculos extraoculares parecem se regenerar mais rapidamente do que os músculos dos membros17. Em contraste, o masseter exibe uma resposta regenerativa mais lenta do que o tibial anterior (TA)18. Essas diferenças podem ser devidas, pelo menos em parte, ao fato de as origens dos músculos serem branquioéricas ou derivadas de somito - resultando em diferentes quantidades de células satélites, bem como perfis distintos de expressão gênica das populações de células satélites residentes19. A consideração das características únicas entre os músculos craniofaciais, bem como em relação aos músculos dos membros e troncos, pode lançar uma visão mecanicista importante para o desenvolvimento terapêutico aprimorado de opções de tratamento personalizadas que abordam lesões de VML específicas do músculo. Essas diferenças músculo-específicas também podem explicar as limitações conhecidas dos músculos em forma de folha, como o grande dorsal, como opções de transferência de tecido muscular doador para cirurgias reconstrutivas de cabeça e pescoço 20,21,22.
Independentemente da localização da lesão VML, atualmente não existem tratamentos que possam restaurar a forma e a função completas. O manejo clínico padrão-ouro inclui transferência de tecido autólogo, bem como reabilitação; No entanto, o primeiro normalmente não melhora a força e pode resultar em morbidade da área doadora3,23, enquanto o segundo melhora a amplitude de movimento, com impacto mínimo na recuperação funcional ou no retorno da força contrátil, nomúsculo1,6. Por todas essas razões, pesquisas estão em andamento para desenvolver abordagens terapêuticas mais eficazes para a regeneração do tecido muscular funcional após lesão de VML. Uma análise recente destacou a importância crítica de estudos pré-clínicos em modelos de ratos de lesão de VML para o avanço de soluções de tecnologia regenerativa para reparo de VML1.
Conforme observado em trabalhos anteriores 5,8,9,10,24,25, avaliar a recuperação funcional após VML é fundamental para avaliar a eficácia das intervenções terapêuticas. Especificamente, embora a cicatrização de feridas e a recuperação de volume sejam características-chave do reparo de VML, medir a recuperação da força após a lesão e o tratamento ajuda a esclarecer os mecanismos biomecânicos multiescala responsáveis pelos déficits de VML, bem como os mecanismos que impulsionam a recuperação funcional. Como tal, estabelecer uma ligação entre reparo tecidual, recuperação de volume e aumento da força muscular é um requisito absoluto para identificar as soluções regenerativas mais eficazes para o reparo do VML9.
A este respeito, existem três métodos principais para fazer essas medições funcionais: (1) in vitro, (2) in situ e (3) testes in vivo - cada um oferecendo suas próprias vantagens e desvantagens8. Por exemplo, o teste in vitro envolve o exame da função muscular isolada fora do organismo vivo e oferece uma oportunidade de manipular mais direta / especificamente a estimulação muscular com uma variedade de drogas e produtos químicos que afetam a excitabilidade e a contração muscular26. Embora esse método permita investigações detalhadas sobre aspectos celulares e moleculares da função e recuperação muscular27, ele remove o suprimento sanguíneo e a inervação, o que limita o quão bem ele recapitula a verdadeira função muscular 8,26. O teste in situ avalia a função muscular enquanto o músculo ainda está em sua localização anatômica natural, mas isolado dos tecidos circundantes25,28. Embora esse método mantenha a inervação e o suprimento sanguíneo, a separação do músculo ainda pode limitar a aplicabilidade dos achados ao ambiente in vivo. Além disso, e talvez o mais importante, os testes in situ e in vitro são procedimentos terminais que impedem os testes longitudinais - o que é necessário para permitir o rastreamento da recuperação funcional ao longo do tempo no mesmo animal. Em contraste, o teste in vivo, que envolve a avaliação da função muscular em seu ambiente nativo, permite uma compreensão mais completa do desempenho muscular em um contexto fisiológico29. Os estudos in vivo também são a técnica menos invasiva e podem ser realizados repetidamente ao longo do tempo de um estudo29. Usando a estimulação elétrica nervosa percutânea, pode-se coletar medidas funcionais em músculos específicos, deixando os tendões, a vasculatura e a inervação intactos30. Essas avaliações longitudinais podem fornecer informações sobre mudanças sutis, mas importantes, que ocorrem durante diferentes estágios de cicatrização no mesmo animal. Este método é comumente empregado em modelos de pequenos roedores 8,31,32,33; no entanto, também tem sido usado em modelos animais maiores de porco30 e cão34.
Atualmente, existem três estudos publicados sobre a avaliação da recuperação funcional após lesões craniofaciais de VML. Rodriguez et al. relatam um método para reparar um modelo de lesão craniofacial de VML no músculo zigomático maior ovino. Seu método detalha um protocolo de teste in situ que só pode ser implementado no ponto de tempo do estudo terminal e, portanto, não permite avaliação longitudinal em um único animal13. Kim et al. descrevem um método para o uso de eletrônica de nanomembrana para rastrear dados contínuos de eletromiograma da mastigação de camundongos após uma lesão de VML. Eles relataram um sinal significativamente menor de camundongos feridos em comparação com o controle, no entanto, eles também observaram que os artefatos de movimento afetavam a análise do sinal e que os camundongos ocasionalmente tentavam raspar o circuito. Além disso, camundongos nus atímicos foram usados para permitir a fixação segura da nanomembrana à pele, o que atualmente impede a utilização mais ampla desse método em modelos animais mais comumente usados (e econômicos)12. Finalmente, Zhao et al. descrevem um defeito de VML de tamanho crítico no masseter de camundongo, que prejudica a nutrição nos animais, refletido na diminuição significativa do ganho de peso corporal, como um resultado funcional14. Com esses estudos em mente, este artigo descreve um método versátil e minimamente invasivo para a avaliação longitudinal in vivo da função contrátil na mandíbula de rato antes e depois de uma lesão de VML por meio da estimulação do nervo trigêmeo com eletrodos subcutâneos. À medida que o teste é executado por meio de uma série de frequências de simulação crescentes (20-200 Hz), um transdutor mede a força gerada pelo músculo. Essas medidas podem permitir a determinação da rigidez muscular e do tétano máximo, entre outros. O protocolo abaixo é projetado para avaliar a recuperação funcional da força de mordida ipsilateral após uma lesão traumática do VML e, como tal, também inclui um protocolo para a criação cirúrgica de uma lesão VML validada. Este método pode ser facilmente implementado em uma ampla variedade de ratos e camundongos - e, com modificações apropriadas no equipamento, é aplicável a modelos animais maiores e lesões de VML também30.
Protocolo
Todo o manejo e procedimentos dos animais foram aprovados e feitos de acordo com as Diretrizes do Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade da Virgínia. Os ratos utilizados nesses experimentos eram ratos Lewis machos de 12 a 14 semanas de idade, pesando 324,8 g ± 12,72 g no momento da cirurgia. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Lesão VML do músculo masseter
- Preparação do equipamento
- Antes da cirurgia, certifique-se de que todos os instrumentos necessários foram esterilizados adequadamente: campos cirúrgicos, bisturi, fórceps, microtesouras, hemostáticos, suturas e gaze.
- Ligue uma plataforma aquecida e ajuste-a para 37 °C.
- Aplique pomada oftálmica estéril em ambos os olhos para evitar o ressecamento dos olhos sob anestesia. Coloque o animal na câmara de indução anestésica e forneça isoflurano a 2% a 3% (seguindo protocolos aprovados institucionalmente).
- Criação cirúrgica de lesão VML
- Certifique-se de que o animal esteja devidamente anestesiado antes de removê-lo da câmara.
NOTA: Isso pode ser determinado se o animal não responder a um beliscão no dedo do pé. - Pese e coloque o animal em uma tábua de cirurgia na posição lateral do lado esquerdo, com o nariz firmemente no cone do nariz para permitir a administração contínua de isoflurano.
- Prepare o animal para a cirurgia aplicando o analgésico apropriado, raspando o lado direito do rosto e esterilizando a área por meio de três trocas de cotonetes de iodo e álcool. Para esses estudos, a buprenorfina de liberação prolongada foi usada para analgesia (0,65 mg / kg de peso corporal).
- Comece a cirurgia fazendo uma incisão de aproximadamente 2 cm ao longo da região vestibular do rato. A incisão deve estar alinhada com o nariz e a orelha do animal. Use dissecção romba para separar a pele e a fáscia.
- Faça uma incisão semelhante ao longo da fáscia e disseque-a suavemente para longe do masseter subjacente.
- Localize os nervos vestibular e marginal (Figura 1A). Utilize um marcador cirúrgico estéril e uma régua para marcar a área a ser removida. A área deve ser um retângulo de 10 mm x 5 mm no centro do masseter exposto entre os nervos faciais (Figura 1B).
- Use cuidadosamente uma microtesoura para iniciar a remoção do tecido. Certifique-se de que a lesão final atinja uma profundidade de aproximadamente 4 mm com 150 mg de tecido excisado (Figura 1C). O tecido removido será de toda a espessura do masseter superficial e irá parcialmente para o masseter profundo.
NOTA: A massa média de tecido removido nesses experimentos foi de 146,1 mg ±1,16 mg. - Feche a fáscia e a pele com suturas interrompidas absorvíveis (6-0) e não absorvíveis (5-0), respectivamente.
- Certifique-se de que o animal esteja devidamente anestesiado antes de removê-lo da câmara.
- Limpeza e monitoramento
- Após a sutura, desligue o gás anestésico e mantenha o animal na superfície aquecida para monitorar seu retorno à consciência. Assim que o rato começar a recuperar a consciência, coloque o animal de volta na gaiola e continue monitorando até que esteja acordado e deambulando.
- Durante 3 dias após a cirurgia, verifique o animal e avalie quaisquer sinais de dor ou desconforto.
- Por 7 dias após a cirurgia, forneça ao animal alimentos macios para reduzir a tensão na mandíbula e mantê-los bem hidratados/alimentados.
- Remova as suturas interrompidas 7 a 10 dias após a cirurgia, garantindo que a ferida esteja totalmente fechada antes da remoção.
- Após o ponto de tempo terminal do estudo, eutanasiar os animais de acordo com as diretrizes da IACUC. Explante os músculos masseteres e congele repentinamente submergindo em nitrogênio líquido ou isopentano resfriado por nitrogênio líquido.
NOTA: As amostras de tecido congelado podem ser armazenadas a longo prazo a -80 °C para avaliação histológica futura.
2. Avaliação funcional in vivo da mandíbula
- Preparação do equipamento
- Verifique e garanta a conexão adequada de todos os equipamentos.
- Em ordem, ligue (1) computador, (2) estimulador bifásico, (3) sistema de alavanca de modo duplo e, finalmente, (4) uma plataforma aquecida para aquecê-lo a 37 °C.
NOTA: O manual do usuário indica um tempo de aquecimento de 1 min para que o estimulador e o sistema de alavanca produzam leituras precisas. Além disso, aguarde de 10 a 15 minutos para que a plataforma aqueça totalmente antes de testar qualquer animal. - Aplique pomada oftálmica estéril em ambos os olhos para evitar o ressecamento dos olhos sob anestesia. Coloque o animal a ser testado na câmara de indução anestésica e forneça 2%-3% de isoflurano.
- Esterilize as pontas dos eletrodos revestidos com politetrafluoretileno, colocando-as em etanol a 70%.
- Localize e abra o software Dynamic Muscle Control (DMC). Isso será necessário para realizar a avaliação funcional.
- Configuração do software
- No software DMC, encontre Instant Stim no menu de configuração e altere os parâmetros para os valores desejados. Neste estudo, nenhum parâmetro é alterado em relação às suas predefinições (Figura 2A).
- No menu Configuração , crie e selecione uma pasta de salvamento automático para armazenar os dados.
- Próximo à parte inferior da tela do software, localize uma caixa intitulada Base de salvamento automático. Altere isso para um título específico para o animal que está sendo testado, por exemplo, "rat#-timepoint" (Figura 2B).
- Selecione Sequencer na parte superior da tela do software. Na nova janela que se abre, selecione Abrir sequência na parte inferior da tela. Selecione a sequência predefinida no explorador de arquivos que é aberto. Isso preencherá a janela Sequência com uma lista de parâmetros, como frequência, duração dos estímulos e tempo de repouso (Figura 2C).
- Clique em Carregar sequência seguido de Fechar janela.
NOTA: A sequência utilizada neste protocolo consiste em 9 etapas (contração, 20 Hz, 40 Hz, 50 Hz, 60 Hz, 80 Hz, 100 Hz, 150 Hz, 200 Hz) com 20 s de descanso entre cada uma. Além da estimulação da contração, todas as etapas têm 500 ms de duração. O protocolo de sequência deve ser ajustado aos objetivos de teste específicos de cada laboratório.
- Clique em Carregar sequência seguido de Fechar janela.
- Para abrir uma nova janela e habilitar a visualização da aquisição de dados em tempo real, selecione Arquivo > Monitor de dados em tempo real.
- Na janela Live Data Monitor , defina a escala de tempo, o valor y mínimo e o valor y máximo manualmente ou marcando a caixa para habilitar o dimensionamento automático.
- Preparação animal
- Certifique-se de que o animal esteja no plano adequado de anestesia antes de removê-lo da câmara de anestesia.
- Coloque o animal em decúbito dorsal com o nariz firmemente no cone do nariz para permitir a administração contínua de isoflurano. Coloque um laço de fixação sobre a metade superior da mandíbula do rato para segurar o nariz firmemente na plataforma.
- Raspe o pescoço e o rosto do animal no lado experimental da mandíbula.
- Prenda a metade superior do animal colocando e prendendo uma alça em seus braços e peito.
- Ajuste a posição da alavanca de mordida usando os três botões giratórios localizados próximos à plataforma da plataforma para controlar os planos X, Y e Z (Figura 3A). Usando o botão superior, abaixe a alavanca da mordida em direção ao animal e use os outros dois botões para ajustar a extremidade da alavanca para ficar logo acima do queixo do animal.
- Use uma pinça para prender o laço de suspensão ao redor dos dentes inferiores do animal para prender a cabeça e evitar que ela se mova (Figura 3B).
NOTA: O laço está localizado através de um orifício perfurado na alavanca de mordida a 3 cm de distância do transdutor de força. O sistema deve ser calibrado antes do primeiro uso. - Ajuste a altura da alavanca para aumentar a tensão na mandíbula. A tensão basal reprodutível usada nesses experimentos foi de ~ 0,5 N.
- Colocação do eletrodo
- Palpe a mandíbula do animal e localize o canto posterior da mandíbula. Posicione os eletrodos por via subcutânea em ambos os lados do canto a aproximadamente 2-3 mm de distância. Os eletrodos devem ser inseridos a uma profundidade de 3-5 mm. Use um clipe jacaré e um suporte para manter os eletrodos na posição.
- Na janela Live Data Monitor , clique no grande botão laranja denominado Instant Stim para ativá-lo.
- O monitor deve começar a exibir picos ascendentes durante cada estimulação. Ajuste o posicionamento do eletrodo e a posição do braço da alavanca usando os botões conforme necessário. Apenas a ativação do lado ipsilateral da mandíbula deve ser observada (Figura 4).
- No estimulador bifásico de alta potência, existem dois botões próximos ao centro, rotulados como "Range" e "Adjust". Comece girando o botão Range para modular a amperagem. À medida que a amperagem aumenta, os picos instantâneos de estimulação começarão a aumentar em magnitude até se estabilizarem - determinado como o nível em que três estímulos consecutivos resultam em respostas contráteis idênticas.
- Evite aumentar muito a amperagem, ou seja, não mais do que 20% acima da amperagem onde os picos máximos foram observados - pois isso pode resultar no recrutamento de músculos vizinhos e leituras de força imprecisas.
- Gire o botão de ajuste para modular a porcentagemtage do "Range" atual que está sendo usado para estimular a mandíbula. Um aumento ou diminuição na corrente pode ser necessário para otimizar a resposta da contração.
- Confirme se os eletrodos ainda estão firmemente no lugar e pare o estímulo instantâneo.
- Abaixo do botão laranja "Instant Stim" no monitor de dados ao vivo, localize o botão cinza Start Sequence e clique nele.
- Continue monitorando as curvas durante todo o protocolo de estimulação. À medida que a frequência de estimulação aumenta, também aumenta a força máxima produzida. Uma vez atingido o tétano, as curvas de força se estabilizarão (Figura 5A).
- Limpeza
- Após a conclusão da sequência de estimulação funcional, remova os eletrodos e limpe-os com etanol a 70%. Se este for o último animal a ser testado, os eletrodos podem ser colocados de volta em suas tampas.
- Desligue o gás anestésico, mas mantenha o animal na superfície aquecida para monitorar seu retorno à consciência. Assim que o rato começar a recuperar a consciência, coloque-o de volta na gaiola e continue monitorando até que o animal esteja acordado e deambulando.
- Desligue o equipamento usado para aquisição de dados e limpe todas as superfícies.
3. Análise dos dados
NOTA: Este método foi descrito anteriormente como documentando um método para o teste funcional in vivo do TA8 de rato. A análise dos dados é projetada para determinar as intenções deste estudo, e os protocolos podem mudar dependendo dos objetivos do usuário.
- Localize e abra o software Dynamic Muscle Analysis .
- Clique no menu Alto rendimento e selecione Análise de frequência de força para analisar várias amostras simultaneamente.
- Selecione Selecionar arquivos e realce quantos arquivos de dados desejar para análise. O botão "Selecionar pasta" também pode ser usado se as amostras forem claramente nomeadas no sistema de arquivos.
- Marque a caixa para Remover Linha de Base. Isso removerá automaticamente a força da linha de base da força máxima registrada para cada tentativa, fornecendo os valores máximos absolutos.
- Clique no botão Analisar e, em seguida, clique em Exportar tabela para o Excel , onde os dados podem ser salvos como uma planilha. Certifique-se de que os valores "Cursor inicial" e "Cursor final" capturem com precisão o carimbo de data/hora da estimulação. Esses valores podem ser definidos manualmente, se necessário.
- Abra a planilha salva.
NOTA: Usando a coluna "Máximo", o usuário pode calcular a força máxima produzida em todas as frequências. A curva força-frequência também pode ser gerada (Figura 5).
Resultados
Conforme descrito em publicação anterior, as curvas tetânicas podem ser usadas para distinguir resultados ótimos de resultados subótimos8. Um resultado ideal é obtido quando o músculo é estimulado à sua força máxima e mantém esse máximo durante toda a duração da contração tetânica. A soma das contrações individuais em curvas tetânicas geralmente começa a aparecer em 100 Hz ou após. A Figura 5A demonstra esse ponto, pois a curva ideal a 150 Hz tem um aumento acentuado no início da estimulação, uma fase de platô plano no valor máximo de força com oscilação mínima e um declínio vertical acentuado quando a estimulação cessa. Curvas tetânicas não ideais podem apresentar oscilações durante a fase de platô e podem apresentar inclinação negativa ou positiva (Figura 5C,D).
Os resultados deste protocolo de teste funcional podem ser representados de forma diferente, dependendo dos objetivos dos pesquisadores e do desenho experimental do estudo. No caso deste protocolo, a força máxima absoluta é determinada empiricamente a partir de todas as frequências de estimulação e representada graficamente em cada ponto de tempo para teste. Isso permite comparar a produção de força máxima basal com a produção de força máxima a cada 4 semanas após a criação da lesão de VML descrita no masseter (Figura 1D). Para comparação, uma coorte de animais não feridos (n = 4) também foi testada em cada ponto de tempo (Figura 1E). Os pesos dos animais em cada momento também foram comparados (Figura 1F). Às 4, 8 e 12 semanas pós-VML, respectivamente, os ratos produziram uma força máxima média de 7,958 N ±1,797 N, 7,183 N ±1,450 N e 7,823 N ± 0,626 N. Análise de variância de medidas repetidas unidirecionais (ANOVA) com a diferença menos significativa de Fisher (LSD) As comparações post hoc em pares determinaram que não houve diferenças estatisticamente significativas entre esses valores em nenhum momento pós-lesão VML, no entanto, todos eles eram significativamente diferentes da força basal média de 10,031 N ±0,564 N.
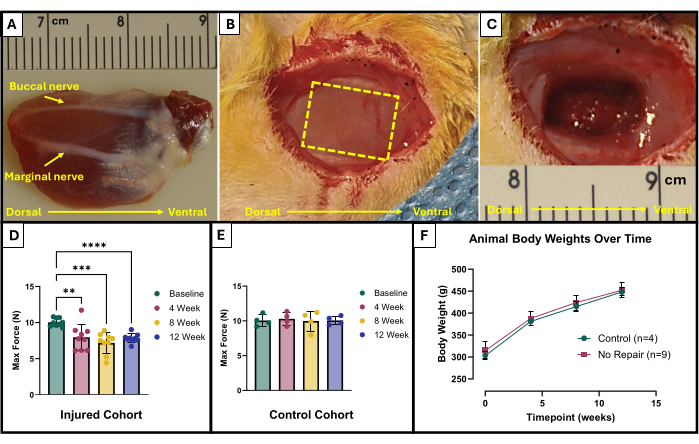
Figura 1: Resultados esquemáticos e funcionais cirúrgicos para o músculo masseter lesionado em VML. Músculo masseter explantado mostrando orientação anatômica, bem como pontos de referência nervosos para criação de lesões (A). Animal durante a cirurgia antes (B) e após (C) a criação da lesão de VML. As imagens são todas apresentadas com músculos na mesma orientação de (A). A linha tracejada amarela indica a região onde o músculo deve ser excisado. Produção máxima de força na linha de base e ao longo do tempo em ratos que receberam uma lesão VML (n = 9) no masseter (D), bem como para ratos controle pareados por idade que não foram feridos (n = 4) (E). Um gráfico dos pesos corporais dos ratos ao longo do tempo (F). (D) representa uma ANOVA de medidas repetidas unidirecional com comparações post hoc de LSD de Fisher, onde **= p < 0,01, ***= p < 0,001, ****= p < 0,0001. As réguas em (A) e (C) estão em centímetros, com graduações em milímetros. Clique aqui para ver uma versão maior desta figura.
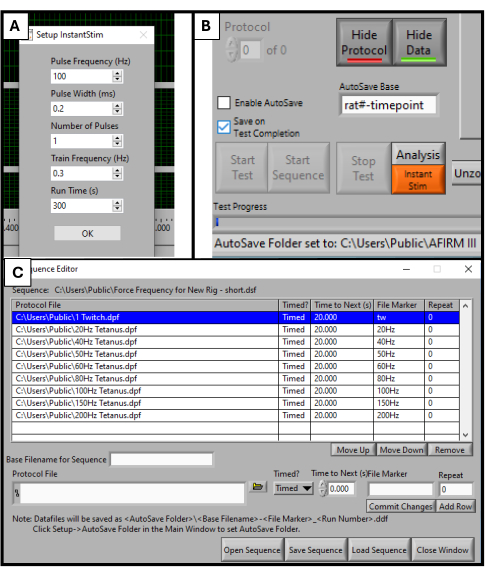
Figura 2: Inicialização de software para testes funcionais. Configuração de parâmetros para o software DMC. Configurando o Instant Stim para os valores desejados (A). Interface gráfica do usuário do software e localização da caixa de configuração Base de salvamento automático (B). Seleção da sequência de protocolo de 9 etapas usada para teste (C). Os valores exibidos aqui são exemplos de valores usados para este estudo, mas podem precisar ser otimizados e ajustados dependendo dos casos de uso específicos de outros. Clique aqui para ver uma versão maior desta figura.
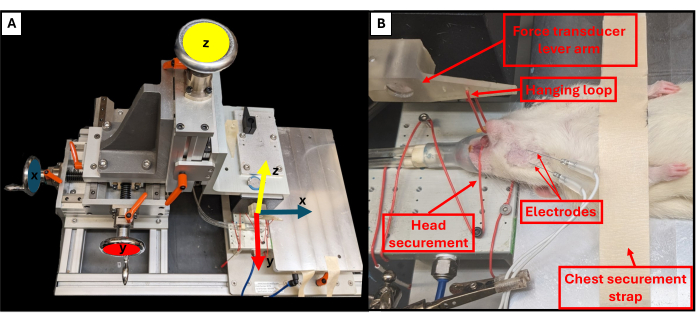
Figura 3: Eixos de movimento funcionais da plataforma e posicionamento adequado do animal. O esquema ilustra a relação entre cada uma das três rodas de ajuste no equipamento de teste funcional e seus eixos de movimento correspondentes para o braço de alavanca (A). Exemplo de imagem de um rato em teste funcional, mostrando o posicionamento supino adequado do animal na plataforma e outros componentes importantes da plataforma (B). Clique aqui para ver uma versão maior desta figura.
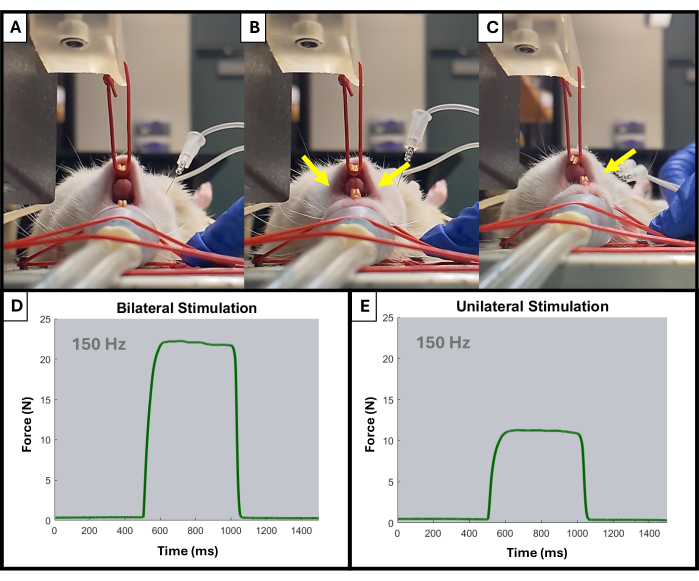
Figura 4: Exemplo de ativação unilateral e bilateral da mandíbula durante o teste. (A) mostra a mandíbula do rato em repouso antes de qualquer estimulação. Eletrodos colocados incorretamente podem resultar em uma contração bilateral da mandíbula, conforme indicado pelas setas amarelas (B), enquanto eletrodos colocados corretamente resultarão na contração ipsilateral desejada (C). As setas amarelas indicam pontos de contração na mandíbula. Também são mostrados exemplos de curvas de força-tempo a 150 Hz para ativação muscular bilateral (D) e unilateral (E). Clique aqui para ver uma versão maior desta figura.
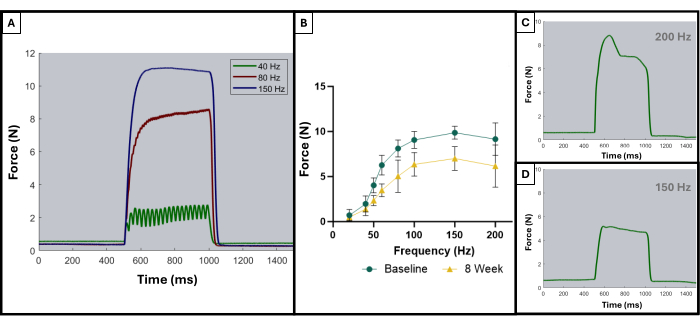
Figura 5: Curvas representativas de estímulo-resposta para ensaios aceitáveis e inaceitáveis. Exemplo de curvas de estimulação em 40, 80 e 150 Hz (A) para demonstrar o que procurar antes e durante uma contração tetânica. À medida que a frequência de estimulação aumenta, o pico de tensão registrado também é maior, o que pode ser observado nas curvas de força-frequência (B) mostrando a média dos animais lesionados (n = 9) no início e 8 semanas após a criação do VML. (C,D) demonstrar exemplos representativos da forma de uma resposta de força que indicaria a necessidade de ajuste do eletrodo devido ao tétano inadequado. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um método simples e confiável para o teste funcional in vivo da força de mordida ipsilateral produzida na mandíbula do rato. Também é descrito um método para a criação cirúrgica de uma lesão VML no músculo masseter de ratos. Em combinação, esses métodos fornecem um modelo animal biologicamente relevante para realizar uma avaliação longitudinal da recuperação funcional antes e depois de uma lesão craniofacial traumática. Embora outros métodos de teste, como in vitro e in situ, também possam fornecer informações valiosas, eles exigem o isolamento do tendão e a remoção do tecido de seu ambiente nativo, limitando sua aplicabilidade para uma melhor compreensão dos resultados funcionais in vivo 8,25,26,27,28. Com treinamento e prática adequados, um pesquisador será capaz de posicionar um animal rapidamente para testes e fazer os ajustes necessários para atingir a produção máxima de força muscular.
Existem detalhes técnicos que devem ser verificados para cada animal para garantir a colocação e estimulação adequadas do eletrodo. Primeiro, os incisivos superiores devem ser fixados de forma que a cabeça do rato fique totalmente em contato com a plataforma aquecida. Isso também manterá o nariz do rato colocado no cone do nariz para administração contínua de anestésico inalado. Se a cabeça não for mantida na posição correta, haverá inconsistências nas leituras de força à medida que a tensão da linha de base se desvia. Além disso, o corpo do animal deve estar em decúbito dorsal e sua coluna deve estar reta. Manter o animal na posição adequada ajudará na colocação e manutenção do eletrodo no local correto. Finalmente, a colocação dos eletrodos pode ser difícil, pois eles devem ser colocados na profundidade e espaçamento adequados para estimular apenas o lado experimental da mandíbula. Vigilância e prática são pertinentes para se tornar adepto da colocação de eletrodos para resultados reprodutíveis e confiáveis. Os eletrodos ficarão cegos rapidamente, por isso é necessário trocá-los com frequência. As características da má colocação do eletrodo são a ativação dos músculos acessórios, leituras de força inclinadas positivamente/negativamente (movimento dos eletrodos durante a estimulação) ou uma forma de onda tetânica não fundida/oscilante8 (Figura 5C,D).
Além disso, existem algumas limitações para este método que merecem ser mencionadas e consideradas em futuras aplicações deste sistema. Em primeiro lugar, embora suficiente para as medições feitas neste estudo, o laço usado para prender a mandíbula superior pode não ser o sistema mais rígido. Em vez disso, uma abordagem estereotáxica usando barras auriculares poderia criar uma melhor aderência da mandíbula superior do rato. Além disso, um valor de tensão passiva foi usado como a posição definida para o teste com esse método, o que pode não resultar na geração de força máxima que seria obtida se o músculo fosse posicionado em seu comprimento ideal (Lo). De fato, o Lo pode ser determinado posicionando o animal conforme descrito aqui e, em seguida, manipulando a oclusão da mandíbula em pequenos incrementos (0,5-1 mm) durante a execução de estímulos de contração - com Lo determinado como a posição de teste ideal onde a força máxima de contração foi gerada. No entanto, o músculo masseter tem uma geometria e locomoção bastante únicas35,36 e, portanto, opera em uma faixa de comprimentos muito mais ampla do que a característica de, por exemplo, músculos dos membros (que normalmente operam em torno deLö). No entanto, a mastigação acontece em uma faixa estreita em comparação com a mordida. Como tal, não existe uma abordagem perfeita para este problema. Portanto, embora definir uma tensão basal não seja a única maneira de abordar esse problema, há uma justificativa científica lógica para fazê-lo, pois o comprimento ideal dos músculos da mandíbula está além da abertura natural da mandíbula. Independentemente disso, a força máxima em uma dada tensão passiva ainda fornece informações importantes sobre os aspectos da função - mesmo que sejam diferentes da força máxima em Lo. Claramente, uma investigação mais aprofundada da relação força-comprimento do músculo masseter é necessária. Finalmente, este método analisa a estimulação do nervo trigêmeo no rato, que é dividido em três ramos: V1-V3. Embora o V3, ou nervo mandibular, seja o único ramo com um componente motor, ele inerva vários músculos, incluindo o masseter, temporal, pterigóideo e milo-hióideo37. É importante considerar isso, pois significa que esse método não relata exclusivamente a força do masseter, o que pode ser relevante para outras investigações de pesquisa.
Apesar desses aspectos técnicos e limitações, esse método se mostra robusto e consistente. Embora apenas o teste ipsilateral seja descrito aqui, o protocolo pode ser facilmente modificado para incluir testes adicionais do outro lado da mandíbula. O teste bilateral da contração/função do masseter permitiria que comparações saudáveis/lesionadas fossem feitas dentro de um único animal, talvez elucidando mudanças compensatórias importantes no lado lesionado e/ou controle (lado não lesionado). No geral, este modelo fornece uma ferramenta poderosa para avaliar a função muscular longitudinal, bem como a recuperação funcional, de forma minimamente invasiva. Como tal, este sistema será aplicável para avaliar mecanismos biomecânicos que atendem a déficits funcionais mediados por VML, bem como para testar a eficácia de várias terapêuticas para o reparo de lesões de VML na região craniofacial.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Myologica LLC por compartilhar o equipamento usado para realizar avaliações funcionais. A pesquisa relatada nesta publicação foi apoiada pelo Instituto Nacional de Pesquisa Odontológica e Craniofacial dos Institutos Nacionais de Saúde sob o número de prêmio U24 DE029463. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
Referências
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Skeletal Trauma Research Consortium. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41(2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487(2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037(2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152(2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610(2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248(2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953(2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85(2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198(2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036(2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167(2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905(2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211(2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782(2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246(2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623(2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. Neuroanatomy, Cranial Nerve 5 (Trigeminal). , StatPearls Publishing. Treasure Island, FL. (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados