需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠心血管重塑的多模式研究:四维超声和质谱成像
* 这些作者具有相同的贡献
摘要
在这里,我们描述了一种使用 体内 四维超声成像和 离体 质谱成像来评估小鼠心血管系统中的生物力学和生物分子改变的方案。该技术用于分析手术诱导的心肌梗死的心脏重塑和衰老动物的血管变化。
摘要
心血管疾病 (CVD) 是美国的主要死亡原因。心血管系统的损害可能是由于环境暴露、创伤、药物毒性或许多其他因素造成的。结果,心脏组织和脉管系统发生结构变化并表现出功能减退。损伤和由此产生的重塑可以通过器官水平的超声 (US) 成像和分子水平的质谱成像 (MSI) 进行检测和量化。本手稿描述了一种研究小鼠心脏病理生理学的创新方法,将 体内 四维 (4D) 超声成像和分析与 体外 基质辅助激光解吸/电离 (MADLI) 心脏 MSI 相结合。4D 超声可以提供动态体积测量,包括整个心动周期中的径向位移、表面积应变和纵向应变。在脉管系统中,MSI 和超声用于评估血管壁成分、血流动力学和血管壁动力学。该方法可以通过调整感兴趣的功能指标和/或改变 MALDI MSI 方案来靶向特定分子,从而定制以研究无数 CV 疾病。MALDI MSI 可用于研究脂质、小代谢物、肽和聚糖。该协议概述了使用 MALDI MSI 进行非靶向脂质组学分析,以及使用超声成像进行心血管血流动力学和生物力学。
引言
心血管疾病 (CVD) 是全球死亡的主要原因1。CVD 的预防和治疗需要深入了解分子对生物力学力的适应以及由此产生的机械性能变化。 在整个心血管系统中,生物力学力在组织的功能和结构中起着重要作用2。心血管 (CV) 组织的机械性能受这些力的影响,使其成为健康和疾病的指标 3,4,5,6。为了预防、诊断和治疗 CVD,开发理解和观察疾病发生和发展过程的方法至关重要。生物医学成像一直是产生生理和机制见解的关键,并且新的成像技术和分析技术不断开发。该协议展示了一种结合两种心血管成像和分析技术的方法,以验证这些成像方式在缺血性心脏病和血管衰老中的潜力。
生物力学领域的研究人员通常通过体内、离体和计算机方法的组合来研究生物力学。以前分子生物力学的研究主要集中在蛋白质7(特别是细胞外基质蛋白胶原蛋白和弹性蛋白,因为它们对生物力学特性有影响),将体内成像生物力学与分子研究相结合的工作仅限于组织学和免疫组织化学。尽管这些方法可以产生许多分子指示剂,并且已经产生了 ECM 和细胞重塑的拟议机制,但它们通常分别局限于目前可用的染色剂或抗体。这个研究领域缺少大类分子,例如脂质。虽然这些分子类别可能在机制上参与也可能不参与,但了解由此产生的分子适应很重要,因为这些分子可能是诊断标志物和治疗的潜在靶标。可以应用分析化学技术,例如液相色谱-质谱 (LC-MS);然而,在这些技术中,分子的空间方向丢失了。通过质谱成像 (MSI),分子的空间分布保持不变,并且可以通过连续切片对多种分析物类型(分子类别)进行成像。MSI 是一种强大的分析工具,可用于研究生物组织中几乎所有类型分子的空间分布,包括代谢物、脂质、聚糖、肽和小分子量药物8。基质辅助激光解吸/电离 (MALDI) MSI 是一种 MSI,非常适合对 50-8000 Da 范围内的分子量进行基于发现的分析。MALDI-MSI 是一种电离技术,它将激光能量吸收基质应用于样品,以帮助电离目标分析物。这种方法可以防止局限于一个分子靶标,并且可以使用生物信息学工具来确定哪些分子对生物力学特性和重塑有影响。
四维超声 (4DUS) 是一种无创体内方法,可用于心脏的时间和空间表征。4DUS 利用来自不同平面的一系列高帧率电影循环,将它们编译成包含时间信息的 3D 数据集。这允许直接可视化和量化心腔在心动周期中复杂的 3D 形状变化,而无需依赖传统 2D 超声心动图所需的几何假设。4DUS 允许根据心脏的复杂形状和运动计算体内功能指标 9,10,而 MALDI MSI 允许对离体心脏组织内的生物分子进行空间研究 11。为了充分了解 CVD 患者心脏的改变,需要研究机械和分子机制。因此,提出了一种研究小鼠心脏病理生理学的组合方法,将 4DUS 成像和分析与心脏脂质的 MALDI MSI 相结合。这种方法在心肌梗死的小鼠模型中得到了证明。
血管生物力学在调节心血管功能方面也起着关键作用2。与衰老相关的血管硬化是 CVD12 的一个危险因素。血管中的生物力学和血流动力学变化可以使用超声成像。血管壁的分子组成是生物力学的重要组成部分,对血流动力学力也非常敏感。例如,振荡壁剪切应力与动脉粥样硬化斑块的发展有关3。随后将介绍老年动物的血管力学和血流动力学的初步数据。
该团队对各种疾病状态下生物力学与分子组成之间的关系感兴趣。临床前超声成像和 MSI 用于确定组织中分子变化的空间分布以及疾病进展过程中发生的相关生物力学变化。本报告详细描述了这些方法,并提供了有关心脏和头部/颈部脉管系统的初步数据。
研究方案
所描述的动物实验是在田纳西大学诺克斯维尔机构动物护理和使用委员会的批准下进行的。
1. 超声成像13
- 设置和动物准备
- 在开始实验之前,检查异氟醚麻醉水平并在必要时重新填充。在打开燃气之前检查氧气罐液位。称量木炭并将其记录在容器上。
- 通过在成像平台附近放置耗材来设置成像空间。用品包括预切胶带、脱毛膏、纱布、棉签、高压灭菌水、角膜润滑剂、润滑凝胶、直肠温度探头、电极导线、超声凝胶、电极凝胶(如果适用)和加热灯(图 1A)。
- 打开超声机并初始化电机(该系统还能够收集 4DUS 图像数据)。在超声系统上设置新实验:选择 New Study 或 New Series 并填写鼠标信息。打开平板电脑进行生理监测。
- 检查旋塞阀,确保液流对感应箱开放,对鼻锥关闭。通过在蒸发器上将氧气打开至 1 L/min 并将刻度盘旋转至 3%-5% 来预填充麻醉诱导箱。
- 从外壳固定架上卸下鼠标。
- 将鼠标放入诱导箱中,直到动物用 3%-5% 之间的异氟醚完全麻醉。
- 切换旋塞阀以改变流向超声成像板上鼻锥的流量。将异氟醚刻度盘旋转 1%-2%。
- 从感应箱中取出老鼠并称重动物。记录动物的体重。
- 将鼠标置于成像板上的仰卧位置。
- 将角膜润滑剂涂抹在动物的眼睛上。
- 如果存在毛皮,请使用市售的脱毛膏和棉签从成像区域去除毛皮。用海绵上的水擦去皮肤上的乳霜,以去除皮肤上多余的脱毛霜并防止烫伤。
- 根据动物的位置,将心电图 (ECG) 导联皮下插入胸部和后肢的两侧。
- 插入后,用胶带将 ECG 导联固定到位。如果不使用 ECG 导联(即未插入 ECG 导联),请通过动物成像板监测 ECG。
- 对于从皮肤到板的电传导,在板上找到导电凝胶并将动物肢体固定到位。
- 用胶带或松紧带将动物肢体固定到位,将其放在板周围和肢体上(图 1B)。
- 使用润滑凝胶插入直肠温度探头并用胶带固定探头。
- 检查平板电脑上的心电图、呼吸和温度信号。确保心率为 ~350-600 次/分,呼吸为 ~50-100 次/分钟,直肠温度在 35-37 °C 之间。 根据需要调整异氟醚水平。
- 如果需要,打开加热灯(例如,250 W 红外线加热灯泡)14 并调整高度以保持核心温度(图 1C)。
- 将加热灯放置在距离动物不超过 12 英寸的地方。对于确定球茎与动物之间最佳距离的初步研究,调整高度并使用红外测温仪记录皮肤温度,其温度不应超过 42 °C15。
- 心脏 4D 超声
- 将传感器放在半锁定位置的支架中。
- 将换能器上凸起的点与屏幕上的蓝点对齐。惯例是将点朝向动物的右侧放置。
- 转动换能器,使其沿鼠标的矢状面定向,并有一个凸起的缺口指向尾部方向。
- 使用超声板底部的杠杆使动物倾斜。使用换能器底部的控制杆调整换能器角度。
- 在胸腔的腹侧表面涂抹大量超声凝胶,以实现皮肤表面和换能器之间的声学耦合。确保在耦合之前没有残留的毛发。
- 降低换能器以与超声凝胶接触。
- 使用印版底部的 X/Y 旋钮进行微调,或移动整个印版进行大幅调整。
- 确保胸骨旁长轴视图包括心尖、左心室流出道和主动脉在屏幕上水平对齐,以获得更准确的短轴图像(图 2A、B)。
- 选择 名称图像 在下角,将图像保存到当前序列。
- 将换能器顺时针旋转 90° 以切换到胸骨旁短轴视图(图 2C)。
注意:为获得最佳 4D 图像质量,用户应尝试沿心室的胸骨旁长轴对齐步进电机,该长轴并不总是与胸骨直接平行。心脏/左心室通常呈左下角。 - 确保左心室在屏幕上可见,右心室在屏幕左侧(图 2D)。
- 如果鼠标有稳定的呼吸节律,请点击图像左上角的 心电图框 ,为 4D 图像打开呼吸门控。如果不稳定,请在后处理期间完成此步骤。
- 选择屏幕左上角的立方体以设置 4D 图像。
- 在调整传感器的 Start 和 Stop 位置之前重置传感器。
- 将 Start(开始 )位置调整到刚好低于心尖的位置,将 Stop 位置调整到主动脉弓。
- 将 “步长 ”设置为 0.08-0.13 毫米,将 “帧速率 ”设置为 200-300 Hz。
注意:较小的步长可能会为分析提供更好的图像分辨率,但会增加采集时间。如果以近乎完美的左心室对准收集数据,并且在分析过程中需要最少/不需要重新定位,则较大的步长是可以接受的。当与心率较高 (>450 bpm) 的动物一起工作时,请考虑提高帧速率。 - 在进行扫描之前,确保生命体征和心电图信号始终稳定(>350 bpm 和呼吸频率高于 50 次/分钟)。
- 扫描和处理完成后,打开 Save EKV/4D data for postprocessing 和 Respiration Gating (保存 EKV/4D 数据以进行后处理 和 呼吸门控 )。
- 选择右下角的 Name image(名称 图像),并在名称中包含鼠标 ID。
- 要检查图像质量,请点击 更多控件 并选择 加载到 4D.
- 查看心脏的每个平面视图,确保心脏中心在整个心动周期中不移动。中心移动表明心电图和/或呼吸门控的变化,因此使分析过程复杂化。重新调整显示器,并在必要时重复扫描。
- 心脏 4D 超声分析
- 导航到分析浏览器。将所有 B 型 2D 图像导出到 Vevo Lab,并将 4D 数据导出为其他文件类型,选择“.raw”数据格式到硬盘驱动器。
注意:这项工作中使用的 4D 图形用户界面工具箱目前尚未公开可用。要请求访问权限和详细说明,请联系普渡大学的 Craig Goergen 博士。 - 使用 VevoLab 软件完成 4D 数据的替代分析。要使用此框架,请将 4D 数据从机器导出到 Vevo Lab 文件。
- 导航到分析浏览器。将所有 B 型 2D 图像导出到 Vevo Lab,并将 4D 数据导出为其他文件类型,选择“.raw”数据格式到硬盘驱动器。
- 血管成像
- 对于颈动脉的 B 型图像,将超声换能器平行于颈动脉放置,靠近中线。
- 一旦颈动脉可见,将换能器向上移动以找到颈动脉分叉处。
- 当找到颈动脉分叉的清晰图像时,将增益设置调整为 35 dB 并捕获 B 型图像。
- 向左或向右倾斜换能器可能会改善图像。调整换能器或载物台的角度,使感兴趣的血管不直接与换能器平行。这允许多普勒角保持在 60° 以下。否则,可能需要 +/- 15° 偏移。
- 切换到 脉冲波多普勒模式 以获得速度测量值。
- 将样品体积放在容器的中心。调整光标的角度,使其与颈动脉平行。然后,点击 播放 开始速度测量并 保存 以记录它们。
- 对于颈静脉的 B 型图像,将超声换能器平行于颈静脉放置。颈静脉位于颈动脉的前部和外侧。
- 找到颈静脉后,将换能器移动到颈内外静脉融合的位置。找到清晰的图像后,将增益设置调整为 35 dB 并捕获 B 模式图像。
- 切换到 脉冲波多普勒 模式以获得速度测量值。
- 将样品体积放在容器的中心。调整光标角度,使其与颈静脉平行。然后,点击 播放 开始速度测量并 保存 以记录它们。
- 血管超声分析
- 收集 B 型图像和脉冲波多普勒测量值后,使用软件测量直径和速度。
- 将图像加载到软件中后,选择 vascular package。
- 选择容器的每一侧以获得完整直径。
- 对于颈动脉,使用血管包中的 diameter 选项进行收缩期和舒张期的直径测量。
- 使用血管包中的 速度 选项进行速度测量。
- 对于颈动脉,选择收缩期速度测量的最高峰和舒张期速度测量的最低峰。
- 使用以下方程使用直径值计算格林拉格朗日应变张量的圆周分量,
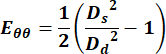 (1)
(1)
其中 Ds 代表收缩期的直径, Dd 代表舒张期的直径。 - 对于颈静脉,选择整个周期中的任何点以获得速度测量值。
2. 安乐死和组织采集
- 准备用于快速冷冻组织的铝箔船(图 3)。
- 在研究结束时,通过 5% 浓度的异氟醚过量和双侧气胸或颈椎脱位(仅限心脏研究)对动物实施安乐死。
- 使用镊子将皮肤固定住,用剪刀在脖子上剪下帐篷状的皮肤进行脉管系统检查,或在胸骨下方切割心脏。
- 切开皮肤和肌肉层以露出脉管系统,或切开骨头以露出心脏。
- 用棉签进行钝性解剖,将心脏或脉管系统与周围组织(包括脂肪)隔离开来。确保将颈动脉与神经分开。使用手术工具切除心脏和血管。
注意:在移除血管之前,可以通过缝合近端和远端来缝合脉管系统。 - 将组织放在预先标记的铝箔船上,并将船放入液氮中(图 3)。
- 将组织储存在 -80 °C 直至冷冻切片。用干冰运输组织以保持温度。
3. 质谱成像
- 载玻片上的冷冻切片和最佳切割温度 (OCT) 安装
- 将低温恒温器温度设置为 -25 °C 并插入刀片。
- 通过应用 OCT 并使其在低温恒温器中冻结来准备金属卡盘。
- 使用 OCT 将心脏底部固定到准备好的金属卡盘上(图 4A)。不要让 OCT 接触感兴趣的样品区域,因为 OCT 会污染质谱(聚乙二醇 [PEG] 污染)并抑制感兴趣的脂质信号。
注:可选择进行水镶嵌以避免样品污染。有关说明,请参阅下面的附加协议。 - 基于空间对齐在这种方法中的重要性,使用 MATLAB GUI 给出的心脏的缩放数字渲染来指导切片(图 4B)。
- 切片时计算每转 (10 μm),并记下要安装在载玻片上的每个切片的深度(以毫米为单位)。
注意:有必要跟踪心脏或脉管系统中的特定位置,以便与 MATLAB 提供的超声数据的数字渲染准确匹配。 - 将组织切片(10 μm 厚)解冻到显微镜载玻片上。
注:载玻片的类型取决于所使用的质谱仪。每张载玻片包括心脏每个区域的一个部分。至少需要三张玻片(正离子模式、负离子模式、额外)。 - 对于 n = 1/组,通过长轴切分心脏,以可视化从顶点到底部的分子变化。
- 对于脉管系统,将组织包埋在明胶中并在切片前快速冷冻11.
- 将载玻片存放在 -80°C 的载玻片邮件中,直到质谱成像实验。
- 如果进行液相色谱-质谱 (LC-MS) 以进一步鉴定和定量脂质或代谢物,请切开 ~60-100 μm 的连续组织切片,并在冷冻前将它们收集到 0.5-2 mL 试管中。
- 载玻片上的冷冻切片和水封片组织
- 用高效液相色谱 (HPLC) 水填充烧杯,并用 5 mL 和 1 mL 注射器放在一边。
- 将低温恒温器温度设置为 -25 °C 并插入刀片。
- 将一对镊子放入低温恒温器中冷却,然后再安装。
- 在注射器中吸取 5 mL HPLC 水,并将其放入低温恒温器中。
- 在注射器完全冷冻之前,将水倒到金属卡盘上并使其完全冻结。
- 吸取 1 mL HPLC 水,将注射器放入低温恒温器中。
- 大约 30-60 秒后,将一小点部分凝固的水放在卡盘的中心。立即用镊子抓住心脏,并在心脏完全冻结之前将其放入点中。将心脏固定在原位,直到周围的水完全结冰。
注意:心脏可以通过根尖或基部安装,具体取决于感兴趣的区域。对于这项研究,底座的安装将使顶点朝外。 - 执行此方法的其余步骤,如步骤 3.1 中所述。
- 矩阵应用
- 从冰箱中取出载玻片,并将其放入干燥器中,直到载玻片干燥。
- 打开 HTX M3+ 喷雾器,在笔记本电脑上打开 HTX 应用程序,选择屏幕中间 的方法 。标准基质浓度可以在存储的方法中找到(屏幕左侧的方法 > OI_usermethods >基质)。
- 对于这项工作,将喷嘴温度设置为 75 °C,流速设置为 100 μL/min,压力设置为 10 psi。
- 在实验室笔记本上写下样品名称、极性、基质、溶剂和浓度。计算每种浓度所需的基质量(例如,5 mL,10 mg/mL = 50 mg 基质)。
- 制备溶剂(例如,70% MeOH)。
- 对于这项工作,制备 40 mg/mL 2,5-二羟基苯甲酸 (DHB) 基质溶液用于正离子模式,10 mg/mL 9-氨基吖啶 (9AA) 基质溶液用于负离子模式。用 70% MeOH 溶剂制备两种基质。对于其他常见矩阵和喷涂参数,请按照步骤 3.3.2作。
- 称量基质并将基质加入 15 mL 锥形管中。确保金额接近步骤 3.3.3 中计算的所需金额,但不必精确。根据测得的质量计算溶剂量。
- 使用移液管将溶剂添加到锥形管中。
注:体积基于步骤 3.3.5 中测得的质量。 - 对混合物进行超声处理 10 分钟。在对基质进行超声处理时,从干燥器中取出玻片。
- 打开喷雾器托盘,将载玻片放在左下角,然后用胶带粘住边缘。
注意:折叠胶带的一端以便于拆卸。 - 选择 样品喷雾 区域。关闭纸盒。
- 使用注射器和过滤器,将基质倒入注射器中,然后通过注射器将基质过滤到喷雾器左侧有黑色盖子的样品瓶中。
- 将样品瓶放回喷雾器上的位置,然后将 D 线管插入样品瓶中。
注:确保试管未接触样品瓶底部,并完全浸入液体中。 - 打开惰性气体,确保喷雾器上的仪表读数为 10 psi。按 start(开始)。喷雾器达到所需温度后,选择闪烁 启动。
- 喷雾完成后,打开托盘,取出样品,然后将其放入 MALDI 载玻片支架或放回干燥器中(图 4C)。
- 扫描 MALDI 玻片架并在扫描仪上滑动,或用手机拍照。将图片保存在闪存驱动器上以用于 MSI。
- 在喷涂机上选择合适的 清洗 或 下一次喷涂 。如果清洗,请将 D 线从基质样品瓶移至废液烧杯中。
- 将甲醇喷洒在托盘上并擦拭以清洁。关闭氮气。
- 马尔迪 MSI
- 在计算机上,导航到 Synapt,检查极性是否更改为所需的模式,如果没有,则切换。
- 将玻片加载到仪器的 MALDI 源上,然后使用该软件单击计算机上的 加载 按钮。
- 将图像(步骤 1.2.17)移动到 Project 文件夹中的 Images 文件夹中。
- 导航到 HD Imaging 并打开上一个项目(使用相同矩阵的项目)。
- 在实验室笔记本中,记录质量范围、捕获和转移碰撞能量、激光能量、负/pos 模式。
- 在 HD Imaging 中,导航到白色页面图标。然后单击下拉箭头并选择 New plate(新板)。
- 浏览以在 Project folder > Images Folder 中找到图像并将其打开。
- 将印版类型更改为 MALDI 标准 并定义印版的边缘(选择下面显示的 4 个角,带有红色加号)。
注意:左上角的框用于导航到每个角落。右上角的框用于选择角。底部框仅用于可视化整个幻灯片。 - 导航到左上角的小 图案 选项卡,然后单击 铅笔 或其他矩形或圆形选项以勾勒组织轮廓。使用左键单击和右键单击完成组织轮廓。
- 像素大小默认为 50 μm。如有需要,请进行更改。
- 单击 “另存为 ”并导航到 “Project Imaging AcqFolder ”,并标记为幻灯片名称(YYYYMMDD 格式)。然后,保存。
- 单击顶部中间的 Mass Lynx 按钮以导出到 Mass Lynx。
- 导航到 Mass Lynx 软件。
- 单击 File >打开项目文件夹。将文件名和文本名称编辑到幻灯片(YYYYMMDD 格式)。
- 右键单击 MS 文件,浏览并选择当前幻灯片。
- 再次右键单击 MS 文件,然后单击 Edit。双击蓝色框。
- 导航到扫描条件。查找源设置并更改为 user-defined。然后导航到当前 幻灯片>>获取的文件夹的正确项目文件夹>确定。
- 单击 Save as 并包含幻灯片名称进行保存。
- 使用参比化合物(例如红磷)校准仪器
- 导航到 Synapt (Calibrate)。单击 play 按钮开始采集数据。标记为 YYYYMMDD_cal1(例如:20230614_cal1)。
- 确保它具有相同的质量范围 50 - 2000。激光能量约为 175。
- 点击 fire laser play,然后单击 下一个 按钮。让它运行到大约 15 或 20 度。单击 红色停止。
- 导航到 W 控制台。
- 创建校准并单击 start。在 calibration profile editor(校准配置文件编辑器)下,单击 file > new(新建文件)。键入 YYYYMMDD_cal1。
- 将质量范围编辑为项目所需的质量范围(例如,50-2000)。
- 选择 manual calibration(手动校准)。选择 resolution mode (分辨率模式 ),然后单击 edit (编辑)。选择 红磷 作为参比化合物。
- 单击原始数据文件,然后滚动到最底部(它应该是刚刚获取的内容)。
- 转到底部的历史记录,选择 Acc mass > okay > okay。
- 继续点击 下一步 和 确定 直到看到 开始 按钮,然后点击 开始.
- 导航到绿色复选标记并查看未找到的峰。
- 导航到 Mass Lynx(开始实验样品的实际运行)。
- 点击 播放 按钮并检查样本数量是否正确
- 导航到 HD 成像。
- 检查以确保像素大小仍为最初设置的大小
- 导航到 Synapt 以检查极性。
- 单击 相机 按钮以确保它正在移动并发射激光。
- 检查并确保它正在收集数据。采集的质谱应显示在 Synapt 页面上。
- MS 分析
- 使用 HD 成像软件和 Mass Lynx 进行分析。
- 使用 HD Imaging 中的 Process 选项卡处理成像数据。
- 在 Analysis 选项卡的 HD Imaging 中可视化分子离子图像,也称为 MS 图像。分子离子图像的热图描述了该 m/z 离子在一个区域上的强度(图 5)。使用 MS 图像的叠加显示分子的空间分布(图 6 和 图 7)。
- 使用 TIC 或适当的标准化进行成像对数据进行标准化。
- 识别在空间上与感兴趣区域相关的 m/z 峰。在 HD Imaging 上运行空间相关性 (R > 0.65) 以识别共定位峰。
- 使用 LipidMaps16 和 METASPACE17 搜索这些峰的推定脂质鉴定。
- 使用后续的 LC-MS 数据确认脂质注释。使用 MetaboAnalyst 对 LC-MS 数据进行统计分析。
结果
上述影像学方案用于两项初步研究: 心肌梗死 (MI) 重塑和血管老化。对于心脏实验,进行了永久性冠状动脉结扎手术以诱导急性心肌梗死18,19。对同一组织进行 4D 超声和 MALDI MSI,揭示生理和分子变化。梗塞心脏中的代表性分子离子图像如图 5 所示。m/z 577.52 已被推定为 Cohibin C 或 D。尽管分析物鉴定需?...
讨论
超声成像可能取决于作者,但使用解剖标志和充分的培训可以限制用户偏倚。2D 超声特别容易受到用户间差异的影响,因为视图与角度有关,而 4DUS 则不太容易受到影响,因为采集包含整个体积并且与角度无关。还确定,由于可调节的动物平台和换能器支架,图像再现性更容易实现。理想情况下,美国数据收集应在整个研究过程中由同一研究人员进行,以防止技术衍生的...
披露声明
Craig J. Goergen 是 FUJIFILM VisualSonics 的付费顾问。
致谢
艾莉森·琼斯得到了田纳西大学机械、航空航天和生物医学工程系研究生奖学金的支持。本出版物 (Conner Earl) 中报告的研究得到了美国国立卫生研究院 F30HL162452 国家心肺血液研究所的支持。内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。
材料
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
参考文献
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274 (1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738 (2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570 (2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100 (2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C., Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530 (1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728 (2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839 (2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006 (2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720 (2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。