Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Мультимодальное исследование мышиного сердечно-сосудистого ремоделирования: четырехмерная ультразвуковая и масс-спектрометрическая визуализация
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной статье мы описываем протокол использования четырехмерной ультразвуковой визуализации in vivo и масс-спектрометрической визуализации ex vivo для оценки биомеханических и биомолекулярных изменений в сердечно-сосудистой системе мышей. Этот метод применяется для анализа ремоделирования сердца при хирургически индуцированном инфаркте миокарда и сосудистых изменениях у стареющих животных.
Аннотация
Сердечно-сосудистые заболевания (ССЗ) являются основной причиной смерти в Соединенных Штатах. Повреждение сердечно-сосудистой системы может быть вызвано воздействием окружающей среды, травмой, токсичностью лекарств или многими другими факторами. В результате сердечная ткань и сосудистая сеть претерпевают структурные изменения и демонстрируют сниженную функцию. Повреждение и последующее ремоделирование могут быть обнаружены и количественно оценены с помощью ультразвуковой визуализации (УЗИ) на уровне органов и масс-спектрометрической визуализации (MSI) на молекулярном уровне. В данной рукописи описывается инновационная методология изучения патофизиологии сердца мышей, сочетающая четырехмерную (4D) ультразвуковую визуализацию и анализ in vivo с матричной лазерной десорбцией/ионизацией (MADLI) MSI сердца. 4D-ультразвук может обеспечить динамические объемные измерения, включая радиальное смещение, деформацию площади поверхности и продольную деформацию на протяжении всего сердечного цикла. В сосудистой системе MSI и ультразвук используются для оценки состава стенки сосуда, гемодинамики и динамики стенки сосуда. Методология может быть адаптирована для изучения множества сердечно-сосудистых заболеваний путем корректировки функциональных показателей и/или изменения протокола MALDI MSI для нацеливания на конкретные молекулы. MALDI MSI можно использовать для изучения липидов, малых метаболитов, пептидов и гликанов. В этом протоколе описывается использование MALDI MSI для нецелевого липидомного анализа и использование ультразвуковой визуализации для сердечно-сосудистой гемодинамики и биомеханики.
Введение
Сердечно-сосудистые заболевания (ССЗ) являются одной из ведущих причин смертности во всем мире1. Профилактика и лечение ССЗ требуют глубокого понимания молекулярных адаптаций к биомеханическим силам и результирующим изменениям механических свойств. Во всей сердечно-сосудистой системе биомеханические силы играют важную роль в функционировании и структуре тканей2. Эти силы влияют на механические свойства сердечно-сосудистой (CV) ткани, что делает их показателями здоровья и болезни 3,4,5,6. Для профилактики, диагностики и лечения ССЗ крайне важно разработать методы понимания и наблюдения за процессами инициации и прогрессирования заболевания. Биомедицинская визуализация играет ключевую роль в получении физиологических и механистических знаний, и постоянно разрабатываются новые технологии визуализации и методы анализа. Этот протокол демонстрирует методологию объединения двух методов визуализации и анализа сердечно-сосудистой системы для проверки потенциала этих методов визуализации при ишемической болезни сердца и сосудистом старении.
Исследователи в области биомеханики часто подходят к изучению биомеханики с помощью комбинации методов in vivo, ex vivo и in silico . Предыдущие исследования в области молекулярной биомеханики были сосредоточены в основном на белках7 (в частности, на белках внеклеточного матрикса коллагене и эластине из-за их влияния на биомеханические свойства), а работа по объединению биомеханики визуализации in vivo с молекулярными исследованиями была ограничена гистологией и иммуногистохимией. Несмотря на то, что эти подходы могут дать множество молекулярных индикаторов и привести к предполагаемым механизмам ремоделирования ВКМ и клеток, они, как правило, ограничены доступными в настоящее время красителями или антителами соответственно. В этой области исследований отсутствуют большие классы молекул, например, липиды. В то время как эти молекулярные классы могут быть или не быть задействованы механистически, результирующие молекулярные адаптации важно понимать, потому что эти молекулы могут быть потенциальными мишенями как для диагностических маркеров, так и для терапевтических средств. Могут применяться методы аналитической химии, такие как жидкостная хроматография-масс-спектрометрия (ЖХ-МС); Однако пространственная ориентация молекул в этих методах теряется. С помощью масс-спектрометрической визуализации (MSI) пространственное распределение молекул остается неизменным, и можно визуализировать несколько типов аналитов (классов молекул) с помощью последовательных срезов. MSI является мощным аналитическим инструментом для исследования пространственного распределения почти всех типов молекул в биологических тканях, включая метаболиты, липиды, гликаны, пептиды и низкомолекулярные препараты8. Матричная лазерная десорбция/ионизация (MALDI) MSI — это тип MSI, который хорошо подходит для анализа молекулярных масс в диапазоне 50-8000 Да. MALDI-MSI — это метод ионизации, который применяет лазерную поглощающую энергию матрицу к образцу для помощи в ионизации исследуемых аналитов. Этот подход позволяет избежать ограничения одной молекулярной мишенью и может использовать инструменты биоинформатики для определения того, какие молекулы влияют на биомеханические свойства и ремоделирование.
Четырехмерное ультразвуковое исследование (4DUS) является неинвазивным методом in vivo, полезным как для временной, так и для пространственной характеристики сердца. 4DUS использует серию киноциклов с высокой частотой кадров из разных плоскостей, компилируя их в 3D-набор данных, который включает временную информацию. Это позволяет напрямую визуализировать и количественно оценить сложные 3D-изменения формы камер сердца в течение сердечного цикла, не полагаясь на геометрические предположения, как это требуется для традиционной 2D-эхокардиографии. 4DUS позволяет рассчитывать функциональные метрики in vivo на основе сложной формы и движения сердца 9,10, а MALDI MSI позволяет проводить пространственные исследования биологических молекул в сердечной ткани ex vivo11. Чтобы полностью понять изменения в сердце при сердечно-сосудистых заболеваниях, необходимо исследовать как механические, так и молекулярные механизмы. Таким образом, предложена комбинированная методология изучения патофизиологии сердца мышей, сочетающая визуализацию и анализ 4DUS с MALDI MSI липидов в сердце. Эта методология продемонстрирована на мышиной модели инфаркта миокарда.
Биомеханика сосудов также играет решающую роль в регулировании сердечно-сосудистой функции2. Жесткость сосудов, связанная со старением, является фактором риска развития ССЗ12. Биомеханические и гемодинамические изменения в сосудах могут быть визуализированы с помощью ультразвука. Молекулярный состав стенок сосудов является важным компонентом биомеханики и также чрезвычайно чувствителен к гемодинамическим силам. Например, колебательное напряжение сдвига стенки было вовлечено в развитие атеросклеротической бляшки3. Предварительные данные по механике сосудов и гемодинамике у пожилых животных будут представлены позже.
Команду интересует взаимосвязь между биомеханикой и молекулярным составом при различных заболеваниях. Доклиническая ультразвуковая визуализация и MSI используются для определения пространственного распределения молекулярных изменений в ткани и связанных с ними биомеханических изменений, которые происходят во время прогрессирования заболевания. В данном отчете подробно описаны эти методологии и представлены предварительные данные о сердце и сосудистой сети головы/шеи.
протокол
Описанные эксперименты на животных проводятся с одобрения Университета Теннесси, Комитета по уходу за животными и их использованию в Ноксвилле.
1. Ультразвуковая визуализация13
- Настройка и подготовка животных
- Перед началом эксперимента проверьте уровень изофлурановой анестезии и при необходимости пополните дозу. Проверьте уровень кислорода в баллоне перед включением газа. Взвесьте древесный уголь и запишите его на контейнере.
- Обустройте пространство для визуализации, разместив расходные материалы рядом с платформой для визуализации. Расходные материалы включают предварительно разрезанную ленту, крем для депиляции, марлю, ватные палочки, автоклавную воду, смазку роговицы, смазывающий гель, ректальный температурный зонд, электродные провода, ультразвуковой гель, электродный гель (если применимо) и тепловую лампу (Рисунок 1A).
- Включите ультразвуковой аппарат и инициализируйте мотор (система также способна собирать данные изображения 4DUS). Настройте новый эксперимент на ультразвуковой системе: выберите «Новое исследование » или «Новая серия» и заполните информацию о мыши. Включите планшет для физиологического мониторинга.
- Проверьте запорный кран, чтобы убедиться, что поток открыт к индукционной коробке и закрыт к носовому конусу. Предварительно заполните индукционную коробку для анестезии, включив кислород до 1 л/мин на испарителе и повернув регулятор на 3%-5%.
- Извлеките мышь из каркаса корпуса.
- Поместите мышь в индукционную коробку до тех пор, пока животное не будет полностью обезболено изофлураном в пределах 3%-5%.
- Переключите запорный кран, чтобы изменить подачу потока к носовому обтекателю на ультразвуковой пластине. Поверните регулятор изофлурана в диапазоне 1%-2%.
- Извлеките мышь из индукционной коробки и взвесьте животное. Запишите вес животного.
- Поместите мышь в положение лежа на спине на пластине для визуализации.
- Нанесите на глаза животного смазку роговицы.
- Если мех присутствует, удалите его из области визуализации с помощью имеющегося в продаже крема для депиляции и ватных палочек. Сотрите крем с кожи водой на губках, чтобы удалить излишки крема для депиляции с кожи и предотвратить ожоги.
- Электрокардиографию (ЭКГ) вводят подкожно с обеих сторон грудной клетки и задней конечности, в зависимости от положения животного.
- После установки удерживайте отведения ЭКГ на месте с помощью ленты. Если отведения ЭКГ не используются (т. е. отведения ЭКГ не вставлены), контролируйте ЭКГ с помощью планшета для визуализации животного.
- Для обеспечения электрической проводимости от кожи к пластине найдите проводящий гель на пластине и удерживайте конечности животного в нужном положении.
- Удерживайте конечности животного на месте с помощью ленты или эластичной ленты, размещенной вокруг пластины и над конечностями (рисунок 1B).
- С помощью смазывающего геля введите ректальный температурный зонд и закрепите зонд лентой.
- Проверяйте сигналы ЭКГ, дыхания и температуры на планшете. Убедитесь, что частота сердечных сокращений составляет ~350-600 ударов в минуту, дыхание ~50-100 вдохов/мин и ректальная температура в пределах 35-37 °C. При необходимости корректируйте уровни изофлурана.
- При необходимости включите нагревательную лампу (например, инфракрасную нагревательную лампу мощностью 250 Вт)14 и отрегулируйте высоту для поддержания внутренней температуры (рис. 1C).
- Размещайте тепловую лампу не ближе 12 дюймов от животного. Для первоначальных исследований для определения оптимального расстояния между луковицей и животным отрегулируйте высоту и зарегистрируйте температуру кожи с помощью инфракрасного термометра, которая не должна превышать 42 °С15.
- Ультразвуковое исследование сердца 4D
- Поместите преобразователь в держатель в полузаблокированное положение.
- Сориентируйте выпуклую точку на преобразователе с помощью синей точки на экране. Принято располагать точку справа от животного.
- Поверните преобразователь так, чтобы он был ориентирован вдоль сагиттальной плоскости мыши с приподнятой выемкой, направленной в каудальном направлении.
- Используйте рычаг в основании ультразвуковой пластины, чтобы наклонить животное. Используйте рычаг в основании датчика для регулировки угла наклона датчика.
- Нанесите обильное количество геля для ультразвука на вентральную поверхность грудной полости для акустической связи между поверхностью кожи и датчиком. Перед спариванием убедитесь, что на нем не осталось шерсти.
- Опустите датчик так, чтобы он соприкоснулся с гелем для ультразвука.
- Выполняйте микрорегулировки с помощью ручек X/Y в основании пластины или перемещайте всю пластину для больших регулировок.
- Убедитесь, что парастернальный вид по длинной оси включает верхушку, выходной тракт левого желудочка и аорту, выровненные горизонтально на экране для получения более точного изображения по короткой оси (рис. 2A, B).
- Выберите «Имя изображения » в нижнем углу, чтобы сохранить изображение в текущей серии.
- Поверните преобразователь на 90° по часовой стрелке, чтобы переключиться на парастернальный вид по короткой оси (рис. 2C).
ПРИМЕЧАНИЕ: Для достижения наилучшего качества изображения 4D пользователи должны попытаться выровнять шаговый двигатель вдоль парастернальной длинной оси желудочка, которая не всегда прямо параллельна грудине. Сердце/ЛЖ часто находится под левым углом вниз. - Убедитесь, что левый желудочек виден с правой стороны экрана, а правый желудочек — с левой стороны экрана (рисунок 2D).
- Если мышь имеет стабильный дыхательный ритм, нажмите на поле ЭКГ в верхнем левом углу изображения, чтобы включить регулирование дыхания для 4D-изображения. Если ситуация не стабильна, выполните этот шаг во время постобработки.
- Выберите куб в левом верхнем углу экрана, чтобы настроить 4D-изображение.
- Сбросьте датчик перед регулировкой положений запуска и остановки датчика.
- Отрегулируйте Начальное положение чуть ниже вершины, а Стоповое положение — на дугу аорты.
- Установите Размер шага на 0,08-0,13 мм и Частоту кадров на 200-300 Гц.
ПРИМЕЧАНИЕ: Меньшие размеры шага могут обеспечить лучшее разрешение изображения для анализа, но увеличат время сбора. Большие размеры шага приемлемы, если данные собираются с почти идеальным выравниванием левого желудочка и минимальная переориентация во время анализа не требуется. Рассмотрите возможность увеличения частоты кадров при работе с животными с более высокой частотой сердечных сокращений (>450 уд/мин). - Перед началом сканирования убедитесь, что жизненно важные показатели и сигнал ЭКГ стабильны (>350 уд/мин и дыхание выше 50 уд/мин).
- После завершения сканирования и обработки включите параметр Сохранить данные EKV/4D для постобработки и Стробирование дыхания .
- Выберите «Имя изображения» в правом нижнем углу и укажите идентификатор мыши в имени.
- Чтобы проверить качество изображения, нажмите «Дополнительные элементы управления » и выберите «Загрузить в 4D».
- Просмотрите каждый вид сердца в плоскости, убедившись, что центр сердца не перемещается на протяжении сердечного цикла. Движение центра указывает на вариабельность ЭКГ и/или респираторного стробирования и, таким образом, усложняет процесс анализа. Повторно настройте мониторы и при необходимости повторите сканирование.
- Ультразвуковой анализ сердца 4D
- Перейдите в браузер обучения. Экспортируйте все 2D-изображения B-Mode в Vevo Lab и экспортируйте 4D-данные как файлы другого типа, выбрав формат данных «.raw» на жесткий диск.
ПРИМЕЧАНИЕ: Набор инструментов 4D графического пользовательского интерфейса, используемый в этой работе, в настоящее время не является общедоступным. Чтобы получить доступ и получить подробные инструкции, обратитесь к доктору Крейгу Гёргену из Университета Пердью. - Проведите альтернативный анализ 4D-данных с помощью программного обеспечения VevoLab. Чтобы использовать эту платформу, экспортируйте 4D-данные со станка в файлы Vevo Lab.
- Перейдите в браузер обучения. Экспортируйте все 2D-изображения B-Mode в Vevo Lab и экспортируйте 4D-данные как файлы другого типа, выбрав формат данных «.raw» на жесткий диск.
- Визуализация сосудов
- Для получения изображений сонных артерий в режиме B поместите ультразвуковой преобразователь параллельно сонным артериям, рядом со срединной линией.
- Как только сонная артерия станет видимой, переместите датчик вверх, чтобы найти бифуркацию сонной артерии.
- Когда будет обнаружено четкое изображение бифуркации сонной артерии, отрегулируйте настройку усиления на 35 дБ и запишите изображение в B-режиме.
- Наклон преобразователя влево или вправо может улучшить изображение. Отрегулируйте угол наклона датчика или предметного столика таким образом, чтобы интересующий сосуд не был прямо параллелен датчику. Это позволяет удерживать угол доплера ниже 60°. В противном случае может потребоваться смещение на +/- 15°.
- Переключитесь в импульсно-волновой режим доплера для получения измерений скорости.
- Поместите объем образца в центр сосуда. Отрегулируйте угол наклона курсора так, чтобы он был параллелен сонной артерии. Затем нажмите кнопку воспроизведения , чтобы начать измерения скорости, и сохраните для их записи.
- Для получения изображения яремных вен в режиме B поместите ультразвуковой датчик параллельно яремным венам. Яремные вены расположены спереди и латеральнее сонных артерий.
- Как только яремная вена будет обнаружена, переместите датчик в место, где сливаются внутренняя и внешняя яремные вены. Когда будет найдено четкое изображение, отрегулируйте настройку усиления на 35 дБ и захватите изображение в B-режиме.
- Переключитесь в режим импульсно-волнового доплера для получения измерений скорости.
- Поместите объем образца в центр сосуда. Отрегулируйте угол наклона курсора так, чтобы он был параллелен яремной вене. Затем нажмите кнопку воспроизведения , чтобы начать измерения скорости, и сохраните для их записи.
- Ультразвуковой анализ сосудов
- После сбора изображений в B-режиме и измерений импульсно-волнового доплеровского излучения измерьте диаметры и скорости с помощью программного обеспечения.
- После того, как изображения загружены в программное обеспечение, выберите сосудистый пакет.
- Выберите каждую сторону сосуда, чтобы получить полный диаметр.
- Для сонной артерии проводят измерения диаметра в систоле и диастоле с помощью опции диаметра в сосудистом пакете.
- Выполните измерение скорости с помощью опции velocity в сосудистом пакете.
- Для сонной артерии выберите самый высокий пик для измерения скорости в систоле и самый низкий пик для измерения скорости в диастоле.
- Используйте значения диаметров для вычисления окружной составляющей тензора деформации Зеленого Лагранжа с помощью следующего уравнения:
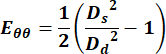 (1)
(1)
где Ds представляет диаметр во время систолы, а Dd представляет диаметр во время диастолы. - Для яремной вены выберите любые точки на протяжении цикла, чтобы получить измерение скорости.
2. Эвтаназия и забор тканей
- Подготовьте лодочки из алюминиевой фольги для мгновенной заморозки тканей (рисунок 3).
- В конце исследования усыпить животное путем передозировки изофлурана в 5% концентрации и либо двустороннего пневмоторакса, либо вывиха шейки матки (только для исследования сердца).
- Используя щипцы для наложения тента на кожу, разрежьте тентованную кожу ножницами над шеей для сосудистой сети или чуть ниже грудины для сердечной системы.
- Разрежьте кожу и мышечные слои, чтобы обнажить сосудистую сеть, или разрежьте кость, чтобы обнажить сердце.
- С помощью тупого рассечения ватными тампонами изолируйте сердце или сосудистую сеть от окружающих тканей, в том числе от жира. Обязательно отделите сонный сосуд от нерва. Удалите сердце и сосуды с помощью хирургических инструментов.
ПРИМЕЧАНИЕ: Швы могут быть использованы для удаления сосудистой сети путем наложения швов проксимального и дистального отделов перед удалением сосудов. - Поместите салфетку на предварительно маркированную лодку из алюминиевой фольги и поместите лодку в жидкий азот (рисунок 3).
- Хранить ткань при температуре -80 °C до момента проведения криосекции. Транспортируйте ткань сухим льдом для поддержания температуры.
3. Масс-спектрометрическая визуализация
- Монтаж криосекции и оптимальной температуры резки (OCT) на предметных стеклах
- Установите температуру криостата на -25 °C и вставьте лезвие.
- Подготовьте металлический патрон, применив ОКТ и дав ему застыть в криостате.
- Закрепите основание сердца на подготовленном металлическом патроне с помощью ОКТ (рисунок 4А). Не позволяйте ОКТ касаться исследуемой области образца, так как ОКТ загрязнит масс-спектры (загрязнение полиэтиленгликолем [ПЭГ]) и подавит липидные сигналы, представляющие интерес.
ПРИМЕЧАНИЕ: Возможность выполнения монтажа в воде во избежание загрязнения образца. Инструкции см. в дополнительном протоколе ниже. - Исходя из важности пространственного выравнивания в данной методологии, используйте масштабированную цифровую визуализацию сердца, полученную с помощью графического интерфейса MATLAB, для управления секционированием (рис. 4B).
- Подсчитайте каждый оборот (10 мкм) во время секционирования и запишите глубину в миллиметрах для каждого среза, который будет установлен на предметном стекле.
ПРИМЕЧАНИЕ: Необходимо отслеживать конкретные места в сердце или сосудистой сети для точного соответствия цифровому рендерингу ультразвуковых данных, предоставляемых MATLAB. - Размораживающие срезы тканей (толщиной 10 мкм) наклейте на предметные стекла микроскопа.
ПРИМЕЧАНИЕ: Тип предметных стекол будет зависеть от используемого масс-спектрометра. Каждый слайд включает в себя по одному разделу от каждой области сердца. Требуется минимум три предметных стекла (режим положительных ионов, режим отрицательных ионов, дополнительный). - Для n = 1/группа разрежьте сердце по длинной оси, чтобы визуализировать молекулярные изменения от вершины к основанию.
- Для сосудистой системы погрузите ткань в желатин и мгновенно заморозьте перед разрезанием11.
- Храните слайды в почтовых ящиках при температуре -80°C до проведения экспериментов по масс-спектрометрической визуализации.
- При проведении жидкостной хроматографии-масс-спектрометрии (ЖХ-МС) для дальнейшей идентификации и количественного определения липидов или метаболитов, срезы серийных тканей размером ~60-100 мкм и сбор их в пробирки объемом 0,5-2 мл перед замораживанием.
- Криосекция и монтажная ткань для монтажа воды на стеклянные предметные стекла
- Наполните стакан водой для высокоэффективной жидкостной хроматографии (ВЭЖХ) и отставьте в сторону шприцами объемом 5 мл и 1 мл.
- Установите температуру криостата на -25 °C и вставьте лезвие.
- Поместите пару щипцов в криостат для охлаждения перед установкой.
- Наберите в шприц 5 мл воды ВЭЖХ и поместите ее в криостат.
- Непосредственно перед тем, как шприц полностью замерзнет, вылейте воду на металлический патрон и дайте ему полностью замерзнуть.
- Наберите 1 мл воды для ВЭЖХ и поместите шприц в криостат.
- Примерно через 30-60 секунд поместите небольшую точку частично застывшей воды в центр патрона. Немедленно захватите сердце щипцами и поместите его в точку, пока оно полностью не замерзло. Удерживайте сердце на месте до тех пор, пока окружающая вода полностью не замерзнет.
ПРИМЕЧАНИЕ: Сердце может быть установлено на вершине или основании, в зависимости от области интереса. Для этого исследования основание будет установлено вершиной наружу. - Выполните остальные шаги для этого метода, описанные в шаге 3.1.
- Матричное приложение
- Достаньте предметное стекло из морозильной камеры и поместите его в эксикатор, пока предметное стекло не высохнет.
- Включите распылитель HTX M3+, откройте приложение HTX на ноутбуке и выберите метод в центре экрана. Стандартные концентрации матрицы можно найти в хранимых методах (методы в левой части экрана > OI_usermethods > матрицы).
- Для этой работы установите температуру сопла на 75 °C, расход на 100 μл/мин и давление на 10 фунтов на квадратный дюйм.
- Запишите название образца, полярность, матрицу, растворитель и концентрацию в лабораторном блокноте. Рассчитайте необходимое количество матрицы на одну концентрацию (например, 5 мл при 10 мг/мл = 50 мг матрицы).
- Сделайте растворитель (например, 70% MeOH).
- Для этой работы готовят матричный раствор 2,5-дигидроксибензойной кислоты (ДГВ) в дозе 40 мг/мл для положительного режима и матричный раствор 9-аминоакридина (9АА) в дозе 10 мг/мл для отрицательного режима. Сделайте обе матрицы с 70% растворителем MeOH. Для других распространенных матриц и параметров распыления выполните шаги 3.3.2.
- Взвесьте матрицу и добавьте матрицу в коническую трубку объемом 15 мл. Убедитесь, что сумма близка к требуемой сумме, рассчитанной на шаге 3.3.3, но не обязательно должна быть точной. Рассчитайте количество растворителя на основе измеренной массы.
- Добавьте растворитель в коническую трубку с помощью пипетки.
ПРИМЕЧАНИЕ: Объем основан на массе, измеренной на шаге 3.3.5. - Обработать смесь ультразвуком в течение 10 минут. Во время обработки матрицы ультразвуковой обработкой снимите предметное стекло с эксикатора.
- Откройте лоток распылителя, поместите предметное стекло в нижний левый угол и заклейте края скотчем.
ПРИМЕЧАНИЕ: Загните один конец ленты для легкого снятия. - Выберите область распыления образца . Закройте лоток.
- С помощью шприца и фильтра налейте матрицу в шприц, затем отфильтруйте матрицу через шприц во флакон с черной крышкой с левой стороны распылителя.
- Поместите флакон обратно на свое место на распылителе и вставьте трубку D-line в флакон.
ПРИМЕЧАНИЕ: Убедитесь, что пробирка не касается дна флакона и полностью погружена в жидкость. - Включите инертный газ и убедитесь, что манометр на распылителе показывает давление 10 фунтов на квадратный дюйм. Нажмите «Пуск». Как только распылитель достигнет желаемой температуры, выберите запуск мигания.
- После завершения распыления откройте лоток, извлеките образец и поместите его в держатель предметных колпаков MALDI или обратно в эксикатор (Рисунок 4C).
- Отсканируйте держатель слайда MALDI и сдайте слайд на сканере или сделайте снимок с помощью телефона. Сохраните снимок на флешке для использования с MSI.
- Выберите подходящий моющий или следующий распылитель на распылитель. Переместите D-line из матричного флакона в стакан для отходов при стирке.
- Распылите метанол на поднос и протрите до очистки. Отключите азот.
- МАЛДИ МСИ
- На компьютере перейдите в Synapt, убедитесь, что полярность изменена на нужный режим, и переключитесь, если нет.
- Загрузите слайд в прибор на источник MALDI и нажмите кнопку загрузки на компьютере с помощью программного обеспечения.
- Переместите изображение (шаг 1.2.17) в папку Изображения в папке Проект .
- Перейдите в раздел HD Imaging и откройте предыдущий проект (в котором используется та же матрица).
- В лабораторном блокноте записывайте диапазон масс, энергию захвата и переноса столкновений, энергию лазера, режим neg/pos.
- В HD Imaging перейдите к белому значку страницы. Затем нажмите на стрелку выпадающего списка и выберите новую пластину.
- Найдите изображение в папке «Проект» > папке «Изображения » и откройте его.
- Измените тип пластины на MALDI Standard и определите кромки пластины (выберите 4 угла, которые показаны ниже с красными знаками плюс).
ПРИМЕЧАНИЕ: Верхнее левое поле предназначено для навигации к каждому углу. Правое верхнее поле предназначено для выбора углов. Нижний блок предназначен только для визуализации всего слайда. - Перейдите на маленькую вкладку с узором в верхнем левом углу и нажмите на карандаш или другой прямоугольник или круг, чтобы обвести ткань. Обведите ткань левыми щелчками мыши и правой кнопкой мыши, чтобы закончить.
- Размер пикселя по умолчанию равен 50 мкм. При необходимости внесите изменения.
- Нажмите кнопку Сохранить как и перейдите в папку Project Imaging AcqFolder и пометьте как имя слайда (формат ГГГГММДД). Затем сохраните.
- Нажмите кнопку Mass Lynx в верхней части посередине, чтобы экспортировать в Mass Lynx.
- Перейдите к программному обеспечению Mass Lynx.
- Нажмите « Файл» > откройте папку проекта. Отредактируйте имя файла и текстовое имя слайда (формат ГГГГММДД).
- Щелкните правой кнопкой мыши по MS-файлу, просмотрите и выберите текущий слайд.
- Щелкните правой кнопкой мыши еще раз на MS файле и нажмите «Редактировать». Дважды щелкните левой кнопкой мыши по синему прямоугольнику.
- Перейдите к условиям сканирования. Найдите исходные настройки и измените их на пользовательские. Затем перейдите к нужной папке проекта > полученной папке > текущим слайдом > ОК.
- Сохраните, нажав на кнопку «Сохранить как » и указав название слайда.
- Откалибруйте прибор с использованием эталонного соединения (например, красного фосфора)
- Перейдите в Synapt (Калибровать). Нажмите кнопку воспроизведения , чтобы начать сбор данных. Пометьте как YYYYMMDD_cal1 (например, 20230614_cal1).
- Убедитесь, что он имеет одинаковый диапазон масс 50 - 2000. Энергия лазера может составлять около 175.
- Нажмите кнопку «Выстрел лазером», затем нажмите кнопку «Далее ». Дайте ему поработать примерно до 15 или 20. Нажмите красный стоп.
- Перейдите к консоли W.
- Создайте калибровку и нажмите «Пуск». В редакторе профилей калибровки нажмите кнопку Файл > создать. Тип YYYYMMDD_cal1.
- Отредактируйте диапазон масс в соответствии с желаемым диапазоном масс для проекта (например, 50-2000).
- Выберите ручную калибровку. Выберите режим разрешения и нажмите редактировать. Выберите красный фосфор в качестве эталонного соединения.
- Нажмите на файл с исходными данными и прокрутите вниз (это должно быть то, что было только что получено).
- Зайдите в историю внизу, выберите Acc mass > ладно > окей.
- Продолжайте нажимать кнопку «Далее » и «ОК», пока не появится кнопка «Пуск », и нажмите «Пуск».
- Перейдите к зеленой галочке и посмотрите, какие вершины не были найдены.
- Перейдите в раздел Mass Lynx (Начните фактический запуск экспериментальных образцов).
- Нажмите кнопку воспроизведения и проверьте правильность количества сэмплов
- Перейдите в раздел Создание изображений в формате HD.
- Убедитесь, что размер пикселя по-прежнему соответствует первоначально установленному
- Перейдите в Synapt, чтобы проверить полярность.
- Нажмите кнопку камеры , чтобы убедиться, что она движется и стреляет лазером.
- Проверьте и убедитесь, что он собирает данные. Полученный масс-спектр должен быть отображен на странице Synapt.
- Анализ МС
- Для анализа используйте программное обеспечение HD Imaging и Mass Lynx.
- Обрабатывайте данные изображения с помощью вкладки «Обработка» в HD Imaging.
- Визуализируйте изображения молекулярных ионов, также называемые изображениями MS, в HD Imaging на вкладке Анализ . Тепловая карта изображения молекулярного иона отображает интенсивность этого m/z иона в определенной области (рис. 5). Используйте наложения изображений MS, чтобы показать пространственное распределение молекул (Рисунок 6 и Рисунок 7).
- Нормализация данных с помощью TIC или соответствующей нормализации для визуализации.
- Определите m/z пики, которые пространственно коррелируют с областями интереса. Запустите пространственную корреляцию (R > 0,65) в HD Imaging для определения колокализованных пиков.
- Поиск предполагаемой липидной идентификации этих вершин с помощью LipidMaps16 и METASPACE17.
- Подтвердите липидные аннотации последующими данными LC-MS. Используйте Metaboanalyst для статистического анализа данных LC-MS.
Результаты
Описанные выше протоколы визуализации были использованы для двух предварительных исследований: ремоделирование инфаркта миокарда (ИМ) и сосудистое старение. Для кардиологических экспериментов была выполнена операция по перевязке коронарных артерий с целью индуци?...
Обсуждение
Ультразвуковая визуализация может зависеть от оператора, но использование анатомических ориентиров и соответствующая подготовка могут ограничить предвзятость пользователя. 2D-ультразвук особенно подвержен вариабельности между пользователями, поскольку изображен...
Раскрытие информации
Крейг Дж. Гёрген (Craig J. Goergen) — платный консультант компании FUJIFILM VisualSonics.
Благодарности
Эллисон Джонс получает стипендию Университета Теннесси на факультет механической, аэрокосмической и биомедицинской инженерии. Исследование, представленное в этой публикации (Коннер Эрл), было поддержано Национальным институтом сердца, легких и крови Национальных институтов здравоохранения F30HL162452. Ответственность за содержание лежит исключительно на авторах и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
Ссылки
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274 (1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738 (2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570 (2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100 (2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C., Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530 (1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728 (2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839 (2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006 (2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720 (2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены