Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Murin Kardiyovasküler Yeniden Şekillenmesinin Multimodal Çalışması: Dört Boyutlu Ultrason ve Kütle Spektrometresi Görüntüleme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, murin kardiyovasküler sistemindeki biyomekanik ve biyomoleküler değişiklikleri değerlendirmek için in vivo dört boyutlu ultrason görüntüleme ve ex vivo kütle spektrometresi görüntülemeyi kullanmak için bir protokol açıklıyoruz. Bu teknik, yaşlanan hayvanlarda cerrahi olarak indüklenen miyokard enfarktüsünde ve vasküler değişikliklerde kardiyak yeniden şekillenmeyi analiz etmek için uygulanır.
Özet
Kardiyovasküler hastalık (CVD), Amerika Birleşik Devletleri'nde önde gelen ölüm nedenidir. Kardiyovasküler sistemdeki hasar, çevresel maruziyet, travma, ilaç toksisitesi veya çok sayıda başka faktöre bağlı olabilir. Sonuç olarak, kalp dokusu ve damar sistemi yapısal değişikliklere uğrar ve azalmış fonksiyon gösterir. Hasar ve bunun sonucunda ortaya çıkan yeniden şekillenme, organ düzeyinde ultrason (US) görüntüleme ve moleküler düzeyde kütle spektrometresi görüntüleme (MSI) ile tespit edilebilir ve ölçülebilir. Bu el yazması, murin kardiyak patofizyolojisini incelemek, in vivo dört boyutlu (4D) ultrason görüntüleme ve analizini kalbin ex vivo matris destekli lazer desorpsiyon/iyonizasyon (MADLI) MSI ile birleştirmek için yenilikçi bir metodolojiyi açıklamaktadır. 4D ultrason, tüm bir kardiyak döngü boyunca radyal yer değiştirme, yüzey alanı gerilmesi ve uzunlamasına gerilme dahil olmak üzere dinamik hacimsel ölçümler sağlayabilir. Damar sisteminde, damar duvarı bileşimlerini, hemodinamiği ve damar duvarı dinamiklerini değerlendirmek için MSI ve ultrason kullanılır. Metodoloji, ilgilenilen fonksiyonel metrikleri ayarlayarak ve/veya belirli molekülleri hedeflemek için MALDI MSI protokolünü değiştirerek sayısız CV hastalığını incelemek için uyarlanabilir. MALDI MSI, lipitleri, küçük metabolitleri, peptitleri ve glikanları incelemek için kullanılabilir. Bu protokol, hedeflenmemiş lipidomik analiz için MALDI MSI'nin kullanımını ve kardiyovasküler hemodinamik ve biyomekanik için ultrason görüntülemenin kullanımını ana hatlarıyla belirtir.
Giriş
Kardiyovasküler hastalık (KVH) dünya çapında önde gelen bir mortalite nedenidir1. KVH'nin önlenmesi ve tedavisi, biyomekanik kuvvetlere moleküler adaptasyonların ve bunun sonucunda mekanik özelliklerde meydana gelen değişikliklerin derinlemesine anlaşılmasını gerektirir. Tüm kardiyovasküler sistem boyunca, biyomekanik kuvvetler dokunun işlevinde ve yapısında önemli bir rol oynar2. Kardiyovasküler (CV) dokunun mekanik özellikleri bu kuvvetlerden etkilenir ve bu da onları sağlık ve hastalık göstergesi yapar 3,4,5,6. KVH'yi önlemek, teşhis etmek ve tedavi etmek için, hastalığın başlama ve ilerleme süreçlerini anlamak ve gözlemlemek için yöntemler geliştirmek çok önemlidir. Biyomedikal görüntüleme, fizyolojik ve mekanik içgörüler üretmede kilit rol oynamıştır ve sürekli olarak yeni görüntüleme teknolojileri ve analiz teknikleri geliştirilmektedir. Bu protokol, iskemik kalp hastalığı ve vasküler yaşlanmada bu görüntüleme modalitelerinin potansiyelini doğrulamak için iki kardiyovasküler görüntüleme ve analiz tekniğini birleştirmek için bir metodoloji göstermektedir.
Biyomekanik alandaki araştırmacılar genellikle biyomekanik çalışmasına in vivo, ex vivo ve in silico yöntemlerin bir kombinasyonu yoluyla yaklaşırlar. Moleküler biyomekanik alanındaki önceki araştırmalar öncelikle protein7'ye (özellikle biyomekanik özellikler üzerindeki etkileri nedeniyle hücre dışı matriks proteinleri kollajen ve elastin) odaklanmıştır ve in vivo görüntüleme biyomekaniğini moleküler çalışmalarla birleştirme çalışmaları histoloji ve immünohistokimya ile sınırlı kalmıştır. Her ne kadar bu yaklaşımlar birçok moleküler gösterge verebilse ve ECM ve hücrelerin yeniden şekillenmesi için önerilen mekanizmaları vermiş olsa da, tipik olarak sırasıyla şu anda mevcut olan lekeler veya antikorlarla sınırlıdır. Bu araştırma alanında, örneğin lipitler gibi büyük molekül sınıfları eksiktir. Bu moleküler sınıflar mekanik olarak dahil olabilir veya olmayabilirken, ortaya çıkan moleküler adaptasyonların anlaşılması önemlidir, çünkü bu moleküller hem tanısal belirteçler hem de terapötikler için potansiyel hedefler olabilir. Sıvı kromatografisi-kütle spektrometresi (LC-MS) gibi analitik kimya teknikleri uygulanabilir; Bununla birlikte, bu tekniklerdeki moleküllerin uzamsal yönelimi kaybolur. Kütle spektrometresi görüntüleme (MSI) ile moleküllerin uzamsal dağılımı bozulmadan kalır ve çoklu analit türleri (molekül sınıfları) seri kesitlerle görüntülenebilir. MSI, metabolitler, lipitler, glikanlar, peptitler ve küçük moleküler ağırlıklı ilaçlar dahil olmak üzere biyolojik dokudaki hemen hemen tüm molekül türlerinin mekansal dağılımlarını araştırmak için güçlü bir analitik araçtır8. Matris destekli lazer desorpsiyon/iyonizasyon (MALDI) MSI, 50-8000 Da aralığındaki moleküler ağırlıkların keşfe dayalı analizi için çok uygun olan bir MSI türüdür. MALDI-MSI, ilgilenilen analitlerin iyonizasyonuna yardımcı olmak için numuneye lazer enerjisi emici bir matris uygulayan bir iyonizasyon tekniğidir. Bu yaklaşım, tek bir moleküler hedefle sınırlı kalmayı önler ve hangi moleküllerin biyomekanik özellikler ve yeniden şekillenme üzerinde etkisi olduğunu belirlemek için biyoinformatik araçlarını kullanabilir.
Dört boyutlu ultrason (4DUS), kalbin hem zamansal hem de mekansal karakterizasyonu için yararlı, non-invaziv bir in vivo yöntemdir. 4DUS, farklı düzlemlerden bir dizi yüksek kare hızlı sinema döngüsü kullanır ve bunları zamansal bilgileri içeren bir 3B veri kümesinde derler. Bu, geleneksel 2D ekokardiyografi için gerekli olan geometrik varsayımlara dayanmadan, kalp döngüsü boyunca kalp odacıklarının karmaşık 3D şekil değişikliklerinin doğrudan görselleştirilmesine ve nicelleştirilmesine olanak tanır. 4DUS, kalbin karmaşık şekli ve hareketinden in vivo fonksiyonel ölçümlerinhesaplanmasına izin verir 9,10 ve MALDI MSI, kardiyak doku içindeki biyolojik moleküllerin ex vivo11 uzamsal çalışmasına izin verir. KVH ile kalpteki değişiklikleri tam olarak anlamak için hem mekanik hem de moleküler mekanizmaların araştırılması gerekir. Bu nedenle, murin kalp patofizyolojisini incelemek, 4DUS görüntülemeyi birleştirmek ve kalpteki lipitlerin MALDI MSI ile analizini yapmak için birleşik bir metodoloji önerilmiştir. Bu metodoloji, miyokard enfarktüsünün bir fare modelinde gösterilmiştir.
Vasküler biyomekanik ayrıca kardiyovasküler fonksiyonun düzenlenmesinde kritik bir rol oynar2. Yaşlanma ile ilişkili olan vasküler sertleşme, CVD12 için bir risk faktörüdür. Damarlardaki biyomekanik ve hemodinamik değişiklikler ultrason ile görüntülenebilir. Damar duvarlarının moleküler bileşimleri biyomekaniğin önemli bileşenleridir ve ayrıca hemodinamik kuvvetlere karşı son derece hassastır. Örneğin, salınımlı duvar kesme gerilmesi aterosklerotik plak gelişiminde rol oynamıştır3. Yaşlı hayvanlarda damar mekaniği ve hemodinamiği ile ilgili ön veriler daha sonra sunulacaktır.
Ekip, çeşitli hastalık durumlarında biyomekanik ve moleküler bileşim arasındaki ilişkiyle ilgilenmektedir. Klinik öncesi ultrason görüntüleme ve MSI, bir dokudaki moleküler değişikliklerin mekansal dağılımını ve hastalığın ilerlemesi sırasında meydana gelen ilişkili biyomekanik değişiklikleri belirlemek için kullanılır. Bu rapor, bu metodolojileri ayrıntılı olarak açıklar ve kalp ve baş/boyun damar sistemi hakkında ön veriler sunar.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tarif edilen hayvan deneyleri, Tennessee Üniversitesi, Knoxville Kurumsal Hayvan Bakım ve Kullanım Komitesi onayı ile gerçekleştirilmektedir.
1. Ultrason görüntüleme13
- Kurulum ve hayvan hazırlığı
- Deneye başlamadan önce, izofluran anestezi seviyesini kontrol edin ve gerekirse yeniden doldurun. Gazı açmadan önce oksijen tankı seviyelerini kontrol edin. Kömürü tartın ve kabın üzerine kaydedin.
- Malzemeleri görüntüleme platformunun yakınına yerleştirerek görüntüleme alanını ayarlayın. Malzemeler arasında önceden kesilmiş bant, tüy dökücü krem, gazlı bez, pamuklu çubuklar, otoklavlanmış su, kornea kayganlaştırıcı, yağlama jeli, rektal sıcaklık probu, elektrot uçları, ultrason jeli, elektrot jeli (varsa) ve ısı lambası bulunur (Şekil 1A).
- Ultrason makinesini açın ve motoru başlatın (sistem ayrıca 4DUS görüntü verilerini toplama yeteneğine de sahiptir). Ultrason sisteminde yeni bir deney ayarlayın: Yeni Çalışma veya Yeni Seri'yi seçin ve fare bilgilerini doldurun. Fizyolojik izleme için tableti açın.
- Akışın indüksiyon kutusuna açık ve burun konisine kapalı olduğundan emin olmak için vanayı kontrol edin. Buharlaştırıcıda oksijeni 1 L/dk'ya getirerek ve kadranı %3-5'e çevirerek anestezi indüksiyon kutusunu önceden doldurun.
- Fareyi muhafaza kafesinden çıkarın.
- Hayvan %3-%5 arasında izofluran ile tamamen uyuşturulana kadar fareyi indüksiyon kutusuna yerleştirin.
- Ultrason görüntüleme plakasındaki burun konisine giden akışı değiştirmek için vanayı değiştirin. İzofluran kadranını %1-%2 arasında çevirin.
- Fareyi indüksiyon kutusundan çıkarın ve hayvanı tartın. Hayvanın ağırlığını kaydedin.
- Fareyi görüntüleme plakasına sırtüstü pozisyonda yerleştirin.
- Hayvanın gözlerine kornea kayganlaştırıcı sürün.
- Kürk varsa, piyasada bulunan tüy dökücü bir krem ve pamuklu çubuklar kullanarak kürkü görüntüleme alanından çıkarın. Ciltteki fazla tüy dökücü kremi çıkarmak ve yanıkları önlemek için kremi süngerler üzerinde su ile ciltten silin.
- Elektrokardiyografi (EKG) uçlarını, hayvanın konumuna bağlı olarak göğsün ve arka bacağın her iki tarafına deri altına yerleştirin.
- Yerleştirildikten sonra, EKG uçlarını bantla yerinde tutun. EKG uçları kullanılmıyorsa (yani EKG uçları takılmamışsa), EKG'yi hayvan görüntüleme plakası aracılığıyla izleyin.
- Deriden plakaya elektrik iletimi için, iletken jeli plaka üzerinde tespit edin ve hayvan uzuvlarını yerinde tutun.
- Hayvan uzuvlarını, plakanın etrafına ve uzuvların üzerine yerleştirilmiş bant veya elastik bir bantla yerinde tutun (Şekil 1B).
- Rektal sıcaklık probunu yerleştirmek için yağlama jeli kullanın ve probu bantla sabitleyin.
- Tabletteki EKG, solunum ve sıcaklık sinyallerini kontrol edin. Kalp atış hızının ~350-600 bpm, solunumun ~50-100 nefes/dk ve rektal sıcaklığın 35-37 °C arasında olduğundan emin olun. İzofluran seviyelerini gerektiği gibi ayarlayın.
- Gerekirse, bir ısı lambasını açın (örn. 250 W Kızılötesi ısıtma ampulü)14 ve çekirdek sıcaklığını korumak için yüksekliği ayarlayın (Şekil 1C).
- Isı lambasını hayvandan 12 inçten daha yakın olmayacak şekilde yerleştirin. Ampul ve hayvan arasındaki en uygun mesafeyi belirlemeye yönelik ilk çalışmalar için, yüksekliği ayarlayın ve 42 ° C'yi geçmemesi gereken bir kızılötesi termometre kullanarak cilt sıcaklığını kaydedin15.
- Kardiyak 4D ultrason
- Dönüştürücüyü tutucuya yarı kilitli bir konumda yerleştirin.
- Dönüştürücü üzerindeki yükseltilmiş noktayı ekrandaki mavi nokta ile yönlendirin. Konvansiyon, noktayı hayvanın sağ tarafına doğru yerleştirmektir.
- Dönüştürücüyü, kaudal yönü gösteren yükseltilmiş bir çentik ile farenin sagital düzlemi boyunca yönlendirilecek şekilde çevirin.
- Hayvanı eğmek için ultrason plakasının tabanındaki kolu kullanın. Dönüştürücü açısını ayarlamak için dönüştürücünün tabanındaki kolu kullanın.
- Cilt yüzeyi ile dönüştürücü arasında akustik bağlantı için göğüs boşluğunun ventral yüzeyine bol miktarda ultrason jeli uygulayın. Birleştirmeden önce kürk kalmadığından emin olun.
- Ultrason jeli ile temas etmek için dönüştürücüyü indirin.
- Plakanın tabanındaki X/Y düğmeleriyle mikro ayarlamalar yapın veya büyük ayarlamalar için tüm plakayı hareket ettirin.
- Daha doğru bir kısa eksen görüntüsü için parasternal uzun eksen görünümünün apeks, sol ventrikül çıkış yolu ve ekranda yatay olarak hizalanmış aortu içerdiğinden emin olun (Şekil 2A, B).
- Görüntüyü geçerli seriye kaydetmek için alt köşedeki Resmi Adlandır'ı seçin.
- Parasternal kısa eksene geçmek için dönüştürücüyü saat yönünde 90° çevirin view (Şekil 2C).
NOT: En iyi 4D görüntü kalitesi için, kullanıcılar step motoru, her zaman sternuma doğrudan paralel olmayan ventrikülün parasternal uzun ekseni boyunca hizalamaya çalışmalıdır. Kalp/LV genellikle sola doğru aşağı doğru bir açıda oturur. - Sol ventrikülün ekranın sağ tarafında göründüğünden ve sağ ventrikülün ekranın sol tarafında olduğundan emin olun (Şekil 2D).
- Farenin sabit bir solunum ritmi varsa, 4D görüntü için solunum kapısını açmak için görüntünün sol üst köşesindeki EKG kutusuna basın. Kararlı değilse, işlem sonrası sırasında bu adımı tamamlayın.
- Bir 4D görüntü ayarlamak için ekranın sol üst köşesindeki küpü seçin.
- Dönüştürücünün Başlat ve Durdur konumlarını ayarlamadan önce dönüştürücüyü sıfırlayın.
- Başlangıç konumunu apeksin hemen altına ve Durdurma konumunu aort kemerine ayarlayın.
- Adım Boyutu'nu 0,08-0,13 mm ve Kare Hızı'nı 200-300 Hz olarak ayarlayın.
NOT: Daha küçük adım boyutları, analiz için daha iyi görüntü çözünürlüğü sağlayabilir ancak alım süresini artıracaktır. Veriler neredeyse mükemmel sol ventrikül hizalaması ile toplanırsa ve analiz sırasında minimum düzeyde / hiç yeniden oryantasyon gerekmiyorsa, daha büyük adım boyutları kabul edilebilir. Daha yüksek kalp atış hızına (>450 bpm) sahip hayvanlarla çalışırken kare hızını artırmayı düşünün. - Taramaya başlamadan önce yaşamsal belirtilerin ve EKG sinyalinin sürekli olarak stabil olduğundan emin olun (>350 bpm ve 50 resp/dk'nın üzerinde solunum).
- Tarama ve işleme tamamlandıktan sonra, İşlem sonrası için EKV/4D verilerini kaydet ve Solunum Kapısını AÇIK konuma getirin.
- Sağ alttaki Ad resmi'ni seçin ve ada fare kimliğini ekleyin.
- Görüntü kalitesini kontrol etmek için Daha Fazla Kontrol'e basın ve 4D'ye Yükle'yi seçin.
- Kalbin merkezinin kalp döngüsü boyunca hareket etmediğinden emin olarak kalbin her düzlem görünümünü gözden geçirin. Merkezin hareketi, EKG ve/veya solunum kapısındaki değişkenliği gösterir ve bu nedenle analiz sürecini zorlaştırır. Monitörleri yeniden ayarlayın ve gerekirse taramayı tekrarlayın.
- Kardiyak 4D ultrason analizi
- Çalışma tarayıcısına gidin. Tüm B-Mode 2D görüntüleri Vevo Lab'a aktarın ve 4D verileri diğer dosya türü olarak dışa aktarın, veri formatını bir sabit sürücüye ".raw" seçin.
NOT: Bu çalışmada kullanılan 4B grafik kullanıcı arayüzü araç kutusu şu anda herkese açık değildir. Erişim ve ayrıntılı talimatlar talep etmek için Purdue Üniversitesi'nden Dr. Craig Goergen ile iletişime geçin. - VevoLab yazılımını kullanarak 4D verilerin alternatif bir analizini gerçekleştirin. Bu çerçeveyi kullanmak için, 4D verileri makineden Vevo Lab dosyalarına aktarın.
- Çalışma tarayıcısına gidin. Tüm B-Mode 2D görüntüleri Vevo Lab'a aktarın ve 4D verileri diğer dosya türü olarak dışa aktarın, veri formatını bir sabit sürücüye ".raw" seçin.
- Vasküler Görüntüleme
- Karotis arterlerin B modu görüntüleri için, ultrason dönüştürücüsünü karotis arterlere paralel olarak, orta hatta yakın bir yere yerleştirin.
- Karotis arter göründüğünde, karotis bifurkasyonunu bulmak için dönüştürücüyü üst konuma getirin.
- Karotis çatallanmasının net bir görüntüsü bulunduğunda, kazanç ayarını 35 dB'ye ayarlayın ve B modu görüntüsünü yakalayın.
- Dönüştürücüyü sola veya sağa açılı hale getirmek görüntüyü iyileştirebilir. Dönüştürücünün veya aşamanın açısını, ilgilenilen kap dönüştürücüye doğrudan paralel olmayacak şekilde ayarlayın. Bu, Doppler açısının 60°'nin altında kalmasını sağlar. Aksi takdirde, +/- 15°'lik bir kayma gerekebilir.
- Hız ölçümlerini elde etmek için darbeli dalga Doppler moduna geçin.
- Numune hacmini kabın ortasına yerleştirin. İmlecin açısını karotis artere paralel olacak şekilde ayarlayın. Ardından, hız ölçümlerini başlatmak için oynat düğmesine basın ve kaydetmek için kaydedin .
- Şah damarlarının B modu görüntüsü için, ultrason dönüştürücüsünü şah damarlarına paralel olarak yerleştirin. Şah damarları, karotis arterlerin önünde ve lateraldidir.
- Şah damarı yerleştirildikten sonra, dönüştürücüyü iç ve dış şah damarının birleştiği yere hareket ettirin. Net bir görüntü bulunduğunda, kazanç ayarını 35 dB'ye ayarlayın ve B modu görüntüsünü yakalayın.
- Hız ölçümlerini elde etmek için darbeli dalga Doppler moduna geçin.
- Numune hacmini kabın ortasına yerleştirin. İmleç açısını şah damarına paralel olacak şekilde ayarlayın. Ardından, hız ölçümlerini başlatmak için oynat düğmesine basın ve kaydetmek için kaydedin .
- Vasküler ultrason analizi
- B-modu görüntülerini ve darbeli dalga Doppler ölçümlerini topladıktan sonra, yazılımı kullanarak çapları ve hızları ölçün.
- Görüntüler yazılıma yüklendikten sonra vasküler paketi seçin.
- Tam çapı elde etmek için teknenin her iki tarafını da seçin.
- Karotis arter için damar paketindeki çap seçeneğini kullanarak sistol ve diyastolde çap ölçümleri yapın.
- Damar paketindeki hız seçeneğini kullanarak hız ölçümleri yapın.
- Karotis arter için, sistolde hız ölçümü için en yüksek tepe noktasını ve diyastolde hız ölçümü için en düşük tepe noktasını seçin.
- Aşağıdaki denklemi kullanarak Green Lagrange gerinim tensörünün çevresel bileşenini hesaplamak için çapların değerlerini kullanın,
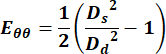 (1)
(1)
burada Ds, sistol sırasındaki çapı ve Dd, diyastol sırasındaki çapı temsil eder. - Juguler ven için, hız ölçümünü elde etmek için döngü boyunca herhangi bir noktayı seçin.
2. Ötenazi ve doku toplama
- Flaş dondurma dokusu için alüminyum folyo tekneler hazırlayın (Şekil 3).
- Bir çalışmanın sonunda, hayvanı% 5 konsantrasyonda izofluran doz aşımı ve bilateral pnömotoraks veya servikal çıkık (sadece kardiyak çalışma) ile ötenazi yapın.
- Cildi çadır yapmak için forseps kullanarak, çadırdaki cildi damar sistemi için boynun üzerinden veya kardiyak için sternumun hemen altından makasla kesin.
- Damar sistemini ortaya çıkarmak için deri ve kas katmanlarını kesin veya kalbi ortaya çıkarmak için kemiği kesin.
- Pamuklu çubuklarla künt diseksiyon kullanarak, kalbi veya damar sistemini yağ da dahil olmak üzere çevre dokulardan izole edin. Karotis damarını sinirden ayırdığınızdan emin olun. Cerrahi aletler kullanarak kalbi ve damarları çıkarın.
NOT: Dikişler, damarları çıkarmadan önce proksimal ve distal dikerek damar sistemini çıkarmak için kullanılabilir. - Mendili önceden etiketlenmiş bir alüminyum folyo tekneye yerleştirin ve tekneyi sıvı nitrojen içine yerleştirin (Şekil 3).
- Kriyoseksiyon zamanına kadar dokuyu -80 °C'de saklayın. Sıcaklığı korumak için dokuyu kuru buzla taşıyın.
3. Kütle spektrometresi görüntüleme
- Cam kızaklara kriyoseksiyon ve optimum kesme sıcaklığı (OCT) montajı
- Kriyostat sıcaklığını -25 °C'ye ayarlayın ve bıçağı yerleştirin.
- OCT uygulayarak ve kriyostatta donmasına izin vererek metal bir ayna hazırlayın.
- OCT kullanarak kalbin tabanını hazırlanan metal aynaya sabitleyin (Şekil 4A). OCT'nin ilgilenilen numune bölgesine dokunmasına izin vermeyin çünkü OCT kütle spektrumlarını kirletecek (polietilen glikol [PEG] kontaminasyonu) ve ilgilenilen lipid sinyallerini bastıracaktır.
NOT: Numune kontaminasyonunu önlemek için su montajı yapma seçeneği. Talimatlar için aşağıdaki ek protokole bakın. - Bu metodolojide uzamsal hizalamanın önemine bağlı olarak, kesitlemeye rehberlik etmek için MATLAB GUI tarafından verilen kalbin ölçeklendirilmiş dijital görüntüsünü kullanın (Şekil 4B).
- Kesit alırken her devri (10 μm) sayın ve kızağa monte edilecek her dilim için derinliği milimetre cinsinden not edin.
NOT: MATLAB tarafından sağlanan ultrason verilerinin dijital olarak işlenmesiyle doğru bir eşleşme için kalp veya damar sistemindeki belirli konumları takip etmek gerekir. - Doku bölümlerini (10 μm kalınlığında) mikroskop slaytlarına çözün.
NOT: Slaytların türü, kullanılan kütle spektrometresine bağlı olacaktır. Her slayt, kalbin her bölgesinden bir bölüm içerir. En az üç slayt gereklidir (pozitif iyon modu, negatif iyon modu, ekstra). - n = 1/grup için, tepeden tabana moleküler değişiklikleri görselleştirmek için kalbi uzun eksen üzerinden bölümlere ayırın.
- Damar sistemi için, dokuyu jelatin içine gömün ve kesitlere ayırmadan önce hızlı dondurun11.
- Slaytları, kütle spektrometresi görüntüleme deneylerine kadar -80 ° C'de slayt postalarında saklayın.
- Lipidleri veya metabolitleri daha fazla tanımlamak ve ölçmek için sıvı kromatografi-kütle spektrometresi (LC-MS) yapılıyorsa, ~60-100 μm'lik seri doku kesitlerini bölümlere ayırın ve dondurmadan önce bunları 0,5-2 mL'lik tüplere toplayın.
- Cam slaytlar üzerine kriyoseksiyon ve su montaj dokusu
- Bir kabı yüksek performanslı sıvı kromatografisi (HPLC) suyla doldurun ve 5 mL ve 1 mL şırıngalarla bir kenara koyun.
- Kriyostat sıcaklığını -25 °C'ye ayarlayın ve bıçağı yerleştirin.
- Montajdan önce soğuması için kriyostatın içine bir çift forseps yerleştirin.
- Bir şırıngaya 5 mL HPLC suyu çekin ve kriyostata yerleştirin.
- Şırınga tamamen donmadan hemen önce, metal aynanın üzerine su boşaltın ve tamamen donmasına izin verin.
- 1 mL HPLC suyu çekin ve şırıngayı kriyostata yerleştirin.
- Yaklaşık 30-60 s sonra, aynanın ortasına küçük bir nokta kısmen katılaşmış su yerleştirin. Kalbi hemen forseps ile tutun ve tamamen donmadan önce noktaya yerleştirin. Çevredeki su tamamen donana kadar kalbi yerinde tutun.
NOT: Kalp, ilgilenilen bölgeye bağlı olarak apeks veya taban ile monte edilebilir. Bu çalışma için taban, tepe noktası dışarı bakacak şekilde monte edilecektir. - Bu yöntem için geri kalan adımları adım 3.1'de açıklandığı gibi gerçekleştirin.
- Matris uygulaması
- Slaytı dondurucudan çıkarın ve sürgü kuruyana kadar bir kurutucuya koyun.
- HTX M3+ püskürtücüyü açın, dizüstü bilgisayarda HTX uygulamasını açın ve ekranın ortasındaki yöntemi seçin. Standart matris konsantrasyonları saklanan yöntemlerde bulunabilir (matris > OI_usermethods > ekranın sol tarafındaki yöntemler).
- Bu iş için nozul sıcaklığını 75 °C'ye, akış hızını 100 μL/dk'ya ve basıncı 10 psi'ye ayarlayın.
- Numune adını, polariteyi, matrisi, çözücüyü ve konsantrasyonu laboratuvar not defterine yazın. Konsantrasyon başına gereken matris miktarını hesaplayın (ör., 10 mg / mL'de 5 mL = 50 mg matris).
- Çözücü yapın (örneğin, %70 MeOH).
- Bu iş için, pozitif mod için 40 mg / mL 2,5-dihidroksibenzoik asit (DHB) matris çözeltisi ve negatif mod için 10 mg / mL 9-aminoakridin (9AA) matris çözeltisi hazırlayın. Her iki matrisi de %70 MeOH çözücü ile yapın. Diğer yaygın matrisler ve püskürtme parametreleri için 3.3.2 adımlarını izleyin.
- Matrisi tartın ve matrisi 15 mL'lik konik bir tüpe ekleyin. Tutarın adım 3.3.3'te hesaplanan gerekli miktara yakın olduğundan ancak kesin olması gerekmediğinden emin olun. Ölçülen kütleye göre çözücü miktarını hesaplayın.
- Bir pipet kullanarak konik boruya çözücü ekleyin.
NOT: Hacim, adım 3.3.5'te ölçülen kütleye dayanmaktadır. - Karışımı 10 dakika boyunca sonikleştirin. Matris sonikleştirilirken, slaydı desikatörden çıkarın.
- Püskürtücü tepsisini açın, sürgüyü sol alt köşeye yerleştirin ve kenarlarını bantlayın.
NOT: Kolay çıkarmak için bandın bir ucunu katlayın. - Örnek püskürtme bölgesini seçin. Tepsiyi kapatın.
- Bir şırınga ve bir filtre kullanın ve matrisi şırıngaya dökün, ardından matrisi şırıngadan püskürtücünün sol tarafındaki siyah kapakla şişeye süzün.
- Şişeyi püskürtücü üzerindeki yerine geri yerleştirin ve D-line borusunu şişeye yerleştirin.
NOT: Tüpün şişenin altına temas etmediğinden ve sıvıya tamamen daldırıldığından emin olun. - İnert gazı açın ve püskürtücü üzerindeki göstergenin 10 psi okuduğundan emin olun. Başlat'a basın. Püskürtücü istenen sıcaklığa geldiğinde, yanıp sönen başlatmayı seçin.
- Püskürtme tamamlandıktan sonra tepsiyi açın, numuneyi çıkarın ve MALDI sürgü tutucusuna veya tekrar kurutucuya yerleştirin (Şekil 4C).
- MALDI slayt tutucusunu tarayın ve tarayıcıda kaydırın veya telefonla bir resim çekin. Resmi MSI ile kullanmak için bir flash sürücüye kaydedin.
- Püskürtücüde uygun yıkamayı veya sonraki spreyi seçin. Yıkıyorsanız, D-hattını matris şişesinden atık kabına taşıyın.
- Tepsiye metanol püskürtün ve temizlemek için silin. Nitrojeni kapatın.
- MALDI MSI
- Bilgisayarda Synapt'a gidin, polaritenin gereken moda değiştirilip değiştirilmediğini kontrol edin ve değilse değiştirin.
- Cihazdaki slaytı MALDI kaynağına yükleyin ve yazılımı kullanarak bilgisayardaki yükle düğmesine tıklayın.
- Görüntüyü (adım 1.2.17) Proje klasöründeki Görüntüler klasörüne taşıyın.
- HD Görüntüleme'ye gidin ve önceki projeyi (aynı matrisi kullanan proje) açın.
- Bir laboratuvar not defterinde, kütle aralığını kaydedin, çarpışma enerjisini, lazer enerjisini, neg / pos modunu yakalayın ve aktarın.
- HD Imaging'de beyaz sayfa simgesine gidin. Ardından açılır oka tıklayın ve yeni plakayı seçin.
- Görüntüyü Proje klasöründe > Görüntüler Klasörü'nde bulmak için göz atın ve açın.
- Plaka tipini MALDI Standardı olarak değiştirin ve plakanın kenarlarını tanımlayın (Aşağıda kırmızı artı işaretleriyle gösterilen 4 köşeyi seçin).
NOT: Sol üstteki kutu, her köşeye gitmek içindir. Sağ üstteki kutu köşeleri seçmek içindir. Alttaki kutu yalnızca tüm slaydı görselleştirmek içindir. - Sol üst köşedeki küçük desen sekmesine gidin ve dokunun ana hatlarını çizmek için kurşun kalem veya diğer dikdörtgen veya daire seçeneklerini tıklayın. Bitirmek için sol tıklamaları ve sağ tıklamayı kullanarak dokuyu ana hatlarıyla belirtin.
- Piksel boyutu varsayılan olarak 50 μm'dir. Gerekirse değiştirin.
- Farklı kaydet'e tıklayın ve Project Imaging AcqFolder'a gidin ve slayt adı (YYYYMMDD biçimi) olarak etiketleyin. Ardından kaydedin.
- Mass Lynx'e aktarmak için üst ortadaki Mass Lynx düğmesine tıklayın.
- Mass Lynx yazılımına gidin.
- Proje klasörünü açmak > Dosya'ya tıklayın. Dosya adını ve metin adını slayda düzenleyin (YYYYAGG biçimi).
- MS dosyasına sağ tıklayın, göz atın ve mevcut slaydı seçin.
- MS dosyasına tekrar sağ tıklayın ve Düzenle'ye tıklayın. Mavi kutuya çift sol tıklayın.
- Tarama koşullarına gidin. Kaynak ayarlarını bulun ve kullanıcı tanımlı olarak değiştirin. Ardından doğru proje klasörüne gidin > alınan klasör > geçerli slaytta TAMAM'>.
- Farklı kaydet'e tıklayarak kaydedin ve slayt adını ekleyin.
- Cihazı bir referans bileşik (örn. kırmızı fosfor) kullanarak kalibre edin
- Synapt (Kalibre Et) öğesine gidin. Veri almaya başlamak için oynat düğmesine tıklayın. YYYYMMDD_cal1 olarak etiketleyin (ör: 20230614_cal1).
- 50 - 2000 arasında aynı kütle aralığına sahip olduğundan emin olun. Lazer enerjisi yaklaşık 175 olabilir.
- Ateş lazer oyununa basın, ardından sonraki düğmeye tıklayın. Yaklaşık 15 veya 20'ye kadar çalışmasına izin verin. Kırmızı durdur'u tıklayın.
- W Console'a gidin.
- Kalibrasyon oluşturun ve başlat'a tıklayın. Kalibrasyon profili düzenleyicisi altında, yeni > dosya'ya tıklayın. YYYYMMDD_cal1 yazın.
- Kütle aralığını proje için istenen kütle aralığına düzenleyin (örneğin, 50-2000).
- Manuel kalibrasyonu seçin. Çözünürlük modunu seçin ve düzenle'yi tıklayın. Referans bileşik olarak kırmızı fosforu seçin.
- Ham veri dosyasını tıklayın ve en alta kaydırın (az önce edinilen şey olmalıdır).
- En alttaki geçmişe gidin, Acc kütlesini seçin > tamam > tamam.
- Başlat düğmesi görünene kadar ileriyi tıklamaya devam edin ve başlat'a basın.
- Yeşil onay işaretine gidin ve hangi zirvelerin bulunamadığına bakın.
- Mass Lynx'e gidin (Deneysel örnekler için gerçek çalıştırmayı başlatın).
- Oynat düğmesine basın ve numune sayısının doğru olup olmadığını kontrol edin
- HD görüntülemeye gidin.
- Piksel boyutunun hala orijinal olarak ayarlanan boyutta olduğundan emin olmak için kontrol edin
- Polariteyi kontrol etmek için Synapt'a gidin.
- Lazerin hareket ettiğinden ve ateşlediğinden emin olmak için kamera düğmesine tıklayın.
- Veri topladığından emin olun ve kontrol edin. Elde edilen kütle spektrumu Synapt sayfasında görüntülenmelidir.
- MS analizi
- Analiz için HD Görüntüleme yazılımını ve Mass Lynx'i kullanın.
- HD Görüntüleme'deki İşlem sekmesini kullanarak görüntüleme verilerini işleyin.
- MS görüntüleri olarak da adlandırılan moleküler iyon görüntülerini, Analiz sekmesindeki HD Görüntüleme'de görselleştirin. Bir moleküler iyon görüntüsünün ısı haritası, o m/z iyonunun bir bölge üzerindeki yoğunluğunu gösterir (Şekil 5). Moleküllerin uzamsal dağılımını göstermek için MS görüntülerinin katmanlarını kullanın (Şekil 6 ve Şekil 7).
- Görüntüleme için TIC veya uygun normalleştirme kullanarak verileri normalleştirin.
- İlgilenilen bölgelerle uzamsal olarak ilişkili olan m/z tepe noktalarını belirleyin. Birlikte lokalize tepe noktalarını belirlemek için HD Görüntülemede uzamsal bir korelasyon (R > 0,65) çalıştırın.
- LipidMaps16 ve METASPACE17 ile bu zirvelerin varsayılan lipid tanımlamasını arayın.
- Lipid ek açıklamalarını sonraki LC-MS verileriyle onaylayın. LC-MS verilerinin istatistiksel analizi için Metaboanalyst'i kullanın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Yukarıda tarif edilen görüntüleme protokolleri iki ön çalışma için kullanıldı: miyokard enfarktüsü (MI) yeniden şekillenmesi ve vasküler yaşlanma. Kardiyak deneyler için, akut miyokard enfarktüsünü indüklemek için kalıcı bir koroner arter ligasyonu ameliyatı yapıldı18,19. 4D ultrason ve MALDI MSI, fizyolojik ve moleküler değişiklikleri ortaya çıkararak aynı doku üzerinde aşamalı olarak gerçekl...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
ABD görüntülemesi operatöre bağlı olabilir, ancak anatomik yer işaretlerinin kullanılması ve yeterli eğitim, kullanıcı yanlılığını sınırlayabilir. 2D ultrason, kullanıcılar arası değişkenliğe karşı özellikle hassastır, çünkü görüntüler açıya bağlıdır, oysa 4DUS, çekim tüm hacmi kapsadığından ve açıdan bağımsız olduğundan daha az hassastır. Ayrıca, ayarlanabilir hayvan platformu ve dönüştürücü tutucu sayesinde görüntü yeniden ?...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Craig J. Goergen, FUJIFILM VisualSonics'in ücretli danışmanıdır.
Teşekkürler
Allison Jones, Tennessee Üniversitesi, Makine, Havacılık ve Biyomedikal Mühendisliği Bölümü Yüksek Lisans Bursu tarafından desteklenmektedir. Bu yayında (Conner Earl) bildirilen araştırmalar, Ulusal Sağlık Enstitüleri Ulusal Kalp, Akciğer ve Kan Enstitüsü F30HL162452 tarafından desteklenmiştir. İçerik yalnızca yazarların sorumluluğundadır ve Ulusal Sağlık Enstitüleri'nin resmi görüşlerini temsil etmek zorunda değildir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
Referanslar
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274(1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738(2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570(2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100(2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C. Jr, Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530(1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728(2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839(2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006(2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720(2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır