このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マウス心血管リモデリングのマルチモーダル研究:4次元超音波および質量分析イメージング
* これらの著者は同等に貢献しました
要約
ここでは、マウスの心血管系における生体力学的および生体分子的変化を評価するために 、in vivo 4次元超音波イメージングおよび ex vivo 質量分析イメージングを使用するプロトコルについて説明します。この手法は、外科的に誘発された心筋梗塞における心臓リモデリングと老化動物の血管変化の解析に適用されます。
要約
心血管疾患(CVD)は、米国の主要な死因です。心血管系の損傷は、環境への曝露、外傷、薬物毒性、またはその他の多くの要因が原因である可能性があります。その結果、心臓組織と血管系は構造変化を起こし、機能が低下します。損傷とそれに伴うリモデリングは、臓器レベルでの超音波(US)イメージングと分子レベルでの質量分析イメージング(MSI)で検出および定量化できます。この原稿では、マウスの心臓病態生理学を研究するための革新的な方法論、 in vivo 4次元(4D)超音波イメージングおよび分析と心臓の ex vivoマトリックス支援レーザー脱着イオン化(MADLI)MSIとの結合について説明します。4D超音波は、半径方向の変位、表面積のひずみ、心周期全体にわたる縦方向のひずみなど、動的な体積測定を提供できます。血管系では、MSIと超音波を使用して、血管壁の組成、血行動態、および血管壁のダイナミクスを評価します。この方法論は、関心のある機能指標を調整したり、特定の分子を標的とするようにMALDI MSIプロトコルを変化させることにより、無数のCV疾患を研究するように調整することができます。MALDI MSIは、脂質、低分子代謝物、ペプチド、糖鎖の研究に使用できます。このプロトコルでは、ノンターゲットリピドーム分析のためのMALDI MSIの使用と、心血管の血行動態および生体力学のための超音波イメージングの使用について概説しています。
概要
心血管疾患(CVD)は、世界中の主要な死亡原因です1。CVDの予防と治療には、生体力学的力に対する分子の適応と、その結果生じる機械的特性の変化について深く理解する必要があります。 心血管系全体を通じて、生体力学的力は組織の機能と構造に重要な役割を果たしています2。心血管(CV)組織の機械的特性はこれらの力の影響を受け、健康と疾患の指標となります3,4,5,6。CVDを予防、診断、治療するためには、疾患の発症と進行のプロセスを理解し観察する方法を開発することが重要です。バイオメディカルイメージングは、生理学的および機構的な洞察を生み出す上で重要であり、新しいイメージング技術と分析技術が絶えず開発されています。このプロトコルは、虚血性心疾患および血管老化におけるこれらのイメージングモダリティの可能性を検証するために、2つの心血管イメージングおよび分析技術を組み合わせる方法論を示しています。
バイオメカニクス分野の研究者は、生体力学の研究に、 in vivo、 ex vivo、 in silico の手法を組み合わせてアプローチすることがよくあります。分子バイオメカニクスのこれまでの研究は、主にタンパク質7 (特に細胞外マトリックスタンパク質であるコラーゲンとエラスチンは生体力学的特性に影響を与えるため)に焦点を当てており、 in vivo イメージングバイオメカニクスと分子研究を組み合わせる研究は、組織学と免疫組織化学に限定されていました。これらのアプローチは多くの分子指標を生み出すことができ、ECMと細胞のリモデリングの提案されたメカニズムを生み出しましたが、それらは通常、それぞれ現在利用可能な染色または抗体に限定されます。この研究分野には、脂質などの大きな分子が欠けています。これらの分子クラスはメカニズム的に関与している場合とそうでない場合がありますが、これらの分子は診断マーカーと治療薬の両方の潜在的な標的となる可能性があるため、結果として生じる分子適応を理解することが重要です。液体クロマトグラフィー-質量分析(LC-MS)などの分析化学技術を適用できます。ただし、これらの手法では、分子の空間配向は失われます。質量分析イメージング(MSI)では、分子の空間分布が損なわれず、複数の分析種タイプ(分子のクラス)を連続切片でイメージングできます。MSIは、代謝物、脂質、糖鎖、ペプチド、低分子量医薬品など、生体組織内のほぼすべての種類の分子の空間分布を調査するための強力な分析ツールです8。マトリックス支援レーザー脱着/イオン化(MALDI) MSIは、50-8000 Daの範囲の分子量の発見ベースの分析に適したMSIの一種です。このアプローチにより、1つの分子標的に限定されることを防ぎ、バイオインフォマティクスツールを使用して、どの分子が生体力学的特性とリモデリングに影響を与えるかを判断できます。
4次元超音波(4DUS)は、心臓の時間的および空間的特性評価に役立つ非侵襲的なin vivo法です。4DUSは、異なる平面からの一連の高フレームレートのシネループを利用し、それらを時間情報を含む3Dデータセットにコンパイルします。これにより、従来の2D心エコー検査に必要な幾何学的な仮定に頼ることなく、心周期にわたる心腔の複雑な3D形状変化を直接視覚化および定量化できます。4DUSは、心臓の複雑な形状と動きからin vivoの機能メトリクスを計算することを可能にし9,10、MALDI MSIは、心臓組織内の生体分子の空間的研究を可能にする11。CVDによる心臓の変化を完全に理解するには、機械的メカニズムと分子的メカニズムの両方を調査する必要があります。したがって、マウスの心臓病態生理学を研究するための複合方法論が提案されており、4DUSイメージングと心臓内の脂質のMALDI MSIと分析を組み合わせています。この方法論は、心筋梗塞のマウスモデルで実証されています。
血管バイオメカニクスは、心血管機能の調節にも重要な役割を果たします2。老化に関連する血管硬化は、CVD12の危険因子です。血管内の生体力学的および血行動態の変化は、超音波を使用して画像化できます。血管壁の分子組成は、生体力学の重要な構成要素であり、血行動態の力に対しても非常に敏感です。例えば、振動壁せん断応力は、アテローム性動脈硬化性プラークの発生に関与している3。老齢動物の血管力学と血行動態の予備データは、その後発表されます。
チームは、さまざまな疾患状態における生体力学と分子組成の関係に興味を持っています。前臨床超音波イメージングとMSIは、組織内の分子変化の空間分布と、疾患の進行中に発生する関連する生体力学的変化を決定するために使用されます。このレポートでは、これらの方法論を詳細に説明し、心臓と頭頸部の血管系に関する予備データを提示します。
プロトコル
記載されている動物実験は、テネシー大学ノックスビル校の動物管理・使用委員会の承認を得て実施されています。
1.超音波画像診断13
- セットアップと動物の準備
- 実験を開始する前に、イソフルラン麻酔レベルを確認し、必要に応じて補充してください。ガスを入れる前に酸素ボンベのレベルを確認してください。木炭の重さを量り、容器に記録します。
- イメージングプラットフォームの近くに消耗品を配置して、イメージングスペースを設定します。消耗品には、カット済みテープ、脱毛クリーム、ガーゼ、綿棒、オートクレーブ水、角膜潤滑剤、潤滑ジェル、直腸温プローブ、電極リード、超音波ゲル、電極ゲル(該当する場合)、およびヒートランプが含まれます(図1A)。
- 超音波装置の電源を入れ、モーターを初期化します(システムは4DUS画像データを収集することもできます)。超音波システムで新しい実験を設定します: [New Study ]または [New Series ]を選択し、マウス情報を入力します。生理学的モニタリングのためにタブレットの電源を入れます。
- ストップコックをチェックして、流れが誘導ボックスまで開いていて、ノーズコーンまで閉じていることを確認します。気化器で酸素を1 L / minにオンにし、ダイヤルを3%〜5%に回して、麻酔誘導ボックスに事前に充填します。
- マウスをハウジングケージから取り外します。
- 動物が3%〜5%のイソフルランで完全に麻酔されるまで、マウスを誘導ボックスに入れます。
- ストップコックを切り替えて、超音波イメージングプレートのノーズコーンへの流れを変更します。イソフルランダイヤルを1%〜2%の間で回します。
- 誘導ボックスからマウスを取り出し、動物の体重を量ります。動物の体重を記録します。
- マウスをイメージングプレート上の仰臥位に置きます。
- 動物の目に角膜潤滑剤を塗ります。
- 毛皮が存在する場合は、市販の脱毛クリームと綿棒を使用して、イメージング領域から毛皮を取り除きます。スポンジの水でクリームを拭き取り、余分な脱毛クリームを皮膚から取り除き、火傷を防ぎます。
- 動物のポジショニングに応じて、心電図検査(ECG)リード線を胸部と後肢の両側に皮下に挿入します。
- 挿入したら、ECGリード線をテープで所定の位置に保持します。心電図リードを使用しない場合(心電図リードが挿入されていない場合)は、動物イメージングプレートを介して心電図をモニターします。
- 皮膚からプレートへの電気伝導のために、プレート上の導電性ゲルを見つけ、動物の手足を所定の位置に保持します。
- プレートの周りと手足の上にテープまたはゴムバンドを貼って、動物の手足を所定の位置に保持します(図1B)。
- 潤滑ジェルを使用して直腸温プローブを挿入し、プローブをテープで固定します。
- タブレットで心電図、呼吸、体温の信号を確認します。心拍数が~350-600 bpm、呼吸が~50-100呼吸/分、直腸温が35-37°Cであることを確認してください。 必要に応じてイソフルランレベルを調整します。
- 必要に応じて、ヒートをオンにしますlamp (例:250 W 赤外線温暖電球)14 コア温度を維持するように高さを調整します(図1C)。
- ヒートlを置きますamp 動物から12インチ以上離れて。球根と動物の間の最適な距離を決定するための初期研究では、高さを調整し、赤外線温度計を使用して皮膚温度を記録します(これは42°Cを超えてはなりません15)。
- 心臓4D超音波
- トランスデューサーをホルダーのセミロック位置に置きます。
- トランスデューサー上の隆起したドットを、画面上の青いドットに向けます。慣例は、ドットを動物の右側に配置することです。
- トランスデューサーを回して、マウスの矢状面に沿って向きを変え、隆起したノッチが尾方向を指すようにします。
- 超音波プレートの基部にあるレバーを使用して、動物を傾けます。トランスデューサーの基部にあるレバーを使用して、トランスデューサーの角度を調整します。
- 胸腔の腹面に十分な量の超音波ゲルを塗布して、皮膚表面とトランスデューサーとの間の音響結合を行います。カップリングする前に、毛皮が残っていないことを確認してください。
- トランスデューサーを下げて、超音波ゲルに接触させます。
- プレートの基部にあるX / Yノブで微調整を行うか、プレート全体を動かして大きな調整を行います。
- 胸骨傍の長軸ビューに、頂点、左心室流出路、および大動脈が画面上で水平に整列し、より正確な短軸画像が得られることを確認します(図2A、B)。
- 下隅にある[ 画像に名前を付け ]を選択して、画像を現在のシリーズに保存します。
- 探触子を時計回りに90°回転させて、傍胸骨短軸ビューに切り替えます(図2C)。
注:最高の4D画像品質を得るには、ステッピングモーターを心室の胸骨傍長軸に沿って位置合わせするようにしてください。これは、必ずしも胸骨と直接平行であるとは限りません。心臓/ LVは、多くの場合、左下向きの角度にあります。 - 左心室が画面の右側に表示され、右心室が画面の左側にあることを確認します(図2D)。
- マウスの呼吸リズムが安定している場合は、画像の左上隅にある 心電図ボックス を押して、4D画像の呼吸ゲーティングをオンにします。安定していない場合は、後処理中にこの手順を完了します。
- 画面の左上隅にある立方体を選択して、4D画像を設定します。
- トランスデューサー の開始 位置と 停止 位置を調整する前に、トランスデューサーをリセットしてください。
- 開始位置を頂点のすぐ下に調整し、停止位置を大動脈弓に調整します。
- [ステップ サイズ] を 0.08-0.13 mm に、[フレーム レート] を 200-300 Hz に設定します。
注:ステップサイズが小さいほど、分析用の画像解像度が向上する可能性がありますが、取得時間が長くなります。データがほぼ完璧な左心室アライメントで収集され、分析中に方向を変える必要が最小限またはまったく必要ない場合は、より大きなステップサイズが許容されます。心拍数が高い動物(>450 bpm)を扱う場合は、フレームレートを上げることを検討してください。 - スキャンを実行する前に、バイタルサインとEKG信号が一貫して安定している(>350 bpmおよび50 resp/minを超える呼吸)ことを確認してください。
- スキャンと処理が完了したら、 後処理用のEKV/4Dデータの保存 と 呼吸ゲーティング をオンにします。
- 右下の 「画像に名前を付け る」を選択し、名前にマウスIDを含めます。
- 画質を確認するには、 More Controls をクリックし、 4Dにロードを選択します。
- 心臓の各平面ビューを確認し、心臓の中心が心周期全体で動かないことを確認します。中心の動きは、心電図および/または呼吸ゲーティングの変動性を示し、したがって分析プロセスを複雑にします。モニターを再調整し、必要に応じてスキャンを繰り返します。
- 心臓4D超音波解析
- スタディブラウザに移動します。すべてのB-Mode 2D画像をVevo Labにエクスポートし、4Dデータを他のファイルタイプとしてエクスポートし、ハードドライブに「.raw」データ形式を選択します。
注: この作業で使用されている4Dグラフィカルユーザーインターフェースツールボックスは、現在公開されていません。アクセスと詳細な手順については、パデュー大学のCraig Goergen博士にお問い合わせください。 - VevoLabソフトウェアを使用して、4Dデータの代替解析を実現します。このフレームワークを使用するには、マシンから4DデータをVevo Labファイルにエクスポートします。
- スタディブラウザに移動します。すべてのB-Mode 2D画像をVevo Labにエクスポートし、4Dデータを他のファイルタイプとしてエクスポートし、ハードドライブに「.raw」データ形式を選択します。
- 血管イメージング
- 頸動脈のBモード画像の場合は、超音波トランスデューサーを頸動脈と平行、正中線の近くに配置します。
- 頸動脈が見えたら、トランスデューサーを上に移動して頸動脈分岐を見つけます。
- 頸動脈の分岐点が鮮明に写った場合は、ゲイン設定を35dBに調整し、Bモードの画像を撮影します。
- トランスデューサーを左または右に傾けると、画像が改善される場合があります。探触子またはステージの角度を調整して、対象の容器が探触子と直接平行にならないようにします。これにより、ドップラー角を60°未満に保つことができます。それ以外の場合は、+/- 15°のシフトが必要になる場合があります。
- パルス波ドップラーモードに切り替えて、速度測定値を取得します。
- サンプル量を容器の中央に置きます。カーソルの角度を調整して、頸動脈と平行になるようにします。次に、 再生 を押して速度測定を開始し、 保存 して記録します。
- 頸静脈のBモード画像の場合は、超音波トランスデューサーを頸静脈と平行に配置します。頸静脈は頸動脈の前方および外側にあります。
- 頸静脈が見つかったら、トランスデューサーを内部頸静脈と外部頸静脈が合流する場所に移動します。鮮明な画像が見つかったら、ゲイン設定を35dBに調整し、Bモード画像をキャプチャします。
- パルス波ドップラーモードに切り替えて、速度測定値を取得します。
- サンプル量を容器の中央に置きます。カーソルの角度を調整して、頸静脈と平行になるようにします。次に、 再生 を押して速度測定を開始し、 保存 して記録します。
- 血管超音波解析
- Bモード画像とパルス波ドップラー測定を収集した後、ソフトウェアを使用して直径と速度を測定します。
- 画像がソフトウェアに読み込まれたら、 血管パッケージを選択します。
- 容器の両側を選択して、全径を取得します。
- 頸動脈については、血管パッケージの 直径 オプションを使用して、収縮期と拡張期の直径測定を行います。
- vascularパッケージ の速度オプションを使用して速度 測定を行います。
- 頸動脈については、収縮期の速度測定の最高ピークと拡張期の速度測定の最低ピークを選択します。
- 直径の値を使用して、次の式を使用してグリーン ラグランジュひずみテンソルの円周成分を計算します。
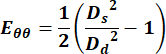 (1)
(1)
ここで、D sは収縮期の直径を表し、Ddは拡張期の直径を表します。 - 頸静脈については、サイクル全体の任意の点を選択して速度測定値を取得します。
2.安楽死と組織採取
- ティッシュを瞬間凍結するためのアルミホイルボートを準備します(図3)。
- 研究の最後に、イソフルランの過剰摂取により動物を5%濃度で安楽死させ、両側気胸または子宮頸部脱臼(心臓研究のみ)のいずれかで安楽死させます。
- 鉗子を使用して皮膚をテントで固定し、血管系の場合は首の上のはさみで、心臓の場合は胸骨のすぐ下をはさみで切ります。
- 皮膚と筋肉の層を切って血管系を露出させるか、骨を切開して心臓を露出させます。
- 綿棒による鈍い解剖を使用して、脂肪を含む周囲の組織から心臓または血管系を分離します。頸動脈血管を神経から分離するようにしてください。手術器具を使用して心臓と血管を取り除きます。
注:縫合糸は、血管を除去する前に近位および遠位を縫合することにより、血管系を除去するために使用できます。 - 事前にラベル付けされたアルミホイルボートにティッシュを置き、ボートを液体窒素に入れます(図3)。
- 凍結切片の時間まで組織を-80°Cで保存します。ティッシュをドライアイスで輸送し、温度を維持します。
3. 質量分析イメージング
- クライオセクショニングとスライドガラスへの最適切断温度(OCT)の取り付け
- クライオスタットの温度を-25°Cに設定し、ブレードを挿入します。
- OCTを塗布し、クライオスタット内で凍結させて金属チャックを準備します。
- OCTを使用して、準備した金属チャックに心臓の基部を固定します(図4A)。OCTは質量スペクトルを汚染し(ポリエチレングリコール[PEG]汚染)、目的の脂質シグナルを抑制するため、OCTがサンプルの対象領域に触れないようにしてください。
注:試料の汚染を避けるために水マウントを実行するオプション。手順については、以下の追加のプロトコルを参照してください。 - この方法論における空間的なアライメントの重要性に基づいて、MATLAB GUIによって与えられた心臓のスケーリングされたデジタルレンダリングを使用して、セクショニングをガイドします(図4B)。
- 切片作成中に各回転数(10 μm)を数え、スライドにマウントする各スライスの深さをミリメートル単位で記録します。
注:MATLABが提供する超音波データのデジタルレンダリングと正確に一致させるためには、心臓または血管系の特定の位置を追跡する必要があります。 - 組織切片(厚さ10 μm)を顕微鏡スライドに融解します。
注:スライドの種類は、使用する質量分析計によって異なります。各スライドには、心臓の各領域から1つのセクションが含まれています。最低3枚のスライドが必要です(ポジティブイオンモード、マイナスイオンモード、エクストラ)。 - n = 1/グループの場合、長軸を介して心臓を切片にして、頂点から基部までの分子変化を視覚化します。
- 血管系の場合、組織をゼラチンに埋め込み、切片化11の前に瞬間凍結します。
- スライドは、質量分析イメージング実験まで-80°Cのスライドメーラーに保管してください。
- 液体クロマトグラフィー質量分析(LC-MS)を実施して脂質または代謝物をさらに同定および定量する場合は、~60-100 μm の連続組織切片を切片化し、凍結する前に 0.5-2 mL のチューブに収集します。
- スライドガラス上のクライオ切片および水埋込組織
- ビーカーに高速液体クロマトグラフィー(HPLC)水を入れ、5 mL と 1 mL のシリンジを取っておきます。
- クライオスタットの温度を-25°Cに設定し、ブレードを挿入します。
- 一対の鉗子をクライオスタットに入れて冷却してから取り付けます。
- 5 mLのHPLC水をシリンジに汲み上げ、クライオスタットに入れます。
- シリンジが完全に凍結する直前に、金属チャックに水を空にし、完全に凍結させます。
- 1 mLのHPLC水を汲み上げ、シリンジをクライオスタットに入れます。
- 約30〜60秒後、部分的に固化した水の小さな点をチャックの中央に置きます。すぐに鉗子で心臓をつかみ、完全に凍る前にドットに入れます。周囲の水が完全に凍るまで、心臓を所定の位置に保持します。
注:心臓は、関心のある領域に応じて、頂点または基部で取り付けることができます。この研究では、頂点を外側に向けてベースを取り付けます。 - この方法の残りの手順は、手順 3.1 で説明した手順として実行します。
- マトリックスアプリケーション
- スライドを冷凍庫から取り出し、スライドが乾くまでデシケーターに入れます。
- HTX M3 +噴霧器の電源を入れ、ラップトップでHTXアプリを開き、画面の中央で方法を選択します。標準マトリックス濃度は、保存されたメソッド(OI_usermethods >マトリックス>画面左側のメソッド)にあります。
- この作業では、ノズル温度を75°C、流量を100μL / min、圧力を10psiに設定します。
- サンプル名、極性、マトリックス、溶媒、濃度をラボノートに記入します。濃度あたりに必要なマトリックスの量を計算します(例:10 mg/mL = 50 mgのマトリックスで5 mL)。
- 溶媒(例:70%MeOH)を作ります。
- この作業では、ポジティブモード用に40 mg/mLの2,5-ジヒドロキシ安息香酸(DHB)マトリックス溶液を、ネガティブモード用に10 mg/mLの9-アミノアクリジン(9AA)マトリックス溶液を調製します。両方のマトリックスを70%MeOH溶媒で作製します。その他の一般的な行列とスプレーパラメータについては、3.3.2の手順に従ってください。
- マトリックスを秤量し、マトリックスを15 mLのコニカルチューブに加えます。金額がステップ 3.3.3 で計算された必要金額に近いことを確認しますが、正確である必要はありません。測定された質量に基づいて溶媒量を計算します。
- ピペットを使用してコニカルチューブに溶媒を追加します。
注意: 体積は、手順3.3.5で測定した質量に基づいています。 - 混合物を10分間超音波処理します。マトリックスが超音波処理されている間に、スライドをデシケーターから取り外します。
- 噴霧器トレイを開き、スライドを左下隅に置き、端をテープで留めます。
注意: テープの一方の端を折りたたむと、簡単に取り外せます。 - サンプルのスプレー領域を選択します。トレイを閉じます。
- シリンジとフィルターを使用してマトリックスをシリンジに注ぎ、次にシリンジを介してマトリックスをろ過し、噴霧器の左側に黒い蓋があるバイアルに入れます。
- バイアルを噴霧器の元の場所に戻し、Dラインチューブをバイアルに挿入します。
注意: チューブがバイアルの底に触れていないか、液体に完全に浸されていることを確認してください。 - 不活性ガスをオンにし、噴霧器のゲージが10psiを示していることを確認します。 スタートを押します。噴霧器が希望の温度になったら、点滅 開始を選択します。
- スプレーが完了したら、トレイを開き、サンプルを取り出し、MALDIスライドホルダーに入れるか、デシケーターに戻します(図4C)。
- MALDIスライドホルダーをスキャンしてスキャナーでスライドするか、電話で写真を撮ります。MSIで使用するために、画像をフラッシュドライブに保存します。
- 噴霧器で適切な 洗浄 または 次のスプレー を選択します。洗浄する場合は、Dラインをマトリックスバイアルから廃棄物ビーカーに移動します。
- メタノールをトレイにスプレーし、拭いて清掃します。窒素をオフにしてください。
- マルディMSI
- コンピュータでSynaptに移動し、極性が必要なモードに変更されていることを確認し、そうでない場合は切り替えます。
- MALDIソース上の装置にスライドをロードし、ソフトウェアを使用してコンピューターの ロード ボタンをクリックします。
- イメージ (手順 1.2.17) を Project フォルダーの Images フォルダーに移動します。
- HD Imagingに移動し、前のプロジェクト(同じマトリックスを使用するプロジェクト)を開きます。
- 実験ノートで、質量範囲を記録し、衝突エネルギー、レーザーエネルギー、ネガティブ/posモードをトラップして伝達します。
- HD Imagingで、白いページアイコンに移動します。次に、ドロップダウン矢印をクリックして、 新しいプレートを選択します。
- プロジェクトフォルダ>イメージフォルダで画像を参照して見つけ、開きます。
- プレートタイプを MALDIスタンダード に変更し、プレートのエッジを定義します(以下に示す赤いプラス記号で示されている4つのコーナーを選択します)。
注意: 左上のボックスは、各コーナーに移動するためのものです。右上のボックスはコーナーを選択するためのものです。一番下のボックスは、スライド全体を視覚化するためだけのものです。 - 左上隅にある小さな パターン タブに移動し、 鉛筆 またはその他の長方形または円のオプションをクリックして、組織の輪郭を描きます。左クリックでティッシュの輪郭を描き、右クリックして終了します。
- ピクセル サイズのデフォルトは 50 μm です。必要に応じて変更します。
- 「 名前を付けて保存 」をクリックし、「 Project Imaging AcqFolder」に移動し 、ラベルをスライド名(YYYYMMDD 形式)として指定します。その後、保存します。
- 上部中央の[ Mass Lynx ]ボタンをクリックして、Mass Lynxにエクスポートします。
- Mass Lynxソフトウェアに移動します。
- 「ファイル」をクリックして>プロジェクトフォルダを開きます。ファイル名とテキスト名をスライド(YYYYMMDD形式)に編集します。
- MSファイルを右クリックし、現在のスライドを参照して選択します。
- MSファイルを再度右クリックし、[ 編集]をクリックします。青いボックスを左ダブルクリックします。
- スキャン条件に移動します。ソース設定を見つけて、ユーザー定義に変更します。次に、 現在のスライド>取得したフォルダー>正しいプロジェクトフォルダーに移動します>OK。
- [ 名前を付けて保存 ]をクリックして保存し、スライド名を含めます。
- 参照化合物(赤リンなど)を使用して装置を校正します
- Synapt(キャリブレーション)に移動します。 再生 ボタンをクリックすると、データの取得が開始されます。ラベルを「YYYYMMDD_cal1」にします(例: 20230614_cal1)。
- 質量範囲が50〜2000と同じであることを確認してください。レーザーエネルギーは約175です。
- ファイアレーザー 再生を押してから、[ 次へ ]ボタンをクリックします。約15または20まで実行します。 赤いストップをクリックします。
- W Consoleに移動します。
- キャリブレーションを作成し、[ 開始]をクリックします。 キャリブレーションプロファイルエディタで、[ ファイル] > [新規] をクリックします。 「YYYYMMDD_cal1」と入力します。
- 質量範囲をプロジェクトの目的の質量範囲(50-2000 など)に編集します。
- 手動キャリブレーションを選択します。解決モードを選択し、[編集]をクリックします。参照化合物として赤リンを選択します。
- 生データファイルをクリックし、一番下までスクロールします(取得したばかりのファイルになっているはずです)。
- 下部の履歴に移動し、[ Acc mass > okay > okay]を選択します。
- スタートボタンが表示されるまで[次へ]をクリックし続け、[OK]をクリックして、[スタート]を押します。
- 緑色のチェックに移動し、見つからなかったピークを確認します。
- Mass Lynxに移動します(実験サンプルの実際の分析を開始します)。
- 再生ボタンを押して、サンプル数が正しいことを確認します
- [HD イメージング] に移動します。
- ピクセルサイズが元のサイズと同じであることを確認します
- Synaptに移動して極性を確認します。
- カメラボタンをクリックして、 カメラ が動いてレーザーを発射していることを確認します。
- データが収集されていることを確認してください。取得した質量スペクトルは、Synaptページに表示されます。
- MS分析
- 分析には、HDイメージングソフトウェアとMass Lynxを使用します。
- HD Imagingの[ Process ]タブを使用して、イメージングデータを処理します。
- 分子イオン画像(MS画像とも呼ばれる)をHDイメージングの [解析 ]タブで可視化します。分子イオン画像のヒートマップは、ある領域におけるそのm/zイオンの強度を示しています(図5)。MS画像のオーバーレイを使用して、分子の空間分布を示します(図6 および 図7)。
- TICまたはイメージングの適切な正規化を使用してデータを正規化します。
- 関心領域と空間的に相関するm/zピークを特定します。HD Imagingで空間相関(R > 0.65)を実行し、共局在するピークを特定します。
- これらのピークの推定脂質同定をLipidMaps16 およびMETASPACE17で検索します。
- 脂質アノテーションを後続のLC-MSデータで確認します。Metaboanalystを使用して、LC-MSデータの統計解析を行います。
結果
上記のイメージングプロトコルは、心筋梗塞(MI)リモデリングと血管老化の2つの予備研究に使用されました。心臓実験では、急性心筋梗塞を誘発するために永久的な冠動脈結紮手術が行われた18,19。4D超音波とMALDI MSIを同じ組織で漸進的に実施し、生理学的および分子的変化を明らかにしました。梗塞性心臓の代表的な分子?...
ディスカッション
米国のイメージングはオペレーターに依存する場合がありますが、解剖学的ランドマークの使用と適切なトレーニングにより、ユーザーの偏見を抑えることができます。2D超音波は、ビューが角度に依存するため、ユーザー間の変動に特に影響を受けやすいのに対し、4DUSは取得が全ボリュームを網羅し、角度に依存しないため、影響を受けにくくなります。また、調...
開示事項
クレイグ・J・ゲルゲンは、富士フイルムビジュアルソニックスの有給コンサルタントです。
謝辞
アリソン・ジョーンズは、テネシー大学機械・航空宇宙・生物医学工学科大学院フェローシップの支援を受けています。この出版物で報告された研究(Conner Earl)は、国立衛生研究所F30HL162452の国立心臓、肺、血液研究所によって支援されました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 2,5-dihydroxybenzoic acid (DHB) | Supelco, >99.0% (HPLC) | 85707-10MG-F | DHB matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sigma/85707?cm_sp=Insite-_-wimsShippingEmailRecs_wims EmailAPI_wimsGruCrossEntropy-_-wimsEmailAPI10-3 |
| 9-aminoacridine (9AA) | Supelco, ≥99.5% (HPLC) | 92817-1G | 9-Aminoacridine matrix substance for MALDI-MS; https://www.sigmaaldrich.com/US/en/product/sial/92817?srsltid=AfmBOooiQjQ4pWv_XxITkU 4Lkm0UnHXKekGS_ dFl7V40V9QLWoPpNLoc |
| Aquasonic Ultrasound Gel | Parker Laboratories | Parker 01-02 | Ultrasound Gel; https://www.parkerlabs.com/products/aquasonic-100-ultrasound-transmission-gel/ |
| Benchtop Dewar Flasks | ThermoScientific | 4150-2000 | Container for liquid nitrogen; https://www.thermofisher.com/order/catalog/product/4150-4000?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sQVc2f-NxN04Nb5Mv F6TZ7GLHWWDEeqDYmEvtKJSQ YHDeVgZ9qylvYaAs27EALw_wcB &source=google_shopping&ISO_ CODE=us&LANG_CODE=en&ef_id =Cj0KCQjwpvK4BhDUARIsADHt9 sQVc2f-NxN04Nb5MvF6TZ7GLHWWDE eqDYmEvtKJSQYHDeVgZ9qylvYa As27EALw_wcB:G:s&s_kwcid=AL!3652 !3!716188292869!!!g!2366243726129 !!21787513085!171591181194&ev_chn =shop&cid=0se_gaw_30092024_ PBYTXL&source=google_shopping &ISO_CODE=us&LANG_CODE= en&gad_source=1 |
| Cryostat | Leica Biosystems | CM Series | https://www.leicabiosystems.com/us/histology-equipment/cryostats/ |
| Dessicator | VWR | 89054-052 | https://us.vwr.com/store/product/9104882/desiccator-plastic-ace-glass-incorporated |
| Epredia MX35 Premier Disposable Low-profile Microtome Blades | Fisher Scientific | 3052835 | Cryostat blade; https://www.fishersci.com/shop/products/mx35-premier-disposable-low-profile-microtome-blades/3052835 |
| Falcon 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | Conical Tubes; https://www.fishersci.com/shop/products/falcon-15ml-conical-centrifuge-tubes-5/1495953A?gclid=Cj0KCQjwpvK4BhDUARIsA DHt9sSBcy5n-lhShligJUOX5KKVGn0bt87 8AB2_muOD2PPTue1phpZgeqwa AqgiEALw_wcB&ef_id=Cj0KCQjw pvK4BhDUARIsADHt9sSBcy5n-lhS hligJUOX5KKVGn0bt878AB2_muO D2PPTue1phpZgeqwaAqgiEALw_ wcB:G:s&ppc_id=PLA_goog_20861 45674_81843405034_1495953A__ 386247001345_165426395473886 37329&ev_chn=shop&s_kwcid=AL!4428!3 !386247001345!!!g!856907751004!& gad_source=1 |
| Flex-Tubes Microcentrifuge Tubes | Eppendorf | EP022364120 | Centrifuge tubes; https://www.sigmaaldrich.com/US/en/product/sigma/ep022364120?utm_source=google%2Cgoogle&utm _medium=organicshopping%2Ccpc&utm _campaign=21043330280&utm_ content=&gclid=Cj0KCQjwpv K4BhDUARIsADHt9sTHRD35k CHPtfI2A41axodnMVr6a1eBKk zM4bSUYQAyfEKo3UgTAEQa Ap7wEALw_wcB |
| Gas Nitrogen | Airgas | N/A | |
| Glass microscope slides | Electron Microscopy Sciences | 71873-02 | https://www.emsdiasum.com/positive-charge-microscope-slides |
| Liquid Nitrogen | Airgas | N/A | |
| Mass Spectrometer | Waters | Synapt G2-Si | https://www.waters.com/waters/en_US/SYNAPT-G2-Si-Mass-Spectrometry/nav.htm?locale=en_mkcid=1000251Foodety%3C/a%3E&cid=134740653&bcid= 134528734 |
| Matrix Sprayer | HTX Technologies | M3+ | https://www.htximaging.com/htx-m3-sprayer |
| Methanol (HPLC), >99.9% | Fisher Chemical | A4524 | Methanol; https://www.fishersci.com/shop/products/methanol-hplc-fisher-chemical-9/A4524?crossRef=A4524#?keyword=A4524 |
| Preclinical Ultrasound System | FUJIFILM VisualSonics | Vevo 3100 | https://www.visualsonics.com/product/imaging-systems/vevo-3100; Vevo F2 has replaced the Vevo 3100 in production. System includes isoflurane vaporizer and induction box. |
| Reynolds Wrap | N/A | N/A | Aluminum foil |
| Signagel Electrode Gel | Parker Laboratories | Parker 15-60 | Electrode Conducting Gel; https://www.parkerlabs.com/products/signagel-electrode-gel/ |
| Sterile Lubricating Jelly | Medline | MDS032273Z | Lubricating Gel; https://www.medline.com/ce/product/Sterile-Lubricating-Jelly/Lubricating-Jelly/Z05-PF03664?sku=MDPMDS032273H |
| Surgical instruments: scissors, forceps/tweezers, sutures | Fine Science Tools | 11252-00, 11050-10, 14016-14, 14084-08, 15000-08 | info@finescience.com |
| Surgical Sponges 200 Pack –Gauze Pads Non sterile -First Aid Wound Care Dressing Sponge –Woven Medical Nonstick, Non Adherent Mesh Scrubbing | Medpride | B08RZGQ5GW | Gauze; https://www.amazon.com/Medpride-Surgical-Sponges-200-Pack/dp/B08RZGQ5GW/ref=asc_df_B08RZGQ5GW/?tag=hyprod-20&linkCode=df0&h vadid=693270340506&hvpos= &hvnetw=g&hvrand=960915122 2290977669&hvpone=&hvptwo= &hvqmt=&hvdev=c&hvdvcmdl=& hvlocint=&hvlocphy=9192978&hv targid=pla-1245491514869&psc= 1&mcid=33f4d647c88630c79116 888d565a63b0 |
| Tissue-Plus O.C.T. Compound | Fisher Scientific | 23-730-571 | OCT; https://www.fishersci.com/shop/products/tissue-plus-o-c-t-compound-2/23730571 |
| Wood Handled Cotton Swabs and Applicators | Fisherbrand | 22-363-160 | Cotton swab; https://www.fishersci.com/shop/products/wood-handled-cotton-swabs-applicators-8/p-7146852 |
参考文献
- Tsao, C. W., et al. Heart disease and stroke statistics-2022 update: A report from the American Heart Association. Circulation. 145 (8), E153-E639 (2022).
- Kassab, G. S. Biomechanics of the cardiovascular system: The aorta as an illustratory example. J R Soc Interface. 3 (11), 719-740 (2006).
- Moore, J. E., Xu, C., Glagov, S., Zarins, C. K., Ku, D. N. Fluid wall shear stress measurements in a model of the human abdominal aorta: Oscillatory behavior and relationship to atherosclerosis. Atherosclerosis. 110 (2), 225-240 (1994).
- Nerem, R. M. Vascular fluid mechanics, the arterial wall, and atherosclerosis. J Biomech Eng. 114 (3), 274 (1992).
- Cecchi, E., et al. Role of hemodynamic shear stress in cardiovascular disease. Atherosclerosis. 214 (2), 249-256 (2011).
- Good, B. The influence of blood composition and loading conditions on the behavior of embolus analogs. J Mech Behav Biomed Mater. 140, 105738 (2023).
- Bao, G., et al. Molecular biomechanics: The molecular basis of how forces regulate cellular function NIH public access. Mol Cell Biomech. 3 (2), 91-105 (2010).
- Schwamborn, K., Caprioli, R. M. Molecular imaging by mass spectrometry-looking beyond classical histology. Nat Rev Cancer. 10 (9), 639-646 (2010).
- Soepriatna, A. H., Kevin Yeh, A., Clifford, A. D., Bezci, S. E., O'Connell, G. D., Goergen, C. J. Three-dimensional myocardial strain correlates with murine left ventricular remodelling severity post-infarction. J R Soc Interface. 16 (160), 20190570 (2019).
- Damen, F. W., et al. High-frequency 4-dimensional ultrasound (4DUS): A reliable method for assessing murine cardiac function. Tomography. 3 (4), 180-187 (2017).
- McDonald, R., Poulos, D., Gutzwiller, L., Sheth, R. A., Good, B., Crouch, A. C. A MALDI mass spectrometry imaging sample preparation method for venous thrombosis with initial lipid characterization of lab made and murine clots. J Am Soc Mass Spectrom. 34 (9), 1879-1889 (2023).
- Benetos, A., et al. Influence of age, risk factors, and cardiovascular and renal disease on arterial stiffness: Clinical applications. Am J Hypertens. 15 (12), 1101-1108 (2002).
- Pistner, A., Belmonte, S., Coulthard, T., Blaxall, B. C. Murine echocardiography and ultrasound imaging. J Vis Exp. (42), v2100 (2010).
- Bellantuono, I., et al. A toolbox for the longitudinal assessment of healthspan in aging mice. Nat Protoc. 15 (2), 540-574 (2020).
- Henriques, F. C., Moritz, A. R. Studies of thermal injury: I. The conduction of heat to and through skin and the temperatures attained therein. A theoretical and an experimental investigation. Am J Pathol. 23 (4), 530 (1947).
- Conroy, M. J., et al. LIPID MAPS: Update to databases and tools for the lipidomics community. Nucleic Acids Res. 52 (D1), D1677-D1682 (2024).
- Palmer, A., et al. FDR-controlled metabolite annotation for high-resolution imaging mass spectrometry. Nat Methods. 14 (1), 57-60 (2016).
- Michael, L. H., et al. Myocardial ischemia and reperfusion: A murine model. Am J Physiol. 269 (6 Pt 2), H2147-H2154 (1995).
- Clark, J. E., Flavell, R. A., Faircloth, M. E., Davis, R. J., Heads, R. J., Marber, M. S. Post-infarction remodeling is independent of mitogen-activated protein kinase kinase 3 (MKK3). Cardiovasc Res. 75 (3), 523-530 (2007).
- Hattori, Y., Konno, H., Abe, M., Miyoshi, H., Goto, T., Makabe, H. Synthesis, determination of the absolute configuration of tonkinelin, and inhibitory action with bovine heart mitochondrial complex I. Bioorg Med Chem. 15 (8), 3026-3031 (2007).
- Golam Mostofa, M., et al. CLIP and cohibin separate rDNA from nucleolar proteins destined for degradation by nucleophagy. J Cell Biol. 217 (8), 2675-2690 (2018).
- Chan, J. N. Y., Poon, B. P. K., Salvi, J., Olsen, J. B., Emili, A., Mekhail, K. Perinuclear cohibin complexes maintain replicative life span via roles at distinct silent chromatin domains. Dev Cell. 20 (6), 867-879 (2011).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. Am J Physiol Heart Circ Physiol. 322 (3), H359-H372 (2022).
- Kaya, I., Sämfors, S., Levin, M., Borén, J., Fletcher, J. S. Multimodal MALDI imaging mass spectrometry reveals spatially correlated lipid and protein changes in mouse heart with acute myocardial infarction. J Am Soc Mass Spectrom. 31 (10), 2133-2142 (2020).
- Tressler, C., et al. Factorial design to optimize matrix spraying parameters for MALDI mass spectrometry imaging. J Am Soc Mass Spectrom. 32 (12), 2728 (2021).
- Zhang, L., et al. Vascular lipidomics analysis reveals increased levels of phosphocholine and lysophosphocholine in atherosclerotic mice. Nutr Metab. 20 (1), 1-16 (2023).
- Kohno, M., et al. Induction by lysophosphatidylcholine, a major phospholipid component of atherogenic lipoproteins, of human coronary artery smooth muscle cell migration. Circulation. 98 (4), 353-359 (1998).
- Crouch, A. C., Batra, A., Greve, J. M. Hemodynamic response to thermal stress varies with sex and age: A murine MRI study. Int J Hyperthermia. 39 (1), 69-80 (2022).
- Crouch, A. C., Scheven, U. M., Greve, J. M. Cross-sectional areas of deep/core veins are smaller at lower core body temperatures. Physiol Rep. 6 (16), e13839 (2018).
- Crouch, A. C., Castle, P. E., Fitzgerald, L., Scheven, U. M., Greve, J. M. Assessing structural and functional response of murine vasculature to acute β-adrenergic stimulation in vivo during hypothermic and hyperthermic conditions. Int J Hyperthermia. 36 (1), 1136-1145 (2019).
- Crouch, A. C., Manders, A. B., Cao, A. A., Scheven, U. M., Greve, J. M. Cross-sectional area of the murine aorta linearly increases with increasing core body temperature. Int J Hyperthermia. 34 (7), 1121-1133 (2018).
- Clift, C. L., Mehta, A., Drake, R. R., Angel, P. M. Multiplexed imaging mass spectrometry of histological staining, N-glycan and extracellular matrix from one tissue section: A tool for fibrosis research. Methods Mol Biol. 2350, 313-329 (2021).
- Salehi, H. S., et al. Coregistered photoacoustic and ultrasound imaging and classification of ovarian cancer: Ex vivo and in vivo studies. J Biomed Opt. 21 (4), 046006 (2016).
- Verbeeck, N., et al. Connecting imaging mass spectrometry and magnetic resonance imaging-based anatomical atlases for automated anatomical interpretation and differential analysis. Biochim Biophys Acta. 1865 (7), 967-977 (2017).
- Yang, E. Y., et al. Real-time co-registration using novel ultrasound technology: Ex vivo validation and in vivo applications. J Am Soc Echocardiogr. 24 (7), 720 (2011).
- Maris, L., et al. Method for co-registration of high-resolution specimen PET-CT with histopathology to improve insight into radiotracer distributions. EJNMMI Phys. 11 (1), 1-20 (2024).
- Lin, B. J., et al. MSIr: Automatic registration service for mass spectrometry imaging and histology. Anal Chem. 95 (6), 3317-3324 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved