需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在单受试者水平使用 2-脱氧-2-[18F] 氟-D-葡萄糖动态正电子发射断层扫描研究代谢脑连接
摘要
获取动态正电子发射断层扫描 (PET) 数据并重建到时间框架中,可以在单个受试者水平进行代谢脑连接分析。我们描述了一种获取大鼠大脑的 [18F] FDG 动态 PET 数据并通过提取感兴趣体积的时间 - 活动曲线获得连接矩阵的方法。
摘要
时至今日,代谢脑连接主要是通过获取多个受试者的静态正电子发射断层扫描 (PET) 数据在群体水平上进行研究。我们的研究小组目前正在研究大鼠脑内出血后多个时间点代谢连接的变化。为了研究受试者内代谢脑连接,需要不同大脑区域示踪剂摄取的时间信息,这可以通过动态 PET 来实现。在本出版物中,我们详细介绍了我们的数据采集和分析协议。
使用 2-脱氧-2-[18F] 氟-D-葡萄糖 ([18F]FDG) 作为示踪剂,在专用的临床前 PET 系统上获取大鼠脑的动态 PET 数据。示踪剂在 PET 扫描开始时作为推注静脉注射。在 60 分钟的采集过程中,用美托咪定对动物进行镇静。
采集后,使用迭代重建算法 (Maximum-Likelihood Expectation-Maximization) 将 PET 数据重建为 32 分钟的时间框架。由多个感兴趣体积 (VOI) 组成的打包图谱用于提取每个 VOI 的时间-活动曲线,然后用于计算每对 VOI 之间的皮尔逊相关系数。
这种动态 PET 协议能够评估两次单次扫描之间的代谢连接差异,而不是扫描组之间的代谢连接差异。这种方法允许研究单个受试者在不同时间点的代谢连接变化,或将个体的代谢连接与正常数据库进行比较。这种比较可能有助于跟踪疾病进展或帮助诊断以大脑区域之间交流中断为特征的神经系统疾病,例如癫痫或痴呆。
引言
正电子发射断层扫描 (PET) 是一种常用于研究和临床环境的分子成像技术。由于各种 PET 示踪剂的发展,PET 可用于研究疾病病理生理学并监测疾病进展和对治疗的反应1。使用最广泛的放射性示踪剂之一是 2-脱氧-2-[18F]氟-D-葡萄糖 ([18F]FDG),它允许对葡萄糖代谢进行成像,指示细胞活化。它在肿瘤学中用于诊断、分期和预后;在神经病学中,通常在神经退行性疾病(如痴呆)的背景下;在心脏病学中,诊断结节病等疾病,仅举几个例子 1,2,3。
从 [18F]FDG PET 数据获得的代谢性脑连接评估是指不同大脑区域示踪剂摄取之间的功能关系。这种方法可以通过选择一组大脑区域来计算“连接矩阵”,这可以深入了解大脑的不同部分如何相互作用和协同工作。这种类型的分析对于研究健康和疾病中的大脑功能特别有用,包括痴呆、癫痫和其他神经系统疾病等疾病 4,5。
评估代谢性大脑连通性的第一项研究可以追溯到 1980 年代6,但研究人员主要通过弥散加权磁共振成像 (DW-MRI) 探索结构性大脑连通性,也称为“连接组”7。此外,使用功能 MRI (fMRI)、脑电图 (EEG) 和脑磁图 (MEG) 等技术的功能连接已被广泛研究数十年 8,9。
最近,人们对使用 [18F]FDG PET 研究代谢脑连接重新产生了兴趣,不仅单独使用,而且与其他形式的大脑连接相结合10。然而,由于 PET 图像固有的“静态”性质(与功能性 MRI 等相比),绝大多数基于脑网络 PET 的结果都是基于组级分析,其中大脑区域之间的相关性是在受试者间水平计算的。这种限制使得不可能对 PET 图像进行受试者内分析,这对于可以跟踪同一个体内部随时间变化的纵向研究至关重要4。因此,开发允许单主体分析的方法,例如基于动态 PET 的分子连接,是研究网络障碍的大脑研究的一个重要研究方向,因为它为分子网络分析在临床实践中的应用打开了大门。因此,我们的临床前研究使用了动态 PET 数据。
我们的研究小组目前正在进行一项研究,使用大鼠胶原酶模型11 在多个时间点检查受试者内出血后代谢连接的变化。为了研究受试者内代谢脑连接,需要不同大脑区域示踪剂摄取的时间信息,这可以通过动态 PET 获得。在以下部分中,我们详细介绍了数据采集和分析协议。
研究方案
所有程序均符合欧洲指南(指令 2010/63/EU),并且该协议已获得根特大学当地动物伦理委员会 (ECD 23/33) 的批准。该研究包括 12 只 Sprague Dawley 大鼠 (6 只雌性,6 只雄性)。他们的 PET 扫描是使用以下方案在诱导脑出血前 2 周到诱导后 18 周的多个时间点获得的。第一次扫描时,所有动物均为 18 周龄,雌性体重为 244.8 ± 10.1 克(平均 ± SD),而雄性体重为 363.6 ± 13.3 克。
确保放射性物质仅由经过培训的人员处理和处理。将工作人员和动物的剂量保持在合理可达到的低剂量 (ALARA)。
1. 数据采集
注:有关用于数据采集的临床前 PET 成像仪和软件的详细信息,请参见 材料表 。该成像仪是一个 45 个检测器(排列成 5 个环)PET 扫描仪,使用 LYSO 晶体和 SiPM 检测器,覆盖 13 cm 的轴向视场 (FOV) 和 7.6 cm 的跨轴 FOV。该系统的空间分辨率为 850 μm,灵敏度为 12%,能量分辨率为 12.6%12。以下步骤是在考虑到这一点的情况下编写的。
- 在扫描前至少 6 小时,从笼子中取出所有食物,剥夺动物的食物。一旦动物经历了足够的禁食期,就开始准备数据采集,如下所示。
- 打开加热垫,让它升温至 30–35 °C。
- 将动物以 2,000 mL/min 的流速置于充满 5% 医用 O2 中异氟醚的气体麻醉室中,用异氟醚麻醉动物。通过在距离腔室 30 厘米处放置加热灯来帮助维持动物的体温。当呼吸频率为 0.5-1 Hz 时,对动物进行适当麻醉。
- 称量动物。
- 将动物放在加热垫上。使用鼻锥以 500 mL/min 的流速在医用 O2 中注入 2% 异氟醚。根据需要调整异氟醚剂量,以保持动物适当麻醉。
- 剃掉动物肩胛骨之间的一段脖子。
- 示踪剂注射的尾静脉准备:
- 将动物向左或向右转动,并使用加热灯加热它的尾巴,引起血管舒张。
- 取大约 20 cm 的 BTPE-10 管。使用持针器折断 30 G 针的轴,并将其后端的 1-2 mm 插入 PE 管中。在 1 mL 胰岛素注射器中加入生理盐水,然后将针尖插入 PE 管 3-5 mm。用装满注射器的生理盐水预填充 PE 管,并保持生理盐水注射器与 PE 管连接。
- 用乙醇清洁动物的尾巴。取下加热灯。
- 将 PE 管的针尖插入外侧尾静脉。确认针头的正确位置:寻找柱塞向后拉时进入 PE 管的血液,注射时没有阻力,以及注射部位是否形成皮下水泡(表明静脉旁注射)。如果进入不成功,请从尾部取下针头,然后在更近端的切片上重试。
- 在插入部位用一滴速溶胶固定针头,并将 PE 管粘在尾部。
注意: 避免移动 PE 管。如果血液在任何时候进入 PE 管,请立即用生理盐水冲洗以防止堵塞。
- 改用美托咪定镇静剂:
- 将动物俯卧在加热垫上。在每只眼睛上滴一滴眼胶,以防止它们干燥。
- 准备 PE 管 (40–100 cm) 以连接到放置在 PET 扫描仪附近的输液泵。使用持针器折断 30 G 针的轴,并将其背面的 1-2 mm 插入 PE 管。用 30 G 针头填充 1 mL 塑料注射器,其中至少加入 0.2 mL 美托咪定(每只动物),然后将针尖插入 PE 管 3-5 mm。用注射器中的美托咪定预填充 PE 管。
- 将装有美托咪定的注射器放入输液泵中。打开泵,然后单击查找注射器选择正确的注射器 |BD 塑料 | 1 毫升。
- 使用泵喷射 0.005 mL 的 boli,直到 PE 管另一端的针头液滴流出。确保 PE 管中没有气泡。
- 将 PE 管的针头皮下插入动物肩胛骨之间 2-3 毫米。在插入部位用一滴速溶胶固定针头,然后轻轻地将 PE 管粘在动物的背部。
- 根据动物的体重注射体积 v 的美托咪定推注(速率:3 mL/min):
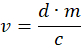
其中 d = 0.05 mg/kg(每公斤动物体重中美托咪定的剂量,单位为 mg), m 是动物的体重(单位为 kg), c 是美托咪定的浓度,单位为 mg/mL。 - 在美托咪定推注后 10 分钟停止异氟醚给药,根据需要调整异氟醚剂量以在此等待期间保持稳定的麻醉。
注意:异氟醚与美托咪定联合使用可显着减慢动物的呼吸频率。在异氟醚停止给药之前,密切监测是必不可少的。 - 停用异氟醚后 5 分钟,开始以以下速率连续输注美托咪定:
r连续 = r • m
其中 r = 0.1 mg/(kg·h);每只动物体重的美托咪定量(以 mg)为单位,以 kg/h 为单位), m 是动物的体重(以 kg为单位)。
注意:在开始扫描之前,开始连续输注后需要再平衡 25 分钟(即停止异氟醚后 30 分钟),以确保动物系统不含异氟醚。在此期间,请继续执行以下步骤。
- PET 扫描仪中的动物定位:
- 用加热垫、压力传感器和纸巾准备扫描仪床。使用传感器监测动物的呼吸频率和纸巾以吸收动物排泄的尿液。
注意:由于美托咪定,动物通常会排泄大量尿液。 - 小心地将动物转移到扫描仪床上,确保美托咪定线和尾静脉导管保持安全。如有必要,使用鼻锥帮助动物的头部尽可能伸直。正确定位后,用胶带固定头部。
- 打开加热垫,验证呼吸频率监测系统是否正常工作,并根据需要调整压力传感器的位置。
- 用加热垫、压力传感器和纸巾准备扫描仪床。使用传感器监测动物的呼吸频率和纸巾以吸收动物排泄的尿液。
- 在开始 PET 扫描前 10 到 5 分钟,在胰岛素注射器中加入大约 20 MBq 2-脱氧-2-[18F]氟-D-葡萄糖 ([18F]FDG),稀释在 0.1-0.8 mL 生理盐水中。
注意: Fluorine-18 (18F) 是一种氟放射性同位素,半衰期为 109.8 分钟。处理放射性物质时,请遵循当地的辐射安全规程。 - 打开扫描仪软件并配置以下扫描参数:选择 18F 作为 同位素 (对衰变校正很重要),输入含有放射性示踪剂的注射器的 测量活性 (以剂量校准器测量的 MBq 为单位)和 测量时间 (信息将保存在元数据中,这是将数据转换为其他单位所必需的,例如标准摄取值)。选择 General 协议并勾选 Automatic sorting after acquisition。将 扫描持续时间 设置为 1 小时,并调整感兴趣区域 (ROI),使其包含整个大鼠大脑(通常位置 2-5)。
- 异氟醚给药停止后 30 分钟后,开始 PET 扫描:
- 同样,按照步骤 1.7.4 中的说明,通过抽吸然后注射少量盐水确认在静脉中的正确位置。
- 用放射性示踪剂注射器更换生理盐水注射器。从 PE 管中取出注射器时,血液可能会进入 PE 管,从而排出盐水。快速插入放射性示踪剂注射器的针头,不要刺穿 PE 管。
- 使用扫描仪软件开始扫描。
- 采集开始后,在大约 0.5-2 秒内将示踪剂作为推注注入。立即用生理盐水注射器更换空的放射性示踪剂注射器,并用大约 0.1 mL 的生理盐水冲洗 PE 管。使用纸巾接住在更换注射器期间可能逸出的任何放射性示踪剂滴剂。
注意:注射示踪剂后,扫描仪软件显示的计数率应迅速增加到 4.5–6.5 Mcps。计数率最初显著低于 4 Mcps,之后增加,表明(部分)静脉旁示踪剂注射。 - 通过测量示踪注射器和可能受污染的组织和手套的活性,评估未注射到动物体内的剩余活性。在扫描仪软件中输入该活动和测量时间,以将其保存在元数据中。
注意:通常为 0.1–1.5 MBq 的剩余活性,具体取决于在切换盐水注射器的示踪剂时逸出的示踪剂量。
- 扫描完成后,从扫描仪中弹出带有动物的床。
注意:动物可能会对刺激做出反应或在美托咪定被拮抗之前醒来。在以下步骤中,请小心处理动物,并为突然的动作做好准备。还要注意动物具有放射性。因此,请尽可能快速、仔细地完成以下步骤。 - 使用持针器从动物尾巴上取下针头和 PE 管。在穿刺部位应用组织或敷布以阻止潜在的出血。
- 停止美托咪定给药并从动物的脖子上取下针头和 PE 管。
- 将动物放在没有其他动物的笼子里,用纸巾捕捉(放射性)尿液,这些尿液可能在移动动物时排出。使用 1 mL 胰岛素注射器在其背部皮下注射 1 mL 生理盐水,以促进补液。
- 通过皮下注射阿替唑来逆转镇静作用。
- 使用以下公式计算适当的体积 v:
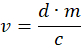
其中 d = 0.5 mg/kg, 即 每公斤动物体重中美托咪定的剂量(毫克), m 是动物的体重(公斤), c 是阿替美唑的浓度(毫克/毫升)。 - 对于导致计算体积小的轻量级动物,用生理盐水稀释阿替美唑以获得更准确的剂量。在胰岛素注射器中加入 4 • v 阿替美唑和 12 • v 生理盐水。将所得溶液的 1/4 皮下注射到动物颈部附近的背部。
- 使用以下公式计算适当的体积 v:
- 目视监测动物直到它醒来,这应该需要 1-5 分钟。一旦动物能够保持直立并自由活动,就将其送回集体饲养。为动物提供食物和水。
2. 数据重建和质量检查
注意:使用我们研究中可用的硬件和软件,所有 PET 数据都针对放射性核素衰变进行了校正,并使用有序子集期望最大化 3 维 (OSEM-3D) 算法使用 511 keV 光峰周围的 30% 窗口重建了获得的正弦图。OSEM 重建软件使用其默认设置,即 10 个子集,每个子集 2000 万个事件。图像被重建为 192 x 192 x 384 的横向矩阵,立方体图像体素为 0.4 毫米。未进行衰减校正。
- 要验证示踪剂注射是否成功,请检查在 60 分钟采集期间检测到的计数率(即时间活性曲线 (TAC))。确认在采集后的第一分钟内,即注射示踪剂后立即出现峰。
- 静态重建:使用 OSEM 算法使用 30 次迭代、400 μm 的等距体素大小和以 511 keV 光峰为中心的 30% 能量窗口重建采集的数据。
- 重建完成后,检查生成的图像是否有伪影。
- 动态重建:使用与静态重建相同的设置,将采集的数据重建为 32 分钟的时间框架。
3. 数据分析
注:以下步骤 3.1 和 3.2 在专用于 PET 数据定量的生物医学软件环境中执行,使用图像配准和融合工具 (PFUS) 和通用动力学建模工具 (PKIN)。
- 在 PFUS 中:
- 在子页面 Load Input Images 中:
- 通过使用 INP load 按钮或将文件拖放到画布中来加载动态重建的 DICOM 文件。使用右上角的 General image display 控件 在切片和时间范围内导航,并调整颜色条。如果需要,请使用右侧边栏上的 Change input image orientation (更改输入图像方向 ) 按钮将图像方向调整为标准方向。
- 裁剪和帧平均:单击右下角的箭头以显示用于求和和裁剪的隐藏控件,然后勾选 裁剪.在画布中,通过调整边缘并拖动裁剪框的中心来定义裁剪边界;确保包含整个大脑和一些填充物,包括眼睛和脊髓的一部分。正确定义裁剪框后,单击裁剪按钮裁剪图像。通过单击橙色平均值按钮计算所有时间框架的时间加权帧平均值,并等待结果自动添加到输入图像中,总共产生两个输入图像:带有时间框架的裁剪动态数据和相同数据的裁剪时间加权平均值。
- 选择 Deform as Matching method 或按下按钮(如果已选择)以继续进行基于模板的标准化。
- 在子页面 参考和匹配中:
- 选择 时间加权平均图像 作为 输入图像 (通常从最后一步开始自动选择)。
- 通过单击按钮选择标准化模板作为参考图像来加载参考。选择 Rat FDG (W. Schiffer)。
- 通过单击按钮将输入与模板匹配 |输入:在右侧边栏中手动调整。拖动并旋转输入图像以大致匹配模板。确保 Rat 被选为 species,注册方式为 Deform,然后点击 Match Current 按钮进入下一个子页面。
- 在子页面 匹配结果中:
- 检查结果并根据需要手动调整匹配项。单击 Apply Current Transformation to All 以匹配由时间范围组成的输入图像。
- 点击绿色按钮 VOIs 以继续下一个处理步骤。
- 在子页面 VOI 分析中:
- 在右下角菜单中选择包含时间框架的图像作为图像 A。
- 转到 模板 选项卡,然后在 Atlas 选项卡中选择 Px Rat (W. Schiffer),或者加载自定义图集,然后选择所需的卷。要应用 VOI,请单击 大纲 底部的按钮。
- 单击 Template (模板 ) 选项卡上方的按钮以计算 TAC 并将其发送到 PKIN 工具。
- 在子页面 Load Input Images 中:
- 在 PKIN 中:
- 在右下角,选择 TAC(TAC) 作为 显示类型 ,以可视化事先选择的 VOI(以 kBq/mL 为单位的 TAC)。
- 右键单击 带有 TAC 的画布 ,然后单击 Value table of visible curves(可见曲线的值表)。将表复制到电子表格中以供进一步分析。
- 使用从第六个到最后一个时间范围(= 扫描开始后 10-60 分钟)的数据计算所有 VOI 配对之间的 Pearson 相关性,以获得相关矩阵。 补充文件 1 中包含一个名为“correlation_matrix.py”的 Python 脚本,用于实现此目的。
- 使用 t 检验统计量计算 Pearson 相关性是否显著:
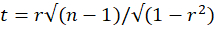 具有 n - 2 个自由度,其中 r 是 Pearson 相关系数,n = 25 是用于计算 Pearson 相关性的时间框架数。对多重比较应用适当的校正,并将统计量与具有 n - 2 个自由度的双尾 t 分布 (p = 0.05) 的临界值进行比较。如果校正的 t 检验值小于临界值,则考虑两个 VOI 之间的 Pearson 相关性显著。
具有 n - 2 个自由度,其中 r 是 Pearson 相关系数,n = 25 是用于计算 Pearson 相关性的时间框架数。对多重比较应用适当的校正,并将统计量与具有 n - 2 个自由度的双尾 t 分布 (p = 0.05) 的临界值进行比较。如果校正的 t 检验值小于临界值,则考虑两个 VOI 之间的 Pearson 相关性显著。
结果
扫描完成后,可以调查采集过程中检测到的速率的 TAC,以检查示踪剂注射和摄取是否正确。 图 1 显示了成功注射和采集示踪剂后扫描仪整个 FOV 产生的 TAC(图 A),以及部分静脉旁示踪剂注射后产生的 TAC(图 B)。在成功的情况下,示踪剂注射后计数率迅速上升,并在前 4 分钟内达到峰值,然后在采集的其余时间稳步下降。在静脉旁病...
讨论
此处提供的协议指导用户完成使用 [18F]FDG 作为大鼠示踪剂获取 1 小时动态 PET 数据的过程。最后,获得 VOI 的相关矩阵,可用于评估单个受试者水平的代谢连接。经验丰富的研究人员可以在不同时间点调整协议以满足他们的特定需求,例如,使用不同的放射性示踪剂、采集时间或时间框架宽度进行图像重建,并在数据分析部分选择相关的 VOI。
披露声明
作者没有需要披露的利益冲突。
致谢
这项工作得到了佛兰德研究基金会 [G0A7422N] 的研究资助。
材料
| Name | Company | Catalog Number | Comments |
| Antisedan | Orion Pharma | Atipamezole hydrochloride 5 mg/mL | |
| BD Micro-Fine+ insulin syringe 1 mL | BD | 324827 | 0.33 mm (29G) x 12.7 mm |
| BD Microlance 3 Needles 30 G x 1/2" | BD | 304000 | 30 G x 1/2"; 0,3 x 13 mm |
| BD Plastipak syringe 1 mL | BD | 303172 | for infusion pump |
| BTPE-10 Polyethylene tubing | Instech | 0.11x.024in (.28x60mm) | |
| Domitor | Orion Pharma | 1070499 | Medetomidine hydrochloride 1 mg/mL |
| Fusion 100 infusion pump | Chemyx Inc. | 07100 | Newer model available: Fusion 100X |
| Isoflutek 1000 mg/g | Alivira | Isoflurane | |
| MOLECUBES β-CUBE with CUBEFLOW software | MOLECUBES NV | Preclinical PET scanner | |
| PMOD Software version 4.4 | Bruker Corporation | http://www.pmod.com; quantification of PET data | |
| Saline | B. Braun | 394496 | NaCl 0.9% |
| Vidisic eye gel | Vidisic | Carbomerum 980 2 mg/g |
参考文献
- Wilson, H., Pagano, G., Politis, M. Dementia spectrum disorders: lessons learnt from decades with PET research. J Neural Transm. 126 (3), 233-251 (2019).
- Singnurkar, A., Poon, R., Metser, U. Comparison of 18F-FDG-PET/CT and 18F-FDG-PET/MR imaging in oncology: a systematic review. Ann Nucl Med. 31 (5), 366-378 (2017).
- Youssef, G., et al. The use of 18F-FDG PET in the diagnosis of cardiac sarcoidosis: a systematic review and metaanalysis including the Ontario experience. J Nucl Med. 53 (2), 241-248 (2012).
- Carli, G., Tondo, G., Boccalini, C., Perani, D. Brain molecular connectivity in neurodegenerative conditions. Brain Sci. 11 (4), 433 (2021).
- Sala, A., Perani, D. Brain molecular connectivity in neurodegenerative diseases: Recent advances and new perspectives using positron emission tomography. Front Neurosci. 13, 617 (2019).
- Horwitz, B., Duara, R., Rapoport, S. I. Intercorrelations of glucose metabolic rates between brain regions: Application to healthy males in a state of reduced sensory input. J Cereb Blood Flow Metab. 4 (4), 484-499 (1984).
- Sporns, O., Tononi, G., Kötter, R. The human connectome: A structural description of the human brain. PLOS Comput Biol. 1 (4), e42 (2005).
- Biswal, B., Zerrin Yetkin, F., Haughton, V. M., Hyde, J. S. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med. 34 (4), 537-541 (1995).
- Sanchez-Catasus, C. A., Diercke, R. A. J. O., de Vries, E. F. J., van Waarde, A., Leenders, K. L., et al. Use of nuclear medicine molecular neuroimaging to model brain molecular connectivity. PET and SPECT in neurology. , 181-207 (2021).
- Wehrl, H. F., et al. Simultaneous PET-MRI reveals brain function in activated and resting state on metabolic, hemodynamic and multiple temporal scales. Nat Med. 19 (9), 1184-1189 (2013).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21 (5), 801-807 (1990).
- Krishnamoorthy, S., et al. Performance evaluation of the MOLECUBES β-CUBE - a high spatial resolution and high sensitivity small animal PET scanner utilizing monolithic LYSO scintillation detectors. Phys Med Biol. 63 (15), 155013 (2018).
- Schiffer, W. K., Mirrione, M. M., Dewey, S. L. Optimizing experimental protocols for quantitative behavioral imaging with 18F-FDG in rodents. J Nucl Med. 48 (2), 277-287 (2007).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. J Nucl Med. 47 (6), 999-1006 (2006).
- Gold, M. E. L., Norell, M. A., Budassi, M., Vaska, P., Schulz, D. Rapid 18F-FDG uptake in brain of awake, behaving rat and anesthetized chicken has implications for behavioral PET studies in species with high metabolisms. Front Behav Neurosci. 12, 115 (2018).
- Miranda, A., et al. PET imaging of freely moving interacting rats. NeuroImage. 191, 560-567 (2019).
- Miranda, A., et al. Awake 18F-FDG PET imaging of memantine-induced brain activation and test-retest in freely running mice. J Nucl Med. 60 (6), 844-850 (2019).
- Jahreis, I., Bascuñana, P., Ross, T. L., Bankstahl, J. P., Bankstahl, M. Choice of anesthesia and data analysis method strongly increases sensitivity of 18F-FDG PET imaging during experimental epileptogenesis. PLOS ONE. 16 (11), e0260482 (2021).
- Pawela, C. P., et al. A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity. NeuroImage. 46 (4), 1137-1147 (2009).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: Uses and interpretations. NeuroImage. 52 (3), 1059-1069 (2010).
- Engel, J., et al. Connectomics and epilepsy. Curr Opin Neurol. 26 (2), 186 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。