このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単一被験者レベルでの2-デオキシ-2-[18F]フルオロ-D-グルコース動的陽電子放出断層撮影法を使用した代謝脳接続性の研究
要約
動的陽電子放出断層撮影法(PET)データを取得し、時間枠に再構成することで、単一被験者レベルでの代謝脳接続性分析が可能になります。ラット脳の[18F]FDG動的PETデータを取得し、対象ボリュームの時間活動曲線を抽出して接続性マトリックスを取得する方法を説明します。
要約
今日まで、代謝脳の接続性は、主に複数の被験者の静的陽電子放出断層撮影法(PET)データの取得を通じてグループレベルで研究されています。私たちの研究グループは現在、ラットの被験者内レベルでの脳内出血後の複数の時点にわたる代謝接続性の変化を研究しています。被験者内の代謝脳の接続性を調査するには、さまざまな脳領域でのトレーサー取り込みの時間的情報が必要であり、これは動的PETによって達成できます。本書では、当社のデータ取得および解析プロトコルについて詳細に説明しています。
ラット脳の動的PETデータは、トレーサーとして2-デオキシ-2-[18F]フルオロ-D-グルコース([18F]FDG)を使用した専用の前臨床PETシステムで取得されます。トレーサーは、PETスキャンの開始時にボーラスとして静脈内注射されます。60分間の捕獲中に、動物はメデトミジンで鎮静されます。
取得後、PETデータは反復再構成アルゴリズム(Maximum-Likelihood Expectation-Maximization)を使用して32分の時間枠に再構築されます。複数の対象体積(VOI)で構成される分割アトラスを使用して、各VOIの時間活動曲線を抽出し、VOIの各ペア間のピアソン相関係数を計算します。
この動的PETプロトコルにより、スキャンのグループ間ではなく、2つの単一スキャン間の代謝接続の違いを評価できます。このアプローチにより、異なる時点にわたる単一の被験者内の代謝接続性の変化を研究したり、個人の代謝接続性を正常なデータベースと比較したりできます。このような比較は、疾患の進行を追跡したり、てんかんや認知症などの脳領域間のコミュニケーションの中断を特徴とする神経障害の診断に役立てるのに役立つ可能性があります。
概要
陽電子放出断層撮影法(PET)は、研究や臨床現場で一般的に使用される分子イメージング技術です。さまざまなPETトレーサーの開発により、PETは疾患の病態生理学を研究し、疾患の進行と治療への反応を監視するために使用できます1。最も広く使用されている放射性トレーサーの1つは、2-デオキシ-2-[18F]フルオロ-D-グルコース([18F]FDG)であり、これによりグルコース代謝のイメージングが可能になり、細胞の活性化を示します。これは、診断、病期分類、および予後に腫瘍学で利用されています。神経学では、一般的に認知症などの神経変性疾患の文脈で。そして心臓病学では、サルコイドーシスのような状態を診断するために、ほんの数例を挙げると1,2,3。
[18F]FDG PET データから得られた代謝脳の接続性の評価は、異なる脳領域におけるトレーサーの取り込み間の機能的関係を指します。このアプローチでは、脳の領域のセットを選択することで「接続性マトリックス」を計算でき、脳のさまざまな部分がどのように相互作用し、一緒に機能するかについての洞察を得ることができます。このタイプの分析は、認知症、てんかん、その他の神経障害などの状態を含む、健康や疾患における脳機能の研究に特に有用です4,5。
代謝性脳の接続性を評価する最初の研究はすでに1980年代にさかのぼります6が、研究者は主に拡散強調磁気共鳴画像法(DW-MRI)を使用して、「コネクトーム」7としても知られる構造的な脳の接続性を調査しました。さらに、機能的MRI(fMRI)、脳波計(EEG)、脳磁図(MEG)などの技術を用いた機能的コネクティビティは、数十年にわたって広く研究されてきた8,9。
最近、代謝脳コネクティビティの研究に再び関心が戻ってきました。[18F]FDG PET は、それ自体だけでなく、他の形態の脳コネクティビティと組み合わせても研究しています10。しかし、PET画像には(例えば、機能的MRIとは対照的に)固有の「静的」な性質があるため、脳ネットワークPETベースの結果の大部分は、脳領域間の相関が被験者間レベルで計算されるグループレベルの分析に基づいています。この制限により、PET画像の被験者内分析は不可能になり、これは、同じ個人内の経時的な変化を追跡できる縦断的研究に不可欠です4。したがって、動的PETベースの分子結合性など、単一被験者の解析を可能にする方法の開発は、臨床現場での分子ネットワーク解析の使用への扉を開くため、ネットワーク障害を調査する脳研究の重要な研究方向です。したがって、動的PETデータは、私たちの前臨床試験で使用されました。
現在、当研究グループでは、脳内出血後の代謝コネクティビティの変化を、ラットコラゲナーゼモデル11を用いて、被験者内レベルで複数時間にわたって検討する研究を進めています。被験者内の脳代謝の接続性を調査するには、さまざまな脳領域でのトレーサー取り込みの時間的情報が必要であり、これは動的PETを通じて取得できます。次のセクションでは、データ集録および解析プロトコルについて詳しく説明します。
プロトコル
すべての手続きは欧州のガイドライン(指令2010/63/EU)に準拠しており、この議定書は地元のゲント大学の動物倫理委員会(ECD 23/33)によって承認されました。12匹のSprague Dawleyラット(雌6匹、雄6匹)が研究に含まれました。彼らの PET スキャンは、誘発された脳内出血の 2 週間前から 18 週間後までの複数の時点で、次のプロトコルを使用して取得されました。最初のスキャンの時点で、すべての動物は18週齢で、雌の体重は244.8±10.1g(平均±SD)、雄の体重は363.6±13.3gでした。
放射性物質は、訓練を受けた人員のみが取り扱い、取り扱うようにしてください。スタッフと動物への投与量は、合理的に達成できる範囲で最小限に抑えてください(ALARA)。
1. データ取得
注:データ取得に使用される前臨床PETイメージャーとソフトウェアの詳細については、 材料の表 を参照してください。イメージャは、LYSO結晶とSiPM検出器を使用して、軸方向視野(FOV)13cmと軸方向FOV7.6cmをカバーする45検出器(5リングに配置されている)PETスキャナーです。このシステムは、850μmの空間分解能、12%の感度、および12.6%のエネルギー分解能を示しています12。次の手順は、このことを念頭に置いて記述されています。
- スキャンの少なくとも6時間前に、ケージからすべての食物を取り出して、動物から食物を奪います。動物が十分な絶食期間を経たら、次のようにデータ取得の準備を開始します。
- 加熱パッドをオンにし、30〜35°Cまで温めます。
- 2,000 mL/minの流速で医療用O2 中の5%イソフルランで満たされたガス麻酔室に動物を置くことにより、イソフルランで動物を麻酔します。チャンバーから30 cmのところに加熱ランプを置くことにより、動物の体温を維持するのを助けます。動物は、呼吸数が0.5〜1 Hzのときに適切に麻酔されます。
- 動物の体重を量ります。
- 動物を加熱パッドの上に置きます。ノーズコーンを使用して、医療用O2 に2%イソフルランを500 mL / minの流速で投与します。.動物を適切に麻酔し続けるために、必要に応じてイソフルランの用量を調整します。.
- 肩甲骨の間の動物の首の一部を剃ります。
- トレーサー注射のための尾静脈の準備:
- 動物を左側または右側に向け、加熱ランプを使用して尻尾を温め、血管拡張を引き起こします。
- 約20cmのBTPE-10チューブを取ります。ニードルホルダーを使用して、30 Gニードルのシャフトを切断し、その後端の1〜2 mmをPEチューブに挿入します。1 mLのインスリン注射器に生理食塩水を入れ、針先をPEチューブに3〜5 mm挿入します。充填されたシリンジから生理食塩水をPEチューブに事前充填し、生理食塩水シリンジをPEチューブに接続したままにします。
- 動物の尻尾をエタノールできれいにします。暖房lを取り外しますamp.
- PEチューブの針先を側尾静脈に挿入します。針の適切な配置を確認する:プランジャーを引き戻したときにPEチューブに入る血液、注入中の抵抗の欠如、および注射部位での皮下ブレブ(傍静脈注射を示す)の形成を探します。エントリーが成功しなかった場合は、テールから針を取り外し、より近位のセクションで再試行してください。
- 針を浸透部位に瞬間接着剤で固定し、PEチューブをテールにテープで固定します。
注意: PEチューブの動きは避けてください。血液がPEチューブに入った場合は、目詰まりを防ぐためにすぐに生理食塩水で洗い流してください。
- メデトミジン鎮静に切り替える:
- 動物を加熱マットの上で腹臥位に置きます。アイジェルを各目に一滴垂らして、乾燥を防ぎます。
- PETスキャナーの近くに配置された輸液ポンプに接続するためのPEチューブ(40〜100 cm)を準備します。ニードルホルダーを使用して、30 Gのニードルのシャフトを折り、その背部の1〜2 mmをPEチューブに挿入します。1 mLのプラスチックシリンジに30 Gの針に少なくとも0.2 mLのメデトミジン(動物あたり)を入れ、針先をPEチューブに3〜5 mm挿入します。PEチューブにシリンジからメデトミジンをプレフィルします。
- メデトミジン入りシリンジを輸液ポンプに入れます。.ポンプをオンにし、クリックして正しいシリンジ を選択します シリンジを見つける | BDプラスチック | 1mLの
- ポンプを使用して、PEチューブのもう一方の端にある針から液滴が出るまで0.005mLのボリを排出します。.PEチューブに気泡が存在しないことを確認します。
- PEチューブの針を動物の肩甲骨の間に2〜3 mm皮下に挿入します。挿入部位に瞬間接着剤を滴下して針を固定し、PEチューブを動物の背中にそっとテープで固定します。
- 動物の体重に基づいて、メデトミジンの容量 v のボーラスを注入します(速度:3 mL /分)。
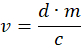
ここで、 d = 0.05 mg / kg(動物の体重1kgあたりのmg単位のメデトミジンの用量)、 mはkg単位の動物の体重、 cはmg / mL単位のメデトミジンの濃度です。 - メデトミジンボーラスの投与から10分後にイソフルラン投与を停止し、この待機期間中に安定した麻酔を維持するために必要に応じてイソフルラン用量を調整します。.
注:イソフルランとメデトミジンを組み合わせると、動物の呼吸数が大幅に遅くなります。イソフルランの投与が中止されるまで、綿密なモニタリングが不可欠です。. - イソフルランを止めてから5分後、メデトミジンの連続注入を次の速度で開始します。
rcont = r • m
ここで 、r = 0.1 mg /(kg・h);動物の体重あたりのメデトミジンの量(mg / h)であり、 mは動物の体重(kg)です。
注:動物のシステムにイソフルランがないことを確認するためにスキャンを開始する前に、持続注入を開始してからさらに25分後(したがって、イソフルランを停止してから30分後)の平衡化期間が必要です。この間、次の手順に進みます。
- PETスキャナーでの動物の位置決め:
- スキャナーベッドには、加熱パッド、圧力センサー、ティッシュペーパーを用意します。センサーを使用して動物の呼吸数を監視し、動物が排泄した尿を吸収するための紙組織を監視します。
注:メデトミジンのため、動物は通常、大量の尿を排泄します。 - 動物をスキャナーベッドに慎重に移し、メデトミジンラインと尾静脈カテーテルがしっかりと固定されていることを確認します。必要に応じて、ノーズコーンを使用して動物の頭をできるだけまっすぐに置きます。適切な位置に配置したら、ヘッドをテープで固定します。
- 加熱パッドをオンにし、呼吸数監視システムが正しく機能していることを確認し、必要に応じて圧力センサーの位置を調整します。
- スキャナーベッドには、加熱パッド、圧力センサー、ティッシュペーパーを用意します。センサーを使用して動物の呼吸数を監視し、動物が排泄した尿を吸収するための紙組織を監視します。
- PETスキャンを開始する10〜5分前に、0.1〜0.8mLの生理食塩水で希釈した約20MBqの2-デオキシ-2-[18F]フルオロD-グルコース([18F]FDG)をインスリン注射器に充填します。
注意:フッ素-18(18F)は、半減期が109.8分のフッ素放射性同位体です。放射性物質を取り扱うときは、地域の放射線安全プロトコルに従ってください。 - スキャナーソフトウェアを開き、次のスキャンパラメータを設定します:同位体として18Fを選択し(崩壊補正に重要)、放射性トレーサーを含むシリンジの測定活性(線量キャリブレーターで測定されたMBq)と測定時間を入力します(情報はメタデータに保存されます。これは、データを標準取り込み値などの他の単位に変換するために必要です)。Generalプロトコルを選択し、Automatic sorting after acquisitionにチェックを入れます。スキャン時間を 1 時間に設定し、関心領域 (ROI) を調整して、ラットの脳全体 (通常は位置 2-5) が含まれるようにします。
- イソフルラン投与の停止から30分が経過したら、PETスキャンを開始します。
- 再度、ステップ1.7.4で説明したように、吸引とそれに続く少量の生理食塩水の注入によって静脈内の適切な配置を確認します。
- 生理食塩水シリンジを放射性トレーサーシリンジと交換します。PEチューブからシリンジを取り外すと、血液がPEチューブに入り、生理食塩水が押し出される可能性があります。放射性トレーサーシリンジの針は、PEチューブに穴を開けずにすばやく挿入します。
- スキャナーソフトウェアを使用してスキャンを開始します。
- 取得が開始されたら、トレーサーをボーラスとして約0.5〜2秒かけて注入します。すぐに空の放射性トレーサーシリンジを生理食塩水シリンジと交換し、PEチューブを約0.1mLの生理食塩水で洗い流します。ティッシュを使用して、シリンジ交換中に漏れる可能性のある放射性トレーサーの滴をキャッチします。
注:スキャナーソフトウェアによって表示されるカウントレートは、トレーサー注入後、4.5〜6.5 Mcpsに急速に増加するはずです。カウント率が最初に 4 Mcps を大幅に下回り、その後増加していることは、(部分的に) 傍静脈トレーサー注射を示しています。 - トレーサーシリンジと汚染された可能性のある組織と手袋の活性を測定することにより、動物に注入されなかった残りの活動を評価します。そのアクティビティと測定時間をスキャナーソフトウェアに入力して、メタデータに保存します。
注:0.1〜1.5 MBqの残りのアクティビティは、生理食塩水シリンジのトレーサーを切り替えるときに逃げたトレーサーの量によって異なります。
- スキャンが完了したら、動物と一緒にベッドをスキャナーから取り出します。
注:動物は刺激に反応するか、メデトミジンが拮抗する前に目を覚ます可能性があります。動物の取り扱いには注意を払い、次の手順での突然の動きに備えてください。また、動物は放射性物質であることに注意してください。したがって、次の手順をできるだけ早く慎重に完了することを目指してください。 - ニードルホルダーを使用して、動物の尻尾から針とPEチューブを取り外します。ティッシュを塗布するか、穿刺部位に圧迫して、出血の可能性を防ぎます。
- メデトミジンの投与を停止し、動物の首から針とPEチューブを取り外します。.
- 動物を他の動物のいないケージに入れ、ティッシュを使用して、動物を移動させるときに排泄される可能性のある(放射性)尿を捕らえます。1mLの生理食塩水を1mLのインスリン注射器を使用して背中に皮下投与し、水分補給を促進します。
- アチパメゾールの皮下注射で鎮静を逆転させます。.
- 次の式を使用して、適切な体積 vを計算します。
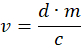
ここで、 d = 0.5 mg / kg、 すなわち 、動物の体重1kgあたりのmg単位のメデトミジンの用量、 mはkg単位の動物の体重、 cはmg / mL単位のアチパメゾールの濃度です。 - 計算量が小さい軽量動物の場合は、アチパメゾールを生理食塩水で希釈して、より正確な用量を可能にします。.インスリン注射器に4 •vのアチパメゾールと12•vの生理食塩水を入れます。.得られた溶液の1/4を動物の背中の首の近くに皮下注射します。
- 次の式を使用して、適切な体積 vを計算します。
- 動物が目を覚ますまで目視で観察します(これには1〜5分かかります)。動物が直立して自由に動き回れるようになったら、グループハウジングに戻します。動物に食べ物と水を提供します。
2. データの再構築と品質チェック
注:私たちの研究で利用可能なハードおよびソフトウェアを使用して、すべてのPETデータを放射性核種の崩壊に対して補正し、取得したシノグラムを511 keVフォトピークの周りの30%ウィンドウを使用して、順序付けされたサブセット期待最大化3次元(OSEM-3D)アルゴリズムで再構築しました。OSEM再構築ソフトウェアは、10のサブセットとサブセットあたり2,000万のイベントというデフォルト設定を使用しました。画像は、0.4 mm の 3 次画像ボクセルを持つ 192 x 192 x 384 の横方向のマトリックスに再構築されました。減衰補正は行われませんでした。
- トレーサー注入が成功したことを確認するには、60 分間の取り込み中に検出されたカウント率(つまり、時間活性曲線(TAC))を確認します。トレーサーを注入した直後の取り込み後1分以内にピークがあることを確認します。
- 静的再構成:OSEMアルゴリズムを使用して、30回の反復、400μmの等尺性ボクセルサイズ、511 keVのフォトピークを中心とした30%のエネルギーウィンドウを使用して、取得したデータを再構築します。
- 再構築が完了したら、結果の画像にアーティファクトがないか調べます。
- 動的再構成:静的再構成と同じ設定を使用して、集録したデータを32分の時間枠に再構築します。
3. データ分析
注:次のステップ3.1および3.2は、PETデータの定量化専用の生物医学ソフトウェア環境で、 Image Registration and Fusion Tool(PFUS) および General Kinetic Modeling Tool(PKIN)を使用して実行されます。
- PFUS の場合:
- サブページの Load Input Imagesで、次の操作を行います。
- 動的再構築のDICOMファイルをロードするには、 INPロード ボタンを使用するか、ファイルをキャンバスにドラッグアンドドロップします。右上の [一般] 画像表示コントロール を使用して、スライスとタイム フレーム間を移動し、カラー バーを調整します。必要に応じて、右側のサイドバーにある [ 入力画像の向きを変更 ] ボタンを使用して、画像の向きを標準の向きに調整します。
- クロップとフレーム平均: 右下の矢印をクリックすると、合計とクロップの非表示のコントロールが表示され、クロップにチェックマークが付きます。キャンバスで、エッジを調整し、クロップボックスの中心をドラッグして、クロップの境界を定義します。脳全体と、目と脊髄の一部を含む少しのパッドが含まれていることを確認してください。クロップボックスが正しく定義されたら、クロップボタンをクリックして画像をクロップします。オレンジ色の平均ボタンをクリックして、すべての時間枠の時間加重フレーム平均を計算し、結果が入力画像に自動的に追加されるのを待ちます。その結果、時間枠を含むトリミングされた動的データと、同じデータのトリミングされた時間加重平均の 2 つの入力画像が生成されます。
- マッチング方法として変形を選択するか、すでに選択されている場合はボタンを押してテンプレートベースの正規化に進みます。
- サブページの 参照とマッチング:
- 入力画像として時間加重平均画像を選択します(通常は最後のステップから自動的に選択されます)。
- 参照をロードするには、ボタンをクリックして参照画像として正規化テンプレートを選択します。 ラットFDG(W.シファー)を選択します。
- 入力をテンプレートに一致させるには、[入力の一致] |入力:右側のサイドバーで手動で調整します。入力画像をドラッグして回転させ、テンプレートとほぼ一致させます。種として Rat が選択されていること、登録方法が Deform であることを確認してから、Match Current ボタンをクリックして次のサブページに移動します。
- サブページの マッチング結果:
- 結果を確認し、必要に応じて手動で一致を調整します。 [現在の変換をすべてに適用] をクリックして、タイム フレームで構成される入力画像とも一致させます。
- 緑色のボタン VOI をクリックして、次の処理ステップに進みます。
- サブページのVOI分析で:
- 右下のメニューで画像Aとして時間枠を含む画像を選択します。
- [テンプレート] タブに移動し、[アトラス] タブで [Px Rat (W. Schiffer)] を選択するか、カスタム アトラスをロードして目的のボリュームを選択します。VOIを適用するには、下部のアウトラインボタンをクリックします。
- [テンプレート]タブの上にあるボタンをクリックして、TACを計算し、PKINツールに送信します。
- サブページの Load Input Imagesで、次の操作を行います。
- PKIN の場合:
- 右下の「Display Type」で「TACs」を選択し、事前に選択したVOIのTACをkBq/mLで可視化します。
- TAC があるキャンバスを右クリックし、[表示カーブの値テーブル] をクリックします。テーブルをスプレッドシートにコピーして、さらに分析します。
- 6 番目から最後の時間枠 (= スキャン開始後 10 〜 60 分) のデータを使用して、VOI のすべてのペア間のピアソン相関を計算し、相関行列を取得します。この目的を果たす「correlation_matrix.py」というPythonスクリプトが Supplemental File 1に含まれています。
- t検定統計量(
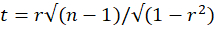 、自由度n - 2、rはピアソン相関係数、n = 25はピアソン相関の計算に使用される時間枠の数)を使用して、ピアソン相関が有意であるかどうかを計算します。多重比較に適切な補正を適用し、自由度が n - 2 の両側 t 分布 (p = 0.05) の棄却限界値と統計量を比較します。2つのVOI間のピアソン相関は、補正されたt検定値が棄却限界値よりも小さい場合に有意であると考えてください。
、自由度n - 2、rはピアソン相関係数、n = 25はピアソン相関の計算に使用される時間枠の数)を使用して、ピアソン相関が有意であるかどうかを計算します。多重比較に適切な補正を適用し、自由度が n - 2 の両側 t 分布 (p = 0.05) の棄却限界値と統計量を比較します。2つのVOI間のピアソン相関は、補正されたt検定値が棄却限界値よりも小さい場合に有意であると考えてください。
結果
スキャンが完了したら、取得中に検出されたレートのTACを調査して、トレーサーの正しい注入と取り込みを確認できます。 図1 は、トレーサーの注入と取得が成功した後のスキャナーのFOV全体から得られたTAC(パネルA)と、部分的に傍静脈されたトレーサーの注入後に得られたTACを示しています(パネルB)。成功したケースでは、トレ?...
ディスカッション
ここで紹介するプロトコルは、[18F]FDGをラットのトレーサーとして使用して1時間の動的PETデータを取得するプロセスをガイドします。最終的に、VOIの相関行列が得られ、これを使用して単一被験者レベルでの代謝接続性を評価できます。経験豊富な研究者は、例えば、画像再構成に異なる放射性トレーサー、取得時間、または時間枠幅を使用したり、データ?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、フランダース研究財団[G0A7422N]からの研究助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Antisedan | Orion Pharma | Atipamezole hydrochloride 5 mg/mL | |
| BD Micro-Fine+ insulin syringe 1 mL | BD | 324827 | 0.33 mm (29G) x 12.7 mm |
| BD Microlance 3 Needles 30 G x 1/2" | BD | 304000 | 30 G x 1/2"; 0,3 x 13 mm |
| BD Plastipak syringe 1 mL | BD | 303172 | for infusion pump |
| BTPE-10 Polyethylene tubing | Instech | 0.11x.024in (.28x60mm) | |
| Domitor | Orion Pharma | 1070499 | Medetomidine hydrochloride 1 mg/mL |
| Fusion 100 infusion pump | Chemyx Inc. | 07100 | Newer model available: Fusion 100X |
| Isoflutek 1000 mg/g | Alivira | Isoflurane | |
| MOLECUBES β-CUBE with CUBEFLOW software | MOLECUBES NV | Preclinical PET scanner | |
| PMOD Software version 4.4 | Bruker Corporation | http://www.pmod.com; quantification of PET data | |
| Saline | B. Braun | 394496 | NaCl 0.9% |
| Vidisic eye gel | Vidisic | Carbomerum 980 2 mg/g |
参考文献
- Wilson, H., Pagano, G., Politis, M. Dementia spectrum disorders: lessons learnt from decades with PET research. J Neural Transm. 126 (3), 233-251 (2019).
- Singnurkar, A., Poon, R., Metser, U. Comparison of 18F-FDG-PET/CT and 18F-FDG-PET/MR imaging in oncology: a systematic review. Ann Nucl Med. 31 (5), 366-378 (2017).
- Youssef, G., et al. The use of 18F-FDG PET in the diagnosis of cardiac sarcoidosis: a systematic review and metaanalysis including the Ontario experience. J Nucl Med. 53 (2), 241-248 (2012).
- Carli, G., Tondo, G., Boccalini, C., Perani, D. Brain molecular connectivity in neurodegenerative conditions. Brain Sci. 11 (4), 433 (2021).
- Sala, A., Perani, D. Brain molecular connectivity in neurodegenerative diseases: Recent advances and new perspectives using positron emission tomography. Front Neurosci. 13, 617 (2019).
- Horwitz, B., Duara, R., Rapoport, S. I. Intercorrelations of glucose metabolic rates between brain regions: Application to healthy males in a state of reduced sensory input. J Cereb Blood Flow Metab. 4 (4), 484-499 (1984).
- Sporns, O., Tononi, G., Kötter, R. The human connectome: A structural description of the human brain. PLOS Comput Biol. 1 (4), e42 (2005).
- Biswal, B., Zerrin Yetkin, F., Haughton, V. M., Hyde, J. S. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med. 34 (4), 537-541 (1995).
- Sanchez-Catasus, C. A., Diercke, R. A. J. O., de Vries, E. F. J., van Waarde, A., Leenders, K. L., et al. Use of nuclear medicine molecular neuroimaging to model brain molecular connectivity. PET and SPECT in neurology. , 181-207 (2021).
- Wehrl, H. F., et al. Simultaneous PET-MRI reveals brain function in activated and resting state on metabolic, hemodynamic and multiple temporal scales. Nat Med. 19 (9), 1184-1189 (2013).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21 (5), 801-807 (1990).
- Krishnamoorthy, S., et al. Performance evaluation of the MOLECUBES β-CUBE - a high spatial resolution and high sensitivity small animal PET scanner utilizing monolithic LYSO scintillation detectors. Phys Med Biol. 63 (15), 155013 (2018).
- Schiffer, W. K., Mirrione, M. M., Dewey, S. L. Optimizing experimental protocols for quantitative behavioral imaging with 18F-FDG in rodents. J Nucl Med. 48 (2), 277-287 (2007).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. J Nucl Med. 47 (6), 999-1006 (2006).
- Gold, M. E. L., Norell, M. A., Budassi, M., Vaska, P., Schulz, D. Rapid 18F-FDG uptake in brain of awake, behaving rat and anesthetized chicken has implications for behavioral PET studies in species with high metabolisms. Front Behav Neurosci. 12, 115 (2018).
- Miranda, A., et al. PET imaging of freely moving interacting rats. NeuroImage. 191, 560-567 (2019).
- Miranda, A., et al. Awake 18F-FDG PET imaging of memantine-induced brain activation and test-retest in freely running mice. J Nucl Med. 60 (6), 844-850 (2019).
- Jahreis, I., Bascuñana, P., Ross, T. L., Bankstahl, J. P., Bankstahl, M. Choice of anesthesia and data analysis method strongly increases sensitivity of 18F-FDG PET imaging during experimental epileptogenesis. PLOS ONE. 16 (11), e0260482 (2021).
- Pawela, C. P., et al. A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity. NeuroImage. 46 (4), 1137-1147 (2009).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: Uses and interpretations. NeuroImage. 52 (3), 1059-1069 (2010).
- Engel, J., et al. Connectomics and epilepsy. Curr Opin Neurol. 26 (2), 186 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved