Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Denek Düzeyinde 2-Deoksi-2-[18F]Floro-D-Glukoz Dinamik Pozitron Emisyon Tomografisi Kullanılarak Metabolik Beyin Bağlantısının İncelenmesi
Bu Makalede
Özet
Dinamik pozitron emisyon tomografisi (PET) verilerinin elde edilmesi ve zaman dilimlerine göre yeniden yapılandırılması, tek denek düzeyinde metabolik beyin bağlantı analizine olanak tanır. Sıçan beyninin [18F]FDG dinamik PET verilerini elde etmek ve ilgilenilen hacimlerin zaman-aktivite eğrilerinin çıkarılması yoluyla bir bağlantı matrisi elde etmek için bir yöntem açıklıyoruz.
Özet
Bugüne kadar, metabolik beyin bağlantısı çoğunlukla birden fazla deneğin statik pozitron emisyon tomografisi (PET) verilerinin elde edilmesi yoluyla grup düzeyinde incelenmiştir. Araştırma gruplarımız şu anda sıçanlarda intradenek düzeyinde intraserebral kanamayı takiben birden fazla zaman noktasında metabolik bağlantıdaki değişiklikleri inceliyor. Özne içi metabolik beyin bağlantısını araştırmak için, dinamik PET ile elde edilebilen, farklı beyin bölgelerindeki izleyici alımının zamansal bilgisi gereklidir. Bu yayında, veri toplama ve analiz protokolümüzün ayrıntılı bir açıklamasını veriyoruz.
Sıçan beyninin dinamik PET verileri, izleyici olarak 2-deoksi-2-[18F]floro-D-glukoz ([18F]FDG) kullanılarak özel bir klinik öncesi PET sisteminde elde edilir. İzleyici, PET taramasının başlangıcında bir bolus olarak intravenöz olarak enjekte edilir. 60 dakikalık edinim sırasında hayvanlar medetomidin ile sakinleştirilir.
Edinimden sonra, PET verileri, yinelemeli bir yeniden yapılandırma algoritması (Maksimum-Olasılık Beklentisi-Maksimizasyon) kullanılarak otuz 2 dakikalık zaman dilimlerinde yeniden yapılandırılır. Her bir VOI'nin zaman-aktivite eğrilerini çıkarmak için birden fazla ilgi hacminden (VOI'ler) oluşan parsellenmiş bir atlas kullanılır ve bunlar daha sonra her bir VOI çifti arasındaki Pearson korelasyon katsayısını hesaplamak için kullanılır.
Bu dinamik PET protokolü, tarama grupları arasında değil, iki tek tarama arasındaki metabolik bağlantı farklılıklarının değerlendirilmesini sağlar. Bu yaklaşım, farklı zaman noktalarında tek bir denek içindeki metabolik bağlantıdaki değişikliklerin incelenmesine veya bir bireyin metabolik bağlantısının normal bir veri tabanıyla karşılaştırılmasına izin verir. Bu tür karşılaştırmalar, hastalığın ilerlemesini izlemek veya epilepsi veya bunama gibi beyin bölgeleri arasındaki iletişimin bozulmasıyla karakterize nörolojik bozuklukların teşhisine yardımcı olmak için yararlı olabilir.
Giriş
Pozitron emisyon tomografisi (PET), araştırmalarda ve klinik ortamlarda yaygın olarak kullanılan bir moleküler görüntüleme tekniğidir. Çeşitli PET izleyicilerin geliştirilmesi nedeniyle, PET, hastalık patofizyolojisini incelemek ve hastalığın ilerlemesini ve tedavilere yanıtı izlemek için kullanılabilir1. En yaygın kullanılan radyoizleyicilerden biri, hücresel aktivasyonun göstergesi olan glikoz metabolizmasının görüntülenmesine izin veren 2-deoksi-2- [18F] floro-D-glikozdur ([18F] FDG). Onkolojide tanı, evreleme ve prognoz için kullanılır; nörolojide, genellikle demans gibi nörodejeneratif hastalıklar bağlamında; Ve kardiyolojide, sarkoidoz gibi durumları teşhis etmek için, sadece birkaç örnek vermek gerekirse, 1,2,3.
[18F] FDG PET verilerinden elde edilen metabolik beyin bağlantısının değerlendirilmesi, farklı beyin bölgelerindeki izleyici alımı arasındaki fonksiyonel ilişkileri ifade eder. Bu yaklaşım, beynin farklı bölümlerinin nasıl etkileşime girdiğine ve birlikte çalıştığına dair içgörüler sağlayabilen bir dizi beyin bölgesi seçerek bir "bağlantı matrisinin" hesaplanmasını sağlar. Bu tür bir analiz, demans, epilepsi ve diğer nörolojik bozukluklar gibi durumlar da dahil olmak üzere sağlık ve hastalıkta beyin fonksiyonlarını incelemek için özellikle yararlıdır 4,5.
Metabolik beyin bağlantısını değerlendiren ilk çalışma zaten 1980'lerekadar uzanıyor6, ancak araştırmacılar esas olarak difüzyon ağırlıklı manyetik rezonans görüntüleme (DW-MRI) yoluyla "konektom"7 olarak da bilinen yapısal beyin bağlantısını araştırdılar. Ayrıca, fonksiyonel MRI (fMRI), elektroensefalografi (EEG) ve manyetoensefalografi (MEG) gibi teknikler kullanılarak fonksiyonel bağlantı, onlarca yıldır geniş çapta araştırılmıştır 8,9.
Son zamanlarda, sadece kendi başına değil, aynı zamanda diğer beyin bağlantısı biçimleriyle kombinasyon halinde [18F]FDG PET kullanarak metabolik beyin bağlantısını incelemeye yeniden ilgi duyulmuştur10. Bununla birlikte, PET görüntülerinin doğal "statik" doğası nedeniyle (örneğin, fonksiyonel MRG'nin aksine), beyin ağı PET tabanlı sonuçların büyük çoğunluğu, beyin bölgeleri arasındaki korelasyonların denekler arası düzeyde hesaplandığı grup düzeyinde analize dayanmaktadır. Bu sınırlama, PET görüntülerinin denek içi analizini imkansız hale getirir, bu da aynı birey içinde zaman içindeki değişiklikleri izleyebilen boylamsal çalışmalar için gereklidir4. Bu nedenle, dinamik PET tabanlı moleküler bağlantı gibi tek denekli analize izin veren yöntemlerin geliştirilmesi, klinik uygulamada moleküler ağ analizinin kullanımına kapı açtığı için, ağ bozukluklarını araştıran beyin araştırmalarında önemli bir araştırma yönüdür. Bu nedenle, klinik öncesi çalışmamızda dinamik PET verileri kullanıldı.
Araştırma gruplarımız şu anda sıçan kollajenaz modeli11'i kullanarak birden fazla zaman noktasında denek içi düzeyde intraserebral kanamayı takiben metabolik bağlantıdaki değişiklikleri inceleyen bir çalışma yürütmektedir. Özne içi metabolik beyin bağlantısını araştırmak için, dinamik PET yoluyla elde edilebilen, farklı beyin bölgelerindeki izleyici alımının zamansal bilgisi gereklidir. Aşağıdaki bölümlerde, veri toplama ve analiz protokolünün ayrıntılı bir açıklamasını veriyoruz.
Protokol
Tüm prosedürler Avrupa yönergelerine (direktif 2010/63/EU) uygundur ve protokol Ghent Üniversitesi yerel Hayvan Etik Komitesi (ECD 23/33) tarafından onaylanmıştır. On iki Sprague Dawley sıçanı (altı dişi, altı erkek) çalışmaya dahil edildi. PET taramaları, indüklenmiş bir intraserebral kanamadan 2 hafta önce ila 18 hafta sonra değişen çoklu zaman noktalarında aşağıdaki protokol kullanılarak elde edildi. İlk tarama sırasında, tüm hayvanlar 18 haftalıktı ve dişiler 244.8 ± 10.1 g (ortalama ± SD), erkekler ise 363.6 ± 13.3 g ağırlığındaydı.
Radyoaktif malzemelerin yalnızca eğitimli personel ile çalışıldığından ve bu personel tarafından kullanıldığından emin olun. Personele ve hayvanlara verilen dozu makul bir şekilde ulaşılabilir olduğu kadar düşük tutun (ALARA).
1. Veri toplama
NOT: Klinik öncesi PET görüntüleyici ve veri toplama için kullanılan yazılım hakkında ayrıntılar için Malzeme Tablosuna bakın. Görüntüleyici, LYSO kristalleri ve SiPM dedektörleri kullanan, 13 cm'lik bir eksenel görüş alanını (FOV) ve 7,6 cm'lik bir transaksiyel FOV'u kapsayan 45 dedektörlü (5 halkalı olarak düzenlenmiş) bir PET tarayıcıdır. Sistem 850 μm uzamsal çözünürlük, %12 hassasiyet ve %12,6 enerji çözünürlüğü göstermektedir12. Aşağıdaki adımlar bu akılda tutularak yazılmıştır.
- Taramadan en az 6 saat önce tüm yiyecekleri kafeslerinden çıkararak hayvanları yiyeceklerden mahrum bırakın. Hayvan yeterli bir açlık döneminden geçtikten sonra, veri toplama için aşağıdaki gibi hazırlıklara başlayın.
- Bir ısıtma yastığını açın ve 30–35 °C'ye kadar ısınmasına izin verin.
- Hayvanı 2.000 mL / dk'lık bir akış hızında tıbbi O2'de % 5 izofluran ile doldurulmuş bir gaz anestezi odasına yerleştirerek hayvanı izofluran ile uyuşturun. Hazneden 30 cm uzağa bir ısıtma lambası yerleştirerek hayvanın vücut sıcaklığının korunmasına yardımcı olun. Solunum hızı 0,5-1 Hz olduğunda hayvan uygun şekilde anestezi edilir.
- Hayvanı tartın.
- Hayvanı ısıtma yastığının üzerine yerleştirin. Tıbbi O2'de 500 mL / dk'lık bir akış hızında% 2 izofluran uygulamak için bir burun konisi kullanın. Hayvanı uygun şekilde anestezi altında tutmak için izofluran dozunu gerektiği gibi ayarlayın.
- Hayvanın boynunun kürek kemikleri arasında bir bölümünü tıraş edin.
- İzleyici enjeksiyonu için kuyruk damarı hazırlığı:
- Hayvanı sola veya sağa çevirin ve kuyruğunu ısıtmak için ısıtma lambasını kullanın, bu da vazodilatasyona neden olur.
- Yaklaşık 20 cm BTPE-10 boru alın. Bir iğne tutucu kullanarak, 30 G'lik bir iğnenin milini kırın ve arka ucunun 1-2 mm'lik kısmını PE boruya yerleştirin. 1 mL'lik bir insülin şırıngasını salinle doldurun ve iğne ucunu PE tüpüne 3-5 mm yerleştirin. PE tüpünü doldurulmuş şırıngadan tuzlu su ile önceden doldurun ve salin şırıngasını PE tüpüne bağlı tutun.
- Hayvanın kuyruğunu etanol ile temizleyin. Isıtma lambasını çıkarın.
- PE borunun iğne ucunu yanal bir kuyruk damarına yerleştirin. İğnenin uygun şekilde yerleştirildiğini onaylayın: piston geri çekildiğinde PE tüpüne giren kanı, enjeksiyon sırasında direnç olmamasını ve enjeksiyon bölgesinde deri altı bleb oluşumunu (paravenöz enjeksiyonu gösterir) arayın. Giriş başarılı olmadıysa, iğneyi kuyruktan çıkarın ve daha yakın bir bölümde tekrar deneyin.
- İğneyi penetrasyon bölgesinde bir damla anında yapıştırıcı ile sabitleyin ve PE boruyu kuyruğa bantlayın.
NOT: PE borunun hareket etmesinden kaçının. Herhangi bir anda PE tüpüne kan girerse, tıkanmayı önlemek için hemen tuzlu su ile yıkayın.
- Medetomidin sedasyonuna geçin:
- Hayvanı ısıtma matı üzerine yüzüstü pozisyonda yerleştirin. Kurumasını önlemek için her göze bir damla göz jeli sürün.
- PET tarayıcının yakınına yerleştirilmiş bir infüzyon pompasına bağlanmak için PE hortumu (40–100 cm) hazırlayın. Bir iğne tutucu kullanarak, 30 G'lik bir iğnenin milini kırın ve sırtının 1-2 mm'lik kısmını PE boruya sokun. 1 mL'lik bir plastik şırıngayı 30 G'lik bir iğne ile en az 0.2 mL medetomidin (hayvan başına) doldurun ve iğne ucunu 3-5 mm PE tüpe yerleştirin. PE tüpünü şırıngadan medetomidin ile önceden doldurun.
- Medetomidin içeren şırıngayı infüzyon pompasına yerleştirin. Pompayı açın ve Şırınga bul'a tıklayarak doğru şırıngayı seçin | BD Plastik | 1 mL'dir.
- PE tüpünün diğer ucundaki iğneden bir damla çıkana kadar pompayı kullanarak 0.005 mL'lik bolileri çıkarın. PE tüpünde hava kabarcığı olmadığından emin olun.
- PE tüpünün iğnesini 2-3 mm deri altından hayvanın omuz bıçakları arasına sokun. İğneyi penetrasyon bölgesinde bir damla anında yapıştırıcı ile sabitleyin ve PE boruyu hayvanın sırtına nazikçe bantlayın.
- Hayvanın ağırlığına bağlı olarak hacim v medetomidin bolusu (oran: 3 mL / dak) enjekte edin:
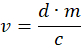
d = 0.05 mg / kg (hayvan ağırlığının kg'ı başına mg cinsinden medetomidin dozu), m hayvanın kg cinsinden ağırlığıdır ve c, mg / mL cinsinden medetomidin konsantrasyonudur. - Medetomidin bolusunun uygulanmasından 10 dakika sonra izofluran uygulamasını durdurun, bu bekleme süresi boyunca stabil anesteziyi sürdürmek için izofluran dozunu gerektiği gibi ayarlayın.
NOT: Medetomidin ile kombine edilen izofluran, hayvanın solunum hızını önemli ölçüde yavaşlatır. İzofluran uygulaması sona erene kadar yakın izleme şarttır. - İzofluranı durdurduktan beş dakika sonra, aşağıdaki oranlarda sürekli bir medetomidin infüzyonuna başlayın:
rdevamı = r • m
Burada r = 0.1 mg/(kg·h); Hayvan vücut ağırlığı başına mg cinsinden medetomidin miktarı kg/saat cinsinden) ve m, hayvanın kg cinsinden ağırlığıdır.
NOT: Hayvanın sisteminin izofluran içermediğinden emin olmak için tarama başlatılmadan önce sürekli infüzyona başladıktan sonra (dolayısıyla izofluranın durdurulmasından 30 dakika sonra) ek 25 dakikalık bir dengeleme periyoduna ihtiyaç vardır. Bu süre zarfında aşağıdaki adımlarla devam edin.
- PET tarayıcıda hayvan konumlandırma:
- Tarayıcı yatağını bir ısıtma yastığı, bir basınç sensörü ve kağıt mendillerle hazırlayın. Hayvanın solunum hızını ve hayvan tarafından atılan idrarı emmek için kağıt dokuları izlemek için sensörü kullanın.
NOT: Medetomidin nedeniyle, hayvan tipik olarak büyük miktarlarda idrar salgılar. - Medetomidin hattının ve kuyruk ven kateterinin güvenli kalmasını sağlayarak hayvanı dikkatlice tarayıcı yatağına aktarın. Gerekirse yardım için bir burun konisi kullanarak hayvanın kafasını mümkün olduğunca düz bir şekilde konumlandırın. Düzgün bir şekilde yerleştirildikten sonra kafayı bantla sabitleyin.
- Isıtma yastığını açın ve solunum hızı izleme sisteminin doğru çalıştığını doğrulayın, gerekirse basınç sensörü konumunu ayarlayın.
- Tarayıcı yatağını bir ısıtma yastığı, bir basınç sensörü ve kağıt mendillerle hazırlayın. Hayvanın solunum hızını ve hayvan tarafından atılan idrarı emmek için kağıt dokuları izlemek için sensörü kullanın.
- PET taramasına başlamadan on ila beş dakika önce, bir insülin şırıngasını 0.1-0.8 mL salin içinde seyreltilmiş yaklaşık 20 MBq 2-deoksi-2- [18F] floro-D-glikoz ([18F] FDG) ile doldurun.
DİKKAT: Flor-18 (18F), yarı ömrü 109.8 dakika olan bir flor radyoizotopudur. Radyoaktif malzemeleri kullanırken yerel radyasyon güvenliği protokollerini izleyin. - Tarayıcı yazılımını açın ve aşağıdaki tarama parametrelerini yapılandırın: İzotop olarak 18F'yi seçin (bozunma düzeltmesi için önemlidir), radyoizleyiciyi içeren şırınganın ölçülen aktivitesini (doz kalibratörü tarafından ölçülen MBq cinsinden) ve ölçüm zamanını girin (bilgiler, verileri standart alım değerleri gibi diğer birimlere dönüştürmek için gerekli olan meta verilere kaydedilecektir). Genel protokol'ü seçin ve Alımdan sonra otomatik sıralama'yı işaretleyin. Tarama süresini 1 saate ayarlayın ve ilgilenilen bölgeyi (ROI) tüm sıçan beynini içerecek şekilde ayarlayın (tipik olarak konum 2-5).
- İzofluran uygulamasının durdurulmasından bu yana 30 dakika geçtikten sonra PET taramasını başlatın:
- Yine, aspirasyon ve ardından adım 1.7.4'te açıklandığı gibi az miktarda salin enjeksiyonu ile damara uygun yerleşimi onaylayın.
- Salin şırıngasını radiotracer şırınga ile değiştirin. Şırıngayı PE tüpünden çıkarırken, kanın PE tüpüne girmesi ve salini dışarı itmesi mümkündür. Radyoizleyici şırınganın iğnesini PE borusunu delmeden hızlı bir şekilde yerleştirin.
- Tarayıcı yazılımını kullanarak taramayı başlatın.
- Edinme başladıktan sonra, izleyiciyi yaklaşık 0,5-2 sn boyunca bir bolus olarak enjekte edin. Boş radyoizleyici şırıngayı hemen salin şırınga ile değiştirin ve PE tüpünü yaklaşık 0.1 mL tuzlu su ile yıkayın. Şırınga değişimi sırasında kaçabilecek herhangi bir radyo izleyici damlasını yakalamak için bir doku kullanın.
NOT: Tarayıcı yazılımı tarafından görüntülenen sayım hızı, izleyici enjeksiyonundan sonra hızla 4,5–6,5 Mcps'ye yükselmelidir. Sayım hızının başlangıçta 4 Mcps'nin önemli ölçüde altında olması ve daha sonra artması, (kısmen) paravenöz izleyici enjeksiyonunu gösterir. - İzleyici şırınganın ve potansiyel olarak kontamine doku (lar) ve eldivenlerin aktivitesini ölçerek hayvana enjekte edilmeyen kalan aktiviteyi değerlendirin. Meta verilere kaydedilmesi için bu aktiviteyi ve ölçüm zamanını tarayıcı yazılımına girin.
NOT: Salin şırıngası için izleyiciyi değiştirirken ne kadar izleyicinin kaçtığına bağlı olarak 0,1-1,5 MBq'lik kalan bir aktivite tipiktir.
- Tarama tamamlandıktan sonra, hayvanın bulunduğu yatağı tarayıcıdan çıkarın.
NOT: Hayvan, medetomidin antagonize edilmeden önce uyaranlara tepki verebilir veya uyanabilir. Hayvanı dikkatli bir şekilde kullanın ve aşağıdaki adımlarda ani hareketlere hazırlıklı olun. Ayrıca hayvanın radyoaktif olduğunu unutmayın. Bu nedenle, aşağıdaki adımları mümkün olduğunca hızlı ve dikkatli bir şekilde tamamlamayı hedefleyin. - Bir iğne tutucu kullanarak iğneyi ve PE boruyu hayvanın kuyruğundan çıkarın. Potansiyel kanamayı durdurmak için delinme bölgesine bir doku uygulayın veya sıkıştırın.
- Medetomidin uygulamasını durdurun ve iğneyi ve PE borusunu hayvanın boynundan çıkarın.
- Hayvanı hareket ettirirken atılabilecek (radyoaktif) idrarı yakalamak için bir doku kullanarak hayvanı diğer hayvanlardan arındırılmış bir kafese yerleştirin. Rehidrasyonu teşvik etmek için 1 mL insülin şırıngası kullanarak sırtına deri altından 1 mL salin uygulayın.
- Deri altı atipamezol enjeksiyonu ile sedasyonu tersine çevirin.
- Aşağıdaki denklemi kullanarak uygun hacim v'yi hesaplayın:
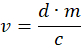
d = 0.5 mg / kg, yani hayvan ağırlığının kg'ı başına mg cinsinden medetomidin dozu, m hayvanın kg cinsinden ağırlığıdır ve c, mg / mL cinsinden atipamezol konsantrasyonudur. - Küçük hesaplanmış hacimlerle sonuçlanan hafif hayvanlar için, daha doğru bir doz elde etmek için atipamezole tuzlu su ile seyreltin. Bir insülin şırıngasını 4 • v atipamezol ve 12 • v salin ile doldurun. Elde edilen çözeltinin 1 / 4'ünü deri altından hayvanın sırtına, boynuna yakın bir yere enjekte edin.
- Aşağıdaki denklemi kullanarak uygun hacim v'yi hesaplayın:
- Hayvanı uyanana kadar görsel olarak izleyin, bu 1-5 dakika sürmelidir. Hayvan kendini dik tutabildiğinde ve serbestçe hareket edebildiğinde, onu grup barınağına geri koyun. Hayvana yiyecek ve su sağlayın.
2. Verilerin yeniden yapılandırılması ve kalite kontrolü
NOT: Çalışmamızda mevcut olan donanım ve yazılım kullanılarak, tüm PET verileri radyonüklid bozunması için düzeltildi ve elde edilen sinogramlar, 511 keV fototepe etrafında %30'luk bir pencere kullanılarak sıralı alt küme beklenti maksimizasyonu 3 boyutlu (OSEM-3D) algoritması ile yeniden yapılandırıldı. OSEM yeniden yapılandırma yazılımı, alt küme başına 20 milyon olay ile 10 alt kümenin varsayılan ayarlarını kullandı. Görüntüler, 0,4 mm'lik kübik görüntü vokselleri ile 192 x 192 x 384 enine matris halinde yeniden yapılandırıldı. Zayıflama düzeltmesi yapılmadı.
- İzleyici enjeksiyonunun başarılı olduğunu doğrulamak için, 60 dakikalık alım sırasında tespit edilen sayım oranını kontrol edin (yani, zaman-aktivite eğrisi (TAC)). İzleyici enjekte edildikten hemen sonra, alımın ilk dakikasında bir zirve olduğunu onaylayın.
- Statik rekonstrüksiyon: 30 yineleme, 400 μm'lik bir izometrik voksel boyutu ve 511 keV fototepe noktasına odaklanan %30'luk bir enerji penceresi kullanan bir OSEM algoritması kullanarak elde edilen verileri yeniden oluşturun.
- Yeniden yapılandırma tamamlandıktan sonra, ortaya çıkan görüntüde artefaktlar olup olmadığını inceleyin.
- Dinamik yeniden yapılandırma: Elde edilen verileri, statik yeniden yapılandırma ile aynı ayarları kullanarak otuz 2 dakikalık zaman dilimlerinde yeniden oluşturun.
3. Veri analizi
NOT: Aşağıdaki 3.1 ve 3.2 adımları, Görüntü Kayıt ve Füzyon Aracı (PFUS) ve Genel Kinetik Modelleme Aracı (PKIN) kullanılarak, PET verilerinin miktar tayini için ayrılmış bir biyomedikal yazılım ortamında gerçekleştirilir.
- PFUS'ta:
- Giriş Resimlerini Yükle alt sayfasında:
- Dinamik yeniden yapılandırmanın DICOM dosyasını, INP yükleme düğmesini kullanarak veya dosyayı tuvale sürükleyip bırakarak yükleyin. Dilimler ve zaman dilimleri arasında gezinmek ve renk çubuğunu ayarlamak için sağ üstteki Genel görüntü görüntüleme denetimini kullanın. Gerekirse, sağ kenar çubuğundaki Giriş görüntü yönlendirmesini değiştir düğmesini kullanarak görüntü yönlendirmesini standart yönlendirmeye ayarlayın.
- Kırpma ve kare ortalaması: Toplama ve kırpma ile ilgili gizli kontrolleri görüntülemek için sağ alttaki oka tıklayın ve Kırp'ı işaretleyin. Tuvalde, kenarları ayarlayarak ve kırpma kutusunun merkezini sürükleyerek kırpma sınırlarını tanımlayın; Tüm beynin ve gözlerin ve omuriliğin bazı kısımlarını içeren bir miktar dolgunun içerdiğinden emin olun. Kırpma kutusu düzgün bir şekilde tanımlandıktan sonra, görüntüyü kırpmak için kırpma düğmesine tıklayın. Turuncu ortalama düğmesine tıklayarak tüm zaman dilimlerinde zaman ağırlıklı kare ortalamasını hesaplayın ve sonucun giriş görüntülerine otomatik olarak eklenmesini bekleyin, böylece toplamda iki giriş görüntüsü elde edilir: zaman dilimleriyle birlikte kırpılmış dinamik veriler ve aynı verilerin kırpılmış zaman ağırlıklı ortalaması.
- Şablon tabanlı normalleştirmeye geçmek için Eşleştirme yöntemi olarak deforme et'i seçin veya zaten seçiliyse düğmeye basın.
- Referans ve Eşleştirme alt sayfasında:
- Giriş görüntüsü olarak zaman ağırlıklı ortalama görüntüyü seçin (normalde son adımdan itibaren otomatik olarak seçilir).
- Referans görüntü olarak bir normalleştirme şablonu seçmek için düğmeye tıklayarak bir referans yükleyin. Sıçan FDG'yi (W. Schiffer) seçin.
- Giriş eşleştirme düğmesine tıklayarak girişi şablonla eşleştirin | Giriş: Sağdaki kenar çubuğunda manuel olarak ayarlayın. Giriş görüntüsünü şablonla kabaca eşleşecek şekilde sürükleyin ve döndürün. Fare'nin tür olarak seçildiğinden emin olun, kayıt yöntemi Deforme Et, ardından bir sonraki alt sayfaya ulaşmak için Günceli Eşleştir düğmesine tıklayın.
- Eşleştirme Sonucu alt sayfasında:
- Sonucu kontrol edin ve gerekirse eşleşmeyi manuel olarak ayarlayın. Zaman dilimlerinden oluşan giriş görüntüsünü de eşleştirmek için Geçerli Dönüştürmeyi Tümüne Uygula'yı tıklatın.
- Bir sonraki işlem adımına geçmek için yeşil düğme VOI'lerini tıklayın.
- VOI Analizi alt sayfasında:
- Sağ alt menüden zaman dilimlerini içeren görüntüyü A görüntüsü olarak seçin.
- Şablon sekmesine gidin ve Atlas sekmesinde Px Rat (W. Schiffer) öğesini seçin veya özel bir atlas yükleyin ve istediğiniz birimleri seçin. VOI'leri uygulamak için alttaki Anahat düğmesini tıklayın.
- TAC'leri hesaplamak ve bunları PKIN araçlarına göndermek için Şablon sekmesinin üzerindeki düğmeyi tıklayın.
- Giriş Resimlerini Yükle alt sayfasında:
- PKIN içinde:
- Sağ altta, önceden seçilen VOI'lerin TAC'lerini kBq/mL cinsinden görselleştirmek için Ekran Türü için TAC'leri seçin.
- TAC'lerle tuval üzerine sağ tıklayın ve görünür eğrilerin Değer tablosuna tıklayın. Daha fazla analiz için tabloyu bir elektronik tabloya kopyalayın.
- Bir korelasyon matrisi elde etmek için altıncı zaman diliminden son zaman dilimine (= tarama başlangıcından 10-60 dakika sonra) kadar olan verileri kullanarak tüm VOI çiftleri arasındaki Pearson korelasyonunu hesaplayın. Bu amacı yerine getiren "correlation_matrix.py" adlı bir Python betiği Ek Dosya 1'e dahil edilmiştir.
- T-testi istatistiğini kullanarak Pearson korelasyonunun anlamlı olup olmadığını hesaplayın:
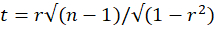 n - 2 serbestlik derecesi ile, burada r Pearson korelasyon katsayısı ve n = 25 Pearson korelasyonunu hesaplamak için kullanılan zaman çerçevesi sayısıdır. Çoklu karşılaştırmalar için uygun bir düzeltme uygulayın ve istatistiği n - 2 serbestlik derecesine sahip iki kuyruklu bir t dağılımının (p = 0.05) kritik değeriyle karşılaştırın. Düzeltilmiş t-testi değeri kritik değerden küçükse, iki VOI arasındaki Pearson korelasyonunu anlamlı olarak kabul edin.
n - 2 serbestlik derecesi ile, burada r Pearson korelasyon katsayısı ve n = 25 Pearson korelasyonunu hesaplamak için kullanılan zaman çerçevesi sayısıdır. Çoklu karşılaştırmalar için uygun bir düzeltme uygulayın ve istatistiği n - 2 serbestlik derecesine sahip iki kuyruklu bir t dağılımının (p = 0.05) kritik değeriyle karşılaştırın. Düzeltilmiş t-testi değeri kritik değerden küçükse, iki VOI arasındaki Pearson korelasyonunu anlamlı olarak kabul edin.
Sonuçlar
Tarama tamamlandıktan sonra, doğru bir izleyici enjeksiyonu ve alımı olup olmadığını kontrol etmek için çekim sırasında tespit edilen oranın TAC'si araştırılabilir. Şekil 1 , başarılı bir izleyici enjeksiyonu ve ediniminden sonra tarayıcının tüm FOV'undan kaynaklanan bir TAC'yi (panel A) ve kısmen paravenöz izleyici enjeksiyonundan sonra ortaya çıkan bir TAC'yi (panel B) göstermektedir. Başarılı durumda, sayı...
Tartışmalar
Burada sağlanan protokol, sıçanlarda izleyici olarak [18F]FDG kullanarak 1 saatlik dinamik PET verisi elde etme sürecinde kullanıcılara rehberlik eder. Sonunda, tek bir denek düzeyinde metabolik bağlantıyı değerlendirmek için kullanılabilecek bir VOI korelasyon matrisi elde edilir. Deneyimli araştırmacılar, protokolü, örneğin görüntü rekonstrüksiyonları için farklı bir radyoizleyici, edinme süresi veya zaman çerçevesi genişlikleri kullanarak ve ve...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Flaman Araştırma Vakfı'ndan [G0A7422N] bir araştırma bursu ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antisedan | Orion Pharma | Atipamezole hydrochloride 5 mg/mL | |
| BD Micro-Fine+ insulin syringe 1 mL | BD | 324827 | 0.33 mm (29G) x 12.7 mm |
| BD Microlance 3 Needles 30 G x 1/2" | BD | 304000 | 30 G x 1/2"; 0,3 x 13 mm |
| BD Plastipak syringe 1 mL | BD | 303172 | for infusion pump |
| BTPE-10 Polyethylene tubing | Instech | 0.11x.024in (.28x60mm) | |
| Domitor | Orion Pharma | 1070499 | Medetomidine hydrochloride 1 mg/mL |
| Fusion 100 infusion pump | Chemyx Inc. | 07100 | Newer model available: Fusion 100X |
| Isoflutek 1000 mg/g | Alivira | Isoflurane | |
| MOLECUBES β-CUBE with CUBEFLOW software | MOLECUBES NV | Preclinical PET scanner | |
| PMOD Software version 4.4 | Bruker Corporation | http://www.pmod.com; quantification of PET data | |
| Saline | B. Braun | 394496 | NaCl 0.9% |
| Vidisic eye gel | Vidisic | Carbomerum 980 2 mg/g |
Referanslar
- Wilson, H., Pagano, G., Politis, M. Dementia spectrum disorders: lessons learnt from decades with PET research. J Neural Transm. 126 (3), 233-251 (2019).
- Singnurkar, A., Poon, R., Metser, U. Comparison of 18F-FDG-PET/CT and 18F-FDG-PET/MR imaging in oncology: a systematic review. Ann Nucl Med. 31 (5), 366-378 (2017).
- Youssef, G., et al. The use of 18F-FDG PET in the diagnosis of cardiac sarcoidosis: a systematic review and metaanalysis including the Ontario experience. J Nucl Med. 53 (2), 241-248 (2012).
- Carli, G., Tondo, G., Boccalini, C., Perani, D. Brain molecular connectivity in neurodegenerative conditions. Brain Sci. 11 (4), 433 (2021).
- Sala, A., Perani, D. Brain molecular connectivity in neurodegenerative diseases: Recent advances and new perspectives using positron emission tomography. Front Neurosci. 13, 617 (2019).
- Horwitz, B., Duara, R., Rapoport, S. I. Intercorrelations of glucose metabolic rates between brain regions: Application to healthy males in a state of reduced sensory input. J Cereb Blood Flow Metab. 4 (4), 484-499 (1984).
- Sporns, O., Tononi, G., Kötter, R. The human connectome: A structural description of the human brain. PLOS Comput Biol. 1 (4), e42 (2005).
- Biswal, B., Zerrin Yetkin, F., Haughton, V. M., Hyde, J. S. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med. 34 (4), 537-541 (1995).
- Sanchez-Catasus, C. A., Diercke, R. A. J. O., de Vries, E. F. J., van Waarde, A., Leenders, K. L., et al. Use of nuclear medicine molecular neuroimaging to model brain molecular connectivity. PET and SPECT in neurology. , 181-207 (2021).
- Wehrl, H. F., et al. Simultaneous PET-MRI reveals brain function in activated and resting state on metabolic, hemodynamic and multiple temporal scales. Nat Med. 19 (9), 1184-1189 (2013).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21 (5), 801-807 (1990).
- Krishnamoorthy, S., et al. Performance evaluation of the MOLECUBES β-CUBE - a high spatial resolution and high sensitivity small animal PET scanner utilizing monolithic LYSO scintillation detectors. Phys Med Biol. 63 (15), 155013 (2018).
- Schiffer, W. K., Mirrione, M. M., Dewey, S. L. Optimizing experimental protocols for quantitative behavioral imaging with 18F-FDG in rodents. J Nucl Med. 48 (2), 277-287 (2007).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. J Nucl Med. 47 (6), 999-1006 (2006).
- Gold, M. E. L., Norell, M. A., Budassi, M., Vaska, P., Schulz, D. Rapid 18F-FDG uptake in brain of awake, behaving rat and anesthetized chicken has implications for behavioral PET studies in species with high metabolisms. Front Behav Neurosci. 12, 115 (2018).
- Miranda, A., et al. PET imaging of freely moving interacting rats. NeuroImage. 191, 560-567 (2019).
- Miranda, A., et al. Awake 18F-FDG PET imaging of memantine-induced brain activation and test-retest in freely running mice. J Nucl Med. 60 (6), 844-850 (2019).
- Jahreis, I., Bascuñana, P., Ross, T. L., Bankstahl, J. P., Bankstahl, M. Choice of anesthesia and data analysis method strongly increases sensitivity of 18F-FDG PET imaging during experimental epileptogenesis. PLOS ONE. 16 (11), e0260482 (2021).
- Pawela, C. P., et al. A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity. NeuroImage. 46 (4), 1137-1147 (2009).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: Uses and interpretations. NeuroImage. 52 (3), 1059-1069 (2010).
- Engel, J., et al. Connectomics and epilepsy. Curr Opin Neurol. 26 (2), 186 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır