A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
חקר קישוריות מוחית מטבולית באמצעות טומוגרפיה דינמית של פליטת פוזיטרונים 2-deoxy-2-[18F]Fluoro-D-Glucose ברמת נבדק יחיד
In This Article
Summary
רכישת נתוני טומוגרפיה דינמית של פליטת פוזיטרונים (PET) ושחזור למסגרות זמן מאפשרת ניתוח קישוריות מוחית מטבולית ברמת הנבדק היחיד. אנו מתארים שיטה לרכישת נתוני PET דינמיים [18F]FDG של מוח החולדה וקבלת מטריצת קישוריות באמצעות חילוץ עקומות זמן-פעילות של נפחים מעניינים.
Abstract
עד היום, קישוריות מוחית מטבולית נחקרת בעיקר ברמה קבוצתית באמצעות רכישת נתוני טומוגרפיה של פליטת פוזיטרונים סטטיים (PET) של מספר נבדקים. קבוצות המחקר שלנו חוקרות כיום שינויים בקישוריות מטבולית על פני נקודות זמן מרובות בעקבות דימום תוך מוחי ברמה תוך-מוחית בחולדות. כדי לחקור קישוריות מוחית מטבולית תוך-נבדקים, נדרש מידע זמני על קליטת העוקב באזורי מוח שונים, שניתן להשיג באמצעות PET דינמי. בפרסום זה, אנו נותנים תיאור מפורט של פרוטוקול איסוף וניתוח הנתונים שלנו.
נתוני PET דינמיים של מוח החולדה נרכשים במערכת PET פרה-קלינית ייעודית המשתמשת ב-2-deoxy-2-[18F]fluoro-D-glucose ([18F]FDG) כעוקב. העוקב מוזרק לווריד כבולוס בתחילת סריקת ה-PET. במהלך הרכישה של 60 דקות, בעלי חיים מרדימים עם מדטומידין.
לאחר הרכישה, נתוני ה-PET משוחזרים למסגרות זמן של 32 דקות באמצעות אלגוריתם שחזור איטרטיבי (Maximum-Probability Expectation-Maximization). אטלס מחולק המורכב ממספר נפחים של עניין (VOIs) משמש לחילוץ עקומות זמן-פעילות של כל VOI, המשמשות לאחר מכן לחישוב מקדם המתאם של פירסון בין כל זוג VOIs.
פרוטוקול PET דינמי זה מאפשר להעריך את הבדלי הקישוריות המטבולית בין שתי סריקות בודדות, ולא בין קבוצות סריקות. גישה זו מאפשרת לחקור שינויים בקישוריות מטבולית בתוך נבדק בודד על פני נקודות זמן שונות, או להשוות את הקישוריות המטבולית של אדם למסד נתונים רגיל. השוואות כאלה יכולות להיות שימושיות למעקב אחר התקדמות המחלה או לסייע באבחון הפרעות נוירולוגיות המאופיינות בתקשורת משובשת בין אזורי מוח, כגון אפילפסיה או דמנציה.
Introduction
טומוגרפיה של פליטת פוזיטרונים (PET) היא טכניקת הדמיה מולקולרית הנפוצה במחקר כמו גם במסגרות קליניות. בשל התפתחותם של עוקבי PET שונים, ניתן להשתמש ב-PET כדי לחקור פתופיזיולוגיה של המחלה ולעקוב אחר התקדמות המחלה והתגובה לטיפולים1. אחד הרדיואקסרים הנפוצים ביותר הוא 2-deoxy-2-[18F]fluoro-D-glucose ([18F]FDG), המאפשר הדמיה של חילוף החומרים של הגלוקוז, המעיד על הפעלה תאית. הוא משמש באונקולוגיה לאבחון, שלב ופרוגנוזה; בנוירולוגיה, בדרך כלל בהקשר של מחלות ניווניות כמו דמנציה; ובקרדיולוגיה, לאבחון מצבים כמו סרקואידוזיס, אם לציין רק כמה דוגמאות 1,2,3.
הערכת קישוריות מוחית מטבולית, המתקבלת מנתוני [18F]FDG PET, מתייחסת ליחסים התפקודיים בין קליטת עוקבים באזורי מוח שונים. גישה זו מאפשרת לחשב "מטריצת קישוריות" על ידי בחירת קבוצה של אזורים במוח, שיכולים לספק תובנות לגבי האופן שבו חלקים שונים במוח מתקשרים ומתפקדים יחד. סוג זה של ניתוח שימושי במיוחד לחקר תפקוד המוח בבריאות ובמחלות, כולל מצבים כמו דמנציה, אפילפסיה והפרעות נוירולוגיות אחרות 4,5.
המחקר הראשון שהעריך קישוריות מוחית מטבולית כבר מתוארך לשנות ה-80 של המאהה-20, אך החוקרים חקרו בעיקר קישוריות מוחית מבנית, הידועה גם בשם "קונקטום"7, באמצעות הדמיית תהודה מגנטית משוקללת דיפוזיה (DW-MRI). יתר על כן, קישוריות פונקציונלית באמצעות טכניקות כגון MRI פונקציונלי (fMRI), אלקטרואנצפלוגרפיה (EEG) ומגנטואנצפלוגרפיה (MEG) נחקרה באופן נרחב במשך מספר עשורים 8,9.
לאחרונה, יש עניין מחודש בחקר קישוריות מוחית מטבולית באמצעות [18F]FDG PET, לא רק בפני עצמו, אלא גם בשילוב עם צורות אחרות של קישוריות מוחית10. עם זאת, בשל האופי ה"סטטי" המובנה של תמונות PET (בניגוד, למשל, ל-MRI תפקודי), הרוב המכריע של התוצאות המבוססות על PET ברשת המוח מבוססות על ניתוח ברמת הקבוצה, שבו מתאמים בין אזורי מוח מחושבים ברמת האינטר-סובייקט. מגבלה זו הופכת ניתוח בתוך הנבדק של תמונות PET לבלתי אפשרי, וזה חיוני למחקרי אורך שיכולים לעקוב אחר שינויים לאורך זמן בתוך אותו אדם4. לכן, פיתוח שיטות המאפשרות ניתוח של נבדק יחיד, כגון קישוריות מולקולרית דינמית מבוססת PET, הוא כיוון מחקר חשוב בחקר המוח החוקר הפרעות רשת, מכיוון שהוא פותח את הדלת לשימוש בניתוח רשתות מולקולאריות בפרקטיקה הקלינית. לפיכך, נעשה שימוש בנתוני PET דינמיים במחקר הפרה-קליני שלנו.
קבוצות המחקר שלנו עורכות כעת מחקר הבוחן שינויים בקישוריות המטבולית בעקבות דימום תוך מוחי ברמה תוך-מוחית על פני מספר נקודות זמן באמצעות מודל קולגנאזחולדה 11. כדי לחקור קישוריות מוחית מטבולית תוך-נבדקים, נדרש מידע זמני על קליטת העוקב באזורי מוח שונים, אותו ניתן להשיג באמצעות PET דינמי. בסעיפים הבאים, אנו נותנים תיאור מפורט של פרוטוקול איסוף וניתוח הנתונים.
Protocol
כל הנהלים הם בהתאם להנחיות האירופיות (הנחיה 2010/63/EU), והפרוטוקול אושר על ידי הוועדה המקומית לאתיקה של בעלי חיים של אוניברסיטת גנט (ECD 23/33). שתים עשרה חולדות Sprague Dawley (שש נקבות, שישה זכרים) נכללו במחקר. סריקות ה-PET שלהם התקבלו באמצעות הפרוטוקול הבא במספר נקודות זמן שנעו בין שבועיים לפני ל-18 שבועות לאחר דימום תוך מוחי. בזמן הסריקה הראשונה, כל בעלי החיים היו בני 18 שבועות והנקבות שקלו 244.8 ±-10.1 גרם (ממוצע ± SD) בעוד שהזכרים שקלו 363.6 ±-13.3 גרם.
ודא שחומרים רדיואקטיביים עובדים ומטופלים רק על ידי צוות מיומן. שמור על המינון לצוות ולבעלי חיים נמוך ככל האפשר (ALARA).
1. רכישת נתונים
הערה: עיין בטבלת החומרים לפרטים על הדמיית ה-PET הפרה-קלינית והתוכנה המשמשת לרכישת נתונים. ההדמיה היא סורק PET של 45 גלאים (מסודרים ב-5 טבעות) המכסה שדה ראייה צירי (FOV) של 13 ס"מ ו-FOV טרנס-צירי של 7.6 ס"מ, באמצעות גבישי LYSO וגלאי SiPM. המערכת מציגה רזולוציה מרחבית של 850 מיקרומטר, רגישות של 12% ורזולוציית אנרגיה של 12.6%12. השלבים הבאים נכתבו מתוך מחשבה על כך.
- מנעו מבעלי החיים מזון לפחות 6 שעות לפני הסריקה על ידי הוצאת כל המזון מהכלוב שלהם. לאחר שהחיה עברה תקופת צום מספקת, התחל בהכנות לרכישת נתונים כדלקמן.
- הפעל כרית חימום ואפשר לה להתחמם עד 30-35 מעלות צלזיוס.
- להרדים את בעל החיים באיזופלורן על ידי הנחת החיה בתא הרדמה בגז מלא באיזופלורן 5% ב-O2 רפואי בקצב זרימה של 2,000 מ"ל לדקה. עזור לשמור על טמפרטורת הגוף של החיה על ידי הצבת מנורת חימום 30 ס"מ מהתא. החיה מורדמת כראוי כאשר קצב הנשימה הוא 0.5-1 הרץ.
- שקלו את החיה.
- הניחו את החיה על כרית החימום. השתמש בקונוס אף כדי לתת 2% איזופלורן ב-O2 רפואי בקצב זרימה של 500 מ"ל/דקה. התאם את מינון האיזופלורן לפי הצורך כדי לשמור על החיה מורדמת כראוי.
- לגלח חלק מצוואר החיה בין השכמות.
- הכנת וריד הזנב להזרקת מעקב:
- סובב את החיה בצד שמאל או ימין והשתמש במנורת החימום כדי לחמם את זנבה, ולגרום להרחבת כלי הדם.
- קח כ -20 ס"מ של צינורות BTPE-10. בעזרת מחזיק מחט, נתק את הפיר של מחט 30 גרם והכנס 1-2 מ"מ מהקצה האחורי שלה לתוך צינור ה-PE. מלאו מזרק אינסולין של 1 מ"ל במי מלח והכניסו את קצה המחט 3-5 מ"מ לתוך צינור ה-PE. מלאו מראש את צינור ה-PE במי מלח מהמזרק המלא, והשאירו את מזרק המלח מחובר לצינור ה-PE.
- נקו את זנב החיה עם אתנול. הסר את מנורת החימום.
- הכנס את קצה המחט של צינור ה-PE לווריד זנב לרוחב. אשר מיקום נכון של המחט: חפש דם שנכנס לצינור PE כאשר הבוכנה נמשכת לאחור, היעדר התנגדות בזמן ההזרקה והיווצרות בלב תת עורי (המעיד על הזרקה פרוורידית) במקום ההזרקה. אם הכניסה לא הצליחה, הסר את המחט מהזנב ונסה שוב בקטע קרוב יותר.
- אבטח את המחט עם טיפת דבק מיידי באתר החדירה והדביק את צינור ה-PE לזנב.
הערה: הימנע מתנועה של צינור ה-PE. אם בכל רגע נכנס דם לצינור ה-PE, יש לשטוף אותו מיד במי מלח כדי למנוע סתימה.
- עבור להרגעה של מדטומידין:
- הניחו את החיה במצב נוטה על מחצלת החימום. יש למרוח טיפת ג'ל עיניים על כל עין כדי למנוע מהן להתייבש.
- הכן צינורות PE (40-100 ס"מ) לחיבור למשאבת עירוי הממוקמת קרוב לסורק ה-PET. בעזרת מחזיק מחט, נתק את הפיר של מחט 30 גרם והכנס 1-2 מ"מ מגבה לתוך צינור ה-PE. מלאו מזרק פלסטיק של 1 מ"ל עם מחט של 30 גרם עם לפחות 0.2 מ"ל מדטומידין (לכל בעל חיים), והכנס את קצה המחט 3-5 מ"מ לתוך צינור ה-PE. מלאו מראש את צינורות ה-PE במדטומידין מהמזרק.
- מניחים את המזרק עם מדטומידין במשאבת העירוי. הפעל את המשאבה ובחר את המזרק הנכון על ידי לחיצה על מצא מזרק | BD פלסטיק | 1 מ"ל.
- הוצא בולי של 0.005 מ"ל באמצעות המשאבה עד שיוצאת טיפה מהמחט בקצה השני של צינור ה-PE. ודא שאין בועות אוויר בצינורות ה-PE.
- הכנס את המחט של צינור ה-PE 2-3 מ"מ תת עורית בין השכמות של החיה. אבטח את המחט עם טיפת דבק מיידי במקום החדירה והדביק בעדינות את צינור ה-PE לגב החיה.
- יש להזריק בולוס בנפח v של מדטומידין (קצב: 3 מ"ל/דקה) בהתבסס על משקל החיה:
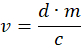
כאשר d = 0.05 מ"ג/ק"ג (המינון של מדטומידין במ"ג לק"ג משקל בעל חיים), m הוא משקל החיה בק"ג, ו-c הוא ריכוז המדטומידין במ"ג/מ"ל. - יש להפסיק את מתן האיזופלורן 10 דקות לאחר מתן בולוס המדטומידין, תוך התאמת מינון האיזופלורן לפי הצורך כדי לשמור על הרדמה יציבה במהלך תקופת המתנה זו.
הערה: איזופלורן בשילוב עם מדטומידין מאט משמעותית את קצב הנשימה של החיה. ניטור צמוד חיוני עד להפסקת מתן איזופלורן. - חמש דקות לאחר הפסקת איזופלורן, התחל עירוי רציף של מדטומידין בקצב של:
rcont = r • m
כאשר r = 0.1 מ"ג/(ק"ג·שעה); כמות המדטומידין במ"ג למשקל גוף של בעל חיים בק"ג/שעה), ו-M הוא משקל החיה בק"ג.
הערה: יש צורך בתקופת שיווי משקל של 25 דקות נוספות לאחר תחילת עירוי רציף (כלומר 30 דקות לאחר הפסקת איזופלורן) לפני שניתן יהיה להתחיל את הסריקה כדי להבטיח שהמערכת של בעל החיים נקייה מאיזופלורן. במהלך תקופה זו, המשך בשלבים הבאים.
- מיקום בעלי חיים בסורק ה-PET:
- הכן את מיטת הסורק עם כרית חימום, חיישן לחץ וממחטות נייר. השתמש בחיישן כדי לנטר את קצב הנשימה של בעל החיים ואת רקמות הנייר לספיגת השתן המופרש על ידי החיה.
הערה: בשל המדטומידין, החיה בדרך כלל תפריש כמויות גדולות של שתן. - העבירו בזהירות את החיה למיטת הסורק, וודאו שקו המדטומידין וצנתר וריד הזנב נשארים מאובטחים. מקם את ראש החיה ישר ככל האפשר באמצעות חרוט אף לסיוע במידת הצורך. אבטח את הראש עם סרט לאחר המיקום הנכון.
- הפעל את כרית החימום וודא שמערכת ניטור קצב הנשימה פועלת כהלכה, והתאם את מיקום חיישן הלחץ במידת הצורך.
- הכן את מיטת הסורק עם כרית חימום, חיישן לחץ וממחטות נייר. השתמש בחיישן כדי לנטר את קצב הנשימה של בעל החיים ואת רקמות הנייר לספיגת השתן המופרש על ידי החיה.
- עשר עד חמש דקות לפני תחילת סריקת ה-PET, מלאו מזרק אינסולין בכ-20 MBq 2-deoxy-2-[18F]fluoro-D-glucose ([18F]FDG) מדולל ב-0.1-0.8 מ"ל מי מלח.
זהירות: פלואור-18 (18F) הוא רדיואיזוטופ פלואור עם זמן מחצית חיים של 109.8 דקות. פעל לפי פרוטוקולי בטיחות קרינה מקומיים בעת טיפול בחומר רדיואקטיבי. - פתח את תוכנת הסורק והגדר את פרמטרי הסריקה הבאים: בחר 18F כאיזוטופ (חשוב לתיקון דעיכה), הזן את הפעילות הנמדדת של המזרק המכיל את הרדיואקסר (ב-MBq נמדד על ידי כיול המינון), ואת זמן המדידה (המידע יישמר במטא נתונים, הדרוש להמרת הנתונים ליחידות אחרות כגון ערכי קליטה סטנדרטיים). בחר את הפרוטוקול הכללי וסמן מיון אוטומטי לאחר הרכישה. הגדירו את משך הסריקה לשעה אחת, והתאימו את אזור העניין (ROI) כך שהוא יכיל את כל מוח החולדה (בדרך כלל מיקום 2-5).
- לאחר שחלפו 30 דקות מהפסקת מתן האיזופלורן, התחל את סריקת ה-PET:
- שוב, יש לאשר מיקום נכון בווריד על ידי שאיבה ואחריה הזרקת כמות קטנה של מי מלח כמתואר בשלב 1.7.4.
- החלף את מזרק המלח במזרק הרדיו-טריסר. כאשר מוציאים את המזרק מצינור ה-PE, יתכן שדם נכנס לצינור ה-PE ודוחף החוצה מי מלח. הכנס את המחט של מזרק הרדיו במהירות מבלי לנקב את צינור ה-PE.
- התחל את הסריקה באמצעות תוכנת הסורק.
- לאחר תחילת הרכישה, הזריק את העוקב כבולוס במשך כ-0.5-2 שניות. החלף מיד את מזרק הרדיו הריק במזרק המלח ושטוף את צינור ה-PE בכ-0.1 מ"ל מי מלח. השתמש בטישו כדי לתפוס טיפות של רדיו-טרסר שעלולות לברוח במהלך החלפת המזרק.
הערה: קצב הספירה המוצג על ידי תוכנת הסורק אמור לעלות במהירות ל-4.5-6.5 Mcps לאחר הזרקת מעקב. שיעור הספירה בהתחלה נמוך משמעותית מ-4 Mcps ועולה לאחר מכן מצביע על הזרקת מעקב (חלקית) paravenide. - העריכו את הפעילות הנותרת שלא הוזרקה לבעל החיים על ידי מדידת הפעילות של מזרק העוקב ורקמות וכפפות שעלולות להיות מזוהמות. הזן את הפעילות ואת זמן המדידה לתוכנת הסורק כדי לשמור אותה במטא נתונים.
הערה: פעילות שנותרה של 0.1-1.5 MBq היא אופיינית, תלוי כמה עוקב ברח בעת החלפת העוקב למזרק המלח.
- לאחר השלמת הסריקה, הוצא את המיטה עם בעל החיים מהסורק.
הערה: בעל החיים עשוי להגיב לגירויים או להתעורר לפני שמדטומידין הפך לאנטגוניזציה. טפל בבעל החיים בזהירות והיה מוכן לתנועות פתאומיות במהלך השלבים הבאים. כמו כן, שים לב שהחיה רדיואקטיבית. לפיכך, שאפו להשלים את השלבים הבאים במהירות ובזהירות ככל האפשר. - הסר את המחט וצינורות ה-PE מזנב החיה באמצעות מחזיק מחט. מרחו טישו או דחיסה על מקום הניקוב כדי לעצור דימום פוטנציאלי.
- הפסק את מתן המדטומידין והסר את המחט וצינורות ה-PE מצוואר החיה.
- הניחו את בעל החיים בכלוב נקי מבעלי חיים אחרים, תוך שימוש ברקמה כדי לתפוס שתן (רדיואקטיבי) שעלול להיות מופרש בזמן הזזת החיה. יש לתת 1 מ"ל מי מלח תת עורי בגב באמצעות מזרק אינסולין של 1 מ"ל כדי לקדם החזרת נוזלים.
- הפוך את ההרגעה עם הזרקה תת עורית של אטיפמזול.
- חשב את אמצעי האחסון המתאים v באמצעות המשוואה הבאה:
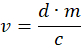
כאשר d = 0.5 מ"ג/ק"ג, כלומר המינון של מדטומידין במ"ג לק"ג משקל בעל חיים, m הוא משקל החיה בק"ג, ו-c הוא ריכוז האטיפמזול במ"ג/מ"ל. - עבור בעלי חיים קלים הגורמים לנפחים מחושבים קטנים, יש לדלל את האטיפמזול במי מלח כדי לאפשר מינון מדויק יותר. מלאו מזרק אינסולין ב-4 • v של atipamezole ו-12 • v של מי מלח. יש להזריק 1/4 מהתמיסה המתקבלת באופן תת עורי לגב החיה ליד הצוואר.
- חשב את אמצעי האחסון המתאים v באמצעות המשוואה הבאה:
- עקוב אחר החיה חזותית עד שהיא מתעוררת, מה שאמור לקחת 1-5 דקות. ברגע שהחיה מסוגלת לשמור על עצמה זקופה ולנוע בחופשיות, החזירו אותה לדיור קבוצתי. ספק לבעל החיים מזון ומים.
2. שחזור נתונים ובדיקת איכות
הערה: באמצעות התוכנה הקשה והתוכנה הזמינה במחקר שלנו, כל נתוני ה-PET תוקנו עבור דעיכת רדיונוקלידים, וסינוגרמות שנרכשו שוחזרו עם אלגוריתם מקסום הציפייה התלת-ממדי (OSEM-3D) באמצעות חלון של 30% סביב פוטו-שיא 511 keV. תוכנת השחזור של OSEM השתמשה בהגדרות ברירת המחדל שלה של 10 תת-קבוצות עם 20 מיליון אירועים לכל תת-קבוצה. התמונות שוחזרו למטריצה רוחבית בגודל 192 x 192 x 384 עם ווקסלים של תמונה מעוקבת של 0.4 מ"מ. לא בוצע תיקון הנחתה.
- כדי לוודא שהזרקת העוקב הצליחה, בדוק את קצב הספירה שזוהה במהלך הרכישה של 60 דקות (כלומר, עקומת זמן-פעילות (TAC)). ודא שיש שיא בדקה הראשונה של הרכישה, מיד לאחר הזרקת העוקב.
- שחזור סטטי: שחזר את הנתונים שנרכשו באמצעות אלגוריתם OSEM באמצעות 30 איטרציות, גודל ווקסל איזומטרי של 400 מיקרומטר וחלון אנרגיה של 30% שבמרכזו פוטו-פיק 511 keV.
- לאחר השלמת השחזור, בדוק את התמונה המתקבלת לאיתור חפצים.
- שחזור דינמי: שחזר את הנתונים שנרכשו למסגרות זמן של שלושים ו-2 דקות תוך שימוש באותן הגדרות כמו לשחזור הסטטי.
3. ניתוח נתונים
הערה: השלבים הבאים 3.1 ו-3.2 מבוצעים בסביבת תוכנה ביו-רפואית המוקדשת לכימות נתוני PET, באמצעות כלי רישום והיתוך תמונה (PFUS) וכלי המידול הקינטי הכללי (PKIN).
- ב-PFUS:
- בתמונות קלט של טען דפי משנה:
- טען את קובץ DICOM של השחזור הדינמי באמצעות לחצן הטעינה INP או על-ידי גרירה ושחרור של הקובץ בבד הציור. השתמש בפקד תצוגת תמונה כללי בחלק העליון הימני כדי לנווט בין פרוסות ומסגרות זמן ולהתאים את סרגל הצבע. במידת הצורך, התאם את כיוון התמונה לכיוון רגיל באמצעות לחצן שנה כיוון תמונת קלט בסרגל הצד הימני.
- חיתוך וממוצע מסגרות: לחץ/י על החץ בתחתית השמאלית כדי להציג את כלי הבקרה המוסתרים לסיכום וחיתוך וסמן/י את ״חתוך״. בבד הציור, הגדירו את גבולות החיתוך באמצעות התאמת הקצוות וגרירת מרכז תיבת החיתוך. ודא שכל המוח ומעט ריפוד, המכיל חלקים מהעיניים וחוט השדרה, מכילים. לאחר שתיבת החיתוך מוגדרת כראוי, לחץ על כפתור החיתוך כדי לחתוך את התמונה. חשב את ממוצע המסגרת המשוקלל בזמן בכל מסגרות הזמן על ידי לחיצה על לחצן הממוצע הכתום והמתן להוספה אוטומטית של התוצאה לתמונות הקלט, וכתוצאה מכך שתי תמונות קלט בסך הכל: הנתונים הדינמיים שנחתכו עם מסגרות הזמן והממוצע המשוקלל בזמן שנחתך של אותם נתונים.
- בחר עיוות כשיטת התאמה או לחץ על הלחצן אם כבר נבחר כדי לעבור לנורמליזציה מבוססת תבנית.
- בדף משנה הפניה והתאמה:
- בחר את התמונה הממוצעת המשוקללת בזמן כתמונת הקלט (היא נבחרת בדרך כלל אוטומטית מהשלב האחרון).
- טען הפניה על ידי לחיצה על הכפתור כדי לבחור תבנית נורמליזציה כתמונת ההתייחסות. בחר Rat FDG (W. Schiffer).
- התאם את הקלט לתבנית על ידי לחיצה על הכפתור להתאמת קלט | קלט: כוונן ידנית בסרגל הצד משמאל. גרור וסובב את תמונת הקלט כך שתתאים בערך לתבנית. ודא שחולדה נבחרה כמין, שיטת הרישום היא עיוות, ולאחר מכן לחץ על כפתור התאם זרם כדי להגיע לדף המשנה הבא.
- בתוצאות התאמת עמוד משנה:
- בדוק את התוצאה והתאם את ההתאמה באופן ידני במידת הצורך. לחצו על Apply Current Transformation to All כדי להתאים גם את תמונת הקלט הכוללת את מסגרות הזמן.
- לחץ על הכפתור הירוק VOIs כדי לעבור לשלב העיבוד הבא.
- בניתוח VOI של עמוד משנה:
- בחר את התמונה המכילה את מסגרות הזמן כתמונה A בתפריט הימני התחתון.
- עבור אל הכרטיסייה תבנית ובחר Px Rat (W. Schiffer) בכרטיסייה אטלס , או טען אטלס מותאם אישית ובחר את אמצעי האחסון הרצויים. כדי להחיל את ה- VOIs, לחץ על מתאר כפתור בתחתית.
- לחץ על הכפתור מעל הכרטיסיה תבנית כדי לחשב TACs ולשלוח אותם לכלי PKIN.
- בתמונות קלט של טען דפי משנה:
- ב-PKIN:
- בפינה השמאלית התחתונה, בחר TACs עבור Display Type כדי להמחיש את ה-TACs ב-kBq/mL של ה-VOIs שנבחרו מראש.
- לחץ לחיצה ימנית על בד הציור עם ה-TACs ולחץ על טבלת הערכים של עקומות גלויות. העתק את הטבלה לגיליון אלקטרוני להמשך ניתוח.
- חשב את מתאם פירסון בין כל הזיווגים של VOIs, תוך שימוש בנתונים ממסגרת הזמן השישית עד האחרונה (= 10-60 דקות לאחר תחילת הסריקה), כדי לקבל מטריצת מתאם. סקריפט Python בשם "correlation_matrix.py" הממלא מטרה זו כלול בקובץ משלים 1.
- חשב אם מתאם פירסון מובהק באמצעות סטטיסטיקת מבחן t:
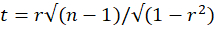 עם n - 2 דרגות חופש, כאשר r הוא מקדם המתאם של פירסון ו- n = 25 מספר מסגרות הזמן המשמשות לחישוב מתאם פירסון. החל תיקון מתאים להשוואות מרובות והשווה את הסטטיסטיקה לערך הקריטי של התפלגות t דו-זנבית (p = 0.05) עם n - 2 דרגות חופש. שקול את מתאם פירסון בין שני VOIs משמעותיים אם ערך מבחן ה-t המתוקן קטן מהערך הקריטי.
עם n - 2 דרגות חופש, כאשר r הוא מקדם המתאם של פירסון ו- n = 25 מספר מסגרות הזמן המשמשות לחישוב מתאם פירסון. החל תיקון מתאים להשוואות מרובות והשווה את הסטטיסטיקה לערך הקריטי של התפלגות t דו-זנבית (p = 0.05) עם n - 2 דרגות חופש. שקול את מתאם פירסון בין שני VOIs משמעותיים אם ערך מבחן ה-t המתוקן קטן מהערך הקריטי.
תוצאות
לאחר השלמת הסריקה, ניתן לחקור את ה-TAC של הקצב שזוהה במהלך הרכישה כדי לבדוק אם יש הזרקה וספיגה נכונה של עוקב. איור 1 מציג TAC הנובע מכל ה-FOV של הסורק לאחר הזרקה ורכישה מוצלחת של עוקב (פאנל A), ו-TAC הנובע לאחר הזרקת עוקב פרוורידי חלקית (פאנל B). במקרה המוצלח,...
Discussion
הפרוטוקול המסופק כאן מנחה את המשתמשים בתהליך של רכישת נתוני PET דינמיים של שעה אחת באמצעות [18F]FDG כעוקב בחולדות. בסופו של דבר, מתקבלת מטריצת מתאם של VOIs, שניתן להשתמש בה כדי להעריך קישוריות מטבולית ברמת נושא יחיד. חוקרים מנוסים עשויים להתאים את הפרוטוקול כך שיתאים לצרכ?...
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
העבודה הזו נתמכה על ידי מענק מחקר מקרן המחקר הפלמי [G0A7422N].
Materials
| Name | Company | Catalog Number | Comments |
| Antisedan | Orion Pharma | Atipamezole hydrochloride 5 mg/mL | |
| BD Micro-Fine+ insulin syringe 1 mL | BD | 324827 | 0.33 mm (29G) x 12.7 mm |
| BD Microlance 3 Needles 30 G x 1/2" | BD | 304000 | 30 G x 1/2"; 0,3 x 13 mm |
| BD Plastipak syringe 1 mL | BD | 303172 | for infusion pump |
| BTPE-10 Polyethylene tubing | Instech | 0.11x.024in (.28x60mm) | |
| Domitor | Orion Pharma | 1070499 | Medetomidine hydrochloride 1 mg/mL |
| Fusion 100 infusion pump | Chemyx Inc. | 07100 | Newer model available: Fusion 100X |
| Isoflutek 1000 mg/g | Alivira | Isoflurane | |
| MOLECUBES β-CUBE with CUBEFLOW software | MOLECUBES NV | Preclinical PET scanner | |
| PMOD Software version 4.4 | Bruker Corporation | http://www.pmod.com; quantification of PET data | |
| Saline | B. Braun | 394496 | NaCl 0.9% |
| Vidisic eye gel | Vidisic | Carbomerum 980 2 mg/g |
References
- Wilson, H., Pagano, G., Politis, M. Dementia spectrum disorders: lessons learnt from decades with PET research. J Neural Transm. 126 (3), 233-251 (2019).
- Singnurkar, A., Poon, R., Metser, U. Comparison of 18F-FDG-PET/CT and 18F-FDG-PET/MR imaging in oncology: a systematic review. Ann Nucl Med. 31 (5), 366-378 (2017).
- Youssef, G., et al. The use of 18F-FDG PET in the diagnosis of cardiac sarcoidosis: a systematic review and metaanalysis including the Ontario experience. J Nucl Med. 53 (2), 241-248 (2012).
- Carli, G., Tondo, G., Boccalini, C., Perani, D. Brain molecular connectivity in neurodegenerative conditions. Brain Sci. 11 (4), 433 (2021).
- Sala, A., Perani, D. Brain molecular connectivity in neurodegenerative diseases: Recent advances and new perspectives using positron emission tomography. Front Neurosci. 13, 617 (2019).
- Horwitz, B., Duara, R., Rapoport, S. I. Intercorrelations of glucose metabolic rates between brain regions: Application to healthy males in a state of reduced sensory input. J Cereb Blood Flow Metab. 4 (4), 484-499 (1984).
- Sporns, O., Tononi, G., Kötter, R. The human connectome: A structural description of the human brain. PLOS Comput Biol. 1 (4), e42 (2005).
- Biswal, B., Zerrin Yetkin, F., Haughton, V. M., Hyde, J. S. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med. 34 (4), 537-541 (1995).
- Sanchez-Catasus, C. A., Diercke, R. A. J. O., de Vries, E. F. J., van Waarde, A., Leenders, K. L., et al. Use of nuclear medicine molecular neuroimaging to model brain molecular connectivity. PET and SPECT in neurology. , 181-207 (2021).
- Wehrl, H. F., et al. Simultaneous PET-MRI reveals brain function in activated and resting state on metabolic, hemodynamic and multiple temporal scales. Nat Med. 19 (9), 1184-1189 (2013).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21 (5), 801-807 (1990).
- Krishnamoorthy, S., et al. Performance evaluation of the MOLECUBES β-CUBE - a high spatial resolution and high sensitivity small animal PET scanner utilizing monolithic LYSO scintillation detectors. Phys Med Biol. 63 (15), 155013 (2018).
- Schiffer, W. K., Mirrione, M. M., Dewey, S. L. Optimizing experimental protocols for quantitative behavioral imaging with 18F-FDG in rodents. J Nucl Med. 48 (2), 277-287 (2007).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. J Nucl Med. 47 (6), 999-1006 (2006).
- Gold, M. E. L., Norell, M. A., Budassi, M., Vaska, P., Schulz, D. Rapid 18F-FDG uptake in brain of awake, behaving rat and anesthetized chicken has implications for behavioral PET studies in species with high metabolisms. Front Behav Neurosci. 12, 115 (2018).
- Miranda, A., et al. PET imaging of freely moving interacting rats. NeuroImage. 191, 560-567 (2019).
- Miranda, A., et al. Awake 18F-FDG PET imaging of memantine-induced brain activation and test-retest in freely running mice. J Nucl Med. 60 (6), 844-850 (2019).
- Jahreis, I., Bascuñana, P., Ross, T. L., Bankstahl, J. P., Bankstahl, M. Choice of anesthesia and data analysis method strongly increases sensitivity of 18F-FDG PET imaging during experimental epileptogenesis. PLOS ONE. 16 (11), e0260482 (2021).
- Pawela, C. P., et al. A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity. NeuroImage. 46 (4), 1137-1147 (2009).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: Uses and interpretations. NeuroImage. 52 (3), 1059-1069 (2010).
- Engel, J., et al. Connectomics and epilepsy. Curr Opin Neurol. 26 (2), 186 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved