É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Estudando a conectividade metabólica do cérebro usando tomografia por emissão de pósitrons dinâmica de 2-desoxi-2-[18F]Fluoro-D-glicose no nível de sujeito único
Neste Artigo
Resumo
A aquisição de dados dinâmicos de tomografia por emissão de pósitrons (PET) e a reconstrução em intervalos de tempo permitem a análise da conectividade metabólica do cérebro no nível de um único sujeito. Descrevemos um método para adquirir dados dinâmicos de PET [18F]FDG do cérebro de ratos e obter uma matriz de conectividade por meio da extração de curvas de tempo-atividade de volumes de interesse.
Resumo
Até hoje, a conectividade metabólica do cérebro é estudada principalmente em nível de grupo por meio da aquisição de dados estáticos de tomografia por emissão de pósitrons (PET) de vários indivíduos. Nossos grupos de pesquisa estão atualmente estudando mudanças na conectividade metabólica em vários pontos de tempo após uma hemorragia intracerebral em um nível intrasujeito em ratos. Para investigar a conectividade cerebral metabólica intrassujeito, são necessárias informações temporais da captação do traçador em diferentes regiões do cérebro, o que pode ser obtido por meio de PET dinâmico. Nesta publicação, damos uma descrição detalhada do nosso protocolo de aquisição e análise de dados.
Os dados dinâmicos de PET do cérebro de ratos são adquiridos em um sistema PET pré-clínico dedicado usando 2-desoxi-2-[18F]fluoro-D-glicose ([18F]FDG) como traçador. O marcador é injetado por via intravenosa como um bolus no início da tomografia por emissão de pósitrons. Durante a aquisição de 60 min, os animais são sedados com medetomidina.
Após a aquisição, os dados PET são reconstruídos em trinta e 2 minutos usando um algoritmo de reconstrução iterativa (Maximum-Likelihood Expectation-Maximization). Um atlas parcelado consistindo de vários volumes de interesse (VOIs) é usado para extrair curvas de tempo-atividade de cada VOI, que são então usadas para calcular o coeficiente de correlação de Pearson entre cada par de VOIs.
Este protocolo PET dinâmico permite a avaliação das diferenças de conectividade metabólica entre duas varreduras únicas, em vez de entre grupos de varreduras. Essa abordagem permite o estudo de mudanças na conectividade metabólica dentro de um único sujeito em diferentes pontos de tempo ou a comparação da conectividade metabólica de um indivíduo com um banco de dados normal. Essas comparações podem ser úteis para rastrear a progressão da doença ou auxiliar no diagnóstico de distúrbios neurológicos caracterizados por comunicação interrompida entre regiões do cérebro, como epilepsia ou demência.
Introdução
A tomografia por emissão de pósitrons (PET) é uma técnica de imagem molecular comumente usada em pesquisas, bem como em ambientes clínicos. Devido ao desenvolvimento de vários traçadores de PET, o PET pode ser usado para estudar a fisiopatologia da doença e monitorar a progressão da doença e a resposta aos tratamentos1. Um dos radiotraçadores mais utilizados é o 2-desoxi-2-[18F]fluoro-D-glicose ([18F]FDG), que permite a imagem do metabolismo da glicose, indicativo de ativação celular. É utilizado em oncologia para diagnóstico, estadiamento e prognóstico; em neurologia, comumente no contexto de doenças neurodegenerativas, como demência; e em cardiologia, para diagnosticar condições como a sarcoidose, para citar apenas alguns exemplos 1,2,3.
A avaliação da conectividade metabólica cerebral, obtida a partir de dados de [18F] FDG PET, refere-se às relações funcionais entre a captação do traçador em diferentes regiões do cérebro. Essa abordagem permite o cálculo de uma "matriz de conectividade" selecionando um conjunto de regiões cerebrais, que podem fornecer informações sobre como diferentes partes do cérebro interagem e funcionam juntas. Esse tipo de análise é particularmente útil para estudar a função cerebral na saúde e na doença, incluindo condições como demência, epilepsia e outros distúrbios neurológicos 4,5.
O primeiro estudo avaliando a conectividade cerebral metabólica já data da década de 19806, mas os pesquisadores exploraram principalmente a conectividade cerebral estrutural, também conhecida como "conectoma"7, por meio de ressonância magnética ponderada em difusão (DW-MRI). Além disso, a conectividade funcional usando técnicas como ressonância magnética funcional (fMRI), eletroencefalografia (EEG) e magnetoencefalografia (MEG) tem sido amplamente investigada por várias décadas 8,9.
Recentemente, recuperou-se o interesse em estudar a conectividade metabólica do cérebro usando [18F] FDG PET, não apenas por conta própria, mas também em combinação com outras formas de conectividade cerebral10. No entanto, devido à natureza "estática" inerente das imagens PET (em contraste com, por exemplo, ressonância magnética funcional), a grande maioria dos resultados baseados em PET de rede cerebral são baseados em análise em nível de grupo, onde as correlações entre as regiões cerebrais são calculadas no nível intersujeito. Essa limitação impossibilita a análise intra-sujeito das imagens de PET, o que é essencial para estudos longitudinais que possam rastrear mudanças ao longo do tempo dentro do mesmo indivíduo4. Portanto, o desenvolvimento de métodos que permitam a análise de um único sujeito, como a conectividade molecular dinâmica baseada em PET, é uma importante direção de pesquisa na pesquisa do cérebro que investiga distúrbios de rede, uma vez que abre as portas para o uso da análise de redes moleculares na prática clínica. Portanto, dados dinâmicos de PET foram usados em nosso estudo pré-clínico.
Nossos grupos de pesquisa estão atualmente conduzindo um estudo que examina as mudanças na conectividade metabólica após uma hemorragia intracerebral em um nível intrasujeito em vários pontos de tempo usando o modelo de colagenase de rato11. Para investigar a conectividade cerebral metabólica intrassujeito, são necessárias informações temporais da captação do traçador em diferentes regiões do cérebro, que podem ser obtidas por meio de PET dinâmico. Nas seções a seguir, fornecemos uma descrição detalhada do protocolo de aquisição e análise de dados.
Protocolo
Todos os procedimentos estão de acordo com as diretrizes europeias (diretiva 2010/63/UE), e o protocolo foi aprovado pelo Comitê de Ética Animal local da Universidade de Ghent (ECD 23/33). Doze ratos Sprague Dawley (seis fêmeas, seis machos) foram incluídos no estudo. Seus exames de PET foram obtidos usando o seguinte protocolo em vários momentos, variando de 2 semanas antes a 18 semanas após uma hemorragia intracerebral induzida. No momento do primeiro exame, todos os animais tinham 18 semanas de idade e as fêmeas pesavam 244,8 ± 10,1 g (média ± DP), enquanto os machos pesavam 363,6 ± 13,3 g.
Certifique-se de que os materiais radioativos sejam trabalhados e manuseados apenas por pessoal treinado. Mantenha a dose para funcionários e animais tão baixa quanto razoavelmente possível (ALARA).
1. Aquisição de dados
NOTA: Consulte a Tabela de Materiais para obter detalhes sobre o gerador de imagens PET pré-clínico e o software usado para aquisição de dados. O imager é um scanner PET de 45 detectores (dispostos em 5 anéis) cobrindo um campo de visão axial (FOV) de 13 cm e um FOV transaxial de 7,6 cm, usando cristais LYSO e detectores SiPM. O sistema apresenta uma resolução espacial de 850 μm, uma sensibilidade de 12% e uma resolução de energia de 12,6%12. As etapas a seguir foram escritas com isso em mente.
- Privar os animais de alimentos pelo menos 6 h antes da digitalização, retirando todos os alimentos da gaiola. Uma vez que o animal tenha sido submetido a um período de jejum suficiente, inicie os preparativos para a aquisição de dados da seguinte forma.
- Ligue uma almofada de aquecimento e deixe-a aquecer até 30–35 °C.
- Anestesie o animal com isoflurano, colocando-o em uma câmara de anestesia gasosa preenchida com isoflurano a 5% em O2 médico a uma taxa de fluxo de 2.000 mL / min. Ajude a manter a temperatura corporal do animal colocando uma lâmpada de aquecimento a 30 cm da câmara. O animal é devidamente anestesiado quando a frequência respiratória está em 0,5–1 Hz.
- Pese o animal.
- Coloque o animal na almofada de aquecimento. Use um cone nasal para administrar isoflurano a 2% em O2 médico a uma taxa de fluxo de 500 mL / min. Ajustar a dose de isoflurano conforme necessário para manter o animal devidamente anestesiado.
- Raspe uma seção do pescoço do animal entre as omoplatas.
- Preparação da veia da cauda para injeção de marcador:
- Vire o animal para o lado esquerdo ou direito e use a lâmpada de aquecimento para aquecer sua cauda, causando vasodilatação.
- Pegue aproximadamente 20 cm de tubo BTPE-10. Usando um porta-agulha, quebre a haste de uma agulha de 30 G e insira 1–2 mm de sua extremidade traseira no tubo de PE. Encha uma seringa de insulina de 1 mL com solução salina e insira a ponta da agulha 3–5 mm no tubo de PE. Encha previamente o tubo de PE com solução salina da seringa cheia e mantenha a seringa salina conectada ao tubo de PE.
- Limpe a cauda do animal com etanol. Remova a lâmpada de aquecimento.
- Insira a ponta da agulha do tubo PE em uma veia da cauda lateral. Confirme o posicionamento adequado da agulha: procure sangue entrando no tubo de PE quando o êmbolo é puxado para trás, ausência de resistência durante a injeção e formação de bolhas subcutâneas (indicando injeção paravenosa) no local da injeção. Se a entrada não for bem-sucedida, remova a agulha da cauda e tente novamente em uma seção mais proximal.
- Prenda a agulha com uma gota de cola instantânea no local da penetração e prenda o tubo de PE na cauda.
NOTA: Evite o movimento da tubulação PE. Se a qualquer momento o sangue entrar no tubo de PE, lave-o imediatamente com solução salina para evitar entupimento.
- Mude para sedação com medetomidina:
- Coloque o animal em uma posição de bruços na esteira de aquecimento. Coloque uma gota de gel para os olhos em cada olho para evitar que sequem.
- Prepare o tubo de PE (40–100 cm) para conectar a uma bomba de infusão colocada perto do scanner PET. Usando um porta-agulhas, quebre a haste de uma agulha de 30 G e insira 1–2 mm de suas costas no tubo de PE. Encha uma seringa de plástico de 1 mL com uma agulha de 30 G com pelo menos 0,2 mL de medetomidina (por animal) e insira a ponta da agulha de 3 a 5 mm no tubo de PE. Encha previamente o tubo de PE com medetomidina da seringa.
- Coloque a seringa com medetomidina na bomba de perfusão. Ligue a bomba e selecione a seringa correta clicando em Localizar seringa | BD Plastic | 1 mL.
- Ejete boli de 0,005 mL usando a bomba até que uma gota saia da agulha na outra extremidade do tubo de PE. Certifique-se de que não haja bolhas de ar na tubulação de PE.
- Insira a agulha do tubo de PE 2–3 mm por via subcutânea entre as omoplatas do animal. Prenda a agulha com uma gota de cola instantânea no local da penetração e prenda suavemente o tubo de PE nas costas do animal.
- Injete um bolus de volume v de medetomidina (taxa: 3 mL / min) com base no peso do animal:
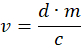
Onde d = 0,05 mg/kg (a dose de medetomidina em mg por kg de peso do animal), m é o peso do animal em kg e c é a concentração de medetomidina em mg/mL. - Interrompa a administração de isoflurano 10 min após a administração do bolus de medetomidina, ajustando a dose de isoflurano conforme necessário para manter a anestesia estável durante esse período de espera.
NOTA: O isoflurano combinado com a medetomidina diminui significativamente a frequência respiratória do animal. O monitoramento rigoroso é essencial até que a administração de isoflurano cesse. - Cinco minutos após a interrupção do isoflurano, inicie uma infusão contínua de medetomidina a uma taxa de:
rcont = r • m
Onde r = 0,1 mg/(kg·h); a quantidade de medetomidina em mg por peso corporal do animal em kg/h), e m é o peso do animal em kg.
NOTA: Um período de equilíbrio de mais 25 minutos após o início da infusão contínua (portanto, 30 minutos após a interrupção do isoflurano) é necessário antes que a varredura possa ser iniciada para garantir que o sistema do animal esteja livre de isoflurano. Durante esse tempo, prossiga com as etapas a seguir.
- Posicionamento do animal no scanner PET:
- Prepare a base do scanner com uma almofada de aquecimento, um sensor de pressão e lenços de papel. Use o sensor para monitorar a frequência respiratória do animal e os tecidos de papel para absorver a urina excretada pelo animal.
NOTA: Devido à medetomidina, o animal normalmente excreta grandes quantidades de urina. - Transfira cuidadosamente o animal para a cama do scanner, garantindo que a linha de medetomidina e o cateter da veia da cauda permaneçam seguros. Posicione a cabeça do animal o mais reta possível usando um cone de nariz para obter assistência, se necessário. Prenda a cabeça com fita adesiva uma vez posicionada corretamente.
- Ligue a almofada de aquecimento e verifique se o sistema de monitoramento da frequência respiratória está funcionando corretamente, ajustando o posicionamento do sensor de pressão, se necessário.
- Prepare a base do scanner com uma almofada de aquecimento, um sensor de pressão e lenços de papel. Use o sensor para monitorar a frequência respiratória do animal e os tecidos de papel para absorver a urina excretada pelo animal.
- Dez a cinco minutos antes de iniciar o PET scan, encha uma seringa de insulina com aproximadamente 20 MBq de 2-desoxi-2-[18F]fluoro-D-glicose ([18F]FDG) diluída em 0,1–0,8 mL de solução salina.
CUIDADO: O flúor-18 (18F) é um radioisótopo de flúor com meia-vida de 109,8 min. Siga os protocolos locais de segurança contra radiação ao manusear material radioativo. - Abra o software do scanner e configure os seguintes parâmetros de varredura: Selecione 18F como o isótopo (importante para correção de decaimento), insira a atividade medida da seringa contendo o radiotraçador (em MBq medido pelo calibrador de dose) e o tempo de medição (as informações serão salvas nos metadados, que são necessários para converter os dados em outras unidades, como valores de absorção padrão). Selecione o Protocolo geral e marque Classificação automática após a aquisição. Defina a duração da varredura para 1 h e ajuste a região de interesse (ROI) para que ela contenha todo o cérebro do rato (normalmente posição 2-5).
- Uma vez que 30 minutos tenham se passado desde a interrupção da administração de isoflurano, inicie o PET scan:
- Novamente, confirme a colocação adequada na veia por aspiração seguida de injeção de uma pequena quantidade de solução salina, conforme descrito na etapa 1.7.4.
- Substitua a seringa salina pela seringa radiotraçadora. Ao remover a seringa do tubo de PE, é possível que o sangue entre no tubo de PE, empurrando a solução salina. Insira a agulha da seringa radiotraçadora rapidamente sem perfurar o tubo de PE.
- Inicie a digitalização usando o software do scanner.
- Assim que a aquisição começar, injete o marcador como um bolus por aproximadamente 0,5–2 s. Substitua imediatamente a seringa radiotraçadora vazia pela seringa salina e lave o tubo PE com aproximadamente 0,1 mL de solução salina. Use um lenço de papel para coletar quaisquer gotas de radiotraçador que possam escapar durante a troca da seringa.
NOTA: A taxa de contagem exibida pelo software do scanner deve aumentar rapidamente para 4,5 a 6,5 Mcps após a injeção do traçador. A taxa de contagem inicialmente sendo significativamente abaixo de 4 Mcps e aumentando depois indica uma injeção de traçador (parcialmente) paravenoso. - Avalie a atividade restante que não foi injetada no animal medindo a atividade da seringa marcadora e do(s) tecido(s) e luvas potencialmente contaminados. Insira essa atividade e o tempo de medição no software do scanner para salvá-lo nos metadados.
NOTA: Uma atividade restante de 0,1 a 1,5 MBq é típica, dependendo de quanto marcador escapou ao trocar o marcador pela seringa salina.
- Assim que a varredura for concluída, ejete a cama com o animal do scanner.
NOTA: O animal pode reagir a estímulos ou acordar antes que a medetomidina seja antagonizada. Manuseie o animal com cuidado e esteja preparado para movimentos bruscos durante as etapas seguintes. Esteja ciente também de que o animal é radioativo. Assim, procure concluir as etapas a seguir o mais rápido e cuidadosamente possível. - Remova a agulha e o tubo de PE da cauda do animal usando um porta-agulha. Aplique um lenço de papel ou compressa no local da punção para interromper o sangramento potencial.
- Interrompa a administração de medetomidina e remova a agulha e o tubo de PE do pescoço do animal.
- Coloque o animal em uma gaiola livre de outros animais, usando um lenço de papel para coletar urina (radioativa) que pode ser excretada durante o movimento do animal. Administre 1 mL de solução salina por via subcutânea nas costas usando uma seringa de insulina de 1 mL para promover a reidratação.
- Reverta a sedação com uma injeção subcutânea de atipamezol.
- Calcule o volume apropriado v usando a seguinte equação:
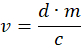
Onde d = 0,5 mg/kg, ou seja , a dose de medetomidina em mg por kg de peso do animal, m é o peso do animal em kg e c é a concentração de atipamezol em mg/mL. - Para animais leves que resultam em pequenos volumes calculados, dilua o atipamezol com solução salina para permitir uma dose mais precisa. Encha uma seringa de insulina com 4 • v de atipamezol e 12 • v de solução salina. Injete 1/4 da solução resultante por via subcutânea nas costas do animal, perto do pescoço.
- Calcule o volume apropriado v usando a seguinte equação:
- Monitore o animal visualmente até que ele acorde, o que deve levar de 1 a 5 minutos. Uma vez que o animal seja capaz de se manter em pé e se movimentar livremente, devolva-o ao alojamento do grupo. Forneça comida e água ao animal.
2. Reconstrução de dados e verificação de qualidade
NOTA: Usando o hardware e o software disponíveis em nosso estudo, todos os dados de PET foram corrigidos para decaimento de radionuclídeos e os sinogramas adquiridos foram reconstruídos com o algoritmo de maximização de expectativa de expectativa de subconjunto ordenado tridimensional (OSEM-3D) usando uma janela de 30% em torno do fotopico de 511 keV. O software de reconstrução OSEM usou suas configurações padrão de 10 subconjuntos com 20 milhões de eventos por subconjunto. As imagens foram reconstruídas em uma matriz transversal de 192 x 192 x 384 com voxels cúbicos de 0,4 mm. Nenhuma correção de atenuação foi realizada.
- Para verificar se a injeção do traçador foi bem-sucedida, verifique a taxa de contagem detectada durante a aquisição de 60 minutos (ou seja, curva de tempo-atividade (TAC)). Confirme se existe um pico no primeiro minuto após a aquisição, imediatamente após a injeção do marcador.
- Reconstrução estática: Reconstrua os dados adquiridos usando um algoritmo OSEM usando 30 iterações, um tamanho de voxel isométrico de 400 μm e uma janela de energia de 30% centrada no fotopico de 511 keV.
- Quando a reconstrução estiver concluída, inspecione a imagem resultante em busca de artefatos.
- Reconstrução dinâmica: Reconstrua os dados adquiridos em intervalos de tempo de trinta e 2 minutos usando as mesmas configurações da reconstrução estática.
3. Análise dos dados
NOTA: As etapas 3.1 e 3.2 a seguir são realizadas em um ambiente de software biomédico dedicado à quantificação de dados de PET, usando a Image Registration and Fusion Tool (PFUS) e a General Kinetic Modeling Tool (PKIN).
- No PFUS:
- Na subpágina Carregar imagens de entrada:
- Carregue o arquivo DICOM da reconstrução dinâmica usando o botão de carregamento INP ou arrastando e soltando o arquivo na tela. Use o controle de exibição de imagem geral na parte superior direita para navegar por fatias e períodos de tempo e ajustar a barra de cores. Se necessário, ajuste a orientação da imagem para a orientação padrão usando o botão Alterar orientação da imagem de entrada na barra lateral direita.
- Corte e média de quadros: clique na seta na parte inferior direita para exibir os controles ocultos para somar e cortar e marque Cortar. Na tela, defina os limites do corte ajustando as bordas e arrastando o centro da caixa de corte; Certifique-se de que todo o cérebro e um pouco de acolchoamento, contendo partes dos olhos e da medula espinhal, estejam contidos. Depois que a caixa de corte estiver definida corretamente, clique no botão de corte para cortar a imagem. Calcule a média do quadro ponderado pelo tempo em todos os períodos clicando no botão laranja de média e aguarde até que o resultado seja adicionado automaticamente às imagens de entrada, resultando em duas imagens de entrada no total: os dados dinâmicos cortados com os períodos de tempo e a média ponderada pelo tempo cortada dos mesmos dados.
- Selecione Deformar como método correspondente ou pressione o botão se já estiver selecionado para passar para a normalização baseada em modelo.
- Na subpágina Referência e correspondência:
- Selecione a imagem média ponderada no tempo como a imagem de entrada (normalmente é selecionada automaticamente a partir da última etapa).
- Carregue uma referência clicando no botão para selecionar um modelo de normalização como a imagem de referência. Selecione Rat FDG (W. Schiffer).
- Combine a entrada com o modelo clicando no botão para Correspondência de entrada | Entrada: ajuste manualmente na barra lateral à direita. Arraste e gire a imagem de entrada para corresponder aproximadamente ao modelo. Certifique-se de que o Rato esteja selecionado como espécie, o método de registro é Deformar e, em seguida, clique no botão Corresponder Atual para acessar a próxima subpágina.
- Na subpágina Resultado correspondente:
- Verifique o resultado e ajuste a correspondência manualmente, se necessário. Clique em Aplicar Transformação Atual a Todos para corresponder também à imagem de entrada que consiste nos períodos de tempo.
- Clique no botão verde VOIs para passar para a próxima etapa de processamento.
- Na subpágina Análise VOI:
- Selecione a imagem que contém os períodos de tempo como imagem A no menu inferior direito.
- Vá para a guia Modelo e selecione Px Rat (W. Schiffer) na guia Atlas ou carregue um atlas personalizado e selecione os volumes desejados. Para aplicar os VOIs, clique no botão Estrutura de tópicos na parte inferior.
- Clique no botão acima da guia Modelo para calcular os TACs e enviá-los para as ferramentas PKIN.
- Na subpágina Carregar imagens de entrada:
- Em PKIN:
- No canto inferior direito, selecione TACs para Tipo de exibição para visualizar os TACs em kBq/mL dos VOIs selecionados anteriormente.
- Clique com o botão direito do mouse na tela com os TACs e clique em Tabela de valores de curvas visíveis. Copie a tabela para uma planilha para análise posterior.
- Calcule a correlação de Pearson entre todos os pares de VOIs, usando dados do sexto ao último período de tempo (= 10–60 minutos após o início da varredura), para obter uma matriz de correlação. Um script Python chamado "correlation_matrix.py" que cumpre esse propósito está incluído no Arquivo Suplementar 1.
- Calcule se a correlação de Pearson é significativa usando a estatística do teste t:
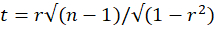 com n - 2 graus de liberdade, onde r é o coeficiente de correlação de Pearson e n = 25 o número de períodos de tempo usados para calcular a correlação de Pearson. Aplique uma correção adequada para comparações múltiplas e compare a estatística com o valor crítico de uma distribuição t bicaudal (p = 0,05) com n - 2 graus de liberdade. Considere a correlação de Pearson entre dois VOIs significativa se o valor do teste t corrigido for menor que o valor crítico.
com n - 2 graus de liberdade, onde r é o coeficiente de correlação de Pearson e n = 25 o número de períodos de tempo usados para calcular a correlação de Pearson. Aplique uma correção adequada para comparações múltiplas e compare a estatística com o valor crítico de uma distribuição t bicaudal (p = 0,05) com n - 2 graus de liberdade. Considere a correlação de Pearson entre dois VOIs significativa se o valor do teste t corrigido for menor que o valor crítico.
Resultados
Uma vez concluída a varredura, o TAC da taxa detectada durante a aquisição pode ser investigado para verificar se há uma injeção e absorção corretas do traçador. A Figura 1 mostra um TAC resultante de todo o FOV do scanner após uma injeção e aquisição bem-sucedidas do traçador (painel A) e um TAC resultante após uma injeção de traçador parcialmente paravenoso (painel B). No caso bem-sucedido, a taxa de contagem aumenta rap...
Discussão
O protocolo fornecido aqui orienta os usuários através do processo de aquisição de dados PET dinâmicos de 1 h usando [18F]FDG como traçador em ratos. No final, obtém-se uma matriz de correlação de VOIs, que pode ser usada para avaliar a conectividade metabólica em um único Pesquisadores experientes podem ajustar o protocolo para atender às suas necessidades específicas em vários pontos, por exemplo, usando um radiotraçador, tempo de aquisição ou larguras de pe...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado por uma bolsa de pesquisa da Fundação Flamenga de Pesquisa [G0A7422N].
Materiais
| Name | Company | Catalog Number | Comments |
| Antisedan | Orion Pharma | Atipamezole hydrochloride 5 mg/mL | |
| BD Micro-Fine+ insulin syringe 1 mL | BD | 324827 | 0.33 mm (29G) x 12.7 mm |
| BD Microlance 3 Needles 30 G x 1/2" | BD | 304000 | 30 G x 1/2"; 0,3 x 13 mm |
| BD Plastipak syringe 1 mL | BD | 303172 | for infusion pump |
| BTPE-10 Polyethylene tubing | Instech | 0.11x.024in (.28x60mm) | |
| Domitor | Orion Pharma | 1070499 | Medetomidine hydrochloride 1 mg/mL |
| Fusion 100 infusion pump | Chemyx Inc. | 07100 | Newer model available: Fusion 100X |
| Isoflutek 1000 mg/g | Alivira | Isoflurane | |
| MOLECUBES β-CUBE with CUBEFLOW software | MOLECUBES NV | Preclinical PET scanner | |
| PMOD Software version 4.4 | Bruker Corporation | http://www.pmod.com; quantification of PET data | |
| Saline | B. Braun | 394496 | NaCl 0.9% |
| Vidisic eye gel | Vidisic | Carbomerum 980 2 mg/g |
Referências
- Wilson, H., Pagano, G., Politis, M. Dementia spectrum disorders: lessons learnt from decades with PET research. J Neural Transm. 126 (3), 233-251 (2019).
- Singnurkar, A., Poon, R., Metser, U. Comparison of 18F-FDG-PET/CT and 18F-FDG-PET/MR imaging in oncology: a systematic review. Ann Nucl Med. 31 (5), 366-378 (2017).
- Youssef, G., et al. The use of 18F-FDG PET in the diagnosis of cardiac sarcoidosis: a systematic review and metaanalysis including the Ontario experience. J Nucl Med. 53 (2), 241-248 (2012).
- Carli, G., Tondo, G., Boccalini, C., Perani, D. Brain molecular connectivity in neurodegenerative conditions. Brain Sci. 11 (4), 433 (2021).
- Sala, A., Perani, D. Brain molecular connectivity in neurodegenerative diseases: Recent advances and new perspectives using positron emission tomography. Front Neurosci. 13, 617 (2019).
- Horwitz, B., Duara, R., Rapoport, S. I. Intercorrelations of glucose metabolic rates between brain regions: Application to healthy males in a state of reduced sensory input. J Cereb Blood Flow Metab. 4 (4), 484-499 (1984).
- Sporns, O., Tononi, G., Kötter, R. The human connectome: A structural description of the human brain. PLOS Comput Biol. 1 (4), e42 (2005).
- Biswal, B., Zerrin Yetkin, F., Haughton, V. M., Hyde, J. S. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI. Magn Reson Med. 34 (4), 537-541 (1995).
- Sanchez-Catasus, C. A., Diercke, R. A. J. O., de Vries, E. F. J., van Waarde, A., Leenders, K. L., et al. Use of nuclear medicine molecular neuroimaging to model brain molecular connectivity. PET and SPECT in neurology. , 181-207 (2021).
- Wehrl, H. F., et al. Simultaneous PET-MRI reveals brain function in activated and resting state on metabolic, hemodynamic and multiple temporal scales. Nat Med. 19 (9), 1184-1189 (2013).
- Rosenberg, G. A., Mun-Bryce, S., Wesley, M., Kornfeld, M. Collagenase-induced intracerebral hemorrhage in rats. Stroke. 21 (5), 801-807 (1990).
- Krishnamoorthy, S., et al. Performance evaluation of the MOLECUBES β-CUBE - a high spatial resolution and high sensitivity small animal PET scanner utilizing monolithic LYSO scintillation detectors. Phys Med Biol. 63 (15), 155013 (2018).
- Schiffer, W. K., Mirrione, M. M., Dewey, S. L. Optimizing experimental protocols for quantitative behavioral imaging with 18F-FDG in rodents. J Nucl Med. 48 (2), 277-287 (2007).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. J Nucl Med. 47 (6), 999-1006 (2006).
- Gold, M. E. L., Norell, M. A., Budassi, M., Vaska, P., Schulz, D. Rapid 18F-FDG uptake in brain of awake, behaving rat and anesthetized chicken has implications for behavioral PET studies in species with high metabolisms. Front Behav Neurosci. 12, 115 (2018).
- Miranda, A., et al. PET imaging of freely moving interacting rats. NeuroImage. 191, 560-567 (2019).
- Miranda, A., et al. Awake 18F-FDG PET imaging of memantine-induced brain activation and test-retest in freely running mice. J Nucl Med. 60 (6), 844-850 (2019).
- Jahreis, I., Bascuñana, P., Ross, T. L., Bankstahl, J. P., Bankstahl, M. Choice of anesthesia and data analysis method strongly increases sensitivity of 18F-FDG PET imaging during experimental epileptogenesis. PLOS ONE. 16 (11), e0260482 (2021).
- Pawela, C. P., et al. A protocol for use of medetomidine anesthesia in rats for extended studies using task-induced BOLD contrast and resting-state functional connectivity. NeuroImage. 46 (4), 1137-1147 (2009).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: Uses and interpretations. NeuroImage. 52 (3), 1059-1069 (2010).
- Engel, J., et al. Connectomics and epilepsy. Curr Opin Neurol. 26 (2), 186 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados