Method Article
Assaying Bewegungsaktivität zu zirkadianen Rhythmen Study and Sleep Parameter in Drosophila
In diesem Artikel
Zusammenfassung
Wir beschreiben Verfahren zur Erfassung täglichen Bewegungsaktivität Rhythmen Drosophila Und die anschließende Analyse der Daten. Bewegungsaktivität Rhythmen sind ein zuverlässiger Verhaltensstörungen Produktion tierischer circadiane Uhren und sind wie die Standard-Anzeige der Uhr-Funktion verwendet werden, wenn das Studium zirkadianen Mutanten oder zu untersuchen, wie die Umwelt auf das circadiane System reguliert.
Zusammenfassung
Die meisten Lebensformen weisen Tagesrhythmus in zellulären, physiologischen und Verhaltens-Phänomene, die durch endogene zirkadiane angetrieben werden (≡ 24 Std.) Herzschrittmachern oder Uhren. Störungen im menschlichen circadianen Systems sind mit zahlreichen Krankheiten oder Störungen assoziiert. Große Fortschritte in Richtung unseres Verständnisses der zugrundeliegenden Mechanismen zirkadianen Rhythmen hat aus genetischen Screens aufgetaucht, wodurch ein leicht gemessen Verhaltensstörungen Rhythmus als Auslesen der Uhr-Funktion verwendet wird. Studien mit Drosophila haben grundlegende Beiträge zum Verständnis der zellulären und biochemischen Grundlagen zugrunde liegenden circadianen Rhythmen gemacht. Die Standard-circadianen Verhaltens read-out in Drosophila gemessen wird Bewegungsaktivität. In der Regel umfasst das Monitoring-System speziell für Geräte, die die Fortbewegung von Drosophila messen können. Diese Geräte sind in kontrollierten Umweltbedingungen Inkubatoren in einer Dunkelkammer und sind über die Verwendung der Unterbrechung eines Strahls von Infrarot-Licht auf die lokomotorische Aktivität der einzelnen Fliegen in kleinen Tuben enthalten Rekord Basis untergebracht. Wenn über mehrere Tage gemessen, zeigen Drosophila täglichen Zyklen von Aktivität und Inaktivität, eine Verhaltensänderung Rhythmus, der durch das Tier endogene circadiane System gesteuert wird. Die gesamte Prozedur wurde mit dem Aufkommen von kommerziell erhältlichen Bewegungsaktivität Überwachungsgeräte und die Entwicklung von Software-Programmen zur Datenanalyse vereinfacht worden. Wir verwenden das System von Trikinetics Inc., die die hier beschriebene Vorgehensweise ist und ist derzeit der populärste System weltweit im Einsatz. In jüngerer Zeit haben die gleiche Überwachungsgeräte eingesetzt, um das Schlafverhalten in Drosophila zu untersuchen. Da die täglichen Schlaf-Wach-Zyklen viele Fliegen gleichzeitig gemessen werden können und nur 1 bis 2 Wochen im Wert von kontinuierlichen Bewegungsaktivität Daten ist in der Regel ausreicht, ist dieses System ideal für große Bildschirme Drosophila manifestiert verändert zirkadiane Schlaf-oder Eigenschaften zu identifizieren.
Protokoll
Das gesamte Design des Protokolls ist in Abbildung 1 dargestellt. Das Setup für die Überwachung der motorischen Aktivität mit Hilfe von Geräten in kontrollierten Umweltbedingungen Inkubatoren in einer Dunkelkammer befindet untergebracht muss zuerst montiert werden. Sobald dies abgeschlossen ist, kann das System in allen nachfolgenden Bewegungsaktivität Rhythmus Messungen eingesetzt werden. Für jedes Experiment, muss man (i) Vorbereitung Versuchstieren, die vielleicht auch von transgenen Tieren oder Einrichtung erforderlich Kreuze, (ii) vorzubereiten Glas Aktivität Röhrchen mit einer Nahrungsquelle, (iii) zu laden Fliegen in Tätigkeit Rohre und verbinden Tätigkeit überwacht die Datenerfassung und (iv) aufzeichnen und analysieren die Daten mit verschiedenen Software-je nachdem, was zirkadiane oder Schlaf-Parameter man will, zu prüfen. Hierbei definieren wir die "start" des Experiments als die Zeit, fliegt bei der Überwachung der Geräte zunächst auf die gewünschte Hell / Dunkel-Bedingungen in der Umwelt-Inkubatoren ausgesetzt.
1. Einrichten des Bewegungsapparates Activity Monitoring-System
- Das Monitoring-System beinhaltet zahlreiche Ausrüstungsgegenstände wie Spezialität Überwachungsgeräte, Umwelt-Inkubatoren, dass die Kapazität für die tägliche Lichtsteuerung haben, Datenerfassungsgeräte, Datenverarbeitungsgeräten und peripheren Materialien wie Kabel, um die Überwachungsgeräte, die Erfassungsgeräte (Abbildung 2) zu verbinden. Anweisungen zur Installation der Drosophila Activity Monitoring (DAM) Datenerfassung werden vom Hersteller (Trikinetics Inc.) zur Verfügung gestellt.
- Um Haus der Bewegungsaktivität Monitoring-System, wählen Sie einen gut belüfteten Raum, vorzugsweise mit Temperaturregelung ausgerüstet, um eine eigene Dunkelkammer werden. Mit all den elektrischen Systemen beteiligt sind (zB Computer-und Gründerzentren) läuft über einen längeren Zeitraum hinweg in einem kleinen und engen Raum kann übermäßige Wärme erzeugt, was zu einem raschen Anstieg in die Raumtemperatur sein. Folglich wird Inkubatoren mit zusätzlichen Arbeitsbelastung der Temperatur und der eher in Temperaturregelung nicht halten belastet werden. Wir finden, dass selbst für gut belüfteten Räumen, den Übergang von der Klimaanlage im Sommer in den Herbst / Winter Wärme kann es schwierig machen, Raumtemperatur zu halten. In solchen Fällen zusätzliche Belüftung haben könnte, um in den dunklen Raum installiert werden, um die Gefahr einer Überhitzung zu verringern. Auch ist es am besten ausschalten Inkubatoren, die nicht im Einsatz sind, um die Produktion von unnötigen Wärme zu minimieren.
- Seal das Zimmer von externen Lichtquellen. Eingang kann mit einer Drehtür oder schwarzen Vorhang verschlossen werden. Wir bevorzugen eine Drehtür, da dies die Wahrscheinlichkeit minimiert unerwünschte Licht in der Dunkelkammer. Im Inneren der Dunkelkammer, ist es nicht notwendig, völlig Arbeit im Dunkeln wie die Fruchtfliegen circadiane System ist nicht empfindlich für infrarote Licht (und ist viel weniger empfindlich für rotes Licht im Vergleich zu grün / blaues Licht). In Fällen, in denen wir brauchen, um in der Dunkelkammer sehen wollen aber trotzdem insgesamt Dunkelheit (zB schnell Entfernen oder Hinzufügen einer Überwachungseinrichtung in einem Inkubator, dass in seinem dunklen Phase) zu halten, verwenden wir einfach ein Standard-Taschenlampe, die mit einem roten bedeckt ist Filter. Alternativ oder zusätzlich zu, wenn Ihre Dunkelkammer Leuchtstoffröhren hat, decken Sie sie mit roten Filterpapier oder eine Stand-alone-Glühlampen Schreibtischlampe mit solchen Filterpapier abgedeckt. Es ist höchst unwahrscheinlich, dass die Exposition fliegt in die dunklen, sehr kurzen Belichtungen (einige Sekunden) von rotem Licht wird ihre inneren Uhren beeinflussen. Auch, obwohl das circadiane System von Drosophila ist sehr empfindlich gegenüber sichtbarem Licht, glauben wir nicht, kleine knarrt von Licht in der Dunkelkammer werden Folgeschäden; in jedem Fall ist eine gute Praxis in den Inkubator Türen halten das Haus die Monitore nur, wenn sie geöffnet notwendig ist. Auch wird nur geöffnet up one Brutschrank bei einer Zeit wie dieser, dass die Möglichkeit eines Inkubators auf seine dunkle Phase wird das Licht von einem Inkubator auf der leichten Phase ausgesetzt.
- Erwerben Sie eine Unterbrechungsfreie Stromversorgung (USV) Notfall-Backup-Einheit, die genug Leistung Kapazität zur Versorgung der Komponenten des Activity Monitoring-System im Falle von Spannungsspitzen, Spike, oder Stromausfall in das Gebäude. Schließen Sie die USV Notfall-Backup-Einheit, um die Notfall-Backup-Schaltung des Gebäudes, falls verfügbar. Seien Sie sich bewusst, dass selbst wenn Ihr Gerät an eine Notfall-Steckdose angeschlossen ist während eines Stromausfalls kann es eine kurze Übergangszeit, da das System schaltet auf Notstrom. Während dieses Übergangs, kann der Verlust der Macht auch nur ein paar Sekunden, um Computer heruntergefahren und die Lichter in den Inkubator dem Ausschalten führen. Daher ist es wichtig, sicherzustellen, dass die Computer verwendet wird, um die Aktivität von Daten und das System Steuerung von Licht in den Inkubator nicht nur in Notstrom angeschlossen, sondern auch eine UPS zu sammeln. Wenn das System Steuerung der Beleuchtung in den Inkubator wird nicht direkt von den Inkubator (in den meisten Fällen ist es) geregelt, so genügt es in den Inkubator in der emerge-Steckerncy Macht ohne UPS, als Verlust von Macht für wenige Sekunden keinen Einfluss auf die Kammertemperatur. Beachten Sie, dass im Allgemeinen ein USV-Gerät wird nur, dass Ihre Geräte laufen für 5-30 min in Abwesenheit von Macht, dessen Hauptziel ist es, gegen vorübergehende Verlust der Macht zu schützen während des Übergangs vom normalen zum Notstromaggregat.
- Richten Sie einen Computer, PC oder Macintosh, voll für die Datenerfassung und / oder für leichte Kontrolle der Inkubatoren gewidmet. Seit dem DAM-System ausgeführt werden soll die ganze Zeit und Raum gelassen wird, empfiehlt es sich, dass dieser Computer nur minimal Software installiert vorzugsweise keine Netzwerkverbindung, um das Risiko von Abstürzen zu minimieren. Darüber hinaus muss das System tragbaren Datenspeicher, zB Zip-Laufwerk, CD / DVD-Brenner, USB-oder für das Herunterladen von Daten zur späteren Analyse gesammelt ermöglichen.
- Manuelles ordnen Sie die Telefonleitung Netzwerk ordentlich um die Regale der kontrollierten Umweltbedingungen Inkubatoren einfache Einstecken / Ausstecken der Tätigkeit Monitore erlauben. Standard-Telefonleitungen, Adapter und Splitter können in kommerzielle elektronische Läden gekauft und verwendet werden. Richten Sie mehrere Telefonleitungen in einer Weise, dass sie zu einer Hauptlinie konvergieren und erweitern aus dem Inkubator auf dem Computer zu verbinden.
- Schließen Sie die Überwachungseinrichtungen in den Inkubatoren an den Computer über ein Netzteil Interface-Einheit (auch bekannt als Blue-Box aus Trikinetics Inc.), die an die Macht der Aktivität zu überwachen (Trikinetics Inc.) über die Telefonleitung dient. Dieses Netzteil Interface-Einheit fungiert auch als Schnittstelle für die Datenübertragung Wechsel von Telefonleitung an USB-Kabel. Optional Licht-Controller in der gleichen Einheit, in der die Macht Netzkabel des Inkubators Licht-System angeschlossen werden können, ist die Kontrolle der circadianen Inkubator Beleuchtung Zeitplan über den Computer ermöglicht.
- Mask möglich Lichtquellen von der elektronischen Gerätes oder unsachgemäß Dichtung Inkubator Tür mit Ente Band oder schwarzes Tuch um freilaufenden Rhythmen sorgen LED sind in Abwesenheit von unerwünschten Licht gemessen.
2. Vorbereitung der Versuchstiere
- Behavioral Phänotypen in Fruchtfliegen wie zirkadianen Rhythmik und Schlaf / Ruhe-Aktivität reagieren sehr empfindlich auf genotypische und altersspezifische Unterschiede der Versuchstiere (Koh et al. 2006). Daher ist es entscheidend, diese Phänotypen unter Verwendung geeigneter Kontrolltiere, die in der gleichen Umgebungsbedingungen und des gleichen Alters aufgezogen werden zu beurteilen. Darüber hinaus gibt es Geschlechtsdimorphismus in zirkadianen Rhythmik (Helfrich-Foster 2000). Die allgemeine Praxis ist, erwachsene männliche Fliegen, die in 25 aufgezogen sind ° C und zwischen 1 bis 5 Tage alte für lokomotorische Aktivität Assays. Verwendung Männliche Fliegen statt der weiblichen Fliegen sind traditionell verwendet, weil Eiablage Aktivität wahre Messung der lokomotorischen Aktivität beeinflussen. Aufgrund der Geschlechtsdimorphismus, könnte manchmal Testen weibliche Fliegen informativ sein. Lebensmittel, bestehend aus nur 5% Saccharose und 2% Bacto-Agar wird Eier von nicht-jungfräulichen Weibchen aus Entwicklungsländern und die Bewegung der Larven von verursacht fehlerhafte Aktivität zählt zu verhindern. Alternativ können jungfräuliche weibliche Fliegen verwendet, obwohl es Unterschiede in der Aktivität Profile zwischen gepaart und jungfräulichen Weibchen (Helfrich-Forster, J. Biol. Rhythms 2000) werden könnte.
- Bei der Prüfung circadianen und Schlaf / Ruhe Parameter der spezifischen mutierten Fliegen von Interesse, ist es ratsam, den mutierten Stamm mit dem Wildtyp-Stamm des gleichen genetischen Hintergrund, z. B. w1118 oder yw outcross. Dies entfernt zweiten Standort genetischen Modifikatoren, die möglicherweise Maske könnte zirkadiane oder Schlaf / Ruhe Phänotyp. Da es keine Crossing-over in Drosophila Männchen, ist es besser, die Auskreuzung durch Kreuzung mutierten Weibchen mit Wildtyp-Männchen durchzuführen. Die Wildtyp-Stamm wird auch als die angemessene Kontrolle für das Experiment dienen. Seed sowohl die Wildtyp-Kontrolle und mutierte Fliegen gleichzeitig in Standard Drosophila Nahrung über 10 bis 14 Tage vor der Bewegungsaktivität Rhythmus Experiment (siehe Bloomington Drosophila Stock Center für Lebensmittel Rezept; http://flystocks.bio.indiana.edu /). Nach Schlüpfen der Nachkommen, sammeln 1 bis 5 Tage alt männlichen Fliegen und legen Sie sie beiseite, um für die Experimente verwendet werden.
- Mit den zahlreichen genetischen Werkzeuge und Ressourcen wie Überexpression, RNAi und Gewebe-spezifische GAL4-Treiber fliegen Linien erhältlich aus verschiedenen Lager-Zentren weltweit, ist es möglich, die Auswirkungen der Überexpression oder Klopfen-spezifischen Genen in sezieren Gewebe-und temporal-spezifische Weise (Brand-und Perrimon 1993; McGuire et al 2004;.. Osterwalder et al 2001). Um zu untersuchen, zirkadiane und Schlaf / Ruhe-Parameter mit Hilfe dieses Ansatzes, fliegt Durchführung transgene Konstrukte mit Gewebe-spezifische oder Drogen-induzierbaren GAL4-Treiber (zB Männer) sind, um Fliegen tragen transgene Konstrukte mit Zielgene an der FH-Responder (zB jungfräulichen Weibchen) überschritten ca. 14 Tage vor Beginn der BewegungsaktivitätExperimente. Nach Schlüpfen der Nachkommen, sammeln 1 bis 5 Tage alt männlichen Fliegen und legen Sie sie beiseite, um für die Experimente verwendet werden. Die elterlichen Linien für das Kreuz verwendet werden routinemäßig als Kontrollen für die Experimente verwendet. Die aus Kreuzungen von UAS-Responder und GAL4-Treiber-Linien mit dem Wildtyp-Fliegen der gleichen genetischen Hintergrund sind auch angemessene Kontrollen.
- Wie in den Schritten (2) angezeigt und (3), die Länge der Zeit für die Vorbereitung der Versuchstiere benötigt variiert stark je nach Art und Design des Experiments. In dem Fall, dass transgene Tiere müssen generiert werden oder ob Sie über Regelungen, die ausgeführt werden müssen, mehr Zeit wird natürlich notwendig sein. Aus logistischen Gründen, dauert es etwa 14 Tage bei 25 ° C für Drosophila von Eiern zu erwachsenen Fliegen entwickeln.
3. Vorbereitung der Aktivität Tubes
- Activity Röhren repräsentieren die fliegen Lebensraum während des Experiments. Sie sind dünn (ca. 5 mm im Durchmesser; beachten Sie, Trikinetics bietet verschiedene Größen in Abhängigkeit von der Drosophila Arten getestet werden) 5 mm Glasröhrchen, dass Lebensmittel Substanz enthalten an einem Ende und verstopft mit Garn oder Kunststoff-Stecker am anderen Ende. Da Glas Aktivität Rohre mehrfach wiederverwendet werden können, werden wir die Vorbereitung Verfahren mit verwendet / ungereinigten Aktivität Rohre aus früheren Experimenten als Ausgangspunkt zu beschreiben. Wenn Sie neue Aktivität Röhren sind einfach zu Schritt (11) überspringen.
- Es ist vorzuziehen, um die Aktivität Rohre, die frisch zubereitet werden, da die Lebensmittel in den Rohren hat eine Tendenz zu trocknen und wird mit Pilzen kontaminiert Überstunden, auch wenn bei 4 ° C gelagert verwenden Sie sind in der Regel ein paar Tage bis eine Woche vor dem Start des Experiments vorbereitet. Es ist daher wichtig, die Anzahl der Röhren für jedes Experiment benötigt vor der Zubereitung zu beurteilen.
- Stopfen (Garn oder Kunststoff-Stecker) aus gebrauchten Rohren Tätigkeit und setzen sie in großen Becherglas. Die Rohre sollten nur bis zur Hälfte füllen das Becherglas. Füllen Sie das Becherglas mit Leitungswasser, und achten Sie darauf tauchen die Rohre.
- Microwave das Becherglas mit Glasröhrchen gefüllt, bis das Wasser kommt in voller schnellen aufkochen, um das Wachs und Agar Nahrung zu schmelzen.
- Seien Sie vorsichtig, dass das Wasser heiß ist. Entfernen Sie das Becherglas von der Mikrowelle und rühren Sie die Rohre mit einem Spatel oder Kunststoff 10 ml Pipette, damit eingeschlossene Wachs an der Oberfläche schwimmen. Dann wiederholen Sie Schritt (4).
- Entfernen Sie das Becherglas von der Mikrowelle und warten, bis es sich abgekühlt hat. Putting das Becherglas in den kalten Raum (wenn es verfügbar ist) wird den Prozess beschleunigen.
- Da das Wasser abkühlt, wird das Wachs auf der Oberfläche des Wassers sammeln und allmählich erstarrt. Entfernen Sie einfach das erstarrte Wachs mit der Hand. Dies sollte loszuwerden meisten der Wachs auf die Rohre.
- Übertragen Sie die Aktivität Rohre, um eine neue Becherglas mit frischem Leitungswasser und wiederholen Sie die Schritte (4) und (5).
- Da die meisten ist das Wachs in Schritt (7) entfernt worden ist, ist es nicht notwendig, für das Wachs zu erstarren warten. Gießen Sie einfach das Wasser aus dem Becher und übertragen Sie die Rohre in eine andere neue Becher. Seien Sie vorsichtig, dass das Wasser noch heiß ist.
- Wiederholen Sie die Schritte (4) und (5) für die letzte Zeit. Gießen Sie das Wasser aus dem Becherglas und warten auf die Aktivität Röhren abkühlen.
- Legen Sie sie senkrecht in 250 ml oder 500 ml Bechergläsern. Achten Sie darauf, sie nicht zu dicht gepackt. Sterilisieren, indem Sie einen Autoklaven mit einem Trocken-Zyklus oder verwenden Sie einfach einen Trockenofen, um die Rohre trocken.
- Unabhängig davon, um Essen zuzubereiten, um in die Tätigkeit Rohre laden, um eine Lösung von 5% Saccharose (Sigma) und 2% Bacto-Agar (BD) in destilliertem Wasser oder Leitungswasser. Autoclave, um die Lösung zu sterilisieren. Die autoklaviert Nahrung kann sofort verwendet werden oder in 4 ° C über einen längeren Zeitraum. Sobald die Nahrung erstarrt, wird man mit Mikrowellen brauchen und verflüssigen, um die Rohre zu füllen. Unbenutzten Teil der Nahrung können gespeichert und verwendet werden zu einem späteren Zeitpunkt.
- Das Essen sollte im Idealfall etwa 65 ° C, wenn für die Abfüllung Aktivität Rohre verwendet. Wenn es zu heiß ist, wird zu viel Kondenswasser im Inneren der Rohre ansammeln. Wenn es nicht heiß genug, wird das Essen zu verfestigen, bevor die Rohre gleichmäßig gefüllt sind. Zum Füllen der Aktivität Rohre mit Nahrungsmittel, die Verwendung einer 10 ml Pipette auf die Liquid-Food-Lösung entlang der Innenwand des Becherglases Pipette, so dass die Lebensmittel-Lösung, um die Aktivität Rohr von unten nach oben zu füllen, bis die Röhren ein Drittel gefüllt mit Lösung. Swirl das Becherglas um sanft um sicherzustellen, dass alle Rohre, vor allem diejenigen in der Mitte des Bechers sind gleichmäßig mit Nahrung gefüllt ist. Warten Sie, bis das Essen komplett erstarren entweder bei Raumtemperatur oder 4 ° C. Fahren Sie mit dem nächsten Schritt nach Kondensation im Inneren der Glasröhren zu zerstreuen.
- So entfernen Sie die Aktivität Rohre aus dem Becher, drücken Sie die Rohre in Richtung Boden des Bechers und drehen Sie die Rohre zur gleichen Zeit, so dass die verfestigte Lebensmittel im Inneren der Rohre und der Bodendes Bechers werden sich trennen. Nehmen Sie die Rohre aus dem Becherglas, vorzugsweise als ein einziger Haufen.
- Reinigen Sie die Rohre nacheinander mit Papiertüchern, um überschüssige Lebensmittel auf der äußeren Oberfläche der Röhren zu entfernen. Setzen Sie die Rohre beiseite in einen sauberen Behälter.
- Werfen Sie einen allgemeinen Laborbedarf Heizblock ohne das Rohr und Abdeckung der Heizung auch sorgfältig mit mehreren Schichten von starken Aluminiumfolie. Add Paraffin (Wachs) Pellets in den Aluminium ausgekleideten Heizung gut zu schmelzen.
- Halten Sie das Röhrchen bei der Non-Food-Ende und tauchen Sie das Essen Ende in das geschmolzene Wachs. Tauchen Sie den gewachst Teil in ein Becherglas mit kaltem Wasser gefüllt zu beschleunigen Wachs Erstarrung. Wiederholen Sie einmal. Das Eintauchen des gewachsten Röhren in Wasser wird das Röhrchen ein Zusammenkleben zu vermeiden.
- Die Rohre können sofort eingesetzt werden, oder in einem luftdichten Behälter bei 4 ° C für den Einsatz innerhalb einer Woche. Bei längerer Lagerung wird eine übermäßige Trocknung der Lebensmittel führen. Wenn die Röhrchen bei 4 ° C gelagert werden, stellen Sie sicher, um sie zu wärmen auf Raumtemperatur lassen, indem sie sie auf den Tisch vor dem Gebrauch.
4. Loading Flies in Activity Tubes und Bewegungsapparat Activity Monitoring-System
- Vor dem Laden fliegt in Aktivität Rohre, die Gründerzentren, die verwendet werden, um die Aktivität überwacht Haus wird einzuschalten. Stellen Sie die Temperatur mit Hilfe des Inkubators Kontrollen und stellen Sie den Hell / Dunkel-Regime mit dem DAM-System Licht-Controller oder den Inkubatoren eigenen Lichtsteuerung entsprechend der gewünschten experimentelles Design. Die benötigte Zeit, um Fliegen in Tätigkeit Rohre Belastung sollte ausreichend sein für die Temperatur zu stabilisieren.
- Anesthetize die Fliegen mit Kohlendioxid.
- Verwenden Sie einen feinen Pinsel vorsichtig Transfer eine Fliege in eine Tätigkeit Röhre.
- Besorgen Sie sich die Mitte eines einzigen Stück Garn, das um einen halben Zoll mit feinen Pinzetten und legen Sie den Faden in die Non-Food-Ende der Aktivität Rohr, um die Öffnung Stecker und verhindern, dass die Fliege an der Flucht während des Experiments, bei gleichzeitiger Zeit erlaubt Luftstrom in die Röhre. Alternativ können Kunststoffkappen mit kleinen Löchern (Trikinetics, Inc.) verwendet, um die Öffnung zu schließen.
- Achten Sie darauf, die Rohre auf ihren Seiten gelegt werden, bis die Fliege erweckt, sonst besteht die Gefahr der Fliege immer das Essen stecken.
- Legen Sie die Rohre in die Tätigkeit überwacht. Mit dem neuen, kompakten Modell der Trikinetics Monitore (Trikinetics DAM2 und DAM2-7), ist es notwendig, die Rohre in Ort mit Gummibändern halten, um sicherzustellen, dass der Infrarotstrahl das Rohr an der mittleren Position geht.
- Legen Sie die Aktivität überwacht in die Inkubatoren und Haken sie bis zum Datenerfassungssystem über die Telefonleitungen. Prüfen Sie mit dem DAM-System-Software-Sammlung, um sicherzustellen, dass alle Monitore sind richtig angeschlossen und es werden Daten von jedem von ihnen gesammelt. Der Monitor sendet infrarote Lichtstrahl über der Mitte jedes Glas Aktivität Röhre. Die lokomotorische Aktivität der Fliegen werden als unformatierte Binärdaten wo "man" jedes Mal, wenn der Infrarotstrahl unterbrochen oder ist ein "Null" wird aufgezeichnet, in dem der Infrarot-Strahl nicht gebrochen aufgezeichnet wird aufgezeichnet.
5. Experimental Design, um Daten zur Bestimmung der circadianen Periodik und Amplitude Rekord
- Fliegen sind synchronisiert und indem sie an die gewünschte Hell / Dunkel (LD) und Temperatur-Regime für 2-5 volle Tage mitgenommen. Die am häufigsten verwendeten Entrainment Bedingung ist ein Licht / Dunkel-Zyklus von 12 Stunden Licht / 12 Stunden Dunkelheit (12:12 LD) bei 25 ° C. Diese allgemein akzeptierte Standard Bedingung ist im wesentlichen auf dem Gedanken, dass Drosophila aus Afro-äquatorialen Standorten entstanden basiert. Bei der Untersuchung von circadianen Rhythmen gibt es einige Formulierungen, die man braucht, um sich mit. Relevant für dieses Protokoll, die Zeit, als die Lichter in den Inkubator zu gehen als Zeitgeber Zeitpunkt 0 (ZT0) und alle anderen Zeiten sind relativ zu diesem Wert (z. B. in einem 12:12 LD-Zyklus definiert ist, wird ZT12 zum Zeitpunkt der Lichter sind ausgeschaltet). Unter Standardbedingungen 00.12 LD Bedingungen Wildtyp Drosophila melanogaster Regel weisen zwei Anfälle von Aktivität, eine rund ZT0 als "Morgen" peak und eine weitere um ZT12 als "Abend" peak (Abbildung 3A) zentriert. Die Morgen-und Abend Kämpfe sind durch die endogene Uhr gesteuert, aber es gibt auch "erschrecken" Antworten, die vorübergehende Ausbrüche von Aktivität in Reaktion auf die Hell / Dunkel-Übergänge sind. Zwei Tage Verschleppung ist die minimale und könnte verwendet werden, zum Beispiel in großen Bildschirmen, die mehr Zeit in Anspruch und sind auf Messen freilaufende Perioden in konstanter Dunkelheit (siehe unten, Schritt 2) ausgerichtet sein. Wenn Sie jedoch in das Studium der Aktivitätsmuster während einer täglichen Hell-Dunkel-Zyklus interessiert sind, ist es vorzuziehen, um die Fliegen für 4-5 Tage in LD unterhalten, um mehr Daten zu erhalten. Im Wesentlichen die Erhöhung der Zahl von Fliegen oder die Anzahl der LD Tage in der letzten Analyse der Daten (zB Pool-Daten aus den letzten beidenTage im Wert von LD Bewegungsaktivität) wird mehr zuverlässige tägliche Aktivität Abmessungen und Profilen (zB Zeitpunkt der Morgen-oder Abend-Peak). Darüber hinaus variiert die tägliche Verteilung der Aktivität als Funktion der Tageslänge (Photoperiode) und Temperatur. Ein wesentlicher Grund für die Änderung der Photoperiode und Temperatur aus der Standard ist, wenn man untersucht, wie tägliche Aktivitätsmuster saisonale Anpassung (z. B. Chen et al 2007). Unterziehen wollte Drosophila auch die tägliche Temperatur-Zyklen (z. B. Glaser und Stanewsky 2005 mitgenommen werden.; Sehadova et al. 2009). Temperatur-Zyklen, die von nur 2-3 ° C variieren ausreichend sind, um mitzureißen Aktivität Rhythmen.
- Freilaufende Bewegungsaktivität Rhythmen stehen unter ständiger Dunkelheit und Temperaturen gemessen, nachdem die Mitnahme abgelaufen ist (siehe oben, Schritt 1). Die Einstellung für die Licht-Zyklus kann jederzeit in die dunkle Phase am letzten Tag der LD, so dass die nachfolgenden Tag des Experiments am ersten Tag des DD stellt geändert werden. Sieben Tage DD Datenerhebung ist ausreichend, um die circadiane Periode und Amplitude (zB Kraft oder Stärke des Rhythmus) von Fliegen zu berechnen. Im Allgemeinen ist eine Stichprobengröße von mindestens 16 Fliegen notwendig, um verlässliche freilaufende Perioden für einen bestimmten Genotyp zu erhalten. Selbst wenn man nur bei der Messung täglichen Aktivitäten interessiert ist, ist es immer noch am besten, um die Fliegen "freilaufende Perioden in DD als Änderungen in endogenen Periode kann die tägliche Verteilung der Aktivität in LD verändern zu messen. Zum Beispiel fliegt mit langen endogenen Perioden zeigen in der Regel verzögert Abend Gipfel in LD (zB siehe Abbildung 4).
- Am Ende des Experiments gesammelt rohe binäre Daten mit der DAM-System-Software auf einem tragbaren Datenträger, zB USB-Stick heruntergeladen werden.
- Die Raw-Binary-Daten werden mit DAM Filescan102X (Trikinetics, Inc.) und summiert in 15 und 30 Minuten bins bei der Analyse von circadianen Parameter, oder 1 bis 5 Minuten bins bei der Analyse von Schlaf / Ruhe-Parameter. Derzeit ist fünf zusammenhängende Minuten Inaktivität der Standard-Definition von Schlaf / Ruhe in Drosophila (Hendricks et al 2000;. Ho und Sehgal 2005).
- Es gibt viele verschiedene Möglichkeiten, um die Daten auf dem DAM-System gesammelt zu analysieren, aber wir bieten nur solche Methoden routinemäßig in unserem Labor eingesetzt. Microsoft Excel wird verwendet, um Genotyp verschiedene Sample-Gruppen zuweisen. FaasX Software (M. Boudinot und F. Rouyer, Centre National de la Recherche Scientifique, Gif-sur-Yvette Cedex, Frankreich) oder Insomniac (Matlab-basierten Programm; Leslie Ashmore, University of Pittsburgh, PA) werden verwendet, um zu untersuchen zirkadianen ( zB Zeit und Kraft) oder Schlaf / Ruhe (zB Prozentsatz Schlaf, meine Ruhe Kampf Länge) Parameter bzw..
6. Repräsentative Ergebnisse
Nach Abschluss dieses Protokolls, kann man die gleichen Daten eingerichtet sein, dass zirkadiane und Schlaf-Parameter der Versuchstiere in Bezug auf den Kontroll-Tieren zu untersuchen.
Die Analyse der circadianen Parameter: Bildung Diagramme täglichen Bewegungs-Aktivitäten oder durchschnittlichen Aktivitäten von Fliegen über mehrere Tage in LD oder DD Bedingungen kann mit Hilfe FaasX (Abbildung 3) Drosophila melanogaster Regel weisen zwei Anfälle von Aktivität, eine rund ZT0 (oder CT zentriert. ) als "Morgen" peak und eine weitere um ZT12 (CT 12) als "Abend" peak. Diese beiden Kämpfe der Aktivitäten werden durch die endogene Uhr gesteuert und kann sogar in freilaufenden DD Bedingungen (Abbildung 3B) beobachtet werden. Änderungen in das Timing dieser Aktivität Gipfeln kann leicht in den Bereichen Bildung Graphen beobachtet werden und kann eine Veränderung der Eigenschaften des endogenen Uhr zeigen. Eine weitere Eigenschaft, die bezeichnend für korrekte Uhr-Funktion ist das präventive Steigerung der lokomotorischen Aktivität im LD-Zyklen beobachtet, dass vor dem eigentlichen Dunkel-Licht oder Licht-Dunkel-Übergänge (Abbildung 3A, Pfeile) auftritt. Dieses Verhalten ist eindeutig in Wildtyp-Fliegen (Abbildung 3A) beobachtet, ist aber in arrhythmic Mutanten wie pro 0 (3C) (Konopka und Benzer, PNAS, 1971) fehlen. Im Fall der pro 0 Mutanten sind die beobachteten "Morgen" und "Abend" Peaks in LD rein erschrecken Reaktionen durch abrupte Änderungen in Hell / Dunkel-Bedingungen (dh "Clockless" fliegt nicht davon aus, do Veränderungen der Umwelt, sondern nur auf sie zu reagieren ). Der Verlust der Verhaltens-Rhythmik ist viel ausgeprägter in DD und in der Regel manifestiert sich in den totalen Verlust der Morgen oder Abend Gipfel der motorischen Aktivität (dh zufälligen Anfälle von Aktivität und Inaktivität), wie in pro 0 fliegt (Abb. 3D) gesehen. Neben der Bildung Grafiken können Bewegungsaktivität Daten als Doppel-Plot Aktogramm (FaasX), wo 2 Tage von Daten nacheinander in jeder Zeile dargestellt dargestellt werden, aber der letzte Tag-Profile beginnt die nächste Zeile von zwei Tagen im Wert von Aktivität (Abbildung 4). Zum Beispiel sind LD1 und 2 auf der ersten Zeile t aufgetragener Aktogramm. Die nächste Zeile beginnt mit einer Wiederholung der LD2 und wird von LD3 und so weiter. Nach diesem Format wird die Bewegungsaktivität Daten, die die gesamte Experiment in der Aktogramm dargestellt. Actograms kann für jeden einzelnen Flug aufgezeichnet werden, oder für jede Fliege Genotyp. Ein Vorteil der actograms über Bildung Graphen ist, dass eine Änderung der Periodenlänge der täglichen Aktivität Rhythmen leicht zu beobachten (Abbildung 4). Neben Erzeugung Bildung Grafiken und actograms kann Bewegungsaktivität Daten aus DD Bedingung FaasX eingereicht werden, um die Periodendauer mit einer Reihe von verschiedenen Programmen, darunter Cycle-P zu berechnen.
Die Analyse der Schlaf / Ruhe-Parameter: Mit der aktuellen Definition von Schlaf / Ruhe in Drosophila (Hendricks et al 2000.), Die fünf zusammenhängende Minuten Inaktivität ist, kann man Daten aus Bewegungsaktivität Assays aufgenommen zu analysieren und zu untersuchen multiple Schlaf-Parameter mit Insomniac (L. Ashmore), eine Matlab-basierten Programm. Der prozentuale Anteil der Zeit, dass verbringen schlafenden Fliegen in unterschiedlichen Zeitintervallen berechnet werden kann, schlafen zB Prozent pro Stunde (5A) oder 12 Stunden (Abbildung 5B). Andere häufiger Schlaf Parameter, die untersucht gehören kann bedeuten Rest Kampf Länge (Abbildung 5C) und Wake-Aktivität rechnen (Abb. 5D). Mittlere Schlaf / Ruhe Kampf Länge ist ein Maß dafür, wie konsolidierte den Schlaf und kann die Qualität des Schlafes zu illustrieren. Wake-Aktivität, wie der Name schon sagt, ist ein Maß für die Erwerbsquote bei den Fliegen wach sind. Dieser Parameter hilft, zwischen Fliegen, die wirklich im Schlaf / Ruhe Verhaltensweisen vs diejenigen, die entweder krank oder hyperaktiv sind betroffen unterscheiden. Zum Beispiel kann Fliegen, die einfach nur krank sind, scheinen mehr schlafen, weil sie nicht so mobil sind. Für diese Fliegen, werden ihre wachen Aktivität niedriger sein in Bezug auf die Tiere zu kontrollieren.
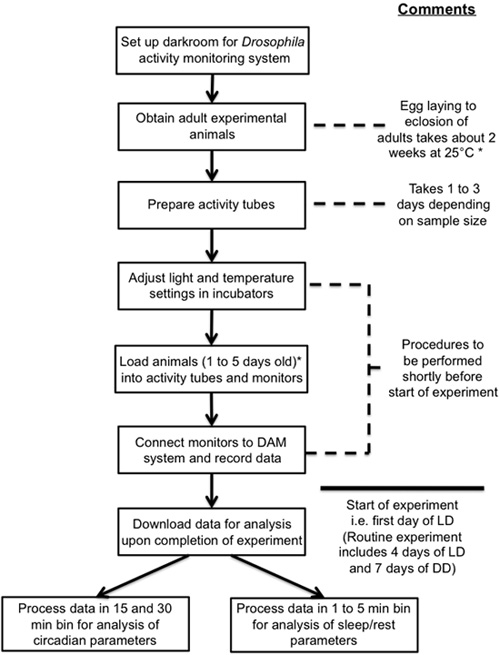
Abbildung 1: Flussdiagramm skizziert die wichtigsten Schritte zur Bestimmung der Bewegungsaktivität Rhythmen in Drosophila Die Verfahren sind auf der linken Seite präsentiert, während hilfreichen Kommentare auf der rechten Seite zur Verfügung.. Der Zeitaufwand für die notwendigen Kreuze und genetische Manipulationen durchführen, um Fliegen Sie mit der rechten Genotyp für bestimmte Experimente zu erhalten, ist variabel und hängt von der Art und Design des Experiments. Die beiden Schritte mit Sternchen (*) gekennzeichnet bieten den Zeitrahmen, wann erwachsenen Fliegen müssen entkernt / werden gepaart, um Nachkommen des entsprechenden Alters (1 bis 5 Tage alt) für das Experiment zu erzeugen.

Bild 2: Anschluss Diagramm, das die Verbindungen zwischen den verschiedenen Komponenten für Drosophila Bewegungsaktivität Datenerfassung mit dem DAM-System Ein dedizierter Computer verwendet wird, um die Bewegungsaktivität Grafen von Drosophila Rekord.. Activity-Monitore sind in Gründerzentren mit der Temperatur und Beleuchtung (On / Off) ausgerüstet untergebracht. Der Computer kann auch verwendet werden, um das Timing von Licht On / Off in Inkubatoren kontrollieren, wenn die Energiequelle der Beleuchtung kann bis zu dem Netzteil (optional) angeschlossen werden. Die Kommunikation zwischen dem Computer und Aktivität Monitore / Inkubatoren sind von der Stromversorgung Interface-Einheit verwaltet. Der Computer, Netzteil und Gründerzentren (wenn die Lichtsteuerung unabhängig von der Computer) werden an die Steckdose über das UPC verbunden, um eine ununterbrochene Überwachung der Aktivität und Dauerlicht während der leichten Phase zu gewährleisten. Es wird empfohlen, alle elektrischen Geräte, die Notfall-Backup-Schaltungen in der Anlage zu verbinden, falls vorhanden.

Abbildung 3:. Education Diagramme erstellt FaasX zeigt täglich Bewegungsaktivität Rhythmen rhythmische Wildtyp Fliegen (w pro 0 fliegt Durchführung einer Pro + Transgen) (A und B) vs arrhythmic w pro 0-Mutanten (C und D) Männliche Fliegen wurden gehalten bei 25 ° C und mitgerissen für 4 Tage in 0.12 LD (Licht: dunkel) Zyklen von sieben Tagen im DD (konstante Dunkelheit) gefolgt. Für jede Fliege Linie wurden die lokomotorische Aktivität der einzelnen Fliegen (n> 32) in 15-Minuten-Behälter gemessen und dann gemittelt, um eine Gruppe Profil Vertreter dieser Linie zu erhalten. A und C zeigen die Daten zu den Mitteln der zweiten und dritten Tag in Hell / Dunkel-Zyklus (LD 2-3) erzeugt wird, während B und D zeigen die Daten zu den Mitteln der zweiten und dritten Tag in konstanter Dunkelheit (DD 3.2 generiert ). Vertikale Balken zeigen die Aktivität (in willkürlichen Einheiten) in 15-Minuten-Behältern während der Lichtperiode (lichtgrau) oder der dunklen Periode (dunkelgrau) aufgezeichnet. Horizontale Balken am unteren Rand des LD Bildung Grafiken, weiß, Lichter, schwarz, Licht aus. ZT0 und ZT12 stellen den Anfang und das Ende der Photoperiode bzw.. Für DD Bildung Graphen; CT0 und CT12 reprESENT Beginn und Ende der subjektiven Tag in konstanter Dunkelheit, durch die grauen Balken gekennzeichnet. In Panel A, M = Morgenspitze; E = Spitzenzeiten am Abend. Die Pfeile in Abb. A stellen vorausschauende Verhalten der morgendlichen und abendlichen Spitzen in Wildtyp-Fliegen, die abwesend sind in w pro 0 arrhythmic Fliegen beobachtet.
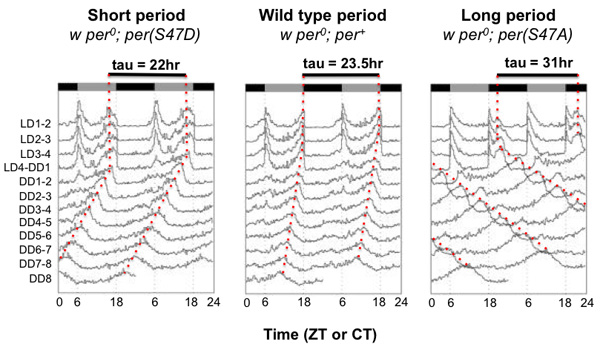
Abbildung 4:. Double-Plot Aktogramm generiert mit dem FaasX Software illustriert Bewegungsaktivität Daten von Fliegen mit Wildtyp, kurze oder lange Zeit männlich Fliegen wurden bei 25 ° C gehalten und mitgerissen für 4 Tage in 0.12 LD-Zyklen gefolgt von acht Tage in konstanter Dunkelheit (DD) für die Berechnung des frei laufenden Periode (t) mit Cycle-P in FaasX. Drei fliegen Linien mit Wildtyp-Periode [w pro 0; pro +; pro 0 mutierten Durchführung pro + Transgen], lange Zeit [w pro 0; pro (S47A); pro 0 mutierten Durchführung pro (S47A) Transgen], und kurze Zeit [w pro 0; pro (S47D); pro 0 mutierten Durchführung pro (S47D) Transgen] sind hier (. Chiu et al 2008) gezeigt. X-Achse stellt ZT-oder CT-Zeit in LD oder DD bzw. und Y-Achse repräsentiert Aktivität zählt (willkürliche Einheiten) in 15-Minuten-Behälter zusammengefasst. Die rot gestrichelten Linien verbinden den Abend Gipfel für jeden Tag der Experimente. Beachten Sie, dass während der LD Spitzenzeiten am Abend ist "gezwungen", synchron mit dem 24-Stunden-LD-Zyklus beizubehalten, während in DD den freilaufenden Zeitraum von 24 Stunden abweichen können. Zum Beispiel für Fliegen mit kurzen Perioden der Zeitpunkt der Abendveranstaltung wird früher auftreten bei jedem nachfolgenden Tag in DD (beim Plotten gegen einen 24-Stunden-Zeitskala, wie hier gezeigt), während eine Verschiebung nach rechts ist für Fliegen mit langen beobachtet Perioden.
. Abbildung 5: Quantifizierung Schlaf-Parameter in Drosophila Fliegen (Canton-S; CS) wurden zu Standard 0.12 LD-Zyklus bei 25 ° C ausgesetzt Insomniac (L. Ashmore) wurde verwendet, um die Daten und Microsoft Excel verwendet, um die Charts hier gezeigten erzeugen Prozess. Mindestens 70 Fliegen wurden gesammelt, um die Gruppe Mittelwerte und Fehlerbalken (Standardfehler des Mittelwerts) gezeigt zu erhalten. (A) Baseline Schlaf berechnet stündlich; gezeigt ist ein repräsentatives täglichen Zyklus. (B) Baseline Schlaf der Vertreter täglichen Zyklus alle 12 Stunden berechnet. (C) Durchschnittliche Länge der einzelnen Rest Kampf im 12-Stunden-Schritten berechnet. (D) Rate von Wachzustand alle 12 Stunden berechnet.
Diskussion
In diesem Protokoll haben wir beschrieben, Verfahren zur Messung der Drosophila Bewegungsaktivität Rhythmen, ein zuverlässiges Verhalten Ausgabe von fly circadianen Uhren, die als Standard Auslesen der Uhr-Funktion verwendet wird. Dieser Assay wurde in großem Maßstab Bildschirme für neuartige Uhr Mutanten (. ZB Konopka und Benzer 1971; Dubruille et al 2009) verwendet wurde und wird ständig benutzt, um zu sezieren und zu verstehen, Uhr-Funktion in vivo. Es wurde auch verwendet, um Schlaf-Wach-Zyklus in Fliegen-Studie, obwohl deuten die jüngsten Berichte, Video-Digital-Analyse wesentlich zuverlässiger ist bei der Quantifizierung schlafen als mit Bewegungsaktivität Rhythmen (Zimmerman et al. 2008). Bei der Verwendung von Bewegungsaktivität Rhythmen zum Schlafen zu analysieren, neigen prozentuale Anteil der Schlafzeit in den Tag zu überschätzen.
Um den Erfolg und die Reproduzierbarkeit dieses Protokolls ist es entscheidend, Tests Fliegen, die ähnlich wie in Alter, genetische Hintergrund, und bäumte sich unter den gleichen Bedingungen, wie Verhaltens-Phänotypen in Fruchtfliegen wie zirkadianen Rhythmik und Schlaf / Ruhe-Aktivität sind sehr empfindlich alle diese Faktoren. Wenn Sie mehrere Inkubatoren für ein einzelnes Experiment, ist es wichtig, sicherzustellen, dass alle Inkubatoren sind bei der zu erwartenden Temperatur seit einigen circadianen Parameter als Funktion der Temperatur ändern kann. Ein Wort zur Vorsicht, wenn man den Kauf Inkubatoren für die Arbeit mit Fliegen, denn nicht alle sind gleich. Während wir zögern, eine bestimmte Einheit gibt es viele Möglichkeiten zu empfehlen. Eine gute Quelle für die Suche nach Unternehmen, Gründerzentren zu verkaufen für Drosophila Arbeit ist bei zur Verfügung gestellt. Einige Firmen verkaufen auch "Drosophila circadianen" Inkubatoren, wobei zusätzliche Funktionen zur Verfügung stehen, wie bereits für die Trikinetics und Temperaturrampen (zB Tritech) verdrahtet. Wichtige Features sind die Möglichkeit zur täglichen Licht-Steuerung und gute Temperaturkontrolle im physiologischen Bereich von Drosophila (~ 15-30 ° C). Preise und Größen von Inkubatoren sind sehr unterschiedlich, aber mit den neueren Tätigkeit Monitore von Trikinetics, auch kleine Inkubatoren können eine ganze Reihe von diesen Geräten zu ermöglichen. Auch, obwohl Inkubatoren mit Feuchtigkeit Steuerung verwendet werden kann, ist diese zusätzliche Funktion nicht notwendig, solange man einen kleinen Topf mit Wasser erfolgt, um Feuchtigkeit (50-70% ist in Ordnung) geben. Schließlich, obwohl wir routinemäßig FaasX und Insomniac für die Datenanalyse in diesem Protokoll gibt es alternative Programme und Software zur Verfügung (Rosato und Kyriacou 2006), zB ClockLab (ActiMetrics), Brandeis Rhythm Package (D. Wheeler, Baylor College of Medicine, Houston ) und MAZ (Zordan et al. 2007).
Offenlegungen
Danksagungen
Diese Arbeit wurde vom NIH gewährt NIH34958 zu I. E und NS061952 um JC unterstützt
Materialien
| Name | Company | Catalog Number | Comments |
| Drosophila activity monitor (DAM) | Trikinetics Inc.; Waltham, MA | DAM2 or DAM5 | DAM2 monitors are more compact, and more can fit into a single incubator |
| Power supply interface unit (for DAM system) | Trikinetics Inc.; Waltham, MA | PSIU9 | Includes PS9-1 AC Power Supply |
| Light controller | Trikinetics Inc.; Waltham, MA | LC6 | |
| Pyrex glass tubes | Trikinetics Inc.; Waltham, MA | PGT5, PGT7, and PGT10 | |
| Plastic activity tube caps | Trikinetics Inc.; Waltham, MA | CAP5 | Yarn can be used instead of plastic caps. |
| DAM System data collection software | Trikinetics Inc.; Waltham, MA | Versions available for both Mac and PC | |
| FaasX software | Centre National de la Recherche Scientifique | Only for Mac | |
| Insomniac 2.0 software | University of Pittsburgh School of Medicine | Runs on Matlab. Can be used on both PC and Macintosh. | |
| Environmental incubator with temperature and diurnal control, e.g. Percival incubator | Percival Scientific, Inc. | I-30BLL | Interior space dimension:Width: 65cm;Height: 86cm;Depth: 55cm |
| Environmental incubator with temperature and diurnal control, e.g. DigiTherm Heating/Cooling Incubator with Circadian Timed Lighting and Timed Temperature | Tritech Research, Inc. | 05DT2CIRC001 | Interior space dimension:Width: 36m;Height: 56m;Depth: 28cm |
| APC Smart-UPS 2200VA 120V (Emergency power backup unit) | APC | SU2200NET | Output Power Capacity of 1600 Watts |
| Sucrose | Sigma-Aldrich | S7903 | |
| Bacto Agar | BD Biosciences | 214010 | |
| TissuePrep Paraffin pellets | Fisher Scientific | T565 | Melting point 56°C-57°C |
| Block heater | VWR international | 12621-014 |
Referenzen
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Chen, W. F., Low, K. H., Lim, C., Edery, I. Thermosensitive splicing of a clock gene and seasonal adaptation. Cold Spring Harb Symp Quant Biol. 72, 599-606 (2007).
- Chiu, J. C., Vanselow, J. T., Kramer, A., Edery, I. The phospho-occupancy of an atypical SLIMB-binding site on PERIOD that is phosphorylated by DOUBLETIME controls the pace of the clock. Genes Dev. 22, 1758-1772 (2008).
- Dubruille, R., Murad, A., Rosbash, M., Emery, P. A constant light-genetic screen identifies KISMET as a regulator of circadian photoresponses. PLoS Genet. 12, e1000787-e1000787 (2009).
- Glaser, F. T., Stanewsky, R. Temperature synchronization of the Drosophila circadian clock. Curr Biol. 15, 1352-1363 (2005).
- Helfrich-Förster, C. Differential control of morning and evening components in the activity rhythm of Drosophila melanogaster- sex-specific differences suggest a different quality of activity. J Biol Rhythms. 15, 135-154 (2000).
- Hendricks, J. C., Finn, S. M., Pancleri, K. A., Chavkin, J., Williams, J., Sehgal, A., Pack, A. I. Rest in Drosophila is a sleep-like state. Neuron. 25, 129-138 (2000).
- Ho, K. S., Sehgal, A. Drosophila melanogaster: an insect model for fundamental studies of sleep. Methods Enzymol. 393, 772-793 (2005).
- Koh, K., Evans, J. M., Hendricks, J. C., Sehgal, A. A Drosophila model for age-associated changes in sleep: wake cycles. Proc Natl Acad Sci USA. 103, 13843-13847 (2006).
- Konopka, R. J., Benzer, S. Clock mutants of Drosophila melanogaster. Proc Natl Acad Sci USA. 68, 2112-2116 (1971).
- McGuire, S. E., Roman, G., Davis, R. L. Gene expression systems in Drosophila: a synthesis of time and space. Trends Genet. 20, 384-391 (2004).
- Osterwalder, T., Yoon, K. S., White, B. H., Keshishian, H. A conditional tissue-specific transgene expression system using inducible GAL4. Proc Natl Acad Sci USA. 98, 12596-12601 (2001).
- Rosato, E., Kyriacou, C. P. Analysis of locomotor activity rhythms in Drosophila. Nature Protocols. 1, 559-568 (2006).
- Sehadova, H., Glaser, F. T., Gentile, C., Simoni, A., Giesecke, A., Albert, J. T., Stanewsky, R. Temperature entrainment of Drosophila's circadian clock involves the gene nocte and signaling from peripheral sensory tissues to the brain. Neuron. 64, 251-266 (2009).
- Zimmerman, J. E., Raizen, D. M., Maycock, M. H., Maislin, G., Pack, A. I. A video method to study Drosophila sleep. Sleep. 31, 1587-1598 (2008).
- Zordan, M. A., Benna, C., Mazzotta, G. Monitoring and analyzing Drosophila circadian locomotor activity. In Circadian Rhythms Methods and Protocols. Rosato, E. , Methods in Molecular Biology series. Humana. Totowa, New Jersey. (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten