Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vorbereitung der Rattenschwanzsehnen für Biomechanik und Mechanobiological Studies
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die experimentellen Verfahren zur Rattenschwanzsehnen für biomechanische und mechanobiological Studien vorzubereiten. Einige Funktionen der wichtigsten Schritte in Vorbereitung sind nachgewiesen, beginnend mit der Extraktion Querschnittsfläche Messung, Spülen und Laden in den Bioreaktor Kammer.
Zusammenfassung
Rattenschwanzsehnen (RTT) sind ein gemeinsames biologisches Modell in experimentellen in vitro-Studien eingesetzt in den Bereichen Sehne Physiologie und Tendopathie. Arbeiten mit diesen Geweben ist eine Herausforderung, weil sie sehr empfindlich sind, und bis jetzt gab es keine streng detailliertes Protokoll für die Isolation.
Angesichts dieser Herausforderungen haben wir Methoden und Instrumente entwickelt, um Manipulationen von RTT und Kontrolle Gewebeviabilität, Sterilität und Unversehrtheit zu erleichtern. Dieser Artikel beschreibt die experimentellen Verfahren zur RTT für biomechanische und mechanobiological Studien vorzubereiten. Extraktion, Querschnittsfläche Messung, Spülen und Laden in den Bioreaktor Kammer: Unsere Arbeit ist in vier Hauptbereiche unterteilt.
Bei jedem Schritt werden alle Verfahren, Materialien und Manipulationen im Detail vorgestellt, so dass sie leicht reproduziert werden kann. Darüber hinaus sind die spezifischen Instrumente entwickelt vorgestellt: eine Manipulation Platte verwendet werden, um RTT zu trennen, eine optische Mikrometer, um das Gewebe während der Querschnittsfläche Messung und eine Verankerung der Lage, die RTT auf einen Bioreaktor befestigen.
Schließlich beschreiben wir die Ergebnisse nach mehreren Tests erhalten unsere Methoden zu validieren. Die Lebensfähigkeit, Sterilität und Unversehrtheit Auswertungen zeigen, dass unser Verfahren streng genug für Manipulationen fragile Gewebe wie Rattenschwanzsehnen sind.
Protokoll
Vor jeder Manipulation, müssen Sie identifizieren die Gruppe der Sehnen verwendet je nach Experiment den Sie gerade führen und die Vorrichtung zu Ihrer Verfügung sein. Für unsere Zwecke wurden ventralen Sehnen gewählt, weil sie kleiner sind und somit leichter zu manipulieren, wenn die Messung der Querschnittsfläche auf und ergänzen sie in den Bioreaktor Kammer.
Bitte beachten Sie, dass alle Instrumente autoklaviert oder sterilisiert mit 70% Ethanol. Darüber hinaus ist eine Sprühflasche mit 70% Ethanol neben jedem Arbeitsplatz aufgestellt, um die Experimentatoren Handschuhe vor jeder Operation zu sterilisieren.
Teil 1: Extraction
Nach der Resektion wird die Rute vorsichtig an den Extremitäten manipuliert, um eine Beschädigung des Gewebes. Auch die Erhaltung der Zellviabilität, sind alle Manipulationen in kalter Kochsalzlösung durchgeführt.
1A) Materialien:
- Kalter Kochsalzlösung (D-PBS)
- Crushed Eis
- Oberflächenschutz
- Schneidbrett
- Individuelle Manipulation Platten
- 2 500 ml Speisen
- 2 2L Glasschalen
- Klebeband
- 1 Pinzette
- 1 Pinzette
- 1 Pinzette stehen
- 1 Paar OP-Schere
- 1 Skalpell
- 1 Paar OP-Schere

Abbildung 1. Individual Manipulation mit Orientierung Identifikation ("P" für "proximal")
1B) Work-Station:
- Breiten Sie die Oberfläche Beschützer und Stelle das Schneidebrett an der Spitze.
- Füllen Sie jeweils zwei größeren Glasschalen zur Hälfte mit gestoßenem Eis und legen sie auf das Papier.
- Stick ein Stück Klebeband an einer Ecke der Manipulation Platte und identifizieren sich mit einem Brief an den proximalen Ende geben.
- Füllen Sie die beiden kleinen Glasschalen auf halbem Weg und alle Nuten der Manipulation Platten mit kalter Kochsalzlösung. Legen Sie sie in das große Glas-Schalen mit Eis.
- Organisieren Sie alle sterilen Instrumenten auf der Oberfläche Beschützer.
- Übertragen Sie die Rute in einer der Glas-Schale mit Kochsalzlösung.
1C) Manipulationen:
- Beachten Sie die Anatomie am proximalen Ende des Schwanzes, die Bauchseite von der Rückenseite zu unterscheiden. Die Bauchseite hat eine größere Anzahl von Sehnen und ein Blutgefäß, das durch leichtes Drücken der Schwanz bis zu winzigen Tropfen Blut zu produzieren überprüft werden kann.
- Mit dem OP-Schere, schneiden Sie die Haut an der Dorsalseite des Schwanzes, wenn Sie die ventralen Sehnen (oder entlang der Bauchseite, wenn Sie die dorsalen Sehnen brauchen) extrahieren möchten.
- Öffnen Sie den Schnitt am proximalen Ende und entfernen Sie die Haut mit einer Pinzette oder mit den Fingern und durch eine sorgfältige Manipulation der Schwanz endet.
- Spülen Sie das Blut und die Haare in der Salzlösung und Transfer der Probe in den verbleibenden Glasschale mit frischen Lösung. Wechseln Sie die Handschuhe.
Ein Transversalschnitt unter dem Lichtmikroskop zeigt die sechs Sehne Gruppen. Eine Sehne aus jeder Gruppe ist es, die kaudale Ende eines jeden Wirbel befestigt, so schneiden wir an der Bandscheibe zu neuen Sehnen entlang der Schnittlinie aussetzen.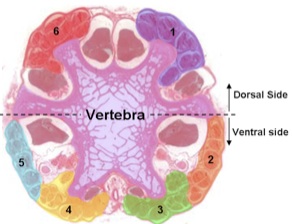
Abbildung 2. Transversalschnitt der Rattenschwanz unter dem Lichtmikroskop. - Schneiden Sie das distale Ende durch den Knorpel 2-3 Wirbeln kürzer mit chirurgischer Schere. Setzen Sie den Schwanz auf dem Schneidebrett auf die Weichteile mit einem Skalpell und dann sofort wieder in den zugeschnittene Lösung.
- Mit einer Pinzette herausziehen eine Sehne aus dem distalen Endstück.
- Mit einem sanften halten an beiden Enden, statt der Sehne in die einzelnen Manipulationen Platte.
Wiederholen Sie die letzten beiden Schritte, bis keine mehr Sehnen aus gehänselt werden können und schneiden ein Wirbel kürzer, wenn neue Gewebe ausgesetzt werden müssen.
Teil 2: Querschnittsfläche Messung 7
Wenn das Gewebe mechanische Charakterisierung oder Stimulation erfährt, sind seine mechanischen Eigenschaften durch die Normalisierung der Kraft im Inneren der Sehne zu betonen, beschrieben. Deshalb haben wir Querschnittsfläche zu bewerten.
2A) Materialien:
- Optic Mikrometer
- Stereomikroskop
- Digitalkamera
- Edge-Anerkennung und Profil Rekonstruktionsalgorithmen 5,6
- Kalter Kochsalzlösung (D-PBS)
- 1 20-200 ul Micro Volumenpipette
- 1 Hex Schlüssel für optische Mikrometer Anpassungen
- 2 Pinzetten
/ Files/ftp_upload/2176/2176fig3.jpg "alt =" Bild 3 "/>
Abbildung 3. Optic Mikrometer
2B) Work-Station:
- Öffnen Sie die Software (Digital-Kamera und Algorithmen).
- Legen Sie die Optik Mikrometer, so dass genügend Platz vorhanden ist, um die Sehne in der Apparatur zu laden.
- Organisieren Sie die Instrumente und Glasschale mit den extrahierten Sehnen in der Nähe.
2C) Manipulationen:
- Füllen Sie den Mess-Fach mit kalter Kochsalzlösung, bis beide Anker-Systeme untergetaucht sind.
- Transfer der Sehne in das Fach, indem Sie die Enden mit einer Pinzette.
- Mit Saug über die Mikro-Volumen Pipetten, ziehen eine Extremität in einer Zeit, in der Silizium-Rohr. Saugen Sie bis zum Ende erstreckt sich über die Welle Kragen.
- Ziehen Sie die Stellringe an den Rohren zu komprimieren und installieren Sie das Gerät unter dem Stereomikroskop.
- Bei 105X Vergrößerung, erstrecken sich die Sehnen unter Beachtung der Gewebe, bis die Falten nicht mehr wahrnehmbar sind. Stretch von zusätzlichen 0,40%.

Abbildung 4. Tendon Projektion bei 105x Vergrößerung vor und nach dem Dehnen. - Stellen Sie Position und Fokus auf ein klares Bild von der Sehne über einen 180 °-Drehung zu halten.
- Nehmen Sie ein Foto an alle 10 °-Drehung ohne Änderung Spannung, Fokus oder Position. Verwenden Sie nur die Welle für die Durchführung der Rotation. Wegen seiner Kegelform, können Sie diese Schritte an verschiedenen Punkten entlang der Sehne wiederholt werden.
- Aktivieren Sie den Rand Anerkennung und Profil Rekonstruktionsalgorithmen, um die Datenbank, die Sie sich registriert haben zu analysieren.
- Befreien Sie die Sehne durch Lösen der Welle Kragen und Einblasen von Luft in die Silikonschläuche mit dem Mikro Volumenpipette.
- Setzen Sie die Sehne auf die Manipulation Platte wieder Handhabung durch den Enden.
- Überprüfen Sie die Form des Profils Wiederaufbau erhalten und den Wert der Querschnittsfläche.
Teil 3: Spülen
So entfernen Sie Verunreinigungen, die während der vorangegangenen Manipulationen stattgefunden haben kann, sind die Gewebe unter Biosicherheitswerkbank gespült.
3A) Materialien:
- Kalter Kochsalzlösung (D-PBS)
- Multiple-Nut Manipulation Platte
- Individuelle Manipulation Platten
- Klebeband
- 2 Pinzetten
- 1 Pinzette stehen
3B) Work-Station:
- Schalten Sie den Lüfter in der Biosicherheitswerkbank 15 Minuten im Voraus und reinigen Sie die Innenflächen mit 70% Ethanol.
- Bringen Sie alle Instrumente im Inneren des Biosicherheitswerkbank.
- Stick-Klebestreifen auf einer Ecke der einzelnen Platte mit dem proximalen Ende zu identifizieren.
- Füllen Sie alle Rillen mit steriler Kochsalzlösung.
3C) Manipulationen:
- Führen Sie die Manipulation Platte mit den extrahierten Sehnen in den Schrank.
- Mit einer Pinzette entfernen Sie die Sehne von ihrem Teller mit einem sanften Griff an jedem Ende.
- Tauchen und sanft rühren die Sehne in der Salzlösung jedes Fach des Multiple-Nut Manipulation Platte, beginnend mit dem nächsten und Verfahren, um die am weitesten Nut.
- Schließlich tauchen die Sehne in eine individuelle Manipulation Platte.
Teil 4: Laden in Bioreaktor Kammer
Zur Vermeidung weiterer Kontaminationen, sind die folgenden Manipulationen auch im Biosicherheitswerkbank durchgeführt.
4A) Materialien:
- Bioreaktor Kammer 4
- Sterile Anker
- 1 Steriles Petrischale
- Kalte Zelle kultivierten Medium (DMEM)
- Cyanacrylat
- 2 Pinzetten
- Pinzetten stehen
- 0,5-10 &mgr; l Micro-Volumenpipette
- 1 Lineal

Abbildung 5. Bioreaktor Kammer
4B) Work-Station:
- Seit dem letzten Schritt wurde auch in Biosicherheitswerkbank realisierte Abbau unnötiger Tools geben Ihnen mehr Platz zum Arbeiten.
- Bringen Sie alle anderen Instrumente im Schrank.
4C) Manipulationen:
- Legen Sie einen Anker auf die Manipulation Platte mit seiner Spule über der Sehne Extremität zentriert und Wunde im Gewebe und um die Spule.
- Rollen Sie den Anker über und halten Sie die lose Extremität gleichzeitig sicherzustellen, dass das Gewebe an der Anker bleibt. Stop nach ¾ abbiegen.
- Führen Sie das GleicheSchritte mit dem anderen Ende.
- Roll beide Anker über gleichmäßig, bis es 6 cm zwischen den Zentren 1.
- Lösen der Sehne, um es in die Lösung eintauchen und damit die Verankerung Abschnitten kurz antrocknen seiner mechanischen Eigenschaften 2-3 erhöhen.
- Gießen Sie in der Petrischale Cyanacrylat und zeichnen 2.5μL in die Mikro-Volumen Pipetten.
- Einen Tropfen Cyanacrylat auf die Wunde-up Gewebe ohne Sturz eines Klebers in der Salzlösung. Wiederholen, bis 2 Tropfen auf jeder Anker angewendet wurden.
- Mit der Sehne noch völlig eingetaucht, 5 Minuten warten, bis der Kleber vollständig trocknen.
- Während dieser Zeit füllen die Kammer Fach mit Kochsalzlösung.
- Rehydrieren alle Gewebe mit Kochsalzlösung, um Schäden zu verhindern.
- Durch die Manipulation nur die Anker, Transfer der Sehne in den Bioreaktor Kammer und schließen Sie es, um ein Auslaufen und Verschmutzung während der Übertragung zu verhindern.
Teil 5: Repräsentative Ergebnisse:
Das Ergebnis des Protokolls zeigt, dass, wenn richtig durchgeführt, unsere Gewebe strenger Isolierung und Herstellung Verfahrens es möglich, Gewebe Sterilität, die Lebensfähigkeit und Integrität aufrecht zu erhalten.
Der erste ist, die einfache und repetitive Extraktionsmethode, können wir bis zum Schwanz Sehnen ohne Beschädigung der Kollagen-Netz, wie es durch eine mikroskopische Analyse von H & E tainted Abschnitte nach der Extraktion realisiert beobachtet werden können extrahieren.

Abbildung 6. Tendon Kollagen-Netzwerk nach der Extraktion (5 um Längsschnitt mit H & E gefärbten).
Wir haben dann kultiviert Sehnen für bis zu 10 Tage und führte Sterilitätstests. Jeder Tag, inkubierten wir vernickelt verwendet Nährlösung auf Agar und es für 24 Stunden. Da kein bakterielles Wachstum beobachtet wurde, schlossen wir, dass unsere Manipulationen nicht zu einer Kontamination führen.
Mit dem Profil Rekonstruktionsalgorithmus und optische Mikrometer, sind wir in der Lage, die Querschnittsfläche innerhalb einer Marge von 2% der Fehler 7 zu schätzen.

Abbildung 7. Profil Rekonstruktion eines RTT.
Schließlich untersuchten wir die Lebensfähigkeit unter Verwendung des LIVE / DEAD Lebensfähigkeit / Zytotoxizität Kit für Säugerzellen nach dem Spülvorgang und nach zwölf Tagen Kulturdauer. Da eine große Mehrheit des grün fluoreszierenden lebenden Zellen erkennbar waren, können wir bestätigen, dass unser Verfahren zur Isolierung von erfolgreich Aufbewahrung lebender Gewebe. Der gleiche Test wurde zwei Stunden nach dem Anbringen der Sehne in den Bioreaktor Kammer durchgeführt. Wir Nachweis erbracht, dass die Entwässerung und kleben an der Anker noch nicht in das Gewebe zwischen den beiden Anker zu verbreiten.

Abbildung 8. Tissue Lebensfähigkeit der Anker (grün = lebende Zellen, rot = tote Zellen)
Access restricted. Please log in or start a trial to view this content.
Diskussion
Durch die Anwendung dieser experimentellen Verfahren, können wir eine Vielzahl von in vitro Studien durchführen zu dieser Art von Geweben. Da war zum Beispiel eine Studie über Gewebedegeneration durch die Anwendung der unter-Stimulation RTT für einen Zeitraum von zehn Tagen zu erfolgen. Jeder Tag, wir Gewebe mechanische Eigenschaften in nicht-destruktive Spannungsrelaxation Tests ausgewertet. Am Ende konnten wir RTT Spannungsverlauf zu beobachten und damit zu analysieren den Verlauf der mechanischen Eigensc...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Danksagungen
Dieser Artikel wurde von NSERC Grant # 299280, IRSST als ein Stipendium an G. Eltern und FRSQ als ein Bachelor-Student Research Award an M. Cyr unterstützt. Wir bedanken uns bei Yoan Lemieux-Laneville für die Durchführung der Manipulationen auf Video aufgezeichnet.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments | |
| D-PBS | Reagent | Wisent Inc. | 311-410-CL | Saline solution |
| Glucose | Reagent | Wisent Inc. | 609-037-EL | Saline solution 1g/L |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Saline solution 1% |
| DMEM | Reagent | Invitrogen | 12800-017 | Culture solution |
| Sodium Bicarbonate | Reagent | Wisent Inc. | 600-105-CG | Culture solution 3.7g/L |
| FBS | Reagent | Wisent Inc. | 090150 | Culture solution 10% |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Culture solution 1% |
| Optic Micrometer | Tool | Custom Made | ||
| Manipulation plate | Tool | Custom Made | ||
| Bioreactor chamber | Tool | Custom Made |
Referenzen
- Bennett, M. B., Ker, R., Dimery, N., Alexander, R. Mechanical properties of various mammalian tendons. J. Zool. Lond. A209, 537-548 (1986).
- Dupuis, D. Déshydratation de matrices collagéniques reconstruites in vitro: effets sur les propriétés mécaniques et histologiques [dissertation]. , Québec, Université Laval. Québec. 114-114 (1981).
- Haut, R. C. Age-dependent influence of strain rate on the tensile failure of rat tail tendon. Journal of Biomechanical Engineering. 105, 296-299 (1983).
- Huppé, N., Lessard, J. -L., Langelier, E. A Bioreactor Design for the Mechanobiological Study of Soft Tissue Damage and Repair in Conditions that Provide the Best Approximation of Actual Use. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
- Langelier, E., Dupuis, D., Guillot, M., Goulet, F. &, Rancourt, D. Cross-sectional profiles and volume reconstructions of soft tissues using laser beam measurements. J Biomech Eng. 126, 796-802 (2004).
- Lee, T. Q., Woo, S. L. -Y. A new method for determining cross-sectional shape and area of soft tissues. J Biomech Eng. 110, 110-114 (1988).
- Parent, G., Cyr, M., Cousineau-Pelletier, P., Desbiens-Blais, F. &, Langelier, E. Current Techniques for the Evaluation of Cross-Sectional Area in Rat Tail Tendons Generate Significant Errors. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten