Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation des tendons de queue de rat pour les études biomécaniques et mécanobiologique
Dans cet article
Résumé
Cet article décrit les procédures expérimentales utilisées pour préparer les tendons de queue de rat pour les études biomécaniques et mécanobiologique. Plusieurs caractéristiques des principales étapes de préparation sont démontrées, à commencer par l'extraction, la mesure de la superficie transversale, le rinçage et le chargement dans la chambre de bioréacteur.
Résumé
Tendons de queue de rat (RTT) sont un modèle commun biologiques utilisés dans études expérimentales in vitro dans les domaines de la physiologie des tendons et des tendinopathies. Travailler avec ces tissus est difficile car ils sont très fragiles, et jusqu'à présent il n'y avait pas de protocole rigoureusement détaillées de leur isolement.
Face à ces défis, nous avons développé des méthodes et des instruments pour faciliter la manipulation des RTT et des tissus de contrôle de viabilité, la stérilité et l'intégrité. Cet article décrit les procédures expérimentales utilisées pour préparer RTT pour les études biomécaniques et mécanobiologique. Notre travail est divisé en quatre grandes étapes: l'extraction, la mesure de la superficie transversale, le rinçage et le chargement dans la chambre de bioréacteur.
A chaque étape, toutes les procédures, les matériaux et les manipulations sont présentés en détail afin qu'ils puissent être facilement reproduits. Par ailleurs, les instruments spécifiques développés sont présentés: une plaque de manipulation utilisée pour séparer RTT, un micromètre optique à la position du tissu pendant la mesure de la superficie transversale et un système d'ancrage pour attacher les RTT sur un bioréacteur.
Enfin, nous décrivons les résultats obtenus après plusieurs tests afin de valider nos méthodes. Évaluations de la viabilité, la stérilité et l'intégrité de démontrer que nos procédures sont suffisamment rigoureux pour les manipulations des tissus fragiles tels que les tendons de queue de rat.
Protocole
Avant toute manipulation, vous devez identifier le groupe de tendons à être utilisés en fonction de l'expérience que vous menez et l'appareil à votre disposition. Pour nos besoins, les tendons ventrale ont été choisis parce qu'ils sont plus petits et donc plus faciles à manipuler lors de la mesure de la section transversale et leur montage dans la chambre de bioréacteur.
S'il vous plaît noter que tous les instruments sont stérilisés à l'autoclave ou 70% d'éthanol. Par ailleurs, un vaporisateur contenant de l'éthanol à 70% est placé à côté de chaque station de travail pour stériliser les gants expérimentateurs avant chaque opération.
Partie 1: Extraction
Après résection, la queue est soigneusement manipulé par ses extrémités pour éviter d'endommager les tissus. Aussi, pour conserver la viabilité des cellules, toutes les manipulations sont effectuées dans une solution saline froide.
1A) Matériaux:
- Froid solution saline (D-PBS)
- Glace concassée
- Surface protecteur
- Planche à découper
- Plaques manipulation individuelle
- 2 500 plats ml
- 2 plats en verre 2L
- Ruban adhésif
- 1 Pince à épiler
- 1 pince
- 1 Pince debout
- Une paire de ciseaux chirurgicaux
- 1 Scalpel
- 1 paire de ciseaux chirurgicaux

Figure 1. Manipulation individuelle avec l'identification d'orientation ("P" pour "proximale")
1B) station de travail:
- Etalez le protecteur de surface et le lieu de la planche à découper sur le dessus.
- Remplir chaque verre de plus de deux plats à moitié avec de la glace pilée et les placer sur le papier.
- Collez un morceau de ruban sur un coin de la plaque de manipulation et d'identifier avec une lettre pour indiquer l'extrémité proximale.
- Remplissez les deux plats de petit verre à mi-course et tous les rainures des plaques de manipulation avec une solution saline froide. Placez-les dans des plats en verre de grande taille contenant de la glace.
- Organiser tous les instruments stériles sur le protecteur de surface.
- Transférer la queue dans l'un des plat en verre contenant une solution saline.
1C) Manipulations:
- Observez l'anatomie à l'extrémité proximale de la queue de distinguer la partie ventrale de la face dorsale. La face ventrale a un plus grand nombre de tendons et un vaisseau sanguin qui peut être vérifié en pressant doucement la queue pour produire de minuscules gouttes de sang.
- En utilisant les ciseaux chirurgicaux, couper la peau le long de la face dorsale de la queue, si vous voulez extraire les tendons ventrale (ou le long de la face ventrale si vous avez besoin des tendons dorsaux).
- Ouvrez l'incision à l'extrémité proximale et enlever la peau à l'aide de forceps ou vos doigts et en prenant soin de manipuler les extrémités de la queue.
- Rincez le sang et les cheveux dans la solution saline et le transfert de l'échantillon dans le plat en verre contenant une solution restante frais. Changer de gants.
Une section transversale considérée sous microscopie optique montre les groupes tendon six. Un tendon de chaque groupe est attaché à l'extrémité caudale de chaque vertèbre, donc on coupe au disque intervertébral pour exposer les tendons le long de la nouvelle coupe.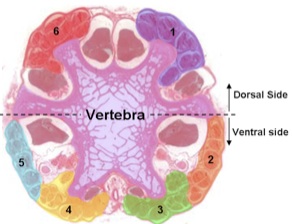
Figure 2. Coupe transversale de la queue du rat vu en microscopie optique. - Coupez l'extrémité distale du cartilage de 2-3 vertèbres courtes avec des ciseaux chirurgicaux. Placez la queue sur le plateau de coupe pour couper les tissus mous à l'aide d'un scalpel, puis immédiatement à le remplacer dans la solution.
- En utilisant une pince à épiler, retirez un tendon de la queue distale.
- Avec une prise douce aux deux extrémités, placez le tendon dans la plaque de manipulation individuelle.
Répétez les deux dernières étapes jusqu'à ce que ne tendons plus peut être taquiné et couper court à chaque fois une vertèbre de nouveaux tissus ont besoin d'être exposée.
Partie 2: mesure de la superficie transversale 7
Quand le tissu est soumis à la caractérisation mécanique ou de stimulation, ses propriétés mécaniques sont décrits en normalisant la force à l'intérieur du tendon au stress. C'est pourquoi nous évaluons section transversale.
2A) Matériaux:
- Micromètre optique
- Stéréomicroscope
- Appareil photo numérique
- Edge et la reconnaissance des algorithmes de reconstruction Profil 5,6
- Froid solution saline (D-PBS)
- 1 pipette de 20 200 pl de volume micro
- Une clé hexagonale pour les réglages du micromètre optique
- 2 pinces
/ Files/ftp_upload/2176/2176fig3.jpg "alt =" Figure 3 "/>
Figure 3. Micromètre optique
2B) station de travail:
- Ouvrez le logiciel (appareil photo numérique et algorithmes).
- Placer le micromètre optique afin qu'il y ait assez de place pour charger le tendon dans l'appareil.
- Organiser les instruments et un plat en verre contenant les tendons extrait à portée de main.
2C) Manipulations:
- Remplir le compartiment de mesure avec une solution saline froide jusqu'à ce que les deux systèmes d'ancrage sont submergés.
- Transfert du tendon dans le compartiment en tenant les extrémités avec des pincettes.
- L'utilisation de la pipette d'aspiration par l'intermédiaire de micro-volume, tirez une extrémité à un moment dans le tube de silicone. Aspirer jusqu'à la fin s'étend au-delà les cols de l'arbre.
- Serrer les colliers d'arbre pour compresser les tubes et d'installer l'appareil sous la loupe binoculaire.
- A un grossissement de 105X, étirer les tendons tout en observant le tissu jusqu'à ce que le plis ne sont plus perceptibles. Étirez par additionnels de 0,40%.

Figure 4. Projection à un grossissement de 105x tendon avant et après étirement. - Ajustez la position et de se concentrer pour maintenir une image claire du tendon au cours d'une rotation de 180 °.
- Prenez une photo à chaque rotation de 10 °, sans modifier la tension, l'accent ou la position. Utilisez uniquement l'arbre rotatif pour effectuer la rotation. Grâce à sa forme conique, ces étapes peuvent être répétées à différents points le long du tendon.
- Activer la reconnaissance de pointe et les algorithmes de reconstruction de profil dans le but d'analyser la base de données que vous avez enregistrés.
- Libre le tendon en desserrant les colliers d'arbre et soufflant de l'air dans les tubes de silicone à l'aide de la pipette du volume micro.
- Réinsérer le tendon sur la plaque de la manipulation, à nouveau sa manipulation par les extrémités.
- Vérifiez la forme de la reconstruction de profil obtenu et la valeur de la zone de coupe.
Partie 3: Rinçage
Pour éliminer la contamination qui pourrait avoir eu lieu pendant les manipulations précédentes, les tissus sont rincés sous l'enceinte de sécurité biologique.
3A) Matériaux:
- Froid solution saline (D-PBS)
- Plaque de manipulations multiples rainures
- Plaques manipulation individuelle
- Ruban adhésif
- 2 pinces
- 1 Pince debout
3B) station de travail:
- Allumez le ventilateur dans l'enceinte de sécurité biologique 15 minutes à l'avance et nettoyer les surfaces à l'intérieur avec 70% d'éthanol.
- Apportez tous les instruments à l'intérieur du poste de sécurité microbiologique.
- Coller des morceaux de ruban adhésif sur un coin de chaque plaque d'identifier l'extrémité proximale.
- Remplissez tous les rainures avec une solution saline stérile.
3C) Manipulations:
- Introduire la plaque contenant la manipulation du tendon d'extraits de l'armoire.
- En utilisant une pince à épiler, retirez le tendon de son assiette avec une prise douce à chaque extrémité.
- Plongez et remuer doucement le tendon dans la solution saline de chaque compartiment de la plaque de la manipulation de multiples rainures, à partir de la plus proche et de procéder à la rainure plus loin.
- Enfin, immerger le tendon dans une plaque de manipulation individuelle.
Partie 4: Chargement en bioréacteur
Pour éviter une nouvelle contamination, les manipulations suivantes sont également menées dans le cabinet de biosécurité.
4A) Matériaux:
- Bioréacteur chambre 4
- Ancres stérile
- Une boîte de Petri stérile
- Moyen de cellules en culture froide (DMEM)
- Cyanoacrylates
- 2 pinces
- Brucelles debout
- 0.5-10 ul micro-pipettes de volume
- Une règle

Figure 5. Bioréacteur
4B) station de travail:
- Depuis l'étape précédente a également été réalisé en enceinte de sécurité biologique, l'enlèvement d'outils inutiles vous donnera plus d'espace de travail.
- Apportez tous les autres instruments à l'intérieur du coffret.
4C) Manipulations:
- Placez un point d'ancrage sur la plaque de la manipulation avec son tiroir centré sur l'extrémité du tendon et le tissu enroulé et autour de la bobine.
- Rouler l'ancre sur et maintenez l'extrémité libre tout en s'assurant que le tissu reste attaché à l'ancre. Arrêt après ¾ de tour.
- Effectuer les mêmesétapes avec l'autre extrémité.
- Rouler les deux ancres plus égale jusqu'à ce qu'il y est de 6 cm entre leurs centres 1.
- Desserrez le tendon de l'immerger dans la solution et permettre les sections ancré à sécher brièvement pour améliorer ses propriétés mécaniques 2-3.
- Verser dans le plat cyanoacrylate Pétri et dessinez 2.5μL dans la pipette du volume micro.
- Appliquez une goutte de cyanoacrylate au tissu liquidé sans laisser tomber la colle dans la solution saline. Répétez l'opération jusqu'à 2 gouttes ont été appliquées à chaque point d'ancrage.
- Avec le tendon reste complètement immergé, attendre 5 minutes pour que la colle sèche complètement.
- Pendant ce temps, remplir le compartiment de chambre avec une solution saline.
- Réhydrater les tissus avec une solution saline pour éviter tout dommage.
- En manipulant que les ancres, le transfert du tendon dans la chambre de bioréacteur et le fermer pour empêcher les fuites et la contamination pendant le transfert.
Partie 5: Résultats du représentant:
Le résultat du protocole montre que lorsqu'elle est effectuée correctement, notre isolement rigoureux et tissus procédure de préparation permettent de maintenir la stérilité des tissus, la viabilité et l'intégrité.
Tout d'abord, en utilisant la méthode d'extraction simple et répétitive, nous sommes en mesure d'extraire tendons de queue sans endommager le réseau de collagène comme il peut être observé par une analyse microscopique des sections H & E contaminé réalisé après l'extraction.

Figure 6. Réseau de collagène des tendons après extraction (5 um section longitudinale colorés avec H & E).
Nous avons ensuite tendons cultivées pendant jusqu'à dix jours et mené des tests de stérilité. Chaque jour, nous plaqués solution de culture utilisé sur de l'agar et incubée pendant 24 heures. Comme aucune croissance bactérienne a été observée, nous avons conclu que nos manipulations ne pas entraîner de contamination.
Avec l'algorithme de reconstruction le profil et le micromètre optique, nous sommes en mesure d'estimer la surface transversale au sein d'une marge de 2% d'erreur 7.

Figure 7. La reconstruction d'un profil de RTT.
Enfin, nous avons évalué la viabilité utilisant le Live / Dead viabilité / cytotoxicité Kit pour les cellules de mammifères après l'étape de rinçage et après une période de douze jours de culture. Depuis la grande majorité des vert fluorescent des cellules vivantes étaient évidents, nous pouvons confirmer que nos procédures d'isolement sont réussi à préserver les tissus vivants. Le même test a été effectué deux heures après la fixation du tendon dans la chambre de bioréacteur. Nous avons vérifié que la déshydratation et de la colle à l'ancre ne s'était pas propagé dans le tissu entre les deux ancres.

Figure 8. Viabilité des tissus à l'ancre (vert = cellules vivantes, rouge = cellules mortes)
Access restricted. Please log in or start a trial to view this content.
Discussion
En appliquant ces procédures expérimentales, nous pouvons mener une grande variété d'études in vitro sur ce type de tissus. Comme par exemple, une étude sur la dégénérescence des tissus a été réalisée par l'application de la sous-stimulation à la RTT, pour une période de dix jours. Chaque jour, nous avons évalué les propriétés mécaniques dans les tissus des essais non destructifs de relaxation des contraintes. A la fin, nous avons pu observer des variations de stress RTT et ...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Cet article a été appuyé par le CRSNG # 299280 Grant, IRSST comme une bourse d'études pour les parents et le FRSQ G. comme une bourse de recherche étudiant de premier cycle à M. Cyr. Nous remercions Yoan Lemieux-Laneville pour effectuer les manipulations enregistrées sur vidéo.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments | |
| D-PBS | Reagent | Wisent Inc. | 311-410-CL | Saline solution |
| Glucose | Reagent | Wisent Inc. | 609-037-EL | Saline solution 1g/L |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Saline solution 1% |
| DMEM | Reagent | Invitrogen | 12800-017 | Culture solution |
| Sodium Bicarbonate | Reagent | Wisent Inc. | 600-105-CG | Culture solution 3.7g/L |
| FBS | Reagent | Wisent Inc. | 090150 | Culture solution 10% |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Culture solution 1% |
| Optic Micrometer | Tool | Custom Made | ||
| Manipulation plate | Tool | Custom Made | ||
| Bioreactor chamber | Tool | Custom Made |
Références
- Bennett, M. B., Ker, R., Dimery, N., Alexander, R. Mechanical properties of various mammalian tendons. J. Zool. Lond. A209, 537-548 (1986).
- Dupuis, D. Déshydratation de matrices collagéniques reconstruites in vitro: effets sur les propriétés mécaniques et histologiques [dissertation]. , Québec, Université Laval. Québec. 114-114 (1981).
- Haut, R. C. Age-dependent influence of strain rate on the tensile failure of rat tail tendon. Journal of Biomechanical Engineering. 105, 296-299 (1983).
- Huppé, N., Lessard, J. -L., Langelier, E. A Bioreactor Design for the Mechanobiological Study of Soft Tissue Damage and Repair in Conditions that Provide the Best Approximation of Actual Use. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
- Langelier, E., Dupuis, D., Guillot, M., Goulet, F. &, Rancourt, D. Cross-sectional profiles and volume reconstructions of soft tissues using laser beam measurements. J Biomech Eng. 126, 796-802 (2004).
- Lee, T. Q., Woo, S. L. -Y. A new method for determining cross-sectional shape and area of soft tissues. J Biomech Eng. 110, 110-114 (1988).
- Parent, G., Cyr, M., Cousineau-Pelletier, P., Desbiens-Blais, F. &, Langelier, E. Current Techniques for the Evaluation of Cross-Sectional Area in Rat Tail Tendons Generate Significant Errors. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon