É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de tendões da cauda de rato de Estudos biomecânicos e Mechanobiological
Neste Artigo
Resumo
Este artigo descreve os procedimentos experimentais usados para preparar os tendões da cauda de rato para estudos biomecânicos e mechanobiological. Várias características dos principais passos na preparação são demonstrados, começando com a extração, transversal medição da área, lavagem e carregamento na câmara biorreator.
Resumo
Tendões de ratos de cauda (RTTs) são um modelo comum biológicos utilizados em estudos experimentais in vitro nas áreas de fisiologia do tendão e tendinopatia. Trabalhando com esses tecidos é um desafio, porque eles são muito frágeis, e até agora não havia nenhum protocolo rigorosamente detalhadas para o seu isolamento.
Diante desses desafios, temos desenvolvido métodos e instrumentos para facilitar a manipulação de RTTs e tecido controle de viabilidade esterilidade e integridade. Este artigo descreve os procedimentos experimentais usados para preparar RTTs para estudos biomecânicos e mechanobiological. Nosso trabalho é dividido em quatro etapas principais: extração, transversal medição da área, lavagem e carregamento na câmara biorreator.
A cada passo, todos os procedimentos, materiais e manipulações são apresentados em detalhe, para que possam ser facilmente reproduzidos. Além disso, os instrumentos específicos desenvolvidos são apresentados: uma placa de manipulação usada para segregar RTTs, um micrômetro óptico para posicionar o tecido durante a medição da área transversal e um sistema de ancoragem para fixar a RTTs em um biorreator.
Por fim, descrevemos os resultados obtidos após vários testes para validar os nossos métodos. Avaliações a viabilidade de esterilidade e integridade demonstrar que os nossos procedimentos são suficientemente rigorosas para manipulações de tecidos frágeis, como os tendões da cauda de rato.
Protocolo
Antes de qualquer manipulação, é preciso identificar o grupo de tendões para ser usado, dependendo da experiência que estão a realizar e os aparelhos à sua disposição. Para os nossos propósitos, tendões ventral foram escolhidos porque são menores e, portanto, mais fácil de manipular durante a medição da área transversal e equipando-os para dentro da câmara biorreator.
Por favor note que todos os instrumentos são autoclavados ou esterilizados com álcool 70%. Além disso, um frasco de spray contendo álcool 70% é colocado ao lado de cada estação de trabalho para esterilizar as luvas experimentadores antes de cada operação.
Parte 1: Extração
Após a ressecção, a cauda é cuidadosamente manipulado por suas extremidades para evitar danificar os tecidos. Além disso, para conservar a viabilidade celular, todas as manipulações são realizadas em solução salina gelada.
1A) Materiais:
- Solução salina fria (D-PBS)
- Gelo picado
- Protetor de superfície
- Tábua
- Placas individuais de manipulação
- 2 500 pratos ml
- 2 2L pratos de vidro
- Fita adesiva
- Uma pinça
- 1 Pinça
- Uma pinça ficar
- 1 par de tesouras cirúrgicas
- Um bisturi
- 1 par de tesouras cirúrgicas

Figura 1. Manipulação individual com a identificação de orientação ("P" para "proximal")
1B) Estação de Trabalho:
- Espalhar o protetor de superfície e coloque a placa de corte na parte superior.
- Preencher cada dois pratos de vidro para maior até a metade com gelo picado e coloque-os no papel.
- Furar um pedaço de fita em um canto da placa de manipulação e identificar com uma letra para indicar o fim proximal.
- Preencha os dois pratos de vidro pequeno para a metade e todas as ranhuras das placas de manipulação com soro fisiológico frio. Colocá-los nos pratos de vidro grande contendo gelo.
- Organizar todos os instrumentos esterilizados no protector de superfície.
- Transferência da cauda em um dos prato de vidro contendo solução salina.
1C) Manipulações:
- Observar a anatomia da extremidade proximal da cauda para distinguir o lado ventral do lado dorsal. O lado ventral tem um maior número de tendões e vasos sanguíneos que pode ser verificado pressionando ligeiramente a cauda para produzir pequenas gotas de sangue.
- Usando a tesoura cirúrgica, cortar a pele ao longo do lado dorsal da cauda se você quer extrair os tendões ventral (ou ao longo do lado ventral se precisar os tendões dorsal).
- Abrir a incisão na extremidade proximal e remover a pele com a pinça ou com os dedos e com cuidado manipular as extremidades da cauda.
- Enxaguar o sangue e cabelo em solução salina e transferir a amostra no prato de vidro contendo solução fresca restantes. Mudar de luvas.
A seção transversal visto sob microscopia de luz mostra os grupos tendão seis. Um tendão de cada grupo é unido à extremidade caudal de cada vértebra, por isso cortamos no disco intervertebral para expor novas tendões ao longo do corte.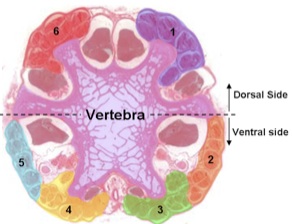
Figura 2. Secção transversal da cauda de ratos visto sob microscopia de luz. - Corte a extremidade distal através da cartilagem 2-3 vértebras mais curto com uma tesoura cirúrgica. Coloque a cauda na tábua de corte para cortar os tecidos moles, usando um bisturi e imediatamente substituí-lo na solução.
- Usando uma pinça, puxe um tendão da cauda distal.
- Com uma retenção suave em ambas as extremidades, coloque o tendão na placa de manipulação individual.
Repita os dois últimos passos até que não mais pode ser tendões brincou e cortar uma vértebra mais curta sempre que novos tecidos precisam ser expostos.
Parte 2: transversal medição da área 7
Quando o tecido sofre caracterização mecânica ou estimulação, suas propriedades mecânicas são descritos por normalizar a força no interior do tendão ao estresse. É por isso que nós avaliamos área transversal.
2A) Materiais:
- Micrômetro óptica
- Estereomicroscópio
- Câmera digital
- Reconhecimento de ponta e algoritmos de reconstrução 5,6 Perfil
- Solução salina fria (D-PBS)
- 1 pipeta de volume de 20 200μL Micro
- Uma chave de Hex para ajustes micrômetro óptico
- 2 Pinças
/ Files/ftp_upload/2176/2176fig3.jpg "alt =" Figura 3 "/>
Figura 3. Micrômetro Optic
2B) Estação de Trabalho:
- Abra o software (câmera digital e algoritmos).
- Coloque o micrômetro óptico para que haja espaço suficiente para carregar o tendão no aparelho.
- Organizar os instrumentos e prato de vidro contendo os tendões extraídos à mão.
2C) Manipulações:
- Encha o compartimento de medição com solução salina fria até que ambos os sistemas de ancoragem são submersas.
- Transferência do tendão no compartimento, segurando as pontas com uma pinça.
- Usando a pipeta de sucção através de micro-volume, puxe uma extremidade de cada vez para dentro do tubo de silício. Aspirar até o final se estende além do eixo colares.
- Aperte os colares de eixo para comprimir os tubos e instale o aparelho sob o estereomicroscópio.
- Com ampliação de 105X, esticar os tendões, enquanto observa o tecido até os vincos já não são perceptíveis. Estiramento por 0,40% adicionais.

Figura 4. Projeção do tendão com ampliação de 105x antes e após o alongamento. - Ajustar a posição e se concentrar para manter uma imagem clara do tendão mais de uma rotação de 180 °.
- Tirar uma foto a cada 10 ° de rotação, sem alterar o foco de tensão, ou posição. Use apenas o eixo rotativo para realizar a rotação. Devido à sua forma de cone, estes passos podem ser repetidos em diferentes pontos ao longo do tendão.
- Ativar o reconhecimento de ponta e algoritmos de reconstrução do perfil, a fim de analisar o banco de dados que você registrou.
- Livre do tendão soltando os colares de eixo e soprando ar para dentro dos tubos de silicone usando a pipeta de volume micro.
- Reinserir o tendão na placa de manipulação, manuseá-lo novamente pelas extremidades.
- Verificar a forma de a reconstrução do perfil obtido eo valor da área transversal.
Parte 3: lavagem
Para remover a contaminação que pode ter ocorrido durante as manipulações anterior, os tecidos são lavados sob biossegurança gabinete.
3A) Materiais:
- Solução salina fria (D-PBS)
- Múltiplas-groove placa manipulação
- Individuais placas de Manipulação
- Fita adesiva
- 2 Pinças
- Uma pinça ficar
3B) Estação de Trabalho:
- Ligue o ventilador na cabine de segurança biológica 15 minutos de antecedência e limpar as superfícies internas com álcool a 70%.
- Trazer todos os instrumentos dentro da cabine de segurança biológica.
- Vara pedaços de fita adesiva em um canto de cada prato individual para identificar a extremidade proximal.
- Preencher todas as ranhuras com solução salina estéril.
3C) Manipulações:
- Introduzir a placa de manipulação contendo o tendão extraído no gabinete.
- Usando uma pinça, remova o tendão de seu prato com um aperto suave em cada extremidade.
- Mergulhar e agitar suavemente o tendão na solução salina de cada compartimento da placa de manipulação de múltipla groove, a partir de mais próximo e prosseguindo ao ritmo mais longe.
- Finalmente submergir, o tendão em uma placa de manipulação individual.
Parte 4: Carregando em biorreator câmara
Para evitar maior contaminação, as manipulações a seguir também são realizadas no gabinete de biossegurança.
4A) Materiais:
- Biorreator de 4 câmaras
- Âncoras estéril
- Uma placa de Petri estéril
- Médio cela fria cultivados (DMEM)
- Cianoacrilato
- 2 Pinças
- Pinças pé
- 0.5-10μl pipeta Micro-volume
- 1 Régua

Figura 5. Biorreator câmara
4B) Estação de Trabalho:
- Desde a etapa anterior também foi realizado em biossegurança do gabinete, remoção de ferramentas desnecessárias lhe dará mais espaço de trabalho.
- Trazer todos os outros instrumentos dentro do armário.
4C) Manipulações:
- Coloque uma âncora na placa de manipulação com o seu spool centrado sobre a extremidade do tendão e ferir o tecido para cima e ao redor do carretel.
- Rolar a âncora mais e segure a extremidade solta, garantindo que o tecido fica preso à âncora. Parar após ¾ vez.
- Realizar o mesmopassos com a outra extremidade.
- Rolar duas âncoras sobre igual até que é de 6 cm entre seus centros 1.
- Solte o tendão para mergulhá-lo na solução e permitir que as seções ancoradas para secar rapidamente para melhorar suas propriedades mecânicas 2-3.
- Despeje cianoacrilato em placa de Petri e desenhar 2.5μL na pipeta de volume micro.
- Aplique uma gota de cianoacrilato no tecido liquidada sem deixar cair nenhuma cola na solução salina. Repita até 2 gotas foram aplicadas a cada âncora.
- Com o tendão ainda completamente imerso, aguarde 5 minutos para a cola secar completamente.
- Durante este tempo, encher o compartimento de câmara com solução salina.
- Hidratar todos os tecidos com solução salina para evitar danos.
- Manipulando apenas as âncoras, a transferência do tendão na câmara biorreator e fechá-lo para evitar vazamento e contaminação durante a transferência.
Parte 5: Resultados Representante:
O resultado do protocolo mostra que quando feita corretamente, nosso isolamento do tecido rigoroso procedimento de preparação e torná-lo possível para manter a esterilidade dos tecidos, viabilidade e integridade.
Primeiro, usando o método de extração simples e repetitivas, que são capazes de extrair tendões da cauda sem danificar a rede de colágeno como pode ser observado por uma análise microscópica de H & E seções contaminado realizada após a extração.

Figura 6. Rede de colágeno do tendão após a extração (5m seção longitudinal corados com H & E).
Em seguida, tendões cultivadas por até dez dias e realizou testes de esterilidade. Cada dia, solução de cultura banhado usado em agar e incubado por 24 horas. Uma vez que não foi observado crescimento bacteriano, concluímos que nossas manipulações não resultam em contaminação.
Com o algoritmo de reconstrução perfil e micrômetro óptico, somos capazes de estimar a área transversal dentro de uma margem de 2% de erro 7.

Figura 7. Reconstrução do perfil de um RTT.
Finalmente, avaliamos a viabilidade usando o LIVE / MORTOS Kit de Viabilidade / citotoxicidade para células de mamíferos após a etapa de lavagem e após um período de cultura de doze dias. Uma vez que a grande maioria dos verde fluorescente de células vivas eram evidentes, podemos confirmar que os nossos procedimentos de isolamento são bem sucedidos na preservação do tecido vivo. O mesmo teste foi realizado duas horas depois de prender o tendão para dentro da câmara biorreator. Verificou-se que a desidratação e cola na âncora não havia se espalhado no tecido entre as duas âncoras.

Figura 8. Viabilidade do tecido na âncora (verde = células vivas, vermelho = células mortas)
Access restricted. Please log in or start a trial to view this content.
Discussão
Aplicando os procedimentos experimentais, podemos realizar uma grande variedade de estudos in vitro sobre este tipo de tecidos. Como por exemplo, um estudo sobre a degeneração do tecido foi realizada pela aplicação de sub-estimulação para RTTs por um período de 10 dias. Cada dia, nós avaliamos as propriedades mecânicas do tecido em ensaios não-destrutivos de relaxamento stress. No final, pudemos observar variação de tensão RTT e, portanto, analisar a evolução das propriedades mecânicas....
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Este artigo foi apoiada pelo Grant NSERC # 299280, IRSST como uma bolsa de estudos para G. Pais e FRSQ como um prêmio de graduação de estudantes de pesquisa para M. Cyr. Agradecemos a Yoan Lemieux-Laneville para realizar as manipulações gravadas em vídeo.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments | |
| D-PBS | Reagent | Wisent Inc. | 311-410-CL | Saline solution |
| Glucose | Reagent | Wisent Inc. | 609-037-EL | Saline solution 1g/L |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Saline solution 1% |
| DMEM | Reagent | Invitrogen | 12800-017 | Culture solution |
| Sodium Bicarbonate | Reagent | Wisent Inc. | 600-105-CG | Culture solution 3.7g/L |
| FBS | Reagent | Wisent Inc. | 090150 | Culture solution 10% |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Culture solution 1% |
| Optic Micrometer | Tool | Custom Made | ||
| Manipulation plate | Tool | Custom Made | ||
| Bioreactor chamber | Tool | Custom Made |
Referências
- Bennett, M. B., Ker, R., Dimery, N., Alexander, R. Mechanical properties of various mammalian tendons. J. Zool. Lond. A209, 537-548 (1986).
- Dupuis, D. Déshydratation de matrices collagéniques reconstruites in vitro: effets sur les propriétés mécaniques et histologiques [dissertation]. , Québec, Université Laval. Québec. 114-114 (1981).
- Haut, R. C. Age-dependent influence of strain rate on the tensile failure of rat tail tendon. Journal of Biomechanical Engineering. 105, 296-299 (1983).
- Huppé, N., Lessard, J. -L., Langelier, E. A Bioreactor Design for the Mechanobiological Study of Soft Tissue Damage and Repair in Conditions that Provide the Best Approximation of Actual Use. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
- Langelier, E., Dupuis, D., Guillot, M., Goulet, F. &, Rancourt, D. Cross-sectional profiles and volume reconstructions of soft tissues using laser beam measurements. J Biomech Eng. 126, 796-802 (2004).
- Lee, T. Q., Woo, S. L. -Y. A new method for determining cross-sectional shape and area of soft tissues. J Biomech Eng. 110, 110-114 (1988).
- Parent, G., Cyr, M., Cousineau-Pelletier, P., Desbiens-Blais, F. &, Langelier, E. Current Techniques for the Evaluation of Cross-Sectional Area in Rat Tail Tendons Generate Significant Errors. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados