Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка сухожилия крысиного хвоста для Биомеханические и Mechanobiological исследований
В этой статье
Резюме
Данная статья описывает экспериментальные процедуры, используемые для подготовки сухожилия крысиного хвоста для биомеханических и mechanobiological исследований. Некоторые особенности основных этапов подготовки продемонстрированы, начиная с добычи, площадь поперечного сечения измерения, промывка и загрузка в биореакторе камеры.
Аннотация
Крыса хвостом сухожилий (RTTs) являются общие биологические модели, используемые в экспериментальной лабораторные исследования в области физиологии и сухожилия тендопатия. Работа с тех тканей является сложной задачей, потому что они очень хрупкие, и до сих пор не было строго подробный протокол для их изоляции.
Столкнувшись с этими проблемами, мы разработали методы и инструменты для облегчения манипулирования RTTs и контроля жизнеспособности тканей, бесплодие и целостности. Данная статья описывает экспериментальные процедуры, используемые для подготовки RTTs для биомеханических и mechanobiological исследований. Наша работа состоит из четырех основных этапов: добыча, площадь поперечного сечения измерения, промывка и загрузка в биореакторе камеры.
На каждом шагу, все процедуры, материалов и манипуляции подробно излагаются так, чтобы они легко могут быть воспроизведены. Более того, конкретные документы, разработанные представлены: манипуляции пластины используются для разделения RTTs, оптический микрометр в положение ткани при поперечном сечении измерения площади и крепления системы приложить RTTs на биореактора.
Наконец, мы описываем результаты, полученные после нескольких тестов для проверки наших методов. Жизнеспособность, бесплодие и целостность оценки показывают, что наши процедуры достаточно строгим для манипуляций хрупких тканей, таких как сухожилия крысиного хвоста.
протокол
До любых манипуляций, вы должны определить группу сухожилий, которые будут использоваться в зависимости от эксперимента вы проводите, и аппарат в вашем распоряжении. Для наших целей, вентральной сухожилия были выбраны потому, что они меньше и, следовательно, легче манипулировать при измерении площади поперечного сечения и монтаж их в биореакторе камеры.
Пожалуйста, обратите внимание, что все инструменты в автоклаве или стерилизуют 70% этанола. Более того, распылитель, содержащие 70% этанола находится рядом с каждой рабочей станции для стерилизации экспериментаторов перчатки перед каждой операцией.
Часть 1: Извлечение
После резекции, хвост тщательно управлять своими конечностями, чтобы не повредить ткани. Кроме того, чтобы сохранить жизнеспособность клеток, все манипуляции проводятся в холодной солевой раствор.
1А) Материалы:
- Холодный солевой раствор (D-PBS)
- Дробленый лед
- Поверхность протектора
- Обрезная доска
- Индивидуальные пластины манипуляции
- 2 500 мл блюда
- 2 2L блюда стекла
- Скотч
- 1 пинцет
- 1 Пинцет
- 1 пинцет стенде
- 1 пара хирургических ножниц
- 1 скальпеля
- 1 пара хирургических ножниц

Рисунок 1. Индивидуальные манипуляции с ориентацией идентификации ("P" для "проксимальных")
1B) Работа станции:
- Выложить поверхность протектора и место разделочная доска на вершине.
- Заполните каждую два больших блюда стекла на полпути с колотым льдом и разместить их на бумаге.
- Придерживайтесь кусок ленты на углу манипуляции пластины и идентифицировать себя с письмом, чтобы указать, проксимальный конец.
- Заполните два небольших блюд стекла на полпути и все пазы манипуляции пластины с холодным физиологическим раствором. Поместите их в больших блюдах стекла, содержащего льда.
- Организовать все стерильные инструменты на поверхности протектора.
- Передача хвост в одну из стекла блюдо с физиологическим раствором.
1С) Манипуляции:
- Соблюдайте анатомии в проксимальный конец хвоста отличить брюшной стороне от спинной стороны. Брюшная сторона имеет большее количество связок и кровеносных сосудов, которые могут быть проверены, осторожно сжимая хвост, чтобы произвести крошечные капли крови.
- Использование хирургических ножниц, разрезать кожу вдоль спинной стороны хвоста, если вы хотите извлечь вентральной сухожилий (или вдоль брюшной стороны, если вам нужно спинные сухожилия).
- Открытый разрез на проксимальном конце и снять кожу с помощью пинцета или пальцами и осторожно манипулирования хвост заканчивается.
- Смывать кровь и волосы в солевой раствор и передачи образцов в оставшиеся стеклянную посуду содержащие свежий раствор. Изменение перчатки.
Поперечного сечения смотреть под световым микроскопом показывает шесть групп сухожилия. Один сухожилия из каждой группы прилагается к хвостовой конец каждого позвонка, поэтому мы сокращаем на межпозвоночный диск, чтобы выставить новую сухожилий вдоль разреза.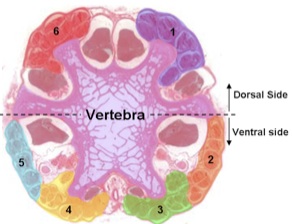
Рисунок 2. Поперечное сечение крысиного хвоста смотреть под световым микроскопом. - Вырезать дистального конца через хрящ 2-3 позвонков короче с хирургическими ножницами. Место хвост на разделочную доску, чтобы сократить мягких тканей с помощью скальпеля, а затем сразу же заменить его в растворе.
- С помощью пинцета вытащить один сухожилия от дистального конца хвоста.
- С нежным провести на обоих концах, место сухожилия на отдельные пластины манипуляции.
Повторите два последних шага, пока больше сухожилия может быть дразнили и нарезать один позвонок короче всякий раз, когда новые ткани должны быть подвержены.
Часть 2: Площадь поперечного сечения измерения 7
Когда ткань подвергается механической характеристике или стимуляции, его механические свойства которых описываются нормализации силы внутри сухожилия на стресс. Вот почему мы оцениваем площадь поперечного сечения.
2А) Материалы:
- Оптический микрометр
- Стереомикроскоп
- Цифровая камера
- Признание края и профиля алгоритмов реконструкции 5,6
- Холодный солевой раствор (D-PBS)
- 1 20-Micro объемом 200 мкл пипетки
- 1 шестигранных ключей для оптических корректировки микрометра
- 2 Пинцет
/ Files/ftp_upload/2176/2176fig3.jpg "ALT =" Рисунок 3 "/>
Рисунок 3. Оптический микрометр
2B) Работа станции:
- Открытое программное обеспечение (цифровые камеры и алгоритмы).
- Место оптический микрометр так, чтобы было достаточно места, чтобы загрузить сухожилия в аппарат.
- Организация инструментов и стеклянную посуду содержащей извлеченные сухожилия под рукой.
2C) Манипуляции:
- Заполните измерения отсек с холодным солевым раствором, пока оба якоря системы водой.
- Передача сухожилия в отсек, удерживая концы с помощью пинцета.
- Использование всасывания через микро-объем пипетки, тянуть одной конечности на время в кремнии трубки. Аспирируйте до конца выходит за пределы вала воротники.
- Затянуть вал воротники для сжатия труб и установку аппарата в стереомикроскопа.
- На 105X увеличение, растянуть сухожилия при соблюдении ткани до складки уже не ощутимо. Стретч дополнительные 0,40%.

Рисунок 4. Сухожилия проекции на 105x увеличением до и после растяжения. - Отрегулируйте положение и сосредоточиться сохранить четкое изображение сухожилия более 180 ° вращение.
- Возьмите фотографию на каждые 10 ° вращение, не изменяя напряжение, фокус или позиции. Используйте только вала осуществлять вращение. Благодаря своей форме конуса, эти шаги могут быть повторены в различных точках вдоль сухожилия.
- Активировать признания края и алгоритмов реконструкции профиля с целью анализа базы данных, которую зарегистрировали.
- Бесплатный сухожилия, ослабив вала воротники и вдувания воздуха в силиконовых трубок использовании микропипетки объема.
- Вставьте сухожилия на манипуляции пластины, снова обработку его концах.
- Проверьте форму профиля реконструкции получить и значение площади поперечного сечения.
Часть 3: Промывка
Для удаления загрязнений, которые могли произойти во время предыдущей манипуляции, ткани промываются под биобезопасности кабинета.
3А) Материалы:
- Холодный солевой раствор (D-PBS)
- Несколько-паз манипуляции пластины
- Индивидуальные пластины Манипуляция
- Скотч
- 2 Пинцет
- 1 пинцет стенде
3B) Работа станции:
- Включите вентилятор в кабинет биобезопасности 15 минут заранее и очистки внутренних поверхностей с 70% этанола.
- Приведите все инструменты внутри шкафа биобезопасности.
- Придерживайтесь куски ленты на углу каждой пластины для выявления проксимального конца.
- Заполните все пазы стерильным физиологическим раствором.
3C) Манипуляции:
- Представьте манипуляции пластину, содержащую извлеченные сухожилия в шкафу.
- С помощью пинцета удалите сухожилия от пластины с нежным понимание на каждом конце.
- Погрузите и осторожно перемешать сухожилия в солевой раствор каждого отсека несколькими паз пластины манипуляции, начиная с ближайшего и переходить к дальний паз.
- Наконец, погрузиться сухожилия в отдельные пластины манипуляции.
Часть 4: загрузка в биореакторе камеры
Чтобы избежать дальнейшего загрязнения, следующие манипуляции проводятся также в шкафу биобезопасности.
4А) Материалы:
- Биореактор камере 4
- Стерильные якоря
- 1 Стерильные чашки Петри
- Холодная ячейки культурной среды (DMEM)
- Цианоакрилат
- 2 Пинцет
- Пинцет стенде
- 10 мкл 0,5-Micro объемом пипетки
- 1 Правитель

Рисунок 5. Биореактор камеры
4B) Работа станции:
- Так как предыдущий шаг был также реализован в области биобезопасности кабинет, удаление ненужных инструментов даст вам больше рабочего пространства.
- Приведите все другие инструменты внутри шкафа.
4С) Манипуляции:
- Место якорь на манипуляции пластины с катушки с центром над сухожилий конечностей и раны ткани и вокруг катушки.
- Ролл якорь снова и провести свободные конечности, обеспечивая при этом ткань остается придается якорь. Остановиться после ¾ оборота.
- Провести жешаги с другого конца.
- Ролл оба якоря более одинаково, пока не будет 6 см между их центрами 1.
- Ослабить сухожилия, чтобы погрузить его в раствор и позволяет якорь разделы сухой кратко для повышения его механических свойств 2-3.
- Налейте цианоакрилат в чашку Петри и привлечь 2.5μL в микропипетки объема.
- Применять капли цианоакрилат к заведенный тканей без потери каких-либо клеев в солевой раствор. Повторяйте, пока 2 капли были применены к каждому якорь.
- С сухожилия еще полностью погружается в воду, подождать 5 минут, когда клей полностью высохнет.
- За это время заполнить камеры отсек с физиологическим раствором.
- Увлажняет все ткани с физиологическим раствором, чтобы предотвратить повреждение.
- Манипулируя только якоря, передача сухожилия в биореакторе камеру и закрыть его, чтобы предотвратить утечки и загрязнения во время передачи.
Часть 5: Представитель Результаты:
Результаты протокола показывает, что при правильном выполнении наших тканей строгой изоляции и подготовки процедура позволяет поддерживать стерильность тканей, жизнеспособность и целостность.
Во-первых, с помощью простых и повторяющихся метод извлечения, мы в состоянии извлечь хвост сухожилий без повреждения коллагена сети как это можно наблюдать, микроскопический анализ H & E испорченной разделах понял после удаления зуба.

Рисунок 6. Сухожилия сеть коллагена после экстракции (5 мкм продольном сечении окрашивали H & E).
Мы затем культивируют сухожилия на срок до десяти дней, и провели испытания стерильности. Каждый день мы использовали культуру покрытием решение на агар и инкубируют ее в течение 24 часов. Поскольку ни роста бактерий наблюдалось, мы пришли к выводу, что наши манипуляции не приводят к загрязнению.
С алгоритмом профиля реконструкции и оптического микрометра, мы имеем возможность оценить площадь поперечного сечения в пределах 2% погрешностью 7.

Рисунок 7. Профиль реконструкции RTT.
Наконец, мы оценивали жизнеспособность использованием LIVE / DEAD жизнеспособность / цитотоксичность Kit для клеток млекопитающих после промывки шаг и после двенадцати дней культуры периода. Так как подавляющее большинство зеленого флуоресцентного живые клетки были очевидны, мы можем подтвердить, что наши процедуры изоляции успеха деятельности по сохранению живой ткани. Этот же тест был выполнен через два часа после крепления сухожилия в биореакторе камеры. Мы проверили, что обезвоживание и клея на якорь не распространился в ткани между двумя якорями.

Рисунок 8. Жизнеспособности тканей на якорь (зеленый = живых клеток, красный = мертвые клетки)
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Применяя эти экспериментальные процедуры, мы сможем провести самые разнообразные лабораторные исследования на этот вид ткани. Как, например, исследование тканей дегенерация была проведена применение при стимуляции, чтобы RTTs в течение десяти дней. Каждый день мы оценили ткани мех...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта статья была поддержана NSERC Грант № 299280, IRSST как стипендию для родителей и Г. FRSQ как бакалавриат аспирант М. Сир. Мы благодарим Йоан Лемье-Laneville для выполнения манипуляций, записанных на видео.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments | |
| D-PBS | Reagent | Wisent Inc. | 311-410-CL | Saline solution |
| Glucose | Reagent | Wisent Inc. | 609-037-EL | Saline solution 1g/L |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Saline solution 1% |
| DMEM | Reagent | Invitrogen | 12800-017 | Culture solution |
| Sodium Bicarbonate | Reagent | Wisent Inc. | 600-105-CG | Culture solution 3.7g/L |
| FBS | Reagent | Wisent Inc. | 090150 | Culture solution 10% |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Culture solution 1% |
| Optic Micrometer | Tool | Custom Made | ||
| Manipulation plate | Tool | Custom Made | ||
| Bioreactor chamber | Tool | Custom Made |
Ссылки
- Bennett, M. B., Ker, R., Dimery, N., Alexander, R. Mechanical properties of various mammalian tendons. J. Zool. Lond. A209, 537-548 (1986).
- Dupuis, D. Déshydratation de matrices collagéniques reconstruites in vitro: effets sur les propriétés mécaniques et histologiques [dissertation]. , Québec, Université Laval. Québec. 114-114 (1981).
- Haut, R. C. Age-dependent influence of strain rate on the tensile failure of rat tail tendon. Journal of Biomechanical Engineering. 105, 296-299 (1983).
- Huppé, N., Lessard, J. -L., Langelier, E. A Bioreactor Design for the Mechanobiological Study of Soft Tissue Damage and Repair in Conditions that Provide the Best Approximation of Actual Use. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
- Langelier, E., Dupuis, D., Guillot, M., Goulet, F. &, Rancourt, D. Cross-sectional profiles and volume reconstructions of soft tissues using laser beam measurements. J Biomech Eng. 126, 796-802 (2004).
- Lee, T. Q., Woo, S. L. -Y. A new method for determining cross-sectional shape and area of soft tissues. J Biomech Eng. 110, 110-114 (1988).
- Parent, G., Cyr, M., Cousineau-Pelletier, P., Desbiens-Blais, F. &, Langelier, E. Current Techniques for the Evaluation of Cross-Sectional Area in Rat Tail Tendons Generate Significant Errors. 31st Canadian Medical and Biological Engineering Conference, 2008 Jun 11-12, Montreal, Canada, , Canadian Medical and Biological Engineering Society. (1985).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены