È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione dei tendini coda di topo per studi di biomeccanica e Mechanobiological
In questo articolo
Riepilogo
In questo articolo vengono descritte le procedure sperimentali utilizzate per preparare i tendini coda di topo per studi di biomeccanica e mechanobiological. Diverse caratteristiche dei passi principali nella preparazione sono dimostrati, a cominciare da estrazione, sezione di misura zona, il risciacquo e il caricamento nella camera bioreattore.
Abstract
Tendini coda di topo (RTT) è un modello comune biologici utilizzati in studi sperimentali in vitro nel campo della fisiologia dei tendini e tendinopatie. Lavorare con questi tessuti è impegnativo perché sono molto fragili, e fino ad ora non c'era protocollo rigorosamente dettagliato per il loro isolamento.
Di fronte a queste sfide, abbiamo sviluppato metodi e strumenti per facilitare la manipolazione di RTT e tessuto di controllo vitalità, sterilità e l'integrità. In questo articolo vengono descritte le procedure sperimentali utilizzati per la preparazione RTT per gli studi di biomeccanica e mechanobiological. Il nostro lavoro è diviso in quattro fasi principali: estrazione, sezione di misura zona, il risciacquo e il caricamento nella camera bioreattore.
Ad ogni passo, tutti, i materiali procedure e le manipolazioni sono presentati in dettaglio in modo che possano essere facilmente riprodotti. Inoltre, gli strumenti specifici sviluppati sono presentati: un piatto di manipolazione utilizzata per separare RTT, un micrometro ottico per posizionare il tessuto durante la sezione di misurazione dell'area e un sistema di ancoraggio per fissare la RTT su un bioreattore.
Infine, descriviamo i risultati ottenuti dopo le prove multiple per validare i nostri metodi. Valutazioni la vitalità, la sterilità e l'integrità dimostrare che le nostre procedure siano sufficientemente rigorosi per le manipolazioni dei tessuti fragili come i tendini coda di topo.
Protocollo
Prima di qualsiasi manipolazione, è necessario identificare il gruppo di tendini da utilizzare a seconda della sperimentazione si sta conducendo e l'apparato a vostra disposizione. Per i nostri scopi, i tendini ventrale sono stati scelti perché sono più piccoli e quindi più facili da manipolare quando si misura la sezione trasversale e montaggio li nella camera bioreattore.
Si prega di notare che tutti gli strumenti vengono sterilizzati in autoclave o sterilizzato con il 70% di etanolo. Inoltre, un flacone spray contenente etanolo al 70% è collocato accanto a ogni postazione di lavoro per sterilizzare i guanti sperimentatori prima di ogni operazione.
Parte 1: Estrazione
Dopo la resezione, la coda è attentamente manipolato dalla sua estremità per evitare di danneggiare i tessuti. Inoltre, per conservare la vitalità cellulare, tutte le manipolazioni sono eseguite a freddo una soluzione salina.
1A) Materiali:
- Freddo una soluzione salina (D-PBS)
- Ghiaccio tritato
- Superficie protettore
- Tagliere
- Piastre di manipolazione individuale
- 2 500 piatti ml
- 2 piatti di vetro 2L
- Nastro adesivo
- 1 pinzette
- 1 Pinza
- 1 Pinzette stare
- 1 paio di forbici chirurgiche
- 1 bisturi
- 1 paio di forbici chirurgiche

Figura 1. Manipolazione individuale con l'identificazione di orientamento ("P" per "prossimale")
1B) stazione di lavoro:
- Stendere il protettore superficie e mettere il tagliere in cima.
- Riempire ogni due piatti di vetro più grande per metà con ghiaccio tritato e metterle sulla carta.
- Bastone un pezzo di nastro in un angolo della piastra di manipolazione e di identificare con una lettera per indicare la fine prossimale.
- Riempire i due piatti di vetro a metà e tutte le scanalature delle piastre manipolazione a freddo con soluzione salina. Metterli nei piatti di vetro di grandi dimensioni contenente ghiaccio.
- Organizzare tutti gli strumenti sterili il protettore superficie.
- Trasferire la coda in uno dei piatti di vetro contenente una soluzione salina.
1C) Manipolazioni:
- Osservare l'anatomia alla fine prossimale della coda di distinguere il lato ventrale dal lato dorsale. Il lato ventrale ha un maggior numero di tendini e dei vasi sanguigni che possono essere verificate premendo delicatamente la coda per la produzione di piccole gocce di sangue.
- Utilizzando le forbici chirurgiche, tagliare la pelle lungo il lato dorsale della coda, se si desidera estrarre i tendini ventrale (o lungo il lato ventrale se avete bisogno i tendini dorsali).
- Aprire l'incisione alla fine prossimale e togliere la pelle con pinze o con le dita e manipolando con attenzione le estremità della coda.
- Lavare via il sangue e capelli nella soluzione salina e trasferire il campione nel recipiente di vetro contenente restante soluzione fresca. Cambiare i guanti.
Una sezione trasversale visto al microscopio ottico mostra i gruppi tendine sei. Un tendine di ogni gruppo è collegato alla fine di ogni vertebra caudale, per cui abbiamo tagliato il disco intervertebrale per esporre i tendini nuovo lungo il taglio.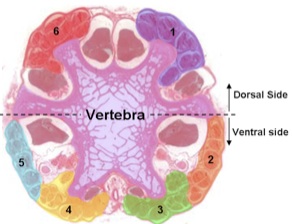
Figura 2. Sezione trasversale della coda di ratto visto al microscopio ottico. - Tagliare l'estremità distale attraverso le vertebre 2-3 cartilagine più breve con forbici chirurgiche. Mettere la coda sul tagliere per tagliare i tessuti molli con un bisturi e poi subito a sostituirlo nella soluzione.
- Utilizzando le pinzette, estrarre uno tendine dalla coda distale.
- Con una presa delicata ad entrambe le estremità, posto il tendine nella piastra di manipolazione individuale.
Ripetere gli ultimi due passaggi fino a quando non più tendini possono essere presi in giro e tagliare fuori una vertebra più breve ogni volta che nuovi tessuti devono essere esposti.
Parte 2: Sezione di misura 7
Quando il tessuto viene sottoposto caratterizzazione meccanica o la stimolazione, le sue proprietà meccaniche sono descritte normalizzando la forza all'interno del tendine allo stress. Per questo motivo valutiamo sezione trasversale.
2A) Materiali:
- Micrometro ottico
- Stereomicroscopio
- Macchina fotografica digitale
- Il riconoscimento dei bordi e gli algoritmi di ricostruzione profilo 5,6
- Freddo una soluzione salina (D-PBS)
- 1 20-200μL Micro volume di pipette
- 1 chiave esagonale per la regolazione micrometrica ottica
- 2 Pinzette
/ "Alt =" files/ftp_upload/2176/2176fig3.jpg Figura 3 "/>
Figura 3. Micrometro ottico
2B) stazione di lavoro:
- Aprire il software (macchina fotografica digitale e gli algoritmi).
- Posizionare il micrometro ottico in modo che vi sia spazio sufficiente per caricare il tendine nell'apparato.
- Organizzare gli strumenti e piatto di vetro contenente i tendini estratto a portata di mano.
2C) Manipolazioni:
- Riempire il vano di misura a freddo con soluzione salina fino a quando entrambi i sistemi di ancoraggio sono sommersi.
- Trasferire il tendine nel vano tenendo le estremità con le pinzette.
- Mediante aspirazione tramite il micro-volume pipetta, tirare una estremità in un momento nel tubo di silicone. Aspirare alla fine si estende oltre il collari per albero.
- Serrare i collari per albero per comprimere i tubi e installare l'apparato con lo stereomicroscopio.
- Con ingrandimento 105X, allungare i tendini, osservando il tessuto fino a quando le pieghe non sono più percepibili. Tratto da ulteriori 0,40%.

Figura 4. Proiezione del tendine con ingrandimento 105X prima e dopo lo stretching. - Regolare la posizione e mettere a fuoco per mantenere una chiara immagine del tendine su una rotazione di 180 °.
- Scattare una foto ad ogni rotazione di 10 ° senza modificare la tensione, messa a fuoco o la posizione. Utilizzare solo l'albero rotante per effettuare la rotazione. Grazie alla sua forma conica, questi passaggi possono essere ripetuti in diversi punti lungo il tendine.
- Attivare il riconoscimento bordo e algoritmi di ricostruzione profilo al fine di analizzare i dati che avete registrato.
- Libero il tendine allentando le collari per albero e soffiando aria nei tubi di silicone con la pipetta micro volume.
- Reinserire il tendine sulla piastra di manipolazione, ancora una volta la manipolazione da parte le estremità.
- Verificare la forma del profilo ricostruzione ottenuti e il valore della sezione trasversale.
Parte 3: risciacquo
Per eliminare la contaminazione che possono essersi verificati durante le manipolazioni precedenti, i tessuti vengono risciacquati sotto biosicurezza cabinet.
3A) Materiali:
- Freddo una soluzione salina (D-PBS)
- Multiple-scanalatura manipolazione piastra
- Piastre di manipolazione individuale
- Nastro adesivo
- 2 Pinzette
- 1 Pinzette stare
3B) stazione di lavoro:
- Accendere il ventilatore nell'armadio biosicurezza 15 minuti in anticipo e pulire le superfici interne con il 70% di etanolo.
- Portare tutti gli strumenti all'interno dell'armadio biosicurezza.
- Stick pezzi di nastro su un angolo di ogni singola piastra per identificare la fine prossimale.
- Riempire tutte le scanalature con soluzione salina sterile.
3C) Manipolazioni:
- Introdurre la piastra manipolazione contenente il tendine estratti nel cabinet.
- Utilizzando le pinzette, rimuovere il tendine dalla sua piastra con una presa delicata su ciascuna estremità.
- Immergere e mescolare dolcemente il tendine nella soluzione salina di ogni comparto della scanalatura multipla piastra manipolazione, a partire dalla più vicina e procedendo verso il solco più lontano.
- Infine, immergere il tendine in una piastra di manipolazione individuale.
Parte 4: Caricamento in bioreattore camera
Per evitare ulteriore contaminazione, le manipolazioni sono anche condotte nel quadro di biosicurezza.
4A) Materiali:
- Bioreattore camera 4
- Ancoraggi sterile
- 1 piatto di Petri sterili
- Cellule in coltura media freddo (DMEM)
- Cianoacrilato
- 2 Pinzette
- Pinzette stare
- 0.5-10μl Micro-volume pipetta
- 1 righello

Figura 5. Bioreattore camera
4B) stazione di lavoro:
- Poiché il passo precedente è stato realizzato anche in materia di biosicurezza gabinetto, la rimozione di strumenti inutili vi darà più spazio di lavoro.
- Portare tutti gli altri strumenti all'interno del cabinet.
4C) Manipolazioni:
- Inserire un ancoraggio sulla piastra di manipolazione con il suo rocchetto centrato sopra l'estremità del tendine e la ferita del tessuto e attorno al rocchetto.
- Rotolare sopra l'ancora e tenere l'estremità libera, garantendo nel contempo che il tessuto rimane agganciato al di ancoraggio. Fermarsi dopo ¾ di giro.
- L'effettuazione della stessapassi con l'altra estremità.
- Rotolo sia ancore oltre allo stesso fino a quando non è di 6 cm tra loro centri 1.
- Allentare il tendine di immergerlo nella soluzione e consentire le sezioni ancorata ad asciugare per breve tempo di migliorare le sue proprietà meccaniche 2-3.
- Versare cianoacrilato nella piastra di Petri e disegnare 2.5μL nella pipetta del volume micro.
- Applicare una goccia di cianoacrilato sulla ferita, i tessuti senza saltare nessun collante nella soluzione salina. Ripetere fino a 2 gocce sono state applicate a ogni ancora.
- Con il tendine ancora completamente immerso, attendere 5 minuti per la colla si asciughi completamente.
- Durante questo tempo, riempire il vano camera con soluzione salina.
- Reidratare tutto il tessuto con una soluzione salina per evitare danni.
- Manipolando solo le ancore, trasferire il tendine nella camera di bioreattori e chiuderlo per evitare perdite e contaminazioni durante il trasferimento.
Parte 5: Risultati Rappresentante:
Il risultato del protocollo dimostra che quando eseguito correttamente, il nostro isolamento dei tessuti rigorosa procedura di preparazione e permettono di mantenere la sterilità dei tessuti, la vitalità e l'integrità.
In primo luogo, utilizzando il metodo di estrazione semplice e ripetitivo, siamo in grado di estrarre i tendini coda senza danneggiare la rete di collagene, come si può osservare da un analisi microscopica di sezioni H & E contaminato realizzata dopo l'estrazione.

Figura 6. Rete di collagene del tendine dopo l'estrazione (5 micron sezione longitudinale colorate con H & E).
Abbiamo poi i tendini in coltura per un massimo di dieci giorni e test di sterilità condotta. Ogni giorno, placcato soluzione cultura utilizzati su agar e incubato per 24 ore. Poiché non è stata osservata la crescita batterica, abbiamo concluso che le nostre manipolazioni non provochino contaminazione.
Con l'algoritmo di ricostruzione profilo e micrometro ottico, siamo in grado di stimare la sezione trasversale all'interno di un margine di errore del 2% 7.

Figura 7. Ricostruzione Profilo di un RTT.
Infine, abbiamo valutato la vitalità usando il Live / Dead Fattibilità / citotossicità Kit per le cellule di mammifero dopo la fase di risciacquo e, dopo dodici giorni di cultura. Dal momento che la grande maggioranza dei verdi fluorescenti cellule vive sono state evidenti, possiamo confermare che le nostre procedure di isolamento sono riuscito a preservare il tessuto vivo. Lo stesso test è stato eseguito due ore dopo collegare il tendine nella camera bioreattore. Abbiamo verificato che la disidratazione e la colla a l'ancora non si era diffuso nel tessuto tra le due ancore.

Figura 8. Vitalità del tessuto al di ancoraggio (verde = cellule vive, rosso = le cellule morte)
Discussione
Mediante l'applicazione di tali procedure sperimentali, siamo in grado di condurre una vasta gamma di studi in vitro su questo tipo di tessuti. Come per esempio, uno studio sulla degenerazione dei tessuti è stata effettuata con l'applicazione di sotto-stimolazione per RTT per un periodo di dieci giorni. Ogni giorno, abbiamo valutato le proprietà meccaniche del tessuto in stress test non distruttivi relax. Alla fine, siamo stati in grado di osservare variazioni RTT stress e quindi di analizzare la prog...
Divulgazioni
Riconoscimenti
Questo articolo è stato supportato da NSERC di Grant # 299280, IRSST come una borsa di studio di padre G. e FRSQ come premio di laurea di ricerca studente di M. Cyr. Ringraziamo Yoan Lemieux-Laneville per eseguire le manipolazioni registrate su video.
Materiali
| Name | Company | Catalog Number | Comments | |
| D-PBS | Reagent | Wisent Inc. | 311-410-CL | Saline solution |
| Glucose | Reagent | Wisent Inc. | 609-037-EL | Saline solution 1g/L |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Saline solution 1% |
| DMEM | Reagent | Invitrogen | 12800-017 | Culture solution |
| Sodium Bicarbonate | Reagent | Wisent Inc. | 600-105-CG | Culture solution 3.7g/L |
| FBS | Reagent | Wisent Inc. | 090150 | Culture solution 10% |
| Antibiotics-antimycotics | Reagent | Invitrogen | 15240-062 | Culture solution 1% |
| Optic Micrometer | Tool | Custom Made | ||
| Manipulation plate | Tool | Custom Made | ||
| Bioreactor chamber | Tool | Custom Made |
Riferimenti
- Bennett, M. B., Ker, R., Dimery, N., Alexander, R. Mechanical properties of various mammalian tendons. J. Zool. Lond. A209, 537-548 (1986).
- Dupuis, D. . Déshydratation de matrices collagéniques reconstruites in vitro: effets sur les propriétés mécaniques et histologiques [dissertation]. , 114-114 (1981).
- Haut, R. C. Age-dependent influence of strain rate on the tensile failure of rat tail tendon. Journal of Biomechanical Engineering. 105, 296-299 (1983).
- Huppé, N., Lessard, J. -. L., Langelier, E. A Bioreactor Design for the Mechanobiological Study of Soft Tissue Damage and Repair in Conditions that Provide the Best Approximation of Actual Use. , (1985).
- Langelier, E., Dupuis, D., Guillot, M., Goulet, F. &. a. m. p. ;. a. m. p., Rancourt, D. Cross-sectional profiles and volume reconstructions of soft tissues using laser beam measurements. J Biomech Eng. 126, 796-802 (2004).
- Lee, T. Q., Woo, S. L. -. Y. A new method for determining cross-sectional shape and area of soft tissues. J Biomech Eng. 110, 110-114 (1988).
- Parent, G., Cyr, M., Cousineau-Pelletier, P., Desbiens-Blais, F. &. a. m. p. ;. a. m. p., Langelier, E. Current Techniques for the Evaluation of Cross-Sectional Area in Rat Tail Tendons Generate Significant Errors. , (1985).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon