Method Article
Feeder-freie Adaption, Kultur und Passagierung der Menschenrechte iPS-Zellen mit Komplett KnockOut Serum Ersatz Feeder-freiem Medium
In diesem Artikel
Zusammenfassung
Das folgende Protokoll enthält Anweisungen für die Anpassung menschlichen induzierten pluripotenten Stammzellen (iPS-Zellen) zu Feeder-freien Kultur mit kompletten KnockOut Serum Ersatz Feeder-freiem Medium (KSR-FF). Einmal angepasst, Anweisungen für die kontinuierliche Wartung sind ebenfalls vorhanden.
Zusammenfassung
Die Entdeckung im Jahr 2006, dass Mensch und Maus-Fibroblasten umprogrammiert könnte zu iPS-Zellen 1-3 mit Qualitäten bemerkenswert ähnlich wie embryonale Stammzellen zu erzeugen ist eine wertvolle neue Quelle für pluripotente Zellen für die Wirkstoffforschung, Zell-Therapie und Grundlagenforschung geschaffen.
GIBCO Medien und Reagenzien sind an der Spitze der pluripotenten Stammzellen seit Jahren. Knockout DMEM mit Knockout Serum Replacement ergänzt wird das Medium der Wahl für die embryonalen Stammzellen das Wachstum und nun iPS Zellkultur 3-9. Dieser Goldstandard Medien kann nun für Feeder-freien Kultur mit der Zugabe von Knockout SR Growth Factor Cocktail verwendet werden.
Traditionelle menschliche ES-und iPS-Zellkultur-Methoden erfordern den Einsatz von Maus oder humanen Fibroblasten Feederschichten oder Feeder-konditioniertem Medium. Diese Kultur Methoden sind arbeitsintensiv, hart zu skalieren und es ist schwierig, Hüften Zellen undifferenziert wegen der undefinierten Zustand zu erhalten. Invitrogen hat Knockout SR Growth Factor Cocktail entwickelt, damit Sie auf einfache Weise Übergang Hüfte Zellkulturen Feeder-free unter Beibehaltung Ihrer Benutzung der Knockout SR.
Protokoll
Hinweis: Um sterile Kultur Bedingungen aufrechtzuerhalten, werden alle Verfahren in diesem Protokoll unter Verwendung von sterilen Laborpraxis durchgeführt und führte unter einer Laminar-Flow-Haube.
Vor dem Start, sicherzustellen, dass alle Medien äquilibriert bis 37 ° C und entsprechend vergast.
Vorbereitung Geltrex-beschichteten Kulturschalen
Hinweis: siehe Anhang für die Nutzung von CELLstart beschichteten Kulturschalen
- Thaw eine Tube Geltrex (1 mL) langsam bei 2-8 ° C und verdünnt 1:100 in 99 ml Knockout D-MEM/F-12. Mischen Sie die Lösung vorsichtig.
Hinweis: Einige iPS-Zelllinien kann eine andere Geltrex Verdünnung für ein optimales Wachstum benötigen. Siehe Anhang für alternative Verdünnungen. - Abdeckung der gesamten Oberfläche jeder Kulturschale mit dem Geltrex-Lösung (1 mL für eine 35-mm-Schale, 1,5 mL für eine 60-mm-Schale).
- Seal jedes Gericht mit Parafilm zum Trocknen zu verhindern und inkubieren Sie die Gerichte für 1 Stunde bei 37 ° C.
Hinweis: An dieser Stelle können Sie die Geltrex-beschichteten Kulturschalen bei 4 ° C lagern bis zu 1 Monat. Seal jedes Gericht mit Parafilm die Geltrex vor dem Austrocknen zu verhindern. - Vor dem Einsatz, übertragen Sie die Geltrex-beschichtete Platten zu einem Laminarströmungshaube und es ihnen ermöglichen, auf Raumtemperatur (ca. 1 Stunde) ausgleichen.
Vorbereitung Komplette KnockOut SR Feeder-freiem Medium
- Zur Vorbereitung 1 mL von 10 pg / mL Grundlegende FGF-Lösung, aseptisch mischen die unten aufgeführten Komponenten. Aliquot der Lösung und bei -20 ° C bis zu 6 Monaten.
Grundlegende FGF 10 ug D-PBS 990 ul 10% BSA 10 l
Hinweis: BSA mit HSA oder Knockout SR in der gleichen Konzentration ersetzt werden. - Zur Vorbereitung 50 ml 2 mg / mL Dispase-Lösung, aseptisch mischen die unten aufgeführten Komponenten. Filter sterilisieren der Lösung und lagern bei 4 ° C für bis zu 2 Wochen.
Dispase 100 mg D-PBS 50 mL - Zu 100 ml komplette KnockOut SR Feeder-Free (KSR-FF) Medium aseptisch verbinden die Komponenten in der folgenden Tabelle aufgeführten vorzubereiten.
Sie können die KSR-FF Medium bei 2-8 ° C lagern bis zu einer Woche.Komponente Lager-Konzentration Endkonzentration Volumen Knockout DMEM/F12 (Kat.-Nr. 12660-012) - 1X 76,8 mL Glutamax-I (Kat. Nr. 35050-061) 200 mM 2 mM 1 mL KnockOut SR (Kat.-Nr. 10828-028) - 20% 20 mL KnockOut SR-GFC (Kat.-Nr. A10580-01) 50X 1X 2 mL bFGF (Kat.-Nr. PHG0024) 10 ug / mL 20 ng / mL 200 ul - Kurz vor pre-Gleichgewicht der gesamten mittel-bis Temperatur und Gase, aseptisch fügen Sie die erforderlichen Volumen von 2 Mercaptoethanol (55 mM Lager-Konzentration) für eine 0,1 mM Endkonzentration. Zum Beispiel auf 100 ml KSR-FF Medium herzustellen add 182 uL 55 mM 2-Mercaptoethanol (1:550 Verdünnung) Alternativ kann die 2-Mercaptoethanol zum 1X fertig zugesetzt werden und bei 2-8 ° C für bis zu einer Woche.
Anpassung IPSCs zu KSR-FF Medium
- Vor Beginn der Pre-Gleichgewicht Ihrer Geltrex beschichtete Platten auf Raumtemperatur in der Motorhaube.
- Kultur der IPSCs am MEF Feeder-Zellen, bis sie 70-80% konfluent. Bitte beachten Sie die GIBCO embryonalen Maus-Fibroblasten-Handbuch für MEF-basierte Kultur-Protokolle.
- Pre-warm das erforderliche Volumen der Dispase in einem 37 ° C Wasserbad. Siehe Tabelle 1 unten für Details auf den Datenträgern erforderlich.
- Pre-Gleichgewicht das erforderliche Volumen des KSR-FF in einem 37 ° C Wasserbad for15 min. Siehe Tabelle 1 unten für Details auf den Datenträgern erforderlich.
- Saugen Sie das Medium von den Kulturschalen, und fügen Sie eine entsprechende Menge an Dispase-Lösung. Inkubieren Sie die Speisen bei 37 ° C für 3-5 Minuten.
- Saugen Sie das Dispase-Lösung aus jeder Kultur Gefäß und waschen Sie die MEF Feeder-Zellen vorsichtig mit D-PBS (2 bis 3 mal).
- Fügen Sie einen angemessenen Betrag von kompletten KnockOut SR-Medium pro Kulturgefäß. Verwenden Sie eine Zelle Schaber oder einer 5-ml-Pipette vorsichtig kratzen die Zellen von der Oberfläche des Kulturgefäßes.
Hinweis: siehe Anhang alternative Anpassung Protokolle für schwer zu iPS-Zelllinien anpassen, - Sammeln Sie die Zellsuspension aus jeder Kulturschale in verschiedene 15 ml konische Röhrchen. Spülen Sie jedes Kulturgefäß mit einer entsprechenden Menge von kompletten KnockOut SR Medium, und fügen Sie die D-PBS spülen Medium in den 15 ml konische Röhrchen mit der Zellsuspension. Seien Sie vorsichtig, nicht auf die Zellklumpen in einzelne Zellen zu brechen
- Zentrifugieren Sie die 15 ml konische Röhrchen bei 200 xg für 5 Minuten auf dem Pellet IPSCs.
- Saugen Sie den Überstand aus der iPSC Pellet. Das Pellet in einer entsprechenden Menge an KSR-FF-Medium nach dem Split-Verhältnis (Tabelle 1). Zerbrechen Sie das Zellklumpen auf eine kleinere Größe, da die kleineren Klumpen nicht gut befestigen zu tun, um die Oberfläche.
Hinweis: Wir empfehlen eine Split-Verhältnis von 1:2 für die ersten 3 Stellen nach dem IPSCs wurden direkt aus dem iPSC MEF Kulturmedium KSR-FF Medium passagiert. Normalerweise wird ein Split-Verhältnis von 1.03 bis 01.05 angebracht, aber die Passage bei 1:2 sichert die höhere Dichte der Zellen benötigt bei der Anpassung in ein Feeder-freien Kultur. - Vor dem Ausplattieren der IPSCs auf Geltrex beschichtete Platten, absaugen Rest Geltrex Lösung aus dem vorbeschichteten Schüssel geben und langsam eine entsprechende Menge an Zellsuspension jeder Kulturschale. Hinweis: nicht ausspülen Gerichte vor dem Beschichten.
- Bewegen Sie die Kulturschale hin und her und hin und her mehrere Male, um die Zellen auf der Oberfläche der Schale zu verteilen. Sanft statt der Kulturschale in einem 37 ° C Inkubator mit einer angefeuchteten Atmosphäre von 4 bis 6% CO 2 in Luft. Ersetzen Sie die verbrauchte Medium mit KSR-FF jeden Tag.
Passagierung menschlichen iPS-Zellen mit KSR-FF
- Beachten Sie die menschliche IPSCs wachsen komplette KSR-FF unter dem Mikroskop, um zu bestätigen, dass die Zellen 70-80% konfluent und bereit, subkultiviert werden. Siehe Abbildung 1.
Hinweis: Wenn Kolonien zu dicht oder zu groß werden, tritt stärkere Differenzierung. - Schneiden Sie und entfernen Sie alle differenzierten iPSC Kolonien vor Passage der Kultur.
- Pre-warm das erforderliche Volumen der Dispase in einem 37 ° C Wasserbad. Siehe Tabelle 1 unten für Details auf den Datenträgern erforderlich.
- Pre-Gleichgewicht das erforderliche Volumen des KSR-FF in einem 37 ° C Wasserbad for15 min. Siehe Tabelle 1 unten für Details auf den Datenträgern erforderlich.
- Saugen Sie das verbrauchte Medium aus dem Kulturgefäß mit einer Pipette, und spülen Sie die Zellen zweimal mit D-PBS.
- Vorsichtig fügen vorgewärmten Dispase-Lösung, um die Kultur Gefäß (z. B. 1 ml Dispase-Lösung pro 60-mm Kulturschale). Swirl das Kulturgefäß zu beschichten die gesamte Zelloberfläche.
- Inkubieren Sie die Behälter bei 37 ° C für 3 Minuten.
- Entfernen Sie das Gefäß aus dem Inkubator, absaugen Dispase-Lösung und vorsichtig waschen der Zellen mit D-PBS.
- Vorsichtig kratzen die Zellen von der Oberfläche der Kulturschale mit einem Zellschaber, und übertragen Sie die Zellen in ein steriles 15 ml Zentrifugenröhrchen.
- Spülen Sie die Kulturschale zweimal mit KSR-FF, sanft "Abspritzen" alle Zellen, die nicht getrennt haben. Pool der Spül-Medium mit den Zellen in der 15 ml Tube.
- Zentrifugieren Sie die Röhrchen bei 200 xg für 5 Minuten bei Raumtemperatur die Zellen zu pelletieren.
- Vorsichtig absaugen der Überstand ohne die Zellpellet und entsorgen Sie sie.
- Gently Flick das Rohr vollständig verdrängen das Zellpellet aus dem Rohrboden.
- Vorsichtig die Zellen in voräquilibriert KSR-FF mit einem 5 ml serologischen Pipette. Nicht verreiben. Hinweis: Es ist entscheidend, um den Schritt in die sanft resuspendieren ohne Anwendung von Gewalt, um Schäden zu vermeiden.
- Übertragen Sie die Zellen in ein frisches 60-mm Geltrex-beschichtete Schale an der gewünschten Teilungsverhältnis und bewegen Sie die Kulturschale hin und her und hin und her mehrere Male, um die Zellen auf ihrer Oberfläche zu verteilen.
- Legen Sie die Kulturschale in einem 37 ° C Inkubator mit einer angefeuchteten Atmosphäre von4 bis 6% CO 2 in Luft.
- Am nächsten Tag sanft ersetzen das verbrauchte Medium mit KSR-FF, um Zelltrümmer zu entfernen. Ersetzen Sie die verbrauchte Medium Alltag danach. Beachten Sie die iPS-Zellen täglich und Passage sie nach Bedarf (ca. alle 4-5 Tage). Passagieren wird empfohlen, wenn die Zellen 70-80% Konfluenz erreichen. Für iPS-Zellen die Kryokonservierung und Auftauen zu unserem Protokoll beziehen sich unter dem Titel "Kryokonservierung und Wiederherstellen von Human iPS-Zellen unter Verwendung Komplette KnockOut Serum Ersatz Feeder-freiem Medium".
Erwartete Ergebnisse
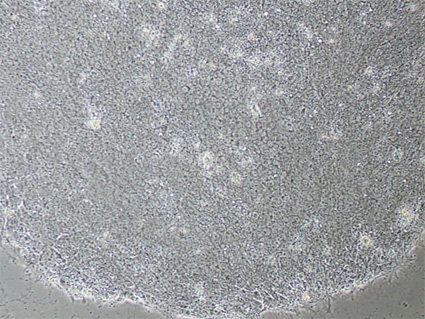
Abbildung 1. Die Phasenkontrast-Abbildung unten zeigt IPSCs auf Geltrex-beschichteten Kulturschalen mit kompletten KnockOut Serum Ersatz Feeder-Free-Medium. Die IPSCs weisen Morphologie ähnlich hESCs, von großen Kernen und wenig Zytoplasma charakterisiert. (40fache Vergrößerung)
| Komponente | 35mm Dish | 60mm Dish | 100mm Dish |
| Komplette KnockOut SR Medium | 2 mL | 4 mL | 10 mL |
| Geltrex Lösung | 1 mL | 1,5 ml | 4-5 ml |
| Dispase | 0,5 ml | 1 mL | 3-4 mL |
| D-PBS für das Spülen | 2 mL | 4 mL | 10 mL |
Tabelle 1. Empfohlene Volumes
Offenlegungen
Materialien
| Name | Company | Catalog Number | Comments |
| Knockout DMEM/F12 | Cat. no. 12660-012 | Note: see appendix for the use of alternative DMEM products | |
| GlutaMAX-I | Cat. No. 35050-061 | ||
| KnockOut Serum Replacement | KnockOut SR, Cat. no. 10828-028 | ||
| KnockOut Serum Replacement Growth Factor Cocktail | KnockOut SR-GFC, Cat. no. A10580-01 | ||
| FGF-basic, human recombinant protein, 10 μg | bFGF, Cat. no. PHG0024 | Note: see appendix for alternative bFGF pack sizes. | |
| 2-Mercapt–thanol | Cat. no. 21985-023 | ||
| Dispase | Cat. no. 17105-041 | Note: see appendix for alternative passaging methods. | |
| Geltrex hESC-Qualified Reduced Growth Factor Basement Matrix, 1 mL | Cat. no. A10480-01 | ||
| Dulbecco’s Phosphate Buffered Saline (D-PBS) without calcium and magnesium | Cat. no. 14190-144 | ||
| Sterile Tissue Culture Hood | |||
| Incubator set at 37°C | |||
| Pipette-Aid | |||
| Water Bath set at 37°C | |||
| Sterile serological pipettes (5 mL, 10 mL) | |||
| Centrifuge | |||
| 15 mL centrifuge tubes | |||
| 60mm Tissue Culture treated dishes |
Referenzen
- Takahashi, K. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Yu, J. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Maherali, N. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Li, W. Generation of rat and human induced pluripotent stem cells by combining genetic reprogramming and chemical inhibitors. Cell Stem Cell. 4, 16-19 (2009).
- Liao, J. Generation of induced pluripotent stem cell lines from adult rat cells. Cell Stem Cell. 4, 11-15 (2009).
- Dimos, J. T. Induced pluripotent stem cells generated from patients with ALS can be differentiated into motor neurons. Science. 321, 1218-1221 (2008).
- Aasen, T. Efficient and rapid generation of induced pluripotent stem cells from human keratinocytes. Nat Biotechnli. 26, 1276-1284 (2008).
- Park, I. H. Generation of human-induced pluripotent stem cells. Nat Protoc. 3, 1180-1186 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten