Method Article
Biomarker in einem Tiermodell für die Aufdeckung Neural, hämatologischen und Behavioral Korrelate der PTSD
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Rattenmodell der Posttraumatischen Belastungsstörung (PTSD), die die anhaltenden Veränderungen im neuroendokrinen Funktion und die verzögerte langfristige, übertriebene Angstreaktion, die charakteristisch für PTBS-Patienten zeigt. Das Tiermodell und hier beschriebenen Methoden sind nützlich zum Korrelieren Biomarkern in Gehirnkernen, die mechanistische sind, aber nicht bei Patienten gemessen werden, wobei Biomarkern in peripheren weißen Blutzellen, welches kann.
Zusammenfassung
Identifizierung von Biomarkern, die die Entwicklung der Pathophysiologie der Posttraumatischen Belastungsstörung (PTSD) ist von entscheidender Bedeutung, nicht nur für eine objektive Diagnose, sondern auch für die Beurteilung der therapeutischen Wirksamkeit und Widerstandsfähigkeit gegen Verletzungen. Kontinuierliche Forschung ist auf die Identifizierung molekularer Biomarker für PTSD, einschließlich traumatischen Stress induzierte Proteine, Transkriptomen genomischer Abweichungen und genetische Modulatoren, mit biologischen Proben von Probanden Blut, Speichel, Urin und postmortalen Hirngewebe geleitet. Allerdings bleibt die Korrelation dieser Biomarker-Moleküle in peripheren oder postmortale Proben auf veränderte Gehirnfunktionen mit psychiatrischen Symptomen in PTSD assoziiert ungelöst. Hier präsentieren wir ein Tiermodell für PTSD in denen sowohl peripheren Blut und zentrales Gehirn Biomarker sowie Verhaltensphänotyp, gesammelt und gemessen werden können, wodurch die erforderliche Korrelation der zentralen Biomarker für PTSD, die mechanistischen und pathogno sindmonic kann aber nicht von Menschen gesammelt werden, mit den peripheren Biomarker und Verhaltensstörungen Phänotypen, die können.
Unser Tiermodell der PTSD beschäftigt Zurückhaltung und tail Schocks für drei aufeinander folgenden Tagen wiederholt - die unausweichliche tail-Schock-Modell (ITS) in Ratten. Das ITS-Modell imitiert die Pathophysiologie der PTSD 17, 7, 4, 10. Wir und andere haben bestätigt, dass die ITS-Modell Verhaltens-und neurobiologische Veränderungen ähnlich denen in PTSD Themen 17, 7, 10, 9 gefunden induziert. Insbesondere weisen diese gestressten Ratten (1) eine verzögerte und Schreckhaftigkeit erscheinen einige Tage nach Stressor Aufhören, das die komprimierte Zeitskala der Ratte das Leben im Vergleich zu einem Menschen gegeben, die ein bis drei Monate Verzögerung der Symptome bei PTBS-Patienten entspricht (DSM-IV-TR PTSD Criterian D / E 13), (2) erweiterte Plasma-Corticosteron (CORT) für mehrere Tage, was darauf hinweist Kompromiss der hypothalamopituitary Achse (HPA), und (3) verzögert body Gewichtszunahme nach Stressor Aufhören, was darauf hinweist Dysfunktion metabolische Regulierung.
Die experimentellen Paradigmen für dieses Modell eingesetzt werden, sind: (1) eine erlernte Hilflosigkeit Paradigmenwechsel in der Ratte durch Messung der akustischen Schreckreaktion (ASR) und einem Charting Körpermasse getestet, (2) Mikrodissektion Gehirn der Ratte in Regionen und Kerne; ( 3) Enzyme-linked Immunosorbent Assay (ELISA) zum Blutspiegel CORT, (4) eine Genexpression Mikroarray sowie zugehörige Bioinformatikwerkzeuge 18. Das Microarray genannt rMNChip, konzentriert sich auf Mitochondrien und Mitochondrien-bezogene nukleare Gene in der Ratte so speziell auf die neuronale Bioenergetik Hypothese in PTSD beteiligt werden.
Protokoll
Ein. Tierische Behavioral Model of PTSD
- Themen: Männliche Albino Sprague Dawley Ratten (Taconic Farms, Derwood, MD) verwendet, Gewichtung 150 bis 200 g zur Zeit der Verabreichung des Stress-Protokoll.
- Messung von Lebensmitteln, Wasseraufnahme und Gewichtszunahme: Bei der Ankunft im Labor Ratten mit einem Gewicht von 100 ± 25 g sind zwei in einem Käfig (: 45x24x20 cm Käfiggröße) untergebracht. Cage padding Substrat (Hackschnitzel) werden zweimal wöchentlich gewechselt. Und die relative Luftfeuchtigkeit (30-70%)-kontrollierten Umgebung einer Woche - auf einer Temperatur (22 ± 4 ° C) Die Tiere werden an einer Reversed 12-Stunden Licht Zyklus (: 1800/0600 und 0600-1800 Lichter auf off) beibehalten vor Experimenten. Wasser und standardmäßigem pelletierten Futter (Harlan (2018) 18% Protein Nagerdiät, Global Diäten, Harlan Teklad) frei in den Heimatkäfige und Körpergewichte werden täglich 3 Tage vor aufgezeichnet, 3 Tage während 3 Tage nach Beendigung der Belastung .
- Akklimatisierung: Ratten werden für drei Tage nach bo eingewöhntth der Tierhaltung und eine akustische Schreckreaktion Kammer. Um sie an die akustische Schreckreaktion Kammer akklimatisieren, werden die Tiere in ihr für 5 min behandelt jeden Tag für drei aufeinander folgende Tage vor den ersten Messungen.
- Gestresst Protokoll: Die Tiere werden in gleicher Weise für jede Gruppe auf ihr Körpergewicht und Baseline Schreckreaktion zugewiesen. Wobei jede Gruppe aus 16 Tieren; Prüfung wird auf zwei Gruppen von Tieren durchgeführt. Gruppe 1 empfängt die Stress-Protokoll, und Gruppe 2 ist die Kontrolle.
Die Stressbelastung Protokoll ist ein durchgehender 2-hr Verfahren, wo jeder Sitzung besteht aus Zurückhaltung ("unausweichliche") und tail-Schocks, wiederholt einmal täglich über 3 aufeinander folgenden Tagen. Betonend, wird am Morgen getan (innerhalb des Fensters von 0800 und 1200). Die Tiere werden durch die in einem belüfteten Plexiglasrohr immobilisiert zurückgehalten. Vierzig Elektroschocks (2 mA, 3 sec Dauer; Animal Test Cage Grid Etage Shocker, Coulbourn Instruments, USA) auf ihren Schwänzen an semi-zufälligen Intervallen von 150 t gelieferto 210 sec (Graphic Staat Notation Software, Habitest Universal Link, Coulbourn Instruments, USA). Stimulation bei 2 mA wurde gewählt, weil es aversive ist, aber nicht schmerzhaft, wenn die stimulierenden Ausgang über den Experimentator Finger platziert wird. Elektroden-Gel wird mittels Wattestäbchen, um eine dünne Schicht aus leitendem Gel zwischen Elektrode und der Haut des Rattenschwanz bilden. Die Elektrodenclips eingestellt sind und mit dem Schwanz, um eine gute Verbindung ohne Beeinträchtigung der Durchblutung des Schwanzes zu gewährleisten. - Acoustic Startle Response (ASR): Acoustic Schreckreaktion Messung wurde mit einer Schreckreaktion Acoustic Test System (Coulbourn Instruments, Columbus, Ohio, USA) 3 durchgeführt. Dieses System besteht aus Gewichts-und Kleinschreibung Plattformen in einer schallgedämpften Kammer. Der Wandler, der ein Dehnungsmesser ist, in jede der Plattformen Schreckreaktion erfordert Kalibrierung vor dem Gebrauch. Erstens muss der Koppler in der gleichspannungsgekoppelten Modus zur Kalibrierung sein. In diesem Modus wird der Koppler-Ausgang didirekt folgt die Eingabe von der Plattform, den Modus zur Kalibrierung mit statischen Gewichte erforderlich. Der Wandler ist mit dem AC-gekoppelten Modus während der Experimente umgeschaltet, so dass nur eine schnelle Veränderung der Kraft, die Schreckreaktion anzeigt, wird ausgegeben. Der Tiere in Reaktion auf Bewegungen Geräuschreize sind somit als eine Spannungsänderung von einem Dehnungsmessstreifen im Inneren jeder Plattform gemessen und als der maximalen Antwortzeit, die innerhalb von 200 ms nach dem Auftreten des Startle-Hervorrufen Stimulus.
Es gibt sechs Arten von Stimulus Studien: 100 dB allein 100 dB mit Pre-Puls, 110 dB allein 110 dB mit Pre-Puls, Vorimpulses allein und ohne Stimulus Kontrolle. Jede Art der Studie wurde acht Mal vorgestellt. Trial-Typen werden in zufälliger Reihenfolge präsentiert, um Effekte und Gewöhnung zu vermeiden. Inter-trial Abständen reichen zufällig 15 bis 25 sek. Unter den acht Versuche nur die Maximalwerte in den Ergebnissen gesammelt und schließlich mit der tierische Körpergewicht des selben Tag angepasst. Tiere werden einen Tag b geprüftevor Stress oder andere Behandlung als Basislinie und 1, 7, 14 und 21 Tage nach dem letzten Tag der aufeinanderfolgenden 3 Tage der Stress Verfahrens oder einer anderen Behandlung. - Datenanalyse:
- ASR: Die Amplitude der akustischen Schreckreaktion getestet jedes Mal als "% des Ausgangswertes", die unter Verwendung der Gleichung wird vertreten:% des Ausgangswertes = (absolute Amplitude / Baseline absolute Amplitude) × 100%. Für jeden Test Tag werden ANOVAs für wiederholte Messungen am Schreckreaktion Amplituden mit Faktoren von Stress-Status und Medikamentendosierung mit SPSS (Version 16) Software durchgeführt. Tukey, Bonferroni oder Dunnett-Tests werden verwendet, um signifikante post-hoc Unterschiede zwischen den einzelnen Gruppen zu bewerten. Die Daten sind dargestellt als Mittelwert ± SEM
- Wachstum: Körpergewicht und Nahrung und Wasser Verbrauch am Tag -1 vorhergehenden Stress und an den Tagen 14, 21 und 30 nach Abschluss der Stress Protokoll gemessen. Statistische Analyse: Futter-und Wasseraufnahme Daten unterzogen ein-Weise wiederholt-Maßnahmen Analyse der Varianz (ANOVA). Um die Änderungen bei der Nahrungsaufnahme sich im Laufe der Zeit zu analysieren, wird die Menge der Nahrungsaufnahme durch das Körpergewicht des Subjekts unterteilt, um die Varianz des Körpergewichts durch die Spannung Protokoll und anfänglichen Unterschied im Körpergewicht zwischen den Gruppen induzierte minimieren. Alle Vorgänge werden im Rahmen der Genehmigung im Einklang mit dem Institutional Animal Care und Use Committee (IACUC) durchgeführt.
2. Gehirn Dissection
- Geräte und Materialien:
- Anästhesie jar: ". Gewürz jar" Dies ist ein Glas mit Deckel, von ca. 6 cm hoch und 5 cm im Durchmesser, wie ein "apothecary jar", "Wattebausch jar" oder
- Guillotine für Ratten, wie sie zB von Kent Scientific.
- Vibratom 1000:
- Cut Rasierklinge in der Mitte längs Waschöl mit Alkohol, stecken in der Klemme.
- Füllen Bad mit gewöhnlichen crushed ice.
- Ortdie Schale in Längsrichtung.
- Wischen Sie die Schale von Feuchtigkeit, bevor ein Tropfen Sekundenkleber.
- Rongeurs (Beispiele sind ein Micro Friedman rongeur von Miltex, cat. Nr. 17-4801 oder eine Pearson rongeur von Fine Science Tools cat. No 16015-17).
- Nr. 3 oder Nr. 5 Juweliere Pinzette (scharf abziehen dura).
- Kleine Schere mit scharfen Spitzen (Vantage V95-304 ist ein Beispiel).
- (2) Flache Edelstahl Mini Spatel, wie verwendet, um pulverförmige Chemikalien zu einer Waagschale zu übertragen. Das breite Ende nach vorne gebogen, so wie zwischen Telencephalon und Schädeldach passen.
- Löffel zum Gehirn Block übertragen. (A Kunststoff Suppenlöffel aus der Cafeteria funktioniert.)
- Skalpell Nr. 10.
- Double Edge Rasierklinge (Stahl):
- Eine Hälfte für Vibratom.
- Eine Hälfte für die Präparation.
- Zwei Glas-Petrischalen, ~ 3,5 Zoll und 4 Zoll im Durchmesser, so dass die ineinander passen. Crushed Eis in der bottom Gericht. Zwei Filterpapiere in der oberen Schale. Bewegen Slice benötigten Positionen, indem das Filterpapier.
- 100 ml Becher.
- Pipette, um Gehirn mit Eis gekühlt Bewässerung eine CSF. (Glas Pasteur Pipette mit schmalen Ende in 1/2 cm breite Latex Glühlampe eingesetzt gut funktioniert.)
- Crushed Eis Fach: Etwa 5 cm hoch, 20 cm lang, 10 cm breit. Enthält:
- Halten Sie alle Instrumente in der crushed ice.
- Low Calcium / hohem Magnesiumgehalt aCSF in Kunststoff-Flasche, die werden knallte kann das Eis brechen.
- Cyanacrylat.
- Low Calcium / hohem Magnesiumgehalt künstlichen Liquor (aCSF):
- In mM: 125 NaCl, 2,5 KCl, 0,5 CaCl 2 · 2H 2 O, 2,0 MgCl 2 * 6H 2 0, 1,2 NaH 2 PO 4 · H 2 O, 25 NaHCO, 11 Glucose.
- In Kunststoff-Flasche, kann knallte das Eis brechen.
- Chill für 20 min in -80 ° C Gefrierschrank, um es in einem Slush machen.
- Wattestäbchen.
- Filterpapier: Whatman 42,5 mm (Art.-Nr. 1001 042.).
- Mini Zentrifugenröhrchen zu sammeln kleinere Abschnitte von Gewebe.
- Wells Platte zu größeren Strukturen und Abschnitte von Gewebe zu sammeln.
- Papiertuch.
- Red biohazard Tasche.
- Anästhesie:
- Anästhesie jar, Gazekompressen, Isofluran, Metall Pinzette, sind in einer Abzugshaube aufgestellt.
- Ratte in der Anästhesie Gefäß gegeben.
- Befeuchten Gaze mit Isofluran und in der Anästhesie jar.
- Warten Sie, bis Pedal Reflex - den Rückzug der Pfote, wenn die Bahn gequetscht mit einer Pinzette - oder Cornealreflex verschwindet.
- Enthaupten: Greifen Ratte mit einer Hand um Brustkorb von hinten, enthaupten Ratte mit Guillotine als in der Nähe in den Hinterkopf wie möglich. Der Atlas wird noch bleiben in der Regel beigefügte auf den Schädel.
- Blutentnahme: Squeeze Ratte in Thorax, um Blut aus spritzt aus Halsschlagadern zu verhindern.Langsam entspannen Griff so den Blutfluss in den Sammelbehälter zu steuern.
- Die Entfernung der Brain:
- Schnell geschnitten Muskeln und alle verbleibenden Wirbeln vom basiocciput mit dem kleinen Schere.
- Mit Rongeur und Anfang am Foramen magnum, schneiden die Hinterhauptkondylen und die basiocciput.
- Midline Kopfhaut Schnitt mit dem Skalpell.
- Mit der Schere, schneiden Sie ein Mitte sagittalen Schnitt in der okzipitalen und parietalen Knochen. Ergreifen des cut-Marge des Schädels mit den rongeurs, brechen sie wieder wie eine Eierschale von der Mittellinie entfernt, wobei darauf geachtet, jeden Kontakt mit dem Gehirn zu minimieren. Die Mittellinie geschnitten und Pause zurück kann in Stufen erfolgen.
- Da das Gehirn weiterhin ausgesetzt wird, ist es kritisch, sie mit Eis gekühlt aCSF begießen um die Integrität und Vitalität der Gewebe zu erhalten.
- Ebenso brechen temporalen und frontalen Knochen.
- Mit feinen Pinzette, reißen die Dura, achten Sie darauf, die gettentorum cerebelli.
- Mit Mini-Spatel unter den Stirnlappen eingesetzt erhöhen das Gehirn aus dem Schädeldach gerade genug, um die Spannung auf der Hirnnerven setzen.
- Transekt die Hirnnerven mit der Schere.
- Heben Sie das Gehirn vollständig aus dem Schädel und fallen lassen in den Becher Eistee niedrigen Calcium / hohem Magnesiumgehalt aCSF. Einen Minuten oder mehr, um so cool, dass das Gewebe fest, werden die Strukturen deutlich sichtbar, und die Gesundheit des Gewebes erhalten bleiben.
- Mit dem Plastiklöffel, übertragen das Gehirn auf das Filterpapier im Eis gekühlt Petrischale Bauchseite auf.
- Dissektion der Brain:
- Machen Sie einen koronalen Durchtrennung mit Rasierklinge an der Arteria cerebri media (Abbildung 2A).
- Speichern Frontallappen vorübergehend in Eis gekühlt niedrigen Calcium / hohem Magnesiumgehalt aCSF in 100 ml Becher.
- Flip Gehirn, so dass die dorsale Oberfläche auf. Transekt den Hirnstamm an der Verbindungsstelle des Mittelhirns einernd diencaphalon. Der resultierende Block wird Gehirns in 2B gesehen.
- Drop the blockiert Großhirns zurück in iced niedrigen Calcium / hohem Magnesiumgehalt aCSF.
- Mit Mini-Spatel, sezieren Kleinhirn von Medulla / Pons. Speichern in den Medien geeignet bestimmt Analyse.
- Bringen Sie das blockiert Großhirns der Petrischale. Mit zwei Filterpapiere, heben das Gehirn, indem ein Filterpapier auf dem ventrum. Damit stellen die hintere Frontalebene des blockierten Cerebrum auf der Kante des zweiten Filterpapier. Mit diesem Filterpapier Ort der anteriore Schnittebene des blockiert Cerebrum auf einen Tropfen auf dem Cyanoacrylat Vibratom Schneidplatte zugewandte Kortikalis die Klinge.
- Mit dem Vibratom, abgeschnitten gerade genug von der Schwanzflosse des Gehirns, so dass die hippcampus zeigt (Abbildung 2C).
- Nehmen Sie einen Abschnitt, 2.400 μ dick in einer 125 g Ratte, 2.700 μ dick 200 g Ratte. Übertragen Sie den Abschnitt mit einem Wattestäbchen auf die Filterpapiere auf der Petrischale(2D).
- Schneiden und speichern Cingulum mit der Rasierklinge.
- Mit einem dentalen Spatel in die distale Kante des Balkens zu schneiden schieben, dann Abziehen der Isocortex.
- Von seiner ventolateral Marge abziehen Hippocampus (Abbildung 2E).
- Speichern Sie das Mittelhirn.
- Nehmen Sie einen zweiten Abschnitt, 2.400 um dick in 120 g Ratte, 2.500 um dick in 200 g Ratte. Setzen Sie den Abschnitt über die Filterpapiere auf der Petrischale (2F). Alternativ könnte fünf Abschnitte 500 um an dieser Stelle für die Elektrophysiologie eingenommen werden.
- Schneiden und speichern Cingulum mit der Rasierklinge.
- Make seitliche Schnitte mit der Rasierklinge in der inneren Kapsel, die Isocortex (2F) zu entfernen.
- Make Schrägschnitte mit der Rasierklinge um die amygdali (2F, G) zu entfernen.
- Erstellen Sie eine Box mit der Rasierklinge geschnitten, um den Hypothalamus zu entfernen. Die seitlicheSchnitte sind lateral der ventromedialen Kern des Hypothalamus, der sichtbar ist. Wir machen den dorsalen Schnitt knapp über dem dritten Ventrikel oder ventralen Tegmentum (2H).
- Schieben Spatel in die Corpus callosum und ziehen Sie das kleine Stück Isocortex an der Hippocampus. Legen Sie das schmale Ende des Spatels ventral der Hippocampus Kommissur und heben dorsal zu ziehen aus den Hippocampus.
- Konservierung von RNA und Protein in den Proben von Hirngewebe und Blut:
- Medien-RNA-Assay:
- Brain: RNAlater RNA-Stabilisierung Reagenz, # 76106 in Eppendorf-Röhrchen.
- Blood: PAXgene Blood RNA Tube (PreAnalytiX, Quagen).
- Medien-Protein (CORT)-Assay aus Blut: Solution d-HBSS, w / o Ca2 + und Mg 2 +, (Quality Biological, Inc.).
- Lagerung:
- Gesammelt Gehirngewebe wird zunächst in einen Korb aus Trockeneis für nicht mehr als 12 Stunden gelagert und dann in einen -70 ° C Gefrierschrankzur Verwendung innerhalb von 6 Monaten, die Dauer der Studie.
- Gesammelte Blut wird über Nacht bei Raumtemperatur zu erlauben Reagenzien zu durchdringen, wonach es in einen -70 ° C Gefrierschrank zur Verwendung innerhalb von 6 Monaten, die Dauer der Studie gespeichert gehalten.
- Medien-RNA-Assay:
3. Gene Microarray der mitochondrialen & Mitochondrien-bezogenen Nuclear Genes
Um rat mitochondrialen Funktionen in Hirngewebe zu untersuchen, haben wir vor kurzem die Ratte Mitochondrium-Neuron fokussierten Mikroarray (rMNChip) und bioinformatische Werkzeuge für die schnelle Identifizierung von differentiellen Wege in Hirngewebe 18 entwickelt. rMNChip enthält 1.500 Genen in der mitochondrialen Funktionen, Stressreaktion, zirkadianen Rhythmen und Signaltransduktion beteiligt. Die Bioinformatik-Tool enthält einen Algorithmus zur Berechnung von differentiell exprimierten Genen und eine Datenbank für die einfache und intuitive Interpretation für Microarray-Ergebnisse.
- Purification von Gesamt-RNA aus dem Gewebe (Cat # GPM-Kit 2011-1, GenProMarkers):
- Rattenhirn Gewebe spezifischer Atomkerne in RNA späteren RNA-Stabilisierung Reagens (Qiagen).
- Tissue (30 mg in 600 ul GPM-L / B-Puffer) Homogenisierung mit Ultra-Turrax T8 Dispergierstation (IKA Labortechnik).
- Zentrifuge in 1,5-ml-Röhrchen bei Sorvall 21.000 rpm für 15 min.
- Dekantieren des Überstandes in ein Spin-Säule mit einem 2-ml-Collection-Tube.
- Zentrifugation der Säule-Röhrchen bei 15.000 UpM für 3 min, die Durchströmung zu verwerfen.
- Fügen Sie 700 ul GPM-B / W-Puffer zu jedem der Spin-Säulen, zentrifugieren Sie die Spalte-Röhrchen bei 16.000 rpm für 15 sec, verwerfen die Durchströmung.
- Hinzufügen 500 ul GPM-W-Puffer zu jedem der Spin-Säulen, zentrifugieren säulenartigen Rohren bei 16.000 Upm für 15 sec, einmal wiederholen.
- Legen Sie die Spin-Säule in ein neues 1,5 ml-Collection-Tube.
- Fügen Sie 30 ul DEPC-behandeltem Wasser zu jeder der Spin-Säulen, bei 16.000 rpm zentrifugieren1 min, einmal wiederholen.
- Messen RNA-Konzentration, stellen Sie die Konzentration auf 1 ug / ul mit DNase-& RNase-freies Wasser, sind die Proben fertig für Microarray-Kennzeichnung.
- Microarray Markierung und Hybridisierung (Cat # Array 900, Genisphere):
- 1,0 ug Gesamt-RNA wird Ratte zur cDNA-Synthese und Microarray Kennzeichnung nach den Anweisungen des Herstellers verwendet.
- Mikroarray-Hybridisierung auf einer rMNChip bei 65 ° C für 12-16 h durchgeführt, wie zuvor beschrieben. 18
- Waschen Hybridisierte Microarray Slides (Cat # GPM0101-6, GenProMarkers):
Waschlösung Volumen 20 X SSC 10% SDS ddH 2 O 0,5 X SSC/0.01 SDS 500 ml 12,5 ml 0,5 ml bis 500 ml 0,5 X SSC 500 ml 12,5 ml auf 500 ml 0,1 X SSC 500 ml 2,5 ml auf 500 ml 0,01 X SSC 500 ml 0,25 ml auf 500 ml
Während des Waschens die Folien sollten vor Licht geschützt werden. Lassen Sie sich nicht Dias trocknen auf jeder Stufe.- Waschen Sie Dias in 250-ml Lösung 1 in einem Glas Coplin (Cat #: 70312-20, Electron Microscopy Sciences, Hatfield, PA) bei Raumtemperatur durch Rühren das Glas auf einem BioShaker (Molecular Technologies Inc., St. Louis, MO ), bis alle der Deckgläser abfallen die Glasobjektträger (Es dauert <3 Minuten).
- Waschen Sie die Slides mit 250-ml Lösung 2 in einem anderen jar durch Schütteln Sie das Glas für 3 min.
- Waschen Sie Objektträger mit 250-ml Lösung 3in einem anderen Gefäß durch Drehen der Behälter für 3 min, Wiederholen dieses Schritts zweimal.
- Waschen Sie Objektträger mit 250-ml Lösung 4 in einem anderen Gefäß für 10 sek. Sofort trocken die Folien durch Zentrifugieren der Gläser auf den PN11779 Platten und ST-H750 Rotor in einer Sorvall Zentrifuge gegeben Super-T21 bei 1000 UpM für 5 min.
- Platzieren der gewaschenen Folien in einem Kasten zum Abtasten so schnell wie möglich.
- Microarray Bild Scan und Analyse mit ScanArray Express Microarray Scanner (PerkinElmer) nach der Bedienungsanleitung und den Schwerpunkt auf:
- Microarray Bildabtastung: Easy Scan vs Scan-Protokoll.
- Auswirkungen der Laserleistung, PMT und Normalisierung Methoden auf Daten Ergebnissen.
- Ausrichtung der GAL-Datei auf Bild.
- Ausrichtung des Spots zu Grids genau.
- Datenanalyse: Die maßgeschneiderten Berechnungsverfahren für Microarray Datenanalyse gehören Microarray Bildauswertung, Datenfilterung, Spotgröße Korrektur, Integration, normalization und Vergleich, wie zuvor beschrieben 18. Darüber hinaus sind die Verfahren für die Ontologie, Weg und Netzwerkanalysen dieselben wie zuvor, um die Erzeugung der reproduzierbaren Ergebnissen und überprüfbar Mikroarray 2, 22, 25, 19, 20, 8, 23, 18 sicherzustellen, beschrieben.
4. Blood Sample Collection und Plasma CORT Konzentrationsmessung
- Pre-oder Post-Stress-tail Blutproben von narkotisierten Tiere werden am Tag-1 gesammelt, 14, 21 und 30 in heparinisierten Röhrchen zur Bestimmung der zirkulierenden CORT Ebenen.
- Trunk Blutproben werden auch in heparinisierten Röhrchen gesammelt, nachdem die Tiere eingeschläfert werden. Plasma extrahiert wird und bei -70 ° C bis zur Analyse.
- Medien für Plasma-Extraktion:
- Blutproben zur RNA-Extraktion werden gesammelt, indem PAXgene Blood RNA Röhrchen (PreAnalytiX, Quagen)
- Blutproben zur DNA-Extraktion werden gesammelt, indem PAXgene Blood DNA Röhren (PreAnalytiX, Quagen).
- Blutproben für Protein-Analyse werden mittels Lithium Heparin Capillary Collection Tube (200 ul) aus MaketLab # ML5601.
- Plasma CORT Konzentration getestet und mit Active Rat Cort EIA (Diagnostic Systems Labs Inc. analysiert http://www.beckmancoulter.com/ ) wie folgt:
- Markieren die Mikrotitrationsstreifen verwendet werden.
- Bereiten Rat CORT Enzymkonjugat durch Verdünnen Rat CORT Enzymkonjugat Konzentrat in der Konjugatdiluent.
- Je 25 ul Standards, Kontrollen und Proben in die Vertiefungen.
- Fügen Sie 100 ul Enzymkonjugat-Lösung in jede Vertiefung mit einem halbautomatischen Dispenser. Klopfen Sie leicht die gut Halterung 5-10 sec.
- Fügen Sie 100 ul Rat CORT Antiserum in jede Vertiefung mit einem halbautomatischen Dispenser.
- Die Vertiefungen bei Raumtemperatur, 25 ° C, auf einem Schüttler bei 500 bis 700 Upm für 60 min.
- Absaugen und waschen jedes well 5-mal mit Waschlösung mit einem automatischen Waschgerät. Trockentupfen von Platte auf einer saugfähigen Material.
- Fügen Sie 100 ul der TMB Chromogen Lösung zu jedem Well mit einem halbautomatischen Dispenser.
- Bei Raumtemperatur 15-20 min auf einem Mikrotiterplatten-Schüttler bei 500-700 rpm eingestellt. Sehen Sie sich das Farbwechsel.
- Fügen Sie 100 ul Stopplösung in jede Vertiefung mit einem halbautomatischen Dispenser.
- Schütteln Platte von Hand 5-10 sec.
- Die Absorption der Lösung in dem Bohrloch innerhalb von 30 min.
- Filter bei 450 nm eingestellt. * EIA-Kits können auch Immunbiologische Laboratories (erworben werden www.ibl-america.com ).
5. Repräsentative Ergebnisse
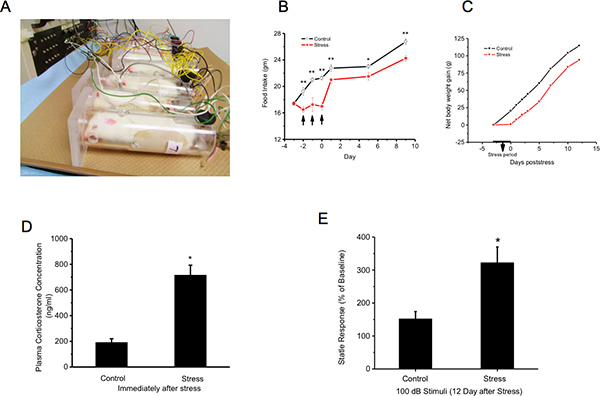
Abbildung 1. Ratten werden zurückgehalten und ausgesetzt tail Schock. Nachfolgende KörpergewichtSind Plasma-Corticosteron-Konzentration und akustische Schreckreaktion gemessen A:. Stress Exposure: Die Tiere werden durch die in einem gut belüfteten Plexiglasrohr immobilisiert zurückhaltend. Vierzig Elektroschocks (2 mA, 3 sec Dauer ;) werden ihre Schwänze in semi-zufälligen Abständen von 150 bis 210 sec B und C geliefert:. Stress verzögert Zunahme des Körpergewichts während des Wachstums: Das Körpergewicht und die Lebensmittel-und Wasserverbrauch gemessen unmittelbar vor der Belastung (Tag -3), am Tag der drei Tage von Stress und dann jeden zweiten Tag dort nach bis zum Tag 14. Der Mangel an Gewinn des Körpergewichts bei Stress ist nie entschädigt D:.. Stress erhöht Plasma-Corticosteron-Konzentration E: Acoustic Startle: Tiere werden einen Tag vor Stress (Tag-1) als Basislinie und 12 Tage lang getestet nach dem letzten Tag der die Folge von 3 Tagen nach dem Stress. Daten für jede Gruppe - Stress und Kontrolle - sind als Prozent der akustischen Ausdruckerschrecken am Tag 12 bezogen auf den Tag -1. Stress erhöht deutlich die akustische Schreckreaktion. Klicken Sie hier für eine größere Abbildung zu sehen .
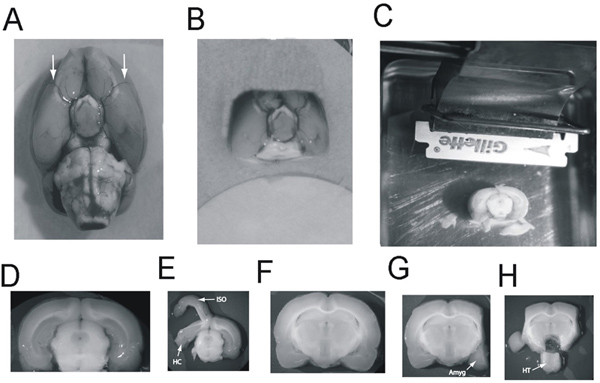
Abbildung 2 Dissection der Amygdala, Hippocampus und Hypothalamus des Gehirns Scheibe A:.. Rattenhirn, ventral: Pfeile zeigen auf die mittleren Hirnarterien B:. Das Gehirn blockieren, ventral, bereit, auf der Vibratom transportiert werden. C: Das Gehirn Block geklebt, um die Vibratom Tablett, kaudalen Seite nach oben Cortex mit Blick auf die Klinge. Die Schwanzflosse Gehirn wurde bereits entfernt Aussetzen der kaudalen Hippocampus geschnitten. Der Block ist nun für die 2500 um Scheiben, die den größeren Teil des Hippocampus zu treffenden D bereit:. Die 2.500 um dicke Scheibe mit der Schwanzflosse Hippocampus E:. Ter Isocortex (ISO) von der Hippocampus (HC) und des Hippocampus aus der Mittelhirn geschält geschält F:.. Die 2500 um dicke Schicht enthaltend die Amygdala und die rostralen Hippocampus G: Die Isocortex wurde ausgeschnitten und der Amygdala (Amyg) resezierten . H:. Der Hypothalamus (HT) wird ausgeschnitten und verdrängt Klicken Sie hier für eine größere Abbildung zu sehen .
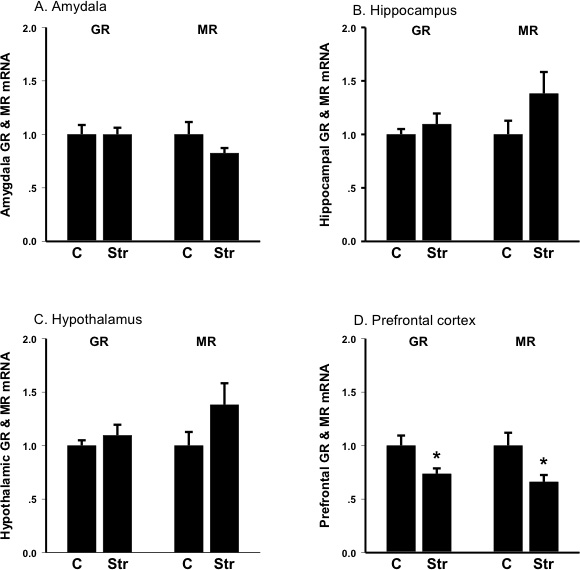
Abbildung 3. Expressionsniveaus für mRNA des Glucocorticoid-Rezeptor (GR) und minerocorticoid Rezeptor (MR) in der Amygdala, Hippocampus, Hypothalamus und frontalen Kortex vor (C, Kontrolle) und nach (Str) Tail-Schockbelastungen. Die Einheiten sind Teil der Kontrolle; Bars sind SEM A: Amygdala: Stress verringert minerocorticoid Rezeptor-mRNA-Expression B: Hippocampus: Stress Increa.ses minerocorticoid Rezeptor-mRNA-Expression C:. Hypothalamus:. Stress erhöht minerocorticoid Rezeptor-mRNA-Expression D: Frontal Cortex: Stress verringert Glucocorticoid-Rezeptor-mRNA-Expression als auch minerocorticoid Rezeptor-mRNA-Expression.
| Die (121bp) PCR-Primer für Ratten GR sind: | 1f.CCACTGCAGGAGTCTCACAA 1rAACACCTCGGGTTCAATCAC |
| Die (99 bp) PCR-Primer für Ratten MR sind: | 1f.GCCTTCAGCTATGCCACTTC 1rAACGTCGTGAGCACCTTTCT |
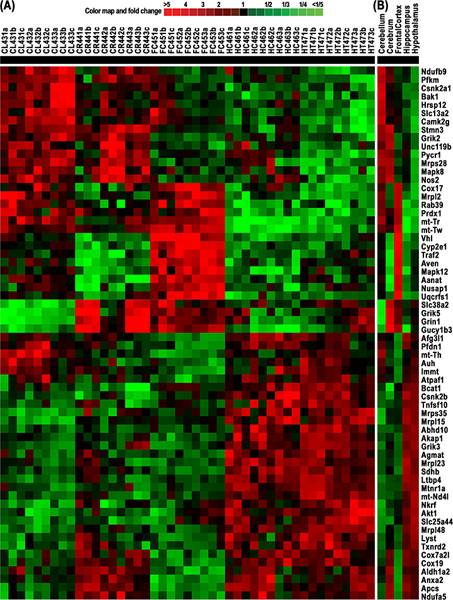
Abbildung 4. Cluster und Heatmap von RNA differentiell exprimierten Genen ab 64 aus 5 Rattenhirn Geweben stammen, einschließlich Kleinhirn (CL), Cerebrum (CR), frontalen Cortex (FC), Hypothalamus (HT) und Hippocampus (HC). Farbe Karte zeigt fache Veränderungen in dEigene-(Grün) und bis-(rot) exprimierten Genen. (A)-Cluster und Heatmap der normierten Signalintensitäten 9 Messungen für jedes der Gene aus 64 15 Mikroarray-Experimenten für diese fünf Gehirngewebe abgeleitet sind. Die Expression von jedem Gen wurde von technischen Triplikaten und experimentelle Triplikaten gemessen. (B)-Cluster und Heatmap der mittleren Niveaus dieser RNA 9 Messungen von jeder der 64 Gene. Diese Ergebnisse zeigen deutliche Unterschiede in der mitochondrialen Genexpression und damit verwandte Funktionen, die unsere Hypothese, dass verschiedene Hirnregionen unterschiedlichen Energiebedarf haben. Klicken Sie hier für eine größere Abbildung zu sehen .
Unsere Anwendung des rMNChip und bioinformatische Werkzeuge führte zur Identifikation eines Clusters und Heatmap von 64 Genen, die mit differentiell exprimierten RNA von 5 Rattenhirn Gewebe einschließlich Kleinhirn (CL), Großhirn (CR), frontalen Kortex (FC), Hypothalamus abgeleitetLamus (HT) und Hippocampus (HC) (Abbildung 4). Diese Daten demonstrieren die deutlichen Unterschiede in der mitochondrialen Genexpression und somit Funktionen. Die Ergebnisse zeigen, dass die verschiedenen Hirnregionen unterschiedlich viel Energie verlangen, um die Durchführung entsprechender Hirnfunktionen.
Diskussion
Die Diagnose PTSD auf selbst berichtete psychiatrische Symptome (DSM IV) von potenziellen Probanden. Kein gut definierten Biomarker ist derzeit die pathophysiologischen Status potenzieller PTBS-Patienten zugreifen. PTBS ist eine Erkrankung, die durch lebensbedrohlichen traumatischen Ereignisse und die wichtigsten psychiatrischen Symptome vorhanden bleiben die Hinterbliebenenversorgung Leben für Monate oder sogar Jahre nach den ersten Ereignisse hervorgerufen werden. Die prominentesten und beharrlicher Symptome bei Patienten mit PTSD enthüllt werden Hypervigilanz, verzögert Schreckhaftigkeit 14, 15, 16 und eine scheinbare Kompromiss der HPA-Achse. Beim Menschen sind diese Symptome bleiben, oder erscheint mit einer Verzögerung von drei Monaten nach Beendigung der traumatischen Stressor 24. Unser aktuelles Modell für Biomarker-Studien von PTBS beschäftigt Zurückhaltung und tail Schocks für drei aufeinander folgenden Tagen (2-hr-Sitzungen von 40, 2 mA tailshocks) wiederholt - die unausweichliche tail-Schock-Modell (ITS) in Ratten mit einem Gewicht 150 Gramm. Das ITS-Modell hatwurde gezeigt, dass zu einem wesentlichen Teil die Pathophysiologie von PTSD 17, 7, 4, 10 zu imitieren. Unsere Labor-und anderen Labors überprüft haben, dass die ITS-Modell von Stress bei Ratten Verhaltens-und neurobiologische Veränderungen, die ähnlich denen in PTSD Themen 17, 7, 10, 9 gefunden werden induziert. Insbesondere weisen diese gestressten Ratten (1) eine verzögerte und Schreckhaftigkeit erscheinen einige Tage nach Stressor Aufhören, das die komprimierte Zeitskala der Ratte das Leben im Vergleich zu einem Menschen gegeben, die ein bis drei Monate Verzögerung der Symptome bei PTBS-Patienten entspricht (DSM-IV-TR PTSD Criterian D / E 13), (2) erweiterte Plasma-Corticosteron (CORT) für mehrere (10) Tagen, was darauf hinweist Kompromiss der hypothalamopituitary Achse (HPA), und (3) verzögert Gewichtszunahme nach dem Stressor Aufhören, entsprechend der Dysfunktion der metabolische Regulation von PTSD. Es gibt keine Beweise in der Literatur, dass fox Geruch, Raubtier Exposition oder potenzierten Schreckreaktion, Ausstellungen fürchtenBit diese persistenten Verhaltens-und neuroendocrinologic Phänotypen mit PTSD assoziiert.
Ratten, die einem Stress-Sitzung (1DS) ausgestellt haben vergänglich, nicht aber die anhaltenden Störungen durch 3DS Ratten 17 angezeigt Das vorliegende Experiment die Schreckreaktion des 3DS und 1DS Ratten 4, 7 und 10 Tage nach der Stressor Aufhören verglichen. Im Einklang mit früheren Arbeiten, betonte Ratten zeigten erhöhte basale Plasma-CORT Ebenen den ersten Tag nach der Belastung 17. Diese Werte waren CORT empfindlich auf die Anzahl der Stressor Belichtungen mit höheren Ebenen in CORT 3DS Ratten als in 1DS Ratten. Wie für Schreckreaktion weisen die 1DS Ratten eine Schreckhaftigkeit 7 Tage nach der Stressor, während Schreckreaktion Sensibilisierung zeigt sich erst 10 Tage nach der Stressor in 3DS Ratten. Somit scheint die Erscheinung eines Schreckhaftigkeit nach Stressor Aufhören zu der Anzahl von Stress-Sitzung Engagements bezogen werden. Der 3DS gestresste Modell scheintnützlich sein, um einen Einblick in die veränderte Expression von Biomarkern mit den Symptomen von PTBS und die wichtigsten messbaren Verhaltens Phänotypen mit dem Timing nach der Einstellung von Stress assoziiert zu gewinnen. Genomic vorgestellten Ergebnisse liefern proof of principle für die Anwendung rMNChip und Bioinformatik Tools zur Differential-Bahnen sowie Gen-und Protein-Biomarkern, die erheblich erleichtern wird systembiologischen Untersuchung und das Verständnis der zugrunde liegenden molekularen Mechanismen komplex und multifaktoriell neurologischen Erkrankungen, einschließlich PTSD zu identifizieren.
Während unser Paradigma nicht in die kognitiven und komplexere Verhaltensweisen von PTBS befassen, stellen wir fest, dass die veränderten Schlaf-Muster in der ITS-Modell 1 auf die Schwierigkeit fallen und durchzuschlafen und die Alpträume von PTBS-Patienten 11 (DSM-IV-TR PTSD entsprechen Kriterien D 13), und die Mängel in Flucht / Vermeidung und Lernen eines appetitive Aufgabe in der ITS-Modell 12 entspricht den armen Konzentrationen und Gedächtnisstörungen von PTBS 5 (DSM-IV-TR PTSD Kriterien C 13). Das aktuelle Modell korreliert gut mit den wichtigsten charakteristischen Symptome von PTSD und bietet ein gutes Modell für die Korrelation peripheren Biomarker für PTSD, die von Patienten gesammelt werden können, mit zentraler, mechanistische Biomarkern, die nicht 6.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der CDMRP, USUHS Grants G188LE, G188MG und G188QC (HL) und die USUHS Zentrum für das Studium der Traumatic Stress unterstützt.
Referenzen
- Adrien, J., Dugovic, C., Martin, P. Sleep-wakefulness patterns in the helpless rat. Physiol. Behav. 49, 257-262 (1991).
- Bai, X., Wu, J., Zhang, Q., Alesci, S., Manoli, I., Blackman, M. R., Chrousos, G. P., Goldstein, A. L., Rennert, O. M., Su, Y. A. Third-generation human mitochondria-focused cDNA microarray and its bioinformatic tools for analysis of gene expression. Biotechniques. 42, 365-375 (2007).
- Blaszczyk, J. W. Startle response to short acoustic stimuli in rats. Acta Neurobiol. Exp. (Wars.). 63, 25-30 (2003).
- Braga, M. F., roniadou-Anderjaska, V., Manion, S. T., Hough, C. J., Li, H. Stress impairs alpha(1A) adrenoceptor-mediated noradrenergic facilitation of GABAergic transmission in the basolateral amygdala. Neuropsychopharmacology. 29, 45-58 (2004).
- Bremner, J. D., Vythilingam, M., Vermetten, E., Anderson, G., Newcomer, J. W., Charney, D. S. Effects of glucocorticoids on declarative memory function in major depression. Biol. Psychiatry. 55, 811-815 (2004).
- Garrick, T., Morrow, N., Eth, S., Marciano, D., Shalev, A. Psychophysiologic parameters of traumatic stress disorder in rats. Ann. N.Y. Acad. Sci. 821, 533-537 (1997).
- Garrick, T., Morrow, N., Shalev, A. Y., Eth, S. Stress-induced enhancement of auditory startle: an animal model of posttraumatic stress disorder. Psychiatry. 64, 346-354 (2001).
- Hsiao, Y. H., Su, Y. A., Tsai, H. D., Mason, J. T., Chou, M. C., Man, Y. G. Increased invasiveness and aggressiveness in breast epithelia with cytoplasmic p63 expression. Int. J. Biol. Sci. 6, 428-442 (2010).
- Jiang, X., Xing, G., Yang, C., Verma, A., Zhang, L., Li, H. Stress Impairs 5-HT(2A) Receptor-Mediated Serotonergic Facilitation of GABA Release in Juvenile Rat Basolateral Amygdala. Neuropsychopharmacology. , (2008).
- Jiang, X., Zhang, Z. J., Zhang, S., Gamble, E. H., Jia, M., Ursano, R. J., Li, H. 5-HT2A receptor antagonism by MDL 11,939 during inescapable stress prevents subsequent exaggeration of acoustic startle response and reduced body weight in rats. J. Psychopharmacol. , (2009).
- Maher, H. K. Sleep deprivation: are you a victim. AAOHN. J. 54, 548 (2006).
- Maier, S. F. Exposure to the stressor environment prevents the temporal dissipation of behavioral depression/learned helplessness. Biol. Psychiatry. 49, 763-773 (2001).
- North, C. S., Suris, A. M., Davis, M., Smith, R. P. Toward validation of the diagnosis of posttraumatic stress disorder. Am. J. Psychiatry. 166, 34-41 (2009).
- Orr, S. P., Metzger, L. J., Pitman, R. K. Psychophysiology of post-traumatic stress disorder. Psychiatr. Clin. North Am. 25, 271-293 (2002).
- Orr, S. P., Roth, W. T. Psychophysiological assessment: clinical applications for PTSD. J. Affect. Disord. 61, 225-240 (2000).
- Pitman, R. K., Orr, S. P., Shalev, A. Y., Metzger, L. J., Mellman, T. A. Psychophysiological alterations in post-traumatic stress disorder. Semin. Clin. Neuropsychiatry. 4, 234-241 (1999).
- Servatius, R. J., Ottenweller, J. E., Natelson, B. H. Delayed startle sensitization distinguishes rats exposed to one or three stress sessions: Further evidence toward an animal model of PTSD. Biological Psychiatry. 38, 539-546 (1995).
- Su, Y. A., Zhang, Q., Su, D. M., Tang, M. X. Rat Mitochondrion-Neuron Focused Microarray (rMNChip) and Bioinformatics Tools for Rapid Identification of Differential Pathways in Brain Tissues. Int. J. Biol. Sci. 7, 308-322 (2011).
- Su, D. M., Zhang, Q., Wang, X., He, P., Zhu, Y. J., Zhao, J., Rennert, O. M., Su, Y. A. Two types of human malignant melanoma cell lines revealed by expression patterns of mitochondrial and survival-apoptosis genes: implications for malignant melanoma therapy. Mol. Cancer Ther. , (2009).
- Su, Y. A., Li, H., He, P., Webster, M. J., Zhang, Q., Zhang, L., Wang, X., Su, D. M., Ursano, R. J., Rennert, O. M. Identification of stress-responsive genes, canonical pathways, molecular networks and drug targets in brain tissues of human and animals for systems-biology study of post-traumatic stress disorder. , (2009).
- Su, Y. A., Wu, J., Zhang, L., Zhang, Q., Su, D. M., He, P., Wang, B. D., Li, H., Webster, M. J., Rennert, O. M., Ursano, R. J. Dysregulated mitochondrial genes and networks with drug targets in postmortem brain of patients with posttraumatic stress disorder (PTSD) revealed by human mitochondria-focused cDNA microarrays. Int. J Biol. Sci. 4, 223-235 (2008).
- Su, Y. A., Yang, J., Tao, L., Nguyen, H., He, P. Undetectable and Decreased Expression of KIAA1949 (Phostensin) Encoded on Chromosome 6p21.33 in Human Breast Cancers Revealed by Transcriptome Analysis. J. Cancer. 1, 38-50 (2010).
- Yehuda, R., Yang, R. K., Buchsbaum, M. S., Golier, J. A. Alterations in cortisol negative feedback inhibition as examined using the ACTH response to cortisol administration in PTSD. Psychoneuroendocrinology. 31, 447-451 (2006).
- Zhang, Q., Wu, J., Nguyen, A., Wang, B. D., He, P., Laurent, G. S., Rennert, O. M., Su, A. Molecular mechanism underlying differential apoptosis between human melanoma cell lines UACC903 and UACC903(+6) revealed by mitochondria-focused cDNA microarrays. Apoptosis. 13, 993-1004 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten