Method Article
Биомаркеры в животной модели для выявления нервных, гематологических, и поведенческие корреляты посттравматического стрессового расстройства
В этой статье
Резюме
Мы описываем крысиной модели посттравматического стрессового расстройства (ПТСР), что свидетельствует о стойких изменений в нейроэндокринной функции и задержка долгосрочные, преувеличенная реакция страха, характерные для посттравматического стрессового расстройства пациентов. Животной модели и методы, описанные здесь, являются полезными для корреляции биомаркеров в мозге ядер, которые механистической, но не могут быть измерены у пациентов с биомаркеров в периферической крови клеток белой, которая может.
Аннотация
Identification of biomarkers representing the evolution of the pathophysiology of Post Traumatic Stress Disorder (PTSD) is vitally important, not only for objective diagnosis but also for the evaluation of therapeutic efficacy and resilience to trauma. Ongoing research is directed at identifying molecular biomarkers for PTSD, including traumatic stress induced proteins, transcriptomes, genomic variances and genetic modulators, using biologic samples from subjects' blood, saliva, urine, and postmortem brain tissues. However, the correlation of these biomarker molecules in peripheral or postmortem samples to altered brain functions associated with psychiatric symptoms in PTSD remains unresolved. Here, we present an animal model of PTSD in which both peripheral blood and central brain biomarkers, as well as behavioral phenotype, can be collected and measured, thus providing the needed correlation of the central biomarkers of PTSD, which are mechanistic and pathognomonic but cannot be collected from people, with the peripheral biomarkers and behavioral phenotypes, which can.
Our animal model of PTSD employs restraint and tail shocks repeated for three continuous days - the inescapable tail-shock model (ITS) in rats. This ITS model mimics the pathophysiology of PTSD 17, 7, 4, 10. We and others have verified that the ITS model induces behavioral and neurobiological alterations similar to those found in PTSD subjects 17, 7, 10, 9. Specifically, these stressed rats exhibit (1) a delayed and exaggerated startle response appearing several days after stressor cessation, which given the compressed time scale of the rat's life compared to a humans, corresponds to the one to three months delay of symptoms in PTSD patients (DSM-IV-TR PTSD Criterian D/E 13), (2) enhanced plasma corticosterone (CORT) for several days, indicating compromise of the hypothalamopituitary axis (HPA), and (3) retarded body weight gain after stressor cessation, indicating dysfunction of metabolic regulation.
The experimental paradigms employed for this model are: (1) a learned helplessness paradigm in the rat assayed by measurement of acoustic startle response (ASR) and a charting of body mass; (2) microdissection of the rat brain into regions and nuclei; (3) enzyme-linked immunosorbent assay (ELISA) for blood levels of CORT; (4) a gene expression microarray plus related bioinformatics tools 18. This microarray, dubbed rMNChip, focuses on mitochondrial and mitochondria-related nuclear genes in the rat so as to specifically address the neuronal bioenergetics hypothesized to be involved in PTSD.
протокол
1. Животное поведенческой модели посттравматического стрессового расстройства
- Темы: Мужской альбиноса Sprague Dawley крыс (Taconic Farms, Derwood, MD) используются, весом от 150 до 200 г в момент администрация стресс протокол.
- Измерение пищи, потребление воды и увеличение массы тела: По прибытии в лабораторных крысах массой 100 ± 25 г размещены два клетку (клетка размер: 45x24x20 см). Подложки Кейдж обивка (щепа) меняются два раза в неделю. Животные ведутся на основе обратного 12-часов света цикла (огни: 1800/0600 и выключения: 0600-1800) при температуре (22 ± 4 ° C) - и относительной влажности воздуха (30-70%)-контролируемой среде неделю Перед экспериментами. Вода и стандартные гранулированные чау (Harlan (2018) 18% белковой диеты грызунов, Global диеты, Харлан Teklad) находятся в свободном доступе в домашних клетках, и bodyweights записываются ежедневно 3 дней до 3 дней во время и 3 дня после прекращения стресса .
- Акклиматизация: Крысы приспособились в течение трех дней, чтобы бого объекта животного и акустической камере испуга. Чтобы акклиматизироваться их в акустической камере испуга, животных, обрабатываются в нем в течение 5 минут каждый день в течение трех последовательных дней до начального измерения.
- Подчеркнул протокола: животные в равной степени присваивается каждой группы в зависимости от их массы тела и ответа базовой испуга. Тестирование проводится по двум группам животных, и каждая группа, состоящая из 16 животных. Группа 1 получает стресс протокол, и группа 2 является контроль.
Протокол воздействия стресса является непрерывным 2-ч процедура, где каждая сессия состоит из сдержанность ("неизбежный") и хвост потрясений, повторяется один раз в день в течение 3 дней подряд. Подчеркивая это делается в первой половине дня (в окне 0800 и 1200). Животные сдерживается, иммобилизованные в проветриваемом оргстекло трубы. Сорок электрическим током (2 мА, 3 сек продолжительность; Animal Test Кейдж сетки этаж Shocker, Coulbourn Instruments, США) доставляются на хвосты в полу-случайных интервалов 150 тØ 210 сек (графическое программное обеспечение обозначения государства, Habitest Универсальный Link, Coulbourn Instruments, США). Стимуляция на 2 мА было выбрано потому, что это отвращение, но не больно, когда стимулирующие выход помещается на пальце экспериментатора. Электрод гель наносится с использованием Q-наконечник для формирования тонкого слоя проводящий гель между электродами и кожей хвоста крысы. Электрод клипы настроены и подключены к хвосту, чтобы обеспечить хорошую связь, не влияя на циркуляцию крови хвоста. - Акустическая ответ испуга (ASR): Acoustic измерений ответ испуг был проведен с испуга Акустическая система тестирования (Coulbourn Instruments, Колумбус, Огайо, США) 3. Эта система состоит из веса чувствительной платформ в звуковом ослабленных камеры. Преобразователь, который является тензодатчик, в каждом из испуга платформ требуется калибровка перед использованием. Во-первых, муфта должна быть в режиме по постоянному току для калибровки. В этом режиме выходной ответвитель-ди-rectly следующем входе с платформы, режим необходимые для калибровки со статическим весом. Преобразователь переключается в режим переменному току во время экспериментов, так что только быстрое изменение в силе, что свидетельствует о реакции испуга, это выход. Движениях животных в ответ на звуковые раздражители, таким образом, определяется как изменение напряжения на тензометрических внутри каждой платформы и регистрируется в качестве максимальной реакции, происходящие в течение 200 мс наступления испуга, выявление стимулов.
Есть шесть типов стимулов испытаний: 100 дБ в одиночку, 100 дБ с предварительным импульсом, 110 дБ в одиночку, 110 дБ с предварительным импульсом, предварительный импульс в одиночку и нет стимула управления. Каждое испытание типа было представлено восемь раз. Судебная типы представлены в случайном порядке, чтобы избежать порядок эффектов и привыкания. Inter-суд интервалов в диапазоне случайно от 15 до 25 сек. Среди восьми испытаний только максимальные значения собраны в результатах и, наконец, согласованы с весом тела животного того же дня. Животные испытывают один день бEfore стресс или другие методы лечения, как чтение базового и 1, 7, 14 и 21 дней после последнего дня 3 дня последовательных процедур стресс или иное лечение. - Анализ данных:
- ASR: амплитуда акустической реакции испуга проверяются каждый раз, представлено как "% от базового", который рассчитывается по следующей формуле:% от базовой = (абсолютная амплитуда / исходная абсолютная амплитуда) × 100%. Для каждого теста день, ANOVAs для повторных измерений выполняется на испуга амплитуды с факторами состояния стресса и дозы лекарства использованием SPSS (версия 16) программное обеспечение. Таки, Бонферрони, или Dunnett тесты используются для оценки значительного пост-специальных различия между отдельными группами. Данные представлены как среднее ± SEM
- Рост: Вес тела и потребление корма и воды измеряется на День -1 предыдущего стресса и в дни 14, 21 и 30 после завершения стресс протокол. Статистический анализ: данные Продовольственной и водозабора подвергается однапутем повторных измерений дисперсионного анализа (ANOVA). Для анализа изменений в пищу норма потребления с течением времени, количество пищи делится на массу тела субъекта свести к минимуму различия в массе тела индуцированной стрессом и протокол начальной разницей в массе тела между группами. Все процедуры проводятся под утверждение в соответствии с Институциональные уходу и использованию животных комитета (IACUC).
2. Мозг Dissection
- Инструменты и материалы:
- Анестезия банка: ". Приправы банку" Это стеклянную банку с крышкой, размером около 6 дюймов в высоту и 5 см в диаметре, таких как "Аптекарь банки", "ватным тампоном банку», или
- Гильотина для крыс, такие как поставляемые Kent Scientific.
- Vibratome 1000:
- Отрежьте лезвием бритвы в половине продольно, мыть нефти у спиртом, вставить в зажим.
- Заполните ванну с обычной колотый лед.
- Местолотка в продольном направлении.
- Протрите лоток влаги перед размещением капли цианоакрилата.
- Rongeurs (Примеры Micro Фридман Rongeur от Miltex, кот. Нет. 17-4801 или Rongeur Пирсон из тонкой кошка науки Tools. Нет 16015-17).
- № 3 или № 5 ювелиры щипцы (резкое снять оболочку).
- Маленькие ножницы с острыми концами (Vantage V95-304 является примером).
- (2) плоский из нержавеющей стали мини-шпатели, таких, как используется для передачи порошкообразных химических веществ на весах. Широкий конец наклонен вперед таким образом, чтобы соответствовать между конечного мозга и черепа.
- Ложка для передачи мозгу блока. (Пластмассовую ложку супа из столовой работает отлично.)
- Скальпель № 10.
- Двухместный лезвие края (углеродистая сталь):
- Одна половина для Vibratome.
- Одна половина для вскрытия.
- Две стеклянные чашки Петри, ~ 3,5 дюйма и 4 дюйма в диаметре, так что один помещается внутри другой. Дробленый лед в бottom блюдо. Два фильтровальной бумаги в верхнем блюдо. Переместить фрагмент в требуемое положение путем перемещения фильтровальной бумаги.
- 100 мл стакан.
- Пипетки для орошения мозга со льдом охлажденным CSF. (Стекло пипетки Пастера с узким концом вставляется в 1/2 дюйма шириной лампы латекса работает хорошо.)
- Щебень для льда: около 5 дюймов, 20 дюймов в длину, 10 см в ширину. Содержит:
- Придерживайтесь всех инструментов в колотый лед.
- Низкий кальций / магний высокой ACSF в пластиковые бутылки, которые могут быть ударил раздавить лед.
- Цианакрилатный.
- Низкий кальций / магний высокой искусственной цереброспинальной жидкости (ACSF):
- В мм: 125 NaCl, 2,5 KCl, 0,5 CaCl 2 * 2H 2 O, 2,0 MgCl 2 * 6H 2 0, 1,2 NaH 2 PO 4 * H 2 O, 25 NaHCO, 11 Глюкоза.
- В пластиковой бутылке, которую можно ударилась раздавить лед.
- Холод в течение 20 мин -80 ° C морозильник, чтобы превратить его в слякоть.
- Ватные тампоны.
- Фильтр бумаги: ватман 42,5 мм (Cat не 1 001 042.).
- Мини пробирки для сбора меньшие участки ткани.
- Wells пластины для сбора крупных структур и слоев ткани.
- Бумажные полотенца.
- Красный биологической сумку.
- Анестезия:
- Анестезия банку, марлевые прокладки, изофлурана, металлические щипцы, расположены в вытяжном шкафу.
- Крыса находится в анестезии банку.
- Смочите марлевую прокладку изофлураном и место в анестезии банку.
- Подождите, пока педаль рефлекс - вывод лапу, когда веб-зажимается щипцами - или роговицы рефлекс исчезает.
- Обезглавьте: Схватив крысу с одной стороны, вокруг грудной клетки сзади, обезглавить крысу с гильотиной как можно ближе к затылку, как это возможно. Атлас будет по-прежнему остаются обычно прилагается к черепу.
- Кровь Коллекция: Squeeze крыс в грудной клетке, чтобы предотвратить кровь из бьющей из сонных артерий.Постепенно расслабить захват так, чтобы регулировать поток крови в коллекцию контейнер.
- Вынос мозга:
- Быстро сокращать мышцы и позвонки оставшиеся от basiocciput с небольшими ножницами.
- Использование Rongeur и начала на затылочного отверстия, срезаем затылочных мыщелков и basiocciput.
- Срединный разрез кожи головы с скальпеля.
- Используя ножницы, вырезать середину сагиттальный разрез в затылочной и теменной костей. Схватив сокращение маржи черепа с rongeurs, разбить его обратно, как яичная скорлупа от средней линии, стараясь свести к минимуму любые контакты с мозгом. Срединный разрез и разрыв назад может быть сделана в несколько этапов.
- Как мозг подвергается дальнейшей, очень важно, чтобы потушить его со льдом охлажденной ACSF, чтобы сохранить целостность и жизнеспособность тканей.
- Точно так же оторваться височной и лобной костей.
- С тонким пинцетом, оторвать твердой мозговой оболочки, убедившись, чтобы получитьtentorum мозжечка.
- С мини-шпатель вводится под лобной доли поднять мозг от черепа достаточно, чтобы положить напряженности на черепных нервов.
- Разрез черепно-мозговых нервов с ножницами.
- Поднимите мозг целиком из черепа и пусть падают в стакан со льдом низким содержанием кальция / высокий ACSF магния. Оставьте на минуту или больше, чтобы охладить так, что ткань будет твердой, структура хорошо видна, и здоровье тканей будут сохранены.
- С пластиковой ложкой, передает мозга на фильтровальную бумагу в ледяной охлажденные чашки Петри, брюшной стороной вверх.
- Препарирование мозга:
- Сделать корональной перерезки с лезвием в средней мозговой артерии (рис. 2A).
- Сохранить лобной доли временно льда охлажденная низким содержанием кальция / высокий ACSF магния в 100 мл стакан.
- Отразить мозг так, что спинной поверхности вверх. Разрез ствола мозга на стыке среднего мозгай diencaphalon. В результате мозг блока показано на рисунке 2B.
- Бросьте их мозг обратно в ледяную низким содержанием кальция / высокий ACSF магния.
- Использование мини-шпатели, рассекают мозжечка от мозга / Понс. Сохранить в средствах массовой информации соответствующего предназначен для анализа.
- Верните их головного мозга в чашке Петри. Использование двух фильтров документы, поднимите мозга, поместив одну фильтровальную бумагу на ventrum. С его место заднего корональной плоскости их головного мозга на краю второй фильтровальной бумаги. С помощью этого фильтра месте бумаге передней плоскости среза их головного мозга на каплю цианакрилатного на Vibratome пластины резки, коры, стоящих перед лезвием.
- С Vibratome, отрезать достаточно хвостового мозг таким образом, что hippcampus показывает (рис. 2).
- Возьмите раздела, 2400 μ толщиной в 125 г крыса, 2700 μ толстые крысы в 200 гр. Передача раздел с помощью ватного тампона на фильтровальную бумагу на чашке Петри(Рис. 2D).
- Вырезать и сохранить поясной коры с лезвием бритвы.
- С помощью зубной шпатель, отодвинуть на дистального края мозолистого тела, чтобы сократить его, а затем снимите изокортекс.
- Со своей ventolateral края, снимите гиппокампа (рис. 2E).
- Сохранить мозга.
- Возьмите вторую секцию, 2400 мкм в 120 г крыса, 2500 мкм в 200 г крыса. Поместите раздел на фильтровальную бумагу на чашку Петри (рис. 2F). Кроме того, пять 500 мкм разделы могут быть приняты на данный момент для электрофизиологии.
- Вырезать и сохранить поясной коры с лезвием бритвы.
- Сделать боковые разрезы с лезвием на внутренней капсулы для удаления изокортекс (рис. 2F).
- Сделать косые разрезы с лезвием, чтобы удалить amygdali (рис. 2F, G).
- Сделать окно резать лезвием, чтобы удалить гипоталамуса. Боковаяразрезы по бокам от вентромедиального ядра гипоталамуса, который является видимым. Мы делаем спинной разрез чуть выше третьего желудочка или вентральной области покрышки (рис. 2H).
- Нажмите шпателем в мозолистого тела и оторваться кусочек изокортекс прикреплены к гиппокампа. Разместите узкий конец шпателя вентрального гиппокампа в спайке и повышения сверху снять гиппокампа.
- Сохранение РНК и белка в образцах ткани мозга и крови:
- СМИ для анализа РНК:
- Мозг: RNAlater РНК стабилизации реагента, # 76106 в пробирках Эппендорф.
- Кровь: PAXgene крови РНК Tube (PreAnalytix, Quagen).
- СМИ для белка (CORT) анализ крови: Решение г-HBSS, без Са2 + и Mg 2 +, (Quality биологических, Inc).
- Хранение:
- Сборник ткани мозга сначала сохраняется в корзине сухого льда не более чем на 12 часов, а затем в морозильной камере -70 ° Cдля использования в течение 6 месяцев, продолжительность исследования.
- Собранная кровь хранится при комнатной температуре в течение ночи, чтобы проникнуть реагентов, после чего она хранится в -70 ° C морозильной камере для использования в течение 6 месяцев, продолжительность исследования.
- СМИ для анализа РНК:
3. Гена Microarray митохондриальной и митохондриях связанных ядерных генов
Для изучения крыс функций митохондрий в тканях головного мозга, недавно мы разработали крысу митохондриях нейронов целенаправленной микрочипов (rMNChip) и биоинформатики инструменты для быстрой идентификации дифференциальных пути в тканях головного мозга 18. rMNChip содержит 1500 генов, участвующих в митохондриальных функций, стрессовые реакции, циркадные ритмы и передачи сигнала. Инструмент биоинформатики включает в себя алгоритм для вычисления разному экспрессируются гены, и базы данных для простой и интуитивно понятной интерпретации результатов микрочипов.
- Purificatioп тотальной РНК из тканей (Cat # GPM-Kit 2011-1, GenProMarkers):
- Крысы тканях мозга конкретных ядер в РНК, РНК позже стабилизации реагента (Qiagen).
- Ткань (30 мг в 600 мкл GPM-L / B буфер) гомогенизации с использованием Ultra-Turrax T8 на Dispergierstation (IKA Labortechnik).
- Центрифуга в 1,5-мл пробирки на Sorvall 21000 оборотов в минуту в течение 15 мин.
- Слейте супернатант в штопор колонки с 2-мл пробирку.
- Центрифуга-столбец труб при 15000 оборотов в минуту в течение 3 минут, отбросить проточные.
- Добавить 700 мкл GPM-B / W буфера для каждого из столбцов спина, центрифуги колонки труб при 16000 оборотов в минуту в течение 15 сек, отбросить проточные.
- Добавить 500 мкл GPM-W буфера для каждого из столбцов спина, центрифуги колонки труб при 16000 оборотов в минуту в течение 15 сек, повторить один раз.
- Поместите спина колонки в новой коллекции трубки 1,5 мл.
- Добавить 30 мкл DEPC обработанной воды для каждого из столбцов спина, центрифугируют при 16000 оборотов в минуту для1 мин, повторить один раз.
- Измерение концентрации РНК, регулировать концентрацию до 1 мкг / мкл аз-и РНКазы воды, образцы готовых для маркировки микрочипов.
- Microarray маркировке и гибридизации (Cat # Массив 900, Genisphere):
- 1,0 мкг общей РНК крысы используется для синтеза кДНК и микрочипов маркировки в соответствии с инструкциями производителя.
- Microarray гибридизации проводят на rMNChip при 65 ° С в течение 12-16 ч, как описано выше 18.
- Стиральные гибридизированных Слайды Microarray (Cat # GPM0101-6, GenProMarkers):
Моющий раствор Объем 20 X SSC 10% SDS DDH 2 O 0,5 X SSC/0.01 SDS 500 мл 12,5 мл 0,5 мл до 500 мл 0,5 X SSC 500 мл 12,5 мл до 500 мл 0,1 х SSC 500 мл 2,5 мл до 500 мл 0,01 х SSC 500 мл 0,25 мл до 500 мл
Во время мытья слайды должны быть защищены от света. Не позволяйте слайды высохнуть на любом этапе.- Вымойте слайды в 250-мл раствора 1 в стеклянную банку Коплин (Cat #: 70312-20, науки электронная микроскопия, Hatfield, PA) при комнатной температуре при перемешивании банку на BioShaker (Molecular Technologies, Сент-Луис, Миссури ), пока все покровные стекла упасть стеклах (он принимает <3 минут).
- Вымойте слайды с 250-мл Решение 2 в другом банке встряхивая банку в течение 3 мин.
- Вымойте слайды с 250-мл раствора 3в другом банке, вращая банку в течение 3 минут, повторяя этот шаг дважды.
- Вымойте слайды с 250-мл раствора 4 в другом банке на 10 сек. Немедленно высушите слайдов путем центрифугирования банках размещены на PN11779 пластин и ST-H750 ротора в Sorvall Супер T21 центрифуге при 1000 оборотов в минуту в течение 5 мин.
- Поместите промытый слайды в коробку для сканирования как можно скорее.
- Microarray сканирования изображений и анализа с использованием ScanArray Экспресс Microarray Scanner (PerkinElmer) в соответствии с инструкцией по эксплуатации и направлена на:
- Microarray изображение сканирования: сканирование легкого сканирования по сравнению с протоколом.
- Эффекты мощности лазера, PMT и методов нормализации данных результатов.
- Выравнивание GAL файл на изображение.
- Согласование мест к сетям точно.
- Анализ данных: настроенной вычислительных процедур для анализа микрочипов данные включают в себя микрочипов оценки изображения, фильтрация данных, коррекция размера пятна, включения, normalizatioп и сравнения, как описано выше 18. Кроме того, методы онтологии, пути и сети анализы такие же, как описано выше, чтобы обеспечить генерацию воспроизводимых и поддающихся проверке результатов микрочипов 2, 22, 25, 19, 20, 8, 23, 18.
4. Кровь сбора проб и плазменные CORT Измерение концентрации
- До или после стресса хвост образцы крови от наркоза животных собираются на день-1, 14, 21 и 30 в гепаринизированной труб для определения уровня циркулирующего CORT.
- Образцы крови Магистральные также собираются в гепаринизированной труб после животных усыпляют. Плазменные извлекают и хранят при температуре -70 ° С до анализа.
- СМИ для извлечения плазмы:
- Образцы крови для выделения РНК собираются с использованием PAXgene крови РНК труб (PreAnalytix, Quagen)
- Образцы крови для выделения ДНК собираются с использованием PAXgene крови ДНК труб (PreAnalytix, Quagen).
- Образцы крови для анализа белков собираются с использованием литий гепарин капиллярная трубка коллекция (200 мкл) из MaketLab # ML5601.
- Плазменные концентрации CORT проверена и проанализирована с активной Крыса Cort ОВОС (Diagnostic Systems Labs Инк http://www.beckmancoulter.com/ ) следующим образом:
- Отметить микротитрования полос, которые будут использоваться.
- Подготовка Крыса CORT конъюгата решение путем разбавления Крыса CORT конъюгата концентрата в сопряженных разведения.
- Внесите 25 мкл стандартов, контролей и неизвестных в скважинах.
- Добавить 100 мкл раствора конъюгата в каждую лунку помощью полуавтоматического дозатора. Слегка постучите а держатель 5-10 сек.
- Добавить 100 мкл Крыса CORT антисыворотки в каждую лунку помощью полуавтоматического дозатора.
- Инкубируйте скважин при комнатной температуре 25 ° C, на шейкере в 500-700 оборотов в минуту в течение 60 мин.
- Аспирируйте и мыть каждый вэйл 5 раз промывочным раствором с помощью автоматической шайбы микропланшетов. Промокните насухо путем обращения планшетом по впитывающей бумаге.
- Добавить 100 мкл раствора хромогена ТМБ в каждую лунку помощью полуавтоматического дозатора.
- Выдержите при комнатной температуре 15-20 мин на орбитальном шейкере планшет установлен на уровне 500-700 оборотов в минуту. Смотреть изменение цвета.
- Добавить 100 мкл останавливающего раствора в каждую лунку помощью полуавтоматического дозатора.
- Встряхнуть пластина вручную 5-10 сек.
- Читайте оптическую плотность раствора в скважину в течение 30 мин.
- Фильтр устанавливается на 450 нм. * EIA наборы можно приобрести на иммунобиологических Laboratories ( www.ibl-america.com ).
5. Представитель Результаты
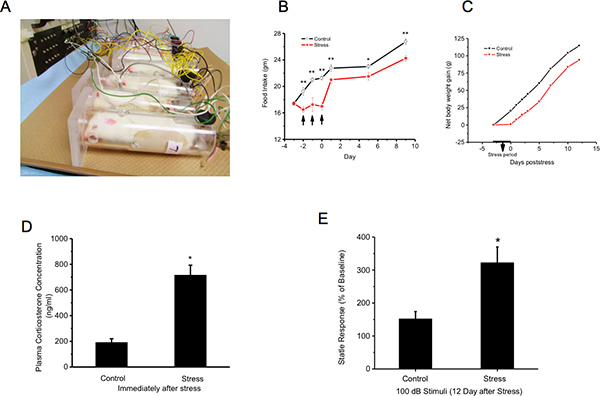
Рисунок 1. Крысы сдержан и подвергается хвост шок. Последующие массы тела, Плазменная концентрация кортикостерона, и акустический ответ испуга измеряется. Стресс экспозиции: Животные сдерживается, иммобилизованные в проветриваемом оргстекло трубы. Сорок электрическим током (2 мА, продолжительностью 3 секунды ;) доставляются хвосты на полу-случайных интервалах от 150 до 210 сек B и C:. Стресс замедляет прирост веса тела в период роста: вес тела и потребление корма и воды измеряются непосредственно перед стрессом (День -3), в день три дня стресса и затем через день после того, как до 14-й день. Отсутствие прироста массы тела во время стресса никогда не компенсируются D:.. Стресса кортикостерона в плазме увеличивается концентрация E: Acoustic испуга: Животные испытывают за день до стресса (день-1), чтение базового уровня и 12 дней после последнего дня последовательно 3 дня от стресса. Данные по каждой группе - Стресс и управление - выражается в процентах от акустическихспугнуть на 12 день по сравнению с днем -1. Стресс заметно повышает акустический рефлекс испуга. Нажмите, чтобы увеличить показатель .
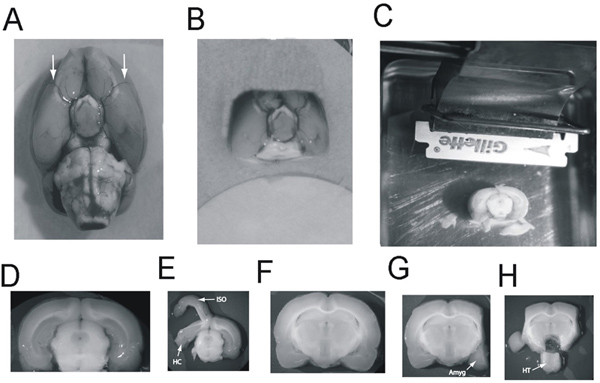
Рисунок 2 Dissection миндалевидного тела, гиппокампа, гипоталамуса и от среза мозга.. Мозга крысы, вид снизу: Стрелки указывают на средней мозговой артерии B:. Мозгу блок, вид снизу, готовых к перевозке в Vibratome. C: мозг блока приклеена к vibratome лоток, хвостовой вверх, кора, стоящих перед лезвием. Хвостовой мозг уже срезаны подвергая хвостового гиппокампа. Блок готов к 2500 мкм нарезать содержащий основную часть гиппокампа, которые должны быть приняты D:. 2500 мкм срез содержащие хвостовой гиппокампа E:. TОн изокортекс (ISO) отслаивается от гиппокампа (HC) и гиппокампа очищенные от мозга F:.. 2500 мкм срез содержащие миндалевидное тело и гиппокамп ростральной G: изокортекс была вырезана и миндалевидное тело (Amyg) резецированной . H:. гипоталамуса (HT) вырезали и перемещенных Нажмите, чтобы увеличить показатель .
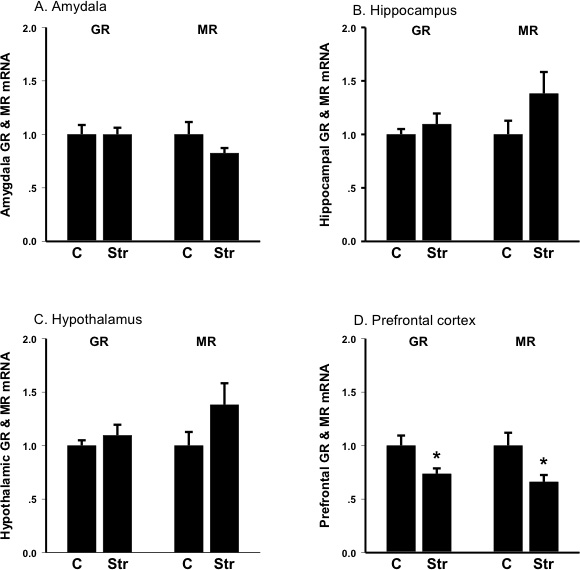
Рисунок 3. Выражение уровней мРНК глюкокортикоидных рецепторов (ГР) и minerocorticoid рецепторов (MR) в миндалине, гиппокампе, гипоталамусе и лобной коре до (C, контроль) и после (Str) Хвост-шок стресс. Единицы измерения доли контроля; бары SEM: Amygdala: Стресс снижает minerocorticoid экспрессию мРНК рецептора B: Hippocampus: Стресс increa.SES minerocorticoid экспрессию мРНК рецептора C:. гипоталамуса. Стресс увеличивает minerocorticoid экспрессию мРНК рецептора D: лобная кора: Стресс снижает экспрессию мРНК глюкокортикоидных рецепторов, а также minerocorticoid экспрессию мРНК рецептора.
| (121bp) ПЦР-праймеров для крыс GR являются: | 1f.CCACTGCAGGAGTCTCACAA 1rAACACCTCGGGTTCAATCAC |
| (99 б.п.) ПЦР-праймеров для крыс MR являются: | 1f.GCCTTCAGCTATGCCACTTC 1rAACGTCGTGAGCACCTTTCT |
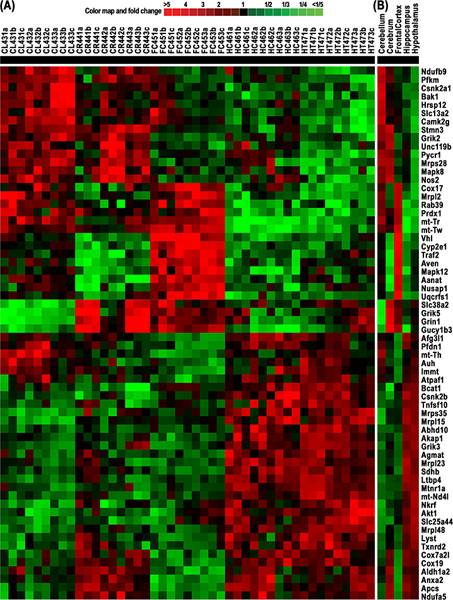
Рисунок 4. Кластер и HeatMap РНК-разному экспрессируются гены из 64, полученных от 5 тканях головного мозга крыс, в том числе мозжечка (CL), головного мозга (CR), фронтальной коры (ФК), гипоталамус (HT) и гиппокампа (HC). Цвет карте указывается раз изменения в гсобственный (зеленый) и до-(красный) выразил генов. (A) кластера и HeatMap нормированной интенсивности сигнала от 9 измерений для каждого из 64 генов, полученных из 15 экспериментов микрочипов для этих пяти тканях мозга. Экспрессии каждого гена измеряли технических трех повторах и экспериментальных трех повторах. (B) кластера и HeatMap среднего уровня РНК из этих 9 измерений каждого из 64 генов. Эти результаты показывают явные различия в экспрессии генов митохондриального и, следовательно, связанных функций, которые подтверждают нашу гипотезу, что различные участки мозга имеют разные потребности в энергии. Нажмите, чтобы увеличить показатель .
Наша применения rMNChip и биоинформатики привели к идентификации кластеров и HeatMap из 64 генов с дифференциально экспрессируются РНК, полученных от 5 головного мозга крыс тканей, включая мозжечок (CL), головного мозга (CR), лобной коры (FC), hypothalamus (HT) и гиппокампа (HC) (рис. 4). Эти данные демонстрируют явные различия в экспрессии генов митохондриального и, следовательно, соответствующих функций. Результаты показывают, что различные участки мозга требуют разного количества энергии в целях осуществления соответствующих функций мозга.
Обсуждение
Диагноз ПТСР основан на самостоятельной сообщили психиатрических симптомов (DSM IV) потенциальных субъектов. Нет четко определенных биомаркеров в настоящее время доступна для доступа к патофизиологические состояния потенциального посттравматического стрессового расстройства пациентов. ПТСР является нарушение спровоцированы опасными для жизни травматические события и главные психиатрические симптомы остаются присутствует в жизни по случаю потери кормильца в течение нескольких месяцев и даже лет после первоначального события. Наиболее известные и стойких симптомов выявлено у пациентов с ПТСР бодрствования, задержка преувеличенные реакции испуга 14, 15, 16 и очевидный компромисс оси HPA. У людей эти симптомы остаются, или появляются с задержкой в три месяца, после прекращения травматического стресса 24. Наша текущая модель для исследования биомаркеров ПТСР работает сдержанность и хвост потрясений повторяется в течение трех дней подряд (2-ч сессий 40, 2 tailshocks мА) - неизбежный хвост шок модели (ITS) у крыс весом 150 грамм. Эта модель имеет ЕЕБыло показано, чтобы имитировать в значительной степени патофизиология PTSD 17, 7, 4, 10. Наша лаборатория и другие лаборатории подтвердили, что его модели стресса у крыс вызывает поведенческие и нейробиологические изменения, похожие на те, что в ПТС субъектов 17, 7, 10, 9. В частности, эти напряженные крысы обладают (1) задержки и преувеличенной реакции испуга появляется через несколько дней после стресса прекращении, которое с учетом сжатых масштабах времени жизни крыс по сравнению с людьми, соответствует одного до трех месяцев задержки симптомы посттравматического стрессового расстройства пациентов (DSM-IV-TR ПТСР Criterian D / E 13), (2) расширение плазмы кортикостерона (CORT) в течение нескольких (10) дней, что указывает на компромисс гипоталамо оси (HPA), и (3) отсталый увеличение веса тела после стресса прекращение, соответствующие дисфункции регуляции метаболизма ПТСР. Существует никаких доказательств в литературе, что лиса запах, воздействие хищников, или боятся потенцированные реакции испуга, выставнемного этих стойких поведенческих и neuroendocrinologic фенотипы, связанные с ПТСР.
При воздействии на одной сессии стресс (1DS) проявили переходные, но не стойкие нарушения отображается 3DS крысы 17 настоящего эксперимента по сравнению реакции испуга 3DS и 1DS крыс 4, 7 и 10 дней после прекращения стресса. В соответствии с предыдущей работой, подчеркнул крыс выставлены повышенные базальные уровни плазмы CORT первый день после стресса 17. Эти CORT уровнях были чувствительны к числу воздействия стрессора с более высоким уровнем CORT у крыс 3DS, чем в 1DS крыс. Что касается реакции испуга, 1DS крысы обладают преувеличенной реакции вздрагивания 7 дней после стресса, в то время испуга сенсибилизации только становится очевидным 10 дней после стресса у крыс 3DS. Таким образом, появление преувеличенные реакции испуга после того, как стресс прекращению по-видимому, связано с числом воздействия стресса сессии. 3DS напряженно модель появится вбыть полезны, чтобы разобраться в измененной экспрессии биомаркеров, связанных с симптомами посттравматического стрессового расстройства и ключевых измеримых поведенческие фенотипы, связанные со сроками после прекращения стресса. Геномная результаты, представленные предоставить доказательство принципа для применения rMNChip и биоинформатики инструменты для выявления дифференциальных пути, и гена и белка биомаркеров, который значительно облегчит систем-биологического изучения и понимания молекулярных механизмов, лежащих в основе сложных и многофакторных неврологических расстройств, включая ПТСР.
В то время как наша парадигма не вникать в познавательной и более сложные поведенческие аспекты посттравматического стрессового расстройства, отметим, что измененный сон в модель ITS 1 соответствуют сложности падения и поддержания сна и ночные кошмары посттравматического стрессового расстройства пациентов 11 (DSM-IV-TR ПТСР Критерии D 13), и недостатки в побег / избежании обучения и изучения аппетит задачу в модель ITS 12 соответствует бедных концентрации и нарушения памяти ПТСР 5 (DSM-IV-TR ПТСР Критерии C 13). Нынешняя модель хорошо коррелирует с ключевыми симптомы, характерные для посттравматического стрессового расстройства и представляет собой хорошую модель для сопоставления периферической биомаркеров посттравматического стрессового расстройства, которые могут быть получены от пациентов, с центральной, механистического биомаркеров, которые не могут быть 6.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана CDMRP, USUHS грантов G188LE, G188MG, и G188QC (для HL), и USUHS Центра по изучению травматического стресса.
Ссылки
- Adrien, J., Dugovic, C., Martin, P. Sleep-wakefulness patterns in the helpless rat. Physiol. Behav. 49, 257-262 (1991).
- Bai, X., Wu, J., Zhang, Q., Alesci, S., Manoli, I., Blackman, M. R., Chrousos, G. P., Goldstein, A. L., Rennert, O. M., Su, Y. A. Third-generation human mitochondria-focused cDNA microarray and its bioinformatic tools for analysis of gene expression. Biotechniques. 42, 365-375 (2007).
- Blaszczyk, J. W. Startle response to short acoustic stimuli in rats. Acta Neurobiol. Exp. (Wars.). 63, 25-30 (2003).
- Braga, M. F., roniadou-Anderjaska, V., Manion, S. T., Hough, C. J., Li, H. Stress impairs alpha(1A) adrenoceptor-mediated noradrenergic facilitation of GABAergic transmission in the basolateral amygdala. Neuropsychopharmacology. 29, 45-58 (2004).
- Bremner, J. D., Vythilingam, M., Vermetten, E., Anderson, G., Newcomer, J. W., Charney, D. S. Effects of glucocorticoids on declarative memory function in major depression. Biol. Psychiatry. 55, 811-815 (2004).
- Garrick, T., Morrow, N., Eth, S., Marciano, D., Shalev, A. Psychophysiologic parameters of traumatic stress disorder in rats. Ann. N.Y. Acad. Sci. 821, 533-537 (1997).
- Garrick, T., Morrow, N., Shalev, A. Y., Eth, S. Stress-induced enhancement of auditory startle: an animal model of posttraumatic stress disorder. Psychiatry. 64, 346-354 (2001).
- Hsiao, Y. H., Su, Y. A., Tsai, H. D., Mason, J. T., Chou, M. C., Man, Y. G. Increased invasiveness and aggressiveness in breast epithelia with cytoplasmic p63 expression. Int. J. Biol. Sci. 6, 428-442 (2010).
- Jiang, X., Xing, G., Yang, C., Verma, A., Zhang, L., Li, H. Stress Impairs 5-HT(2A) Receptor-Mediated Serotonergic Facilitation of GABA Release in Juvenile Rat Basolateral Amygdala. Neuropsychopharmacology. , (2008).
- Jiang, X., Zhang, Z. J., Zhang, S., Gamble, E. H., Jia, M., Ursano, R. J., Li, H. 5-HT2A receptor antagonism by MDL 11,939 during inescapable stress prevents subsequent exaggeration of acoustic startle response and reduced body weight in rats. J. Psychopharmacol. , (2009).
- Maher, H. K. Sleep deprivation: are you a victim. AAOHN. J. 54, 548 (2006).
- Maier, S. F. Exposure to the stressor environment prevents the temporal dissipation of behavioral depression/learned helplessness. Biol. Psychiatry. 49, 763-773 (2001).
- North, C. S., Suris, A. M., Davis, M., Smith, R. P. Toward validation of the diagnosis of posttraumatic stress disorder. Am. J. Psychiatry. 166, 34-41 (2009).
- Orr, S. P., Metzger, L. J., Pitman, R. K. Psychophysiology of post-traumatic stress disorder. Psychiatr. Clin. North Am. 25, 271-293 (2002).
- Orr, S. P., Roth, W. T. Psychophysiological assessment: clinical applications for PTSD. J. Affect. Disord. 61, 225-240 (2000).
- Pitman, R. K., Orr, S. P., Shalev, A. Y., Metzger, L. J., Mellman, T. A. Psychophysiological alterations in post-traumatic stress disorder. Semin. Clin. Neuropsychiatry. 4, 234-241 (1999).
- Servatius, R. J., Ottenweller, J. E., Natelson, B. H. Delayed startle sensitization distinguishes rats exposed to one or three stress sessions: Further evidence toward an animal model of PTSD. Biological Psychiatry. 38, 539-546 (1995).
- Su, Y. A., Zhang, Q., Su, D. M., Tang, M. X. Rat Mitochondrion-Neuron Focused Microarray (rMNChip) and Bioinformatics Tools for Rapid Identification of Differential Pathways in Brain Tissues. Int. J. Biol. Sci. 7, 308-322 (2011).
- Su, D. M., Zhang, Q., Wang, X., He, P., Zhu, Y. J., Zhao, J., Rennert, O. M., Su, Y. A. Two types of human malignant melanoma cell lines revealed by expression patterns of mitochondrial and survival-apoptosis genes: implications for malignant melanoma therapy. Mol. Cancer Ther. , (2009).
- Su, Y. A., Li, H., He, P., Webster, M. J., Zhang, Q., Zhang, L., Wang, X., Su, D. M., Ursano, R. J., Rennert, O. M. Identification of stress-responsive genes, canonical pathways, molecular networks and drug targets in brain tissues of human and animals for systems-biology study of post-traumatic stress disorder. , (2009).
- Su, Y. A., Wu, J., Zhang, L., Zhang, Q., Su, D. M., He, P., Wang, B. D., Li, H., Webster, M. J., Rennert, O. M., Ursano, R. J. Dysregulated mitochondrial genes and networks with drug targets in postmortem brain of patients with posttraumatic stress disorder (PTSD) revealed by human mitochondria-focused cDNA microarrays. Int. J Biol. Sci. 4, 223-235 (2008).
- Su, Y. A., Yang, J., Tao, L., Nguyen, H., He, P. Undetectable and Decreased Expression of KIAA1949 (Phostensin) Encoded on Chromosome 6p21.33 in Human Breast Cancers Revealed by Transcriptome Analysis. J. Cancer. 1, 38-50 (2010).
- Yehuda, R., Yang, R. K., Buchsbaum, M. S., Golier, J. A. Alterations in cortisol negative feedback inhibition as examined using the ACTH response to cortisol administration in PTSD. Psychoneuroendocrinology. 31, 447-451 (2006).
- Zhang, Q., Wu, J., Nguyen, A., Wang, B. D., He, P., Laurent, G. S., Rennert, O. M., Su, A. Molecular mechanism underlying differential apoptosis between human melanoma cell lines UACC903 and UACC903(+6) revealed by mitochondria-focused cDNA microarrays. Apoptosis. 13, 993-1004 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены