Method Article
Biomarcadores em um modelo animal para Revelando correlatos neurais, hematológica e Comportamental do TEPT
Neste Artigo
Resumo
Nós descrevemos um modelo de rato do transtorno de estresse pós-traumático (TEPT), que revela as alterações persistentes na função neuroendócrina eo atraso de longo prazo, resposta de medo exagerado, característico de pacientes com TEPT. O modelo animal e os métodos descritos aqui são úteis para correlacionar biomarcadores em núcleos do cérebro, que são mecanicista, mas não pode ser medido em pacientes com biomarcadores em células brancas do sangue periférico, os quais podem.
Resumo
Identificação de biomarcadores que representam a evolução da fisiopatologia do Transtorno de Estresse Pós-Traumático (TEPT) é de vital importância, não só para o diagnóstico objetivo, mas também para a avaliação da eficácia terapêutica e resistência ao trauma. A pesquisa em curso é dirigido a identificar biomarcadores de TEPT, incluindo as proteínas de stress traumático, induzidas transcriptomas genômicas, variâncias e moduladores genéticos, utilizando amostras biológicas a partir de sangue dos sujeitos, a saliva, a urina, e tecidos cerebrais post-mortem. No entanto, a correlação destas moléculas de biomarcadores em amostras de periféricos ou post-mortem para funções cerebrais alteradas associados a sintomas psiquiátricos em TEPT continua por resolver. Aqui, nós apresentamos um modelo animal de PTSD em que tanto no sangue periférico e biomarcadores cerebrais centrais, bem como fenótipo comportamental, pode ser recolhido e medido, fornecendo assim a correlação necessária dos biomarcadores centrais de PTSD, que são mecânica e pathognomônico, mas não podem ser coletadas de pessoas, com os biomarcadores periféricos e fenótipos comportamentais, que podem.
Nosso modelo animal de TEPT emprega contenção e choques cauda repetidas por três dias consecutivos - o modelo rabo-choque inescapável (ITS) em ratos. Este modelo ITS imita a patofisiologia da PTSD 17, 7, 4, 10. Nós e outros autores verificaram que o modelo ITS induz alterações comportamentais e neurobiológicos semelhantes aos encontrados em indivíduos PTSD 17, 7, 10, 9. Especificamente, estes ratos estressados apresentam (1) uma resposta atrasada e exagerada de sobressalto aparecimento de vários dias após a cessação do estressor, que dada a escala de tempo comprimido de vida dos ratos em comparação a um ser humano, corresponde ao atraso meses 1-3 de sintomas em pacientes com TEPT (DSM-IV-TR PTSD Criterian D / E 13), (2) aumento da corticosterona no plasma (CORT) por vários dias, o que indica o comprometimento do eixo hypothalamopituitary (HPA), e (3) bo retardadoganho de peso após a cessação dy estressor, indicando disfunção de regulação metabólica.
Os paradigmas experimentais utilizados para este modelo são: (1) um paradigma desamparo aprendido em ratos ensaiadas por medição da resposta de sobressalto acústico (ASR) e um gráfico de massa corporal, (2) microdissecção do cérebro de rato em regiões e núcleos, ( 3) ensaio de imunossorvente ligado a enzima (ELISA) para os níveis sanguíneos de CORT, (4) um microarray de expressão de genes, mais relacionada com as ferramentas da bioinformática 18. Este microarray, apelidado rMNChip, centra-se na mitocôndria mitocondriais e nucleares relacionadas com genes em ratos, de modo a abordar especificamente as bioenergética neuronais hipótese de estar envolvido no TEPT.
Protocolo
1. Modelo Animal Comportamental do TEPT
- Sujeitos: albinas machos ratos Sprague Dawley (Taconic Farms, Derwood, MD) são utilizados, de ponderação 150 a 200 g no momento da administração do protocolo de stress.
- Medição de ingestão de alimentos, água e ganho de peso corporal: Na chegada em ratos de laboratório com peso de 100 ± 25 g estão alojados dois a uma gaiola (tamanho da gaiola: 45x24x20 cm). Substrato preenchimento gaiola (lascas de madeira) são mudadas duas vezes por semana. Os animais são mantidos num ciclo de luz invertido de 12 h (luzes acesas: 1800/0600 e off: 0600-1800) a uma temperatura (22 ± 4 ° C) - e uma humidade relativa (30-70%), controlado ambiente uma semana antes de experimentos. Água e ração peletizada padrão (Harlan (2018) dieta Roedor 18% de proteína, dietas globais, Harlan Teklad) estão disponíveis gratuitamente nas gaiolas em casa, e do peso corporal são registrados diariamente 3 dias antes, três dias durante e 3 dias após a cessação do sofrimento .
- Aclimatação: ratos são aclimatados por três dias a boª a facilidade animal e uma câmara de sobressalto acústico. Para aclimatar-las para a câmara de sobressalto acústico, os animais são tratados na mesma, durante 5 minutos cada dia durante três dias consecutivos antes das medições iniciais.
- Salientou protocolo: Os animais são igualmente atribuído a cada grupo com base no seu peso corporal e resposta de sobressalto de linha de base. O teste é feito em dois grupos de animais; cada grupo consistindo de 16 animais. O Grupo 1 recebe o protocolo de stress, e o Grupo 2 é o controle.
O protocolo de exposição stress é um procedimento de 2 hr contínuo, em que cada sessão consiste de retenção ("inevitável") e rabo-choques, repetida uma vez por dia durante 3 dias consecutivos. Salientando é feito na parte da manhã (entre a janela de 0800 e 1200). Os animais são seguras por ser imobilizado num tubo de plexiglass ventilado. Quarenta choques elétricos (2 mA, 3 segundos de duração; Animal Test Gaiola Shocker Piso Grid, Coulbourn Instruments, EUA) são entregues a suas caudas em semi-aleatórios intervalos de 150 to 210 seg (software notação gráfica do Estado, Habitest ligação Universal, Coulbourn Instruments, EUA). Estimulação em 2 mA foi escolhido porque é aversivo, mas não dolorosas, quando a saída do estimulador é colocado em frente do dedo do experimentador. Gel de eléctrodo é aplicado utilizando Q-ponta para formar uma fina camada de gel condutor entre o eléctrodo ea pele da cauda do rato. Os clipes de eléctrodos são ajustados e conectada à cauda para garantir uma boa ligação sem afectar a circulação do sangue da cauda. - Resposta de sobressalto acústico (ASR): medição da resposta de sobressalto acústico foi realizado com um sobressalto Sistema de Teste de resposta acústica (Coulbourn Instruments, Columbus, Ohio, EUA) 3. Este sistema consiste de peso sensíveis plataformas em uma câmara de som atenuado. O transdutor, o que é um medidor de tensão, em cada uma das plataformas de sobressalto requer calibragem antes do uso. Em primeiro lugar, o engate deve estar no modo acoplado DC para a calibração. Neste modo, o acoplador de saída directamente segue a entrada a partir da plataforma, o modo requerido para a calibração com pesos estáticos. O transdutor é comutado para o modo acoplado AC durante as experiências de modo a que apenas a mudança rápida, em vigor, o que indica a resposta de sobressalto, é a saída. Movimentos dos animais em resposta a um estímulo sonoro, são, assim, medido como uma alteração de voltagem através de um medidor de tensão dentro de cada plataforma e registada como o máximo de resposta que ocorre dentro de 200 ms o início do estímulo sobressalto-eliciar.
Existem seis tipos de ensaios de estímulo: 100 dB sozinho, 100 dB com pré-pulso, 110 dB sozinho, 110 dB com pré-pulso, pré-pulso sozinho e sem controle de estímulo. Cada tipo de julgamento foi apresentado oito vezes. Tipos de avaliação são apresentados em ordem aleatória, para evitar efeitos de ordem e habituação. Inter-ensaio intervalos variar aleatoriamente 15-25 seg. Entre as oito ensaios apenas os valores máximos são recolhidos os resultados e finalmente ajustado com o peso corporal do animal do mesmo dia. Os animais são testados um b diaestresse ntes ou outro tratamento, como uma leitura de linha de base e 1, 7, 14 e 21 dias após o último dia de 3 dias consecutivos do procedimento de stress ou de outro tratamento. - Análise dos dados:
- ASR: A amplitude de resposta de sobressalto acústico cada vez testados é representado como "% da linha de base", a qual é calculada utilizando a equação:% da linha de base = (amplitude amplitude / linha de base absoluta absoluto) x 100%. Para cada dia de teste, ANOVAs para medidas repetidas são realizadas em amplitudes de sobressalto com fatores de estado de estresse e dosagem de drogas usando SPSS (versão 16) software. Teste de Tukey, Bonferroni, ou Dunnett são usados para avaliar significativos post-hoc diferenças entre os grupos individuais. Os dados são representados como a média ± SEM
- Crescimento: O peso corporal e consumo de alimentos e água são medidos em stress do dia -1 anterior e nos dias 14, 21 e 30 após a conclusão do protocolo de estresse. Análise estatística: Os dados de consumo de alimentos e de água são submetidas a umanálise forma de medidas repetidas de variância (ANOVA). Para analisar as alterações na taxa de consumo de alimentos ao longo do tempo, a quantidade de ingestão de alimentos é depois dividido pelo peso do corpo do indivíduo, para minimizar a variação de peso corporal induzida por stress e o protocolo inicial diferença no peso corporal entre os grupos. Todos os procedimentos são realizados sob a aprovação de acordo com o Animal Care Institucional e Comitê de Uso (IACUC).
2. Dissecção cérebro
- Instrumentos e Materiais:
- Jar anestesia: ". Pote condimento" Este é um frasco de vidro com tampa, medindo cerca de 6 centímetros de altura e 5 cm de diâmetro, como um "jar boticário", "Pote de bola de algodão", ou
- Guilhotina de ratos, tal como fornecido pela Scientific Kent.
- Vibratome 1000:
- Corte lâmina de barbear na metade longitudinalmente, óleo de lavagem fora com álcool, inserir no grampo.
- Encha banho com gelo moído comum.
- Lugaro tabuleiro longitudinalmente.
- Seque a bandeja de humidade, antes de colocar uma gota de cianoacrilato.
- Rongeurs (exemplos são um Micro Friedman rongeur de Miltex, gato. Nenhuma. 17-4801 ou um rongeur Pearson de Fina gato Ferramentas da Ciência. Nenhuma 16.015-17).
- # 3 ou # 5 joalheiros fórceps (afiado para retirar dura).
- Tesoura pequena com pontas afiadas (Vantage V95-304 é um exemplo).
- (2) planas espátulas de aço inoxidável mini, como o usado para transferir produtos químicos em pó a uma balança. A extremidade larga está dobrado para a frente, de modo a caber entre telencéfalo e calvária.
- Colher para transferir bloco cérebro. (Uma colher de sopa de plástico do refeitório funciona bem.)
- Bisturi n º 10.
- Lâmina de barbear duplo fio (aço carbono):
- Um meio para Vibratome.
- Um meio para dissecção.
- Dois pratos de Petri de vidro, ~ 3,5 polegadas e 4 polegadas de diâmetro, de tal modo que se encaixa dentro da outra. Gelo picado no bottom prato. Dois papéis de filtro no prato superior. Mover a fatia posições requeridas movendo o papel de filtro.
- 100 ml proveta.
- Conta-gotas para irrigar o cérebro com gelo refrigerados a CSF. (Pipeta de Pasteur de vidro com extremidade estreita inserido na meia pêra de borracha látex polegada de largura funciona bem.)
- Esmagado bandeja de gelo: Cerca de 5 centímetros de altura, 20 centímetros de comprimento, 10 centímetros de largura. Contém:
- Fure todos os instrumentos no gelo picado.
- Cálcio / magnésio aCSF alta em garrafa de plástico que pode ser bateu para esmagar o gelo.
- Cianoacrilato.
- Cálcio de baixa / alta artificial de magnésio líquido cefalorraquidiano (ACSF):
- Em mM: 125 NaCl, 2,5 KCl, 0,5 de CaCl2 * 2H 2 O, 2,0 MgCl 2 * 6H 2 0, 1,2 NaH 2 PO 4 * H 2 O, 25 de NaHCO, 11 Glucose.
- Na garrafa de plástico que pode ser bateu para esmagar o gelo.
- Frio durante 20 min a -80 ° C congelador para se tornar uma lama.
- Cotonetes.
- Filtro de papel: Whatman milímetro 42,5 (Cat n º 1001 042.).
- Mini tubos de centrífuga de recolher seções menores de tecido.
- Wells placa de recolher estruturas maiores e seções de tecido.
- Toalha de papel.
- Saco biohazard vermelho.
- Anestesia:
- Jar anestesia, compressas de gaze, isoflurano, pinças de metal, são posicionados em uma coifa.
- Rato é colocado no frasco de anestesia.
- Umedeça gaze com isoflurano e coloque no frasco anestesia.
- Espere até pedal reflexo - a retirada da pata quando a web é pinçada com pinças - ou reflexo da córnea desaparece.
- Decapitar: Compreender rato com uma mão em torno do tórax por trás, decapitar rato com guilhotina tão perto do occipital possível. O atlas ainda permanecem geralmente anexado ao crânio.
- Coleta de Sangue: rato Squeeze no tórax para evitar que o sangue jorrando de artérias carótidas.Gradualmente relaxe aperto, de modo a controlar o fluxo de sangue para dentro do recipiente de recolha.
- A remoção do cérebro:
- Rapidamente cortar músculo e qualquer remanescente vértebras para longe da basiocciput com a tesoura pequena.
- Usando rongeur e início no forame magno, cortaram os côndilos occipitais e basiocciput.
- Incisão no couro cabeludo linha média, com bisturi.
- Usando a tesoura, corte uma incisão sagital nos ossos occipital e parietal. Agarrando a margem de corte do crânio com os fórceps, quebrá-lo de volta como uma casca de ovo de distância da linha média, tendo o cuidado de minimizar qualquer contato com o cérebro. O corte na linha média e ruptura de volta pode ser feito por fases.
- Como o cérebro está ainda exposto, é crítico para extinguir com aCSF gelo refrigerados para preservar a integridade e vitalidade do tecido.
- Da mesma forma romper ossos temporal e frontal.
- Com uma pinça fina, rasgar a dura, certificando-se de obter otentorum cerebelo.
- Com mini-espátula inserido sob o lobo frontal do cérebro levantar da calvária apenas o suficiente para colocar tensão sobre os nervos cranianos.
- Transecto os nervos cranianos com a tesoura.
- Levantar o cérebro inteiramente do crânio e deixe cair no copo de cálcio gelado / aCSF magnésio elevado. Deixar um minuto ou mais para arrefecer, de modo que o tecido será sólido, as estruturas claramente visível, bem como a saúde dos tecidos será preservada.
- Com a colher de plástico, transferir o cérebro para o papel de filtro no prato de Petri de gelo refrigerados, lado ventral para cima.
- Dissecção do cérebro:
- Fazer uma transecção coronal com lâmina de barbear para a artéria cerebral média (Figura 2A).
- Guardar lobo frontal temporariamente em gelo gelado cálcio / magnésio aCSF alta em 100 ml proveta.
- Virar cérebro, de forma que a superfície dorsal é para cima. Transecção do tronco cerebral, na junção do mesencéfalo de umª diencaphalon. O bloco cerebral resultante é visto na Figura 2B.
- Largue a volta cérebro bloqueado em cálcio gelado / aCSF alta concentração de magnésio.
- Usando espátulas mini, dissecar cerebelo da medula / ponte. Salvar em mídia apropriada para a análise pretendida.
- Devolver o cérebro bloqueado para a placa de Petri. Usando dois papéis de filtro, levante o cérebro, colocando um papel de filtro sobre o ventrum. Com isso, colocar o plano coronal posterior do cérebro bloqueado na extremidade do segundo filtro de papel. Com este lugar de papel de filtro o plano de corte anterior do cérebro bloqueado em uma gota de cianoacrilato sobre a placa de corte Vibratome, de frente para o córtex lâmina.
- Com a Vibratome, cortado apenas o suficiente do cérebro caudal de modo a que as apresentações hippcampus (Figura 2C).
- Dê uma seção, 2400 μ de espessura em um rato 125 g, 2700 μ de espessura em 200 g de rato. Transferir a seção com um cotonete para os papéis de filtro sobre a placa de Petri(Figura 2D).
- Cortar e salvar córtex cingulado com a lâmina de barbear.
- Com uma espátula odontológica, empurrar para a borda distal do corpo caloso para cortá-la, em seguida, retire a isocórtex.
- De sua margem ventolateral, retire o hipocampo (Figura 2E).
- Salve o mesencéfalo.
- Dê uma segunda seção, 2.400 mm de espessura em 120 g de rato, 2.500 mm de espessura em 200 g de rato. Coloque a secção sobre os papéis de filtro na caixa de Petri (Figura 2F). Alternativamente, cinco seções 500 mM poderia ser tomada neste momento para eletrofisiologia.
- Cortar e salvar córtex cingulado com a lâmina de barbear.
- Fazer cortes laterais com a lâmina de barbear na cápsula interna para remover o isocórtex (Figura 2F).
- Fazer cortes oblíquos com a lâmina de barbear para remover o amygdali (Figura 2F, G).
- Fazer uma caixa de corte com a lâmina de barbear para remover o hipotálamo. O lateralcortes são laterais ao núcleo ventromedial do hipotálamo, que é visível. Fazemos o corte dorsal logo acima do terceiro ventrículo ou área tegmental ventral (Figura 2H).
- Empurre espátula no corpo caloso e afastar o pequeno pedaço de isocórtex ligada ao hipocampo. Coloque a parte mais estreita da espátula ventral à comissura hipocampal e levantar dorsalmente para retirar o hipocampo.
- Preservação de RNA e de proteínas em amostras de tecido cerebral e sangue:
- Mídia para ensaio RNA:
- Cérebro: RNAlater RNA reagente estabilização, # 76106 em tubos de Eppendorf.
- Blood: Sangue PAXgene RNA Tube (PreAnalytix, Quagen).
- Meios para ensaio de proteína (CORT) do sangue: Solução d-HBSS, w / o Ca2 + e Mg 2 +, (Quality Biological, Inc).
- Armazenamento:
- Tecido cerebral recolhido é primeiro armazenado num cesto de gelo seco durante não mais do que 12 horas e, em seguida, em um congelador -70 ° Cpara o uso dentro de 6 meses, a duração do estudo.
- Sangue recolhido é mantida à temperatura ambiente durante a noite para permitir que os reagentes penetrem, após o que é armazenado num congelador -70 ° C para utilização no prazo de 6 meses, o período de duração do estudo.
- Mídia para ensaio RNA:
3. Microarray Gene de mitocondriais e mitocôndrias relacionadas com genes nucleares
Para estudar as funções do rato mitocondrial nos tecidos cerebrais, nós desenvolvemos recentemente o rato mitocôndria-neurônio focada microarray (rMNChip) e ferramentas de bioinformática para identificação rápida de vias diferencial nos tecidos cerebrais 18. rMNChip contém 1.500 genes envolvidos em funções mitocondriais, resposta ao estresse, os ritmos circadianos e transdução de sinal. A ferramenta de bioinformática inclui um algoritmo para a computação de genes diferencialmente expressos, e um banco de dados para interpretação simples e intuitiva para resultados de microarrays.
- Purification de RNA total a partir de tecidos (Cat # 2011-1 GPM-Kit, GenProMarkers):
- Tecidos de cérebro de rato de núcleos específicos em RNA RNA posterior estabilização reagente (Qiagen).
- Homogeneização do tecido (30 mg em 600 de tampão GPM-L / B ul) utilizando Ultra-Turrax T8 em Dispergierstation (IKA Labortechnik).
- Centrifugar em 1,5 ml em tubos Sorvall 21000 rpm durante 15 min.
- Decanta-se o sobrenadante numa coluna de spin com um tubo de recolha de 2 ml.
- Centrifugar os tubos das colunas a 15.000 rpm durante 3 minutos, rejeitar o flow-through.
- Adicionar 700 ul de GPM-B / W tampão para cada uma das colunas de centrifugação, centrifugar os tubos de coluna a 16.000 rpm durante 15 segundos, descartar o flow-through.
- Adicionar 500 de tampão GPM-W ul de cada uma das colunas de centrifugação, centrifugar os tubos de coluna a 16.000 rpm durante 15 segundos, repetir uma vez.
- Colocar a coluna de centrifugação em um novo tubo de recolha de 1,5 ml.
- Adicionar 30 de água tratada com DEPC ul de cada uma das colunas de centrifugação, centrifugar a 16.000 rpm durante1 min, repetir uma vez.
- Medir a concentração de RNA, para ajustar a concentração de 1 ug / uL com DNase e água isenta de RNase, as amostras estão prontas para a rotulagem de microarray.
- Microarray rotulagem e hibridação (Array Cat # 900, Genisphere):
- 1,0 ug de ARN total de rato é usado para a síntese de cDNA e rotulagem microarray seguindo as instruções do fabricante.
- Microarray hibridação é realizada em um rMNChip a 65 ° C durante 12-16 horas como descrito previamente 18.
- Lavar Slides Microarray hibridizado (Cat # GPM0101-6, GenProMarkers):
Solução de lavagem Volume 20 X SSC SDS a 10% DDH 2 O 0.5 X SSC/0.01 SDS 500 ml 12,5 ml 0,5 ml até 500 ml 0,5 X SSC 500 ml 12,5 ml até 500 ml 0,1 X SSC 500 ml 2,5 ml até 500 ml 0,01 X SSC 500 ml 0,25 ml até 500 ml
Durante a lavagem das lâminas deve ser protegido da luz. Não deixe secar lâminas em qualquer fase.- Lavagem das lâminas em 250 ml da solução 1 em um frasco de vidro de Coplin (Cat #: 70312-20, Electron Microscopy Sciences, Hatfield, PA) à temperatura ambiente, por agitação do frasco com um (Molecular Technologies Inc., St. Louis, MO BioShaker ) até que todas as lamelas cair as lâminas de vidro (Leva <3 minutos).
- Lavar as lâminas com 250 ml Solução 2 noutro frasco, por agitação do frasco durante 3 min.
- Lave as lâminas com 250 ml Solução 3noutro frasco, rodando o frasco durante 3 min, repetindo este passo duas vezes.
- Lavar as lâminas com 250 ml da solução 4 em um outro frasco de 10 seg. Secar as lâminas imediatamente por centrifugação os frascos colocados sobre as placas e PN11779 ST-H750 rotor Sorvall em Super T21 centrífuga a 1000 rpm durante 5 min.
- Colocar as lâminas lavadas em uma caixa de verificação para o mais rapidamente possível.
- Microarray varredura e análise de imagem usando ScanArray expresso Microarray Scanner (PerkinElmer), seguindo o manual de instruções e foco em:
- Microarray digitalização de imagens: verificação fácil vs digitalização protocolo.
- Efeitos de métodos LASER PMT poder, e normalização de dados sobre os resultados.
- Alinhamento de arquivo da GAL para imagem.
- Alinhamento de pontos para as redes com precisão.
- Análise dos dados: Os procedimentos personalizados computacionais para análise de dados microarray microarray incluem avaliação da imagem, filtragem de dados, correção de tamanho do local, a inclusão, normalization e comparação, como descrito anteriormente 18. Além disso, os métodos de análise de via ontologia, e da rede são os mesmos, como descrito anteriormente, a fim de assegurar a geração de resultados de microarray reprodutíveis e controláveis 2, 22, 25, 19, 20, 8, 23, 18.
4. Coleta de sangue e medição da concentração do plasma CORT
- Amostras da cauda pré ou pós-stress de sangue de animais anestesiados são coletados no dia-1, 14, 21 e 30 em tubos heparinizados para determinação dos níveis circulantes de Cort.
- As amostras de sangue do tronco são também recolhidas em tubos heparinizados, depois os animais são sacrificados. O plasma é extraído e armazenado a -70 ° C até à análise.
- Mídia para extração de plasma:
- Amostras de sangue para extração de RNA são coletadas utilizando Sangue PAXgene RNA tubos (PreAnalytix, Quagen)
- As amostras de sangue para extração de DNA são coletadas utilizando tubos de sangue PAXgene DNA (PreAnalytix, Quagen).
- As amostras de sangue para análise de proteína são obtidos utilizando lítio tubo capilar Colecção Heparina (200 ul) a partir de MaketLab # ML5601.
- A concentração plasmática de CORT é testada e analisada com Active Rat Cort EIA (Diagnostic Systems Labs Inc. http://www.beckmancoulter.com/ ) como se segue:
- Identificar as tiras de microtitulação a serem utilizadas.
- Prepare Rat CORT Solução Conjugado diluindo Rat CORT Concentrado Conjugado no Diluente de Conjugado.
- Pipetar 25 uL Padrões, Controles e Amostras em poços.
- Adicionar 100 ul de solução do conjugado enzimático a cada cavidade utilizando um dispensador semi-automático. Bata suavemente o bem titular seg 5-10.
- Adicionar 100 ul de anti-soro de rato CORT para cada cavidade utilizando um dispensador semi-automático.
- Incubar os poços à temperatura ambiente, 25 ° C, num conjunto agitador a 500-700 rpm durante 60 min.
- Aspirar e lavar cada poçol 5 vezes com solução de lavagem utilizando uma lavadora automática. Secar invertendo a placa sobre material absorvente.
- Adicionar 100 ul da solução de cromogénio TMB a cada poço, utilizando um dispensador semi-automático.
- Incubar a temperatura ambiente 15-20 min em um agitador orbital fixado em 500-700 rpm. Assista a mudança de cor.
- Adicionar 100 ul de solução de paragem a cada poço, utilizando um dispensador semi-automático.
- Agite placa com a mão sec 5-10.
- Leia a absorvância da solução no poço no prazo de 30 min.
- Filtro é ajustado a 450 nm. * Os kits EIA também podem ser adquiridos em laboratórios Imunobiológicos ( www.ibl-america.com ).
5. Resultados representativos
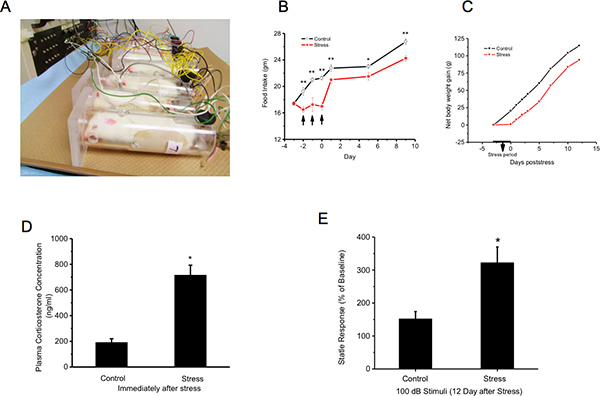
Rats Figura 1. São contidos e expostos a um choque de cauda. Peso do corpo posterior, A concentração plasmática de corticosterona e resposta de sobressalto acústico são medidos A:. Exposição Stress: Os animais são seguras por ser imobilizado num tubo de plexiglass ventilado. Quarenta choques eléctricos (2 mA, duração 3 segundos ;) são entregues às suas caudas em semi-aleatórios intervalos de 150 a 210 seg B e C:. Ganho stress retarda no peso do corpo durante o crescimento: O peso corporal e consumo de alimento e de água são medidos imediatamente antes de stress (Dia -3), no dia dos três dias de tensão e, em seguida, a cada dois dias depois lá até ao dia 14. A falta de ganho de peso do corpo durante o stress não é compensada D:. Aumenta o stress concentração plasmática de corticosterona E:. Sobressalto acústico: Os animais são testados um dia antes do stress (dia-1), como uma leitura de linha de base e 12 dias após o último dia de os consecutivos 3 dias do estresse. Os dados para cada grupo de - O stress e controlo - são expressos como percentagem de acústicastartle no dia 12 relativamente ao dia -1. Estresse aumenta significativamente o reflexo de sobressalto acústico. Clique aqui para ver maior figura .
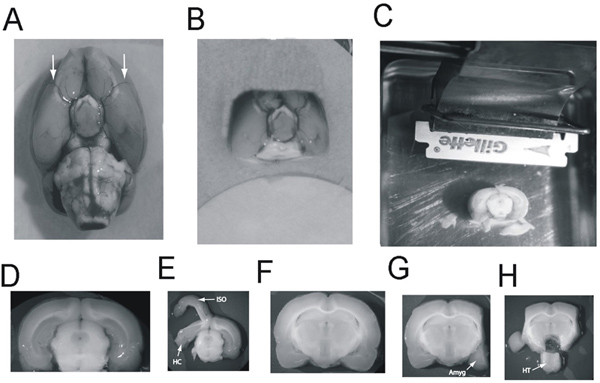
Figura 2 Dissecção da amígdala, o hipocampo, hipotálamo e da fatia do cérebro A:.. Cérebro de rato, vista ventral: Setas apontam para as artérias cerebrais médias B:. Bloco O cérebro, vista ventral, pronto para ser transportado para o Vibratome. C: O bloco do cérebro colada à bandeja de vibratome, caudal lateral para cima, de frente para o córtex lâmina. O cérebro caudal já foi cortada expondo o hipocampo caudal. O bloco está agora pronto para os 2500 uM fatia contém a maior parte do hipocampo a tomar D:. A fatia uM 2,500 de espessura, contendo o hipocampo caudal E:. Tele isocórtex (ISO) é desenrolada a partir do hipocampo (HC) e do hipocampo desenrolada a partir do mesencéfalo F:.. A fatia de espessura contendo 2,500 uM a amígdala e o hipocampo rostral G: O isocórtex foi excisado e amígdala (Amyg) ressecado . H:. hipotálamo (HT) é extirpado e deslocados Clique aqui para ver maior figura .
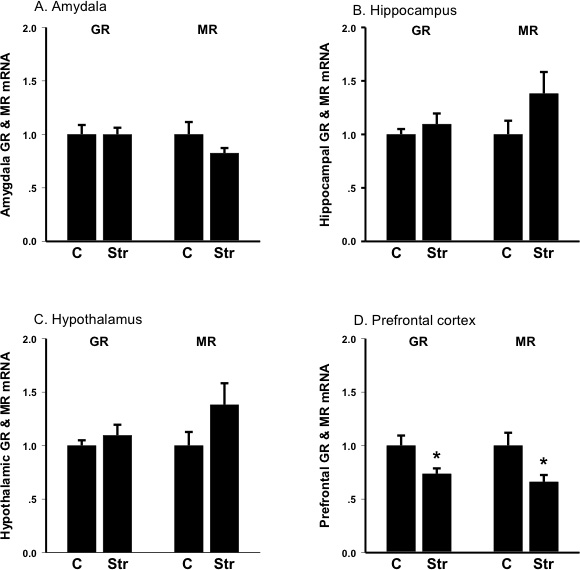
Figura 3. Os níveis de expressão de mRNA de receptor de glucocorticóide (GR) e receptor minerocorticoid (MR) na amígdala, hipocampo, hipotálamo e córtex frontal antes (C, controlo) e após (Str) tail shock-stress. As unidades são parte de controle; barras são SEM A: Amígdala: Stress diminui a expressão de mRNA minerocorticoid receptor B: Hippocampus: au Stress.expressão de mRNA ses minerocorticoid receptor C:. Hipotálamo:. Estresse aumenta a expressão de mRNA minerocorticoid receptor D: Cortex Frontal: Estresse diminui a expressão de mRNA do receptor glicocorticóide bem como a expressão de mRNA minerocorticoid receptor.
| Os iniciadores (121bp) de PCR para GR rato são as seguintes: | 1f.CCACTGCAGGAGTCTCACAA 1rAACACCTCGGGTTCAATCAC |
| A (99 bp) Os iniciadores de PCR para rato MR são: | 1f.GCCTTCAGCTATGCCACTTC 1rAACGTCGTGAGCACCTTTCT |
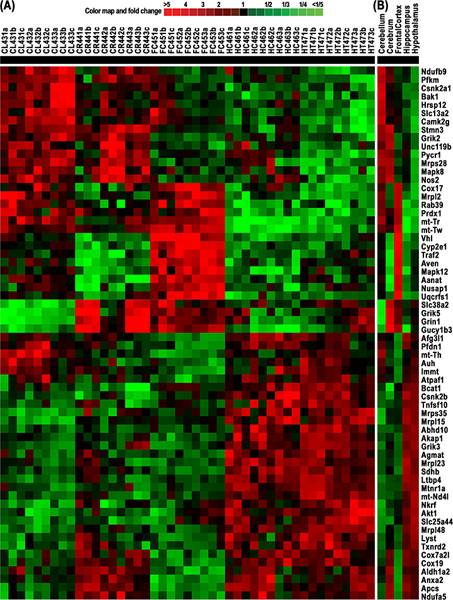
Figura 4. Cluster e heatmap de RNA diferencialmente expressos a partir de 64 genes derivados de 5 tecidos cerebrais de ratos, incluindo o cerebelo (CL), cérebro (CR), córtex frontal (FC), hipotálamo (HT), e hipocampo (HC). Mapa de cores indica mudanças dobra em dprópria (verde) e para cima (vermelha) genes expressos. (A) e Cluster heatmap das intensidades de sinal normalizadas de 9 medições para cada um dos 64 genes derivados a partir de 15 experiências de microarrays para estes tecidos cerebrais cinco. A expressão de cada gene foi medida por triplicado técnicas e triplicatas experimentais. (B) e Cluster heatmap dos níveis médios de ARN destes 9 medições de cada um dos 64 genes. Estes resultados mostram claras diferenças na expressão de genes mitocondriais e funções relacionadas, portanto, que suportam a hipótese de que diferentes regiões do cérebro têm demandas diferentes de energia. Clique aqui para ver maior figura .
Nossa aplicação do rMNChip e ferramentas de bioinformática levou à identificação de um cluster e heatmap de 64 genes diferencialmente expressos com RNA derivados de 5 tecidos de cérebro de rato, incluindo o cerebelo (CL), cérebro (CR), córtex frontal (FC), hypothaLamus (HT), e hipocampo (HC) (Figura 4). Estes dados demonstram as claras diferenças na expressão dos genes mitocondriais e, portanto, as funções relacionadas. Os resultados demonstram que as diferentes regiões do cérebro exigem diferentes quantidades de energia, a fim de realizar as funções cerebrais correspondentes.
Discussão
O diagnóstico de TEPT é baseado em auto-relatos de sintomas psiquiátricos (DSM IV) por potenciais sujeitos. Não biomarcador bem definido está atualmente disponível para acessar o estado fisiopatológico do potencial pacientes com TEPT. TEPT é um transtorno provocado por risco de vida eventos traumáticos e os principais sintomas psiquiátricos continuam presentes na vida do sobrevivente por meses e até mesmo anos após os eventos iniciais. Os sintomas mais proeminentes e persistentes revelados em pacientes com TEPT são hipervigilância, atraso resposta exagerada sobressalto 14, 15, 16 e um compromisso aparente do eixo HPA. Nos humanos os sintomas permanecem, ou aparecer com um atraso de três meses, após a cessação do estressor traumático 24. Nosso atual modelo para estudos de biomarcadores de PTSD emprega contenção e choques cauda repetidas por três dias consecutivos (2-h sessões de 40, 2 tailshocks MA) - o modelo rabo-choque inescapável (ITS) em ratos com peso de 150 gramas. Este modelo tem SEUFoi demonstrado que imitam de forma substancial a fisiopatologia da PTSD 17, 7, 4, 10. Nosso laboratório e outros laboratórios têm verificado que o seu modelo de estresse em ratos induz alterações comportamentais e neurobiológicos que são semelhantes aos encontrados no TEPT assuntos 17, 7, 10, 9. Especificamente, estes ratos estressados apresentam (1) uma resposta atrasada e exagerada de sobressalto aparecimento de vários dias após a cessação do estressor, que dada a escala de tempo comprimido de vida dos ratos em comparação a um ser humano, corresponde ao atraso meses 1-3 de sintomas em pacientes com TEPT (DSM-IV-TR PTSD Criterian D / E 13), (2) aumento da corticosterona no plasma (CORT) para vários (10) dias, indicando o comprometimento do eixo hypothalamopituitary (HPA), e (3) o ganho de peso corporal após retardado stressor cessação, correspondente à disfunção da regulação metabólica de PTSD. Não há evidências na literatura que a Fox odor, a exposição predador, ou temem resposta sobressalto potencializado, expopouco esses fenótipos comportamentais e persistentes neuroendocrinologic associado com PTSD.
Ratos expostos a uma sessão de tensão simples (1DS) exibiram transiente, mas não as anormalidades persistentes exibidos por 3DS ratos 17 A presente experiência comparou a resposta de sobressalto de 3DS e 1DS ratos 4, 7, e 10 dias após a cessação do estressor. Consistente com trabalhos anteriores, salientou ratos apresentaram elevados níveis plasmáticos basais de CORT o estresse pós primeiro dia 17. Estes níveis de CORT foram sensíveis ao número de exposições estressores com níveis mais elevados em ratos CORT 3DS que em 1DS ratos. Quanto à resposta de sobressalto, os ratos 1DS exibem uma resposta de sobressalto exagerada 7 dias pós estressor, enquanto sensibilização sobressalto só se torna aparente 10 dias após o estressor em ratos 3DS. Assim, o aparecimento de uma resposta exagerada de sobressalto após cessação estressor parece estar relacionado com o número de posições de sessão de stress. O modelo 3DS estressado pareceser útil para obter insights sobre a expressão alterada de biomarcadores associados com os sintomas da PTSD e os principais mensuráveis fenótipos comportamentais associadas com o tempo após a cessação do sofrimento. Genômicas resultados apresentados fornecem prova de princípio para a aplicação de ferramentas de bioinformática e rMNChip para identificar vias de diferenciais, e biomarcadores de genes e proteínas, o que vai facilitar muito sistemas biológicos estudo e compreensão dos mecanismos moleculares subjacentes multifatoriais e complexos distúrbios neurológicos, incluindo TEPT.
Enquanto o nosso paradigma não mergulhar no cognitivo e mais complexos aspectos comportamentais do TEPT, notamos que os padrões de sono alterados no modelo STI 1 corresponde à dificuldade e manter o sono e os pesadelos de 11 pacientes com TEPT (DSM-IV-TR TEPT Critérios D 13), e as deficiências na fuga / esquiva de aprendizagem e de aprendizagem de uma tarefa apetitiva no seu modelo 12 corresponde às concentrações de pobres e déficits de memória de TEPT 5 (DSM-IV-TR TEPT Critério C 13). O modelo atual se correlaciona bem com os principais sintomas característicos do TEPT e fornece um bom modelo para correlacionar biomarcadores periféricos de TEPT, que podem ser coletados de pacientes, com centrais, biomarcadores mecanicistas, que não pode 6.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pela CDMRP, Grants USUHS G188LE, G188MG, e G188QC (para HL), e do Centro USUHS para o Estudo do Estresse Traumático.
Referências
- Adrien, J., Dugovic, C., Martin, P. Sleep-wakefulness patterns in the helpless rat. Physiol. Behav. 49, 257-262 (1991).
- Bai, X., Wu, J., Zhang, Q., Alesci, S., Manoli, I., Blackman, M. R., Chrousos, G. P., Goldstein, A. L., Rennert, O. M., Su, Y. A. Third-generation human mitochondria-focused cDNA microarray and its bioinformatic tools for analysis of gene expression. Biotechniques. 42, 365-375 (2007).
- Blaszczyk, J. W. Startle response to short acoustic stimuli in rats. Acta Neurobiol. Exp. (Wars.). 63, 25-30 (2003).
- Braga, M. F., roniadou-Anderjaska, V., Manion, S. T., Hough, C. J., Li, H. Stress impairs alpha(1A) adrenoceptor-mediated noradrenergic facilitation of GABAergic transmission in the basolateral amygdala. Neuropsychopharmacology. 29, 45-58 (2004).
- Bremner, J. D., Vythilingam, M., Vermetten, E., Anderson, G., Newcomer, J. W., Charney, D. S. Effects of glucocorticoids on declarative memory function in major depression. Biol. Psychiatry. 55, 811-815 (2004).
- Garrick, T., Morrow, N., Eth, S., Marciano, D., Shalev, A. Psychophysiologic parameters of traumatic stress disorder in rats. Ann. N.Y. Acad. Sci. 821, 533-537 (1997).
- Garrick, T., Morrow, N., Shalev, A. Y., Eth, S. Stress-induced enhancement of auditory startle: an animal model of posttraumatic stress disorder. Psychiatry. 64, 346-354 (2001).
- Hsiao, Y. H., Su, Y. A., Tsai, H. D., Mason, J. T., Chou, M. C., Man, Y. G. Increased invasiveness and aggressiveness in breast epithelia with cytoplasmic p63 expression. Int. J. Biol. Sci. 6, 428-442 (2010).
- Jiang, X., Xing, G., Yang, C., Verma, A., Zhang, L., Li, H. Stress Impairs 5-HT(2A) Receptor-Mediated Serotonergic Facilitation of GABA Release in Juvenile Rat Basolateral Amygdala. Neuropsychopharmacology. , (2008).
- Jiang, X., Zhang, Z. J., Zhang, S., Gamble, E. H., Jia, M., Ursano, R. J., Li, H. 5-HT2A receptor antagonism by MDL 11,939 during inescapable stress prevents subsequent exaggeration of acoustic startle response and reduced body weight in rats. J. Psychopharmacol. , (2009).
- Maher, H. K. Sleep deprivation: are you a victim. AAOHN. J. 54, 548 (2006).
- Maier, S. F. Exposure to the stressor environment prevents the temporal dissipation of behavioral depression/learned helplessness. Biol. Psychiatry. 49, 763-773 (2001).
- North, C. S., Suris, A. M., Davis, M., Smith, R. P. Toward validation of the diagnosis of posttraumatic stress disorder. Am. J. Psychiatry. 166, 34-41 (2009).
- Orr, S. P., Metzger, L. J., Pitman, R. K. Psychophysiology of post-traumatic stress disorder. Psychiatr. Clin. North Am. 25, 271-293 (2002).
- Orr, S. P., Roth, W. T. Psychophysiological assessment: clinical applications for PTSD. J. Affect. Disord. 61, 225-240 (2000).
- Pitman, R. K., Orr, S. P., Shalev, A. Y., Metzger, L. J., Mellman, T. A. Psychophysiological alterations in post-traumatic stress disorder. Semin. Clin. Neuropsychiatry. 4, 234-241 (1999).
- Servatius, R. J., Ottenweller, J. E., Natelson, B. H. Delayed startle sensitization distinguishes rats exposed to one or three stress sessions: Further evidence toward an animal model of PTSD. Biological Psychiatry. 38, 539-546 (1995).
- Su, Y. A., Zhang, Q., Su, D. M., Tang, M. X. Rat Mitochondrion-Neuron Focused Microarray (rMNChip) and Bioinformatics Tools for Rapid Identification of Differential Pathways in Brain Tissues. Int. J. Biol. Sci. 7, 308-322 (2011).
- Su, D. M., Zhang, Q., Wang, X., He, P., Zhu, Y. J., Zhao, J., Rennert, O. M., Su, Y. A. Two types of human malignant melanoma cell lines revealed by expression patterns of mitochondrial and survival-apoptosis genes: implications for malignant melanoma therapy. Mol. Cancer Ther. , (2009).
- Su, Y. A., Li, H., He, P., Webster, M. J., Zhang, Q., Zhang, L., Wang, X., Su, D. M., Ursano, R. J., Rennert, O. M. Identification of stress-responsive genes, canonical pathways, molecular networks and drug targets in brain tissues of human and animals for systems-biology study of post-traumatic stress disorder. , (2009).
- Su, Y. A., Wu, J., Zhang, L., Zhang, Q., Su, D. M., He, P., Wang, B. D., Li, H., Webster, M. J., Rennert, O. M., Ursano, R. J. Dysregulated mitochondrial genes and networks with drug targets in postmortem brain of patients with posttraumatic stress disorder (PTSD) revealed by human mitochondria-focused cDNA microarrays. Int. J Biol. Sci. 4, 223-235 (2008).
- Su, Y. A., Yang, J., Tao, L., Nguyen, H., He, P. Undetectable and Decreased Expression of KIAA1949 (Phostensin) Encoded on Chromosome 6p21.33 in Human Breast Cancers Revealed by Transcriptome Analysis. J. Cancer. 1, 38-50 (2010).
- Yehuda, R., Yang, R. K., Buchsbaum, M. S., Golier, J. A. Alterations in cortisol negative feedback inhibition as examined using the ACTH response to cortisol administration in PTSD. Psychoneuroendocrinology. 31, 447-451 (2006).
- Zhang, Q., Wu, J., Nguyen, A., Wang, B. D., He, P., Laurent, G. S., Rennert, O. M., Su, A. Molecular mechanism underlying differential apoptosis between human melanoma cell lines UACC903 and UACC903(+6) revealed by mitochondria-focused cDNA microarrays. Apoptosis. 13, 993-1004 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados