Method Article
Biomarcatori in un modello animale per Rivelare correlati neurali, ematologiche, e comportamentali di PTSD
In questo articolo
Riepilogo
Descriviamo un modello murino del disturbo post traumatico da stress (PTSD) che rivela le alterazioni persistenti della funzione neuroendocrina e del ritardato a lungo termine, di risposta paura esagerata, caratteristici dei pazienti con PTSD. Il modello animale e metodi descritti qui sono utili per correlare biomarcatori nei nuclei del cervello, che sono meccanicistica ma non possono essere misurati nei pazienti, con biomarcatori nelle periferie globuli bianchi, che può.
Abstract
Identificazione di biomarcatori che rappresentano l'evoluzione della fisiopatologia del Disturbo Post Traumatico da Stress (PTSD) è di vitale importanza, non solo per la diagnosi oggettiva, ma anche per la valutazione di efficacia terapeutica e la resilienza ai traumi. La ricerca in corso è diretto ad individuare biomarcatori molecolari per il PTSD, comprese le proteine dello stress traumatico, indotte trascrittomi, varianze genomici e modulatori genetici, utilizzando campioni biologici dal sangue dei soggetti, la saliva, l'urina, e tessuti cerebrali post-mortem. Tuttavia, la correlazione di queste molecole biomarcatori in campioni periferici o post-mortem per le funzioni cerebrali alterate associate a sintomi psichiatrici in PTSD rimane irrisolto. Qui, presentiamo un modello animale di PTSD in cui sangue periferico e biomarcatori cerebrali centrali, nonché fenotipo comportamentale, può essere raccolto e misurato, fornendo così la necessaria correlazione dei biomarkers centrali di PTSD, che sono meccanicistico e pathognomonico, ma non possono essere raccolti da persone, con i biomarcatori periferici e fenotipi comportamentali, che possono.
Il nostro modello animale di PTSD impiega moderazione e ripetuti colpi di coda per tre giorni consecutivi - l'inevitabile coda-shock modello (ITS) nel ratto. Questo il suo modello simula la fisiopatologia della PTSD 17, 7, 4, 10. Noi e altri abbiamo verificato che il suo modello induce alterazioni comportamentali e neurobiologiche simili a quelli riscontrati in soggetti PTSD 17, 7, 10, 9. In particolare, questi ratti stressati presentano (1) una risposta ritardata ed esagerata startle apparire diversi giorni dopo la cessazione fattore di stress, che, data la scala compressa tempo della vita del ratto rispetto ad un uomo, corrisponde al ritardo di uno a tre mesi dei sintomi del PTSD pazienti (DSM-IV-TR PTSD Criterian D / E 13), (2) una maggiore plasma corticosterone (CORT) per diversi giorni, indicando compromesso dell'asse hypothalamopituitary (HPA), e (3) ritardato boaumento di peso dopo la cessazione dy stress, che indica una disfunzione della regolazione metabolica.
I paradigmi sperimentali utilizzati per questo modello sono i seguenti: (1) un paradigma impotenza acquisita nel ratto dosati con misura della risposta agli stimoli acustici (ASR) e una creazione di grafici di massa corporea, (2) microdissezione del cervello di ratto in regioni e nuclei; ( 3) enzyme-linked test immunoenzimatico (ELISA) per i livelli ematici di CORT, (4) un microarray dell'espressione genica più correlati strumenti bioinformatici 18. Questo microarray, chiamato rMNChip, si concentra su geni nucleari e mitocondriali mitocondri connessi nel ratto, in modo da affrontare specificamente i bioenergetica neuronali ipotizzate di essere coinvolti in PTSD.
Protocollo
1. Animal modello comportamentale di PTSD
- Soggetti: albini maschi Sprague Dawley (Taconic Farms, Derwood, MD) sono utilizzati, ponderazione 150 a 200 g al momento della somministrazione del protocollo stress.
- Misurazione di cibo, l'assunzione di acqua e aumento di peso corporeo: All'arrivo in topi di laboratorio peso 100 ± 25 g sono alloggiati due a una gabbia (dimensioni della gabbia: 45x24x20 cm). Imbottitura substrato Cage (cippato) vengono cambiati due volte a settimana. Gli animali sono mantenuti su un inverso 12 ore ciclo di luce (luci accese: 1800/0600 e si spegne: 0600-1800) a una temperatura di (22 ± 4 ° C) - e umidità relativa (30-70%) ambiente controllato uno settimana prima degli esperimenti. Acqua e standard pellet chow (Harlan (2018) il 18% di proteine dieta Roditore, diete globali, Harlan Teklad) sono liberamente disponibili nelle gabbie a casa, e Il peso corporeo vengono registrati ogni giorno 3 giorni prima, 3 giorni durante e 3 giorni dopo la cessazione del dolore .
- Acclimatazione: I ratti sono acclimatati per tre giorni a both la stabulario e una camera di stimoli acustici. Acclimate loro alla camera stimoli acustici, gli animali sono trattati in esso per 5 minuti ogni giorno per tre giorni consecutivi prima delle misurazioni iniziali.
- Sottolineato protocollo: Gli animali vengono ugualmente assegnati a ciascun gruppo in base al loro peso corporeo e risposta ad uno stimolo basale. Test viene effettuato su due gruppi di animali, ciascun gruppo essendo composto di 16 animali. Gruppo 1 riceve il protocollo stress, e il gruppo 2 è il controllo.
Il protocollo di esposizione stress è un continuo 2-hr procedura, dove ogni sessione consiste di ritenuta ("inevitabile") e di coda shock, ripetuta una volta al giorno per 3 giorni consecutivi. Sottolineando viene fatta al mattino (all'interno della finestra di 0800 e 1200). Animali vengono immobilizzati da essere immobilizzato in un tubo di plexiglass ventilato. Quaranta scosse elettriche (2 mA, 3 sec durata; Animal Test Cage Shocker griglia Piano, Coulbourn Instruments, USA) sono consegnati a loro code a semi-casuali intervalli di 150 to 210 secondi (Graphic software di notazione Stato, Habitest Universal Link, Coulbourn Instruments, USA). La stimolazione a 2 mA è stato scelto perché è avversione, ma non dolorosa, quando l'uscita stimolante è posto in tutta dito dello sperimentatore. Gel dell'elettrodo viene applicato mediante pipetta per formare un sottile strato di gel conduttivo tra l'elettrodo e la pelle della coda del topo. Le clip elettrodi sono regolati e collegati alla coda di garantire un buon collegamento senza influenzare la circolazione del sangue della coda. - Acustica della risposta agli stimoli (ASR): Acustica misura della risposta agli stimoli è stata condotta con un sistema di test Startle acustica di risposta (Coulbourn Instruments, Columbus, Ohio, USA) 3. Questo sistema è costituito peso sensibili piattaforme in un suono attenuato-camera. Il trasduttore, che è un estensimetro, in ciascuna delle piattaforme startle richiede calibratura prima dell'uso. Primo, l'accoppiatore deve essere in modalità di accoppiamento DC per la calibrazione. In questa modalità, l'accoppiatore di uscita disegue direttamente l'ingresso dalla piattaforma, la modalità di approntamento della calibrazione con pesi statiche. Il trasduttore viene commutato al modo di accoppiamento AC durante gli esperimenti in modo che solo cambiamenti rapidi in vigore, che indica risposte di allarme, viene emesso. Movimenti degli animali in risposta a stimoli sonori sono così misurati come variazione di tensione da un estensimetro all'interno di ogni piattaforma e registrata come la risposta massima si verifica entro 200 ms l'insorgenza della startle elicitare stimolo.
Ci sono sei tipi di prove di stimolo: 100 dB da solo, 100 dB con pre-impulso, 110 dB da solo, 110 dB con pre-impulso, pre-impulso solo e senza il controllo dello stimolo. Ogni tipo di prova è stato presentato otto volte. Tipi di prova sono riportati in ordine casuale per evitare effetti di ordine e assuefazione. Inter-prova intervalli variano casualmente 15-25 sec. Tra gli otto studi solo i valori massimi sono raccolti nei risultati e infine regolato con il peso corporeo del giorno stesso. Gli animali vengono testati uno b daylo stress rima o altro trattamento come una lettura di base e 1, 7, 14 e 21 giorni dopo l'ultimo giorno dei consecutive 3 giorni della procedura di stress o altro trattamento. - Analisi dei dati:
- ASR: L'ampiezza della risposta acustica startle testato ogni volta che viene rappresentato come "% di base", che è calcolato usando l'equazione:% di base = (assoluta ampiezza / basale ampiezza assoluta) × 100%. Per ogni giorno di test, ANOVA per misure ripetute sono effettuate su ampiezze spaventare con fattori di stato di stress e di dosaggio del farmaco utilizzando SPSS (Versione 16) software. Test di Tukey, Bonferroni, Dunnett o sono utilizzate per valutare significativi post-hoc differenze tra i singoli gruppi. I dati sono rappresentati come media ± SEM
- Crescita: Peso corporeo e consumo di cibo e acqua sono misurati su Giorno -1 sforzo precedente e nei giorni 14, 21 e 30 dopo il completamento del protocollo di stress. Analisi statistica: dati di assunzione di cibo e l'acqua vengono sottoposti ad uno-modo misure ripetute analisi della varianza (ANOVA). Per analizzare le variazioni della frequenza del consumo alimentare nel tempo, la quantità di cibo è ulteriormente diviso per il peso corporeo del soggetto per minimizzare la varianza del peso corporeo indotto dal protocollo di stress e differenza iniziale nel peso corporeo tra i gruppi. Tutte le procedure vengono svolte sotto la omologazione in conformità con la cura degli animali e del Comitato Istituzionale uso (IACUC).
2. Dissezione del cervello
- Strumenti e materiali:
- Anestesia jar: ". Jar condimento" Questo è un vaso di vetro con coperchio, misura circa 6 cm di altezza e 5 cm di diametro, ad esempio un "vaso di farmacia", "brocca batuffolo di cotone", o
- Ghigliottina per i ratti, come fornito da Kent scientifico.
- Vibratomo 1000:
- Tagliare lama di rasoio a metà longitudinalmente, olio di lavaggio con alcool, inserire nel morsetto.
- Riempire bagno con ordinaria ghiaccio tritato.
- Postoil vassoio longitudinalmente.
- Pulire il vassoio di umidità prima di mettere una goccia di cianoacrilato.
- Rongeurs (Esempi sono una Micro Friedman Rongeur da Miltex, cat. N. 17-4801 o rongeur Pearson da cat Belle Strumenti Science. Senza 16015-17).
- # 3 e # 5 gioiellieri pinza (forte per tirare fuori dura).
- Forbici di piccole dimensioni con punte acuminate (Vantage V95-304 è un esempio).
- (2) Piatti inox mini spatole in acciaio, come ad esempio utilizzato per trasferire le sostanze chimiche in polvere ad una bilancia. L'estremità larga è piegato in avanti, in modo da inserire tra telencefalo e cranica.
- Cucchiaio di trasferire blocco cervello. (Un cucchiaio da minestra di plastica dalla mensa funziona bene.)
- Scalpel # 10.
- Doppia lama di rasoio bordo (acciaio al carbonio):
- Un mezzo per vibratomo.
- Un mezzo per la dissezione.
- Due piastre di Petri in vetro, ~ 3.5 pollici e 4 pollici di diametro, in modo tale che si adatta dentro l'altro. Ghiaccio tritato in la bottom piatto. Due filtri di carta nel piatto superiore. Spostare fetta di posizioni richieste spostando la carta da filtro.
- Becher da 100 ml.
- Contagocce per irrigare cervello con ghiaccio fresco un QCS. (Vetro pipetta Pasteur con estremità più stretta inserita in 1/2 pollici di larghezza lampadina lattice di gomma funziona bene.)
- Schiacciato vaschetta del ghiaccio: Circa 5 cm di altezza, 20 centimetri di lunghezza, 10 cm di larghezza. Contiene:
- Stick tutti gli strumenti del ghiaccio tritato.
- Di calcio a bassa / aCSF magnesio in bottiglia di plastica che può essere sbattuto a schiacciare il ghiaccio.
- Cianoacrilato.
- Di calcio a bassa / alta artificiale liquido cerebrospinale di magnesio (aCSF):
- In mM: 125 NaCl, 2.5 KCl, CaCl 2 0,5 * 2H 2 O, 2,0 MgCl 2 * 6H 2 0, 1,2 NaH 2 PO 4 * H 2 O, 25 NaHCO, 11 glucosio.
- In bottiglia di plastica che può essere sbattuto a schiacciare il ghiaccio.
- Mettere in frigorifero per 20 minuti a -80 ° C per congelatore in una fanghiglia.
- Tamponi di cotone.
- Carta da filtro: Whatman 42,5 millimetri (Cat. N. 1001 042.).
- Provette Mini per raccogliere più piccole sezioni di tessuto.
- Pozzetti piastra per raccogliere grandi strutture e sezioni di tessuto.
- Tovagliolo di carta.
- Red sacchetto.
- Anestesia:
- Jar anestesia, garze, isoflurano, pinze di metallo, sono posizionati in una cappa aspirante.
- Rat si trova in barattolo anestesia.
- Inumidire tampone di garza con isoflurano e mettere in vaso anestesia.
- Attendere fino a quando il pedale riflesso - il ritiro della zampa quando il web è pizzicato con le pinze - o riflesso corneale scompare.
- Decapitare: Cogliere ratto con una mano intorno torace da dietro, decapitare ratto con ghigliottina più vicino all'occipite possibile. L'atlante sarà ancora di solito rimangono attaccato al cranio.
- Il prelievo di sangue: ratto squeeze a torace per evitare che il sangue che sgorga dalle arterie carotidi.Gradualmente rilassarsi aderenza in modo da controllare il flusso di sangue nel recipiente di raccolta.
- La rimozione del cervello:
- Rapidamente tagliare muscoli e ogni vertebre rimanendo lontano dal basiocciput con la forbice di piccole dimensioni.
- Utilizzando rongeur e l'inizio al foro occipitale, tagliare via i condili occipitali e il basiocciput.
- Cuoio capelluto incisione mediana con bisturi.
- Con le forbici, tagliare una incisione sagittale nelle ossa occipitali e parietali. Cogliere il margine di taglio del cranio con i rongeurs, è spezzare la schiena come un guscio d'uovo di distanza dalla linea mediana, facendo attenzione a ridurre al minimo il contatto con il cervello. Il taglio linea mediana e spezzare la schiena può essere fatto in più fasi.
- Come il cervello è ulteriormente esposta, è fondamentale per spegnere con aCSF ghiaccio refrigerati per preservare l'integrità e la vitalità del tessuto.
- Allo stesso modo rompere le ossa temporali e frontali.
- Con una pinza sottile, strappare la dura madre, avendo cura di ottenere iltentorum cervelletto.
- Con spatola mini inserito sotto il lobo frontale sollevare il cervello dal cranica quel tanto che basta per mettere in tensione i nervi cranici.
- Transetto i nervi cranici con la forbice.
- Sollevare completamente il cervello dal cranio e lasciò cadere nel bicchiere ghiacciato di bassi livelli di calcio / magnesio aCSF. Lascia un minuto o più per raffreddare in modo che il tessuto sarà solido, le strutture ben visibili, e la salute del tessuto verranno mantenuti.
- Con il cucchiaio di plastica, trasferire il cervello sulla carta da filtro nel piatto freddo ghiaccio Petri, lato ventrale in alto.
- Dissezione del cervello:
- Effettuare una transezione coronale con lametta a livello dell'arteria cerebrale media (Figura 2A).
- Salva lobo frontale temporaneamente in ghiaccio fresco bassi livelli di calcio / magnesio aCSF in un becher da 100 ml.
- Rifletti cervello in modo che la superficie dorsale è alto. Transetto tronco cerebrale alla giuntura del mesencefalo unnd diencaphalon. Il blocco cervello risultante è visto nella figura 2B.
- Eliminare la parte posteriore cervello bloccato in ghiacciato bassi livelli di calcio / magnesio aCSF.
- Con spatole mini, sezionare cervelletto dal midollo / ponte. Salva nelle matrici appropriate per l'analisi previsto.
- Riportare il cervello bloccato alla piastra di Petri. L'uso di due filtri di carta, sollevare il cervello mettendo una carta da filtro sul ventre. Con esso, posizionare il piano posteriore coronale del cervello bloccato sul bordo della carta secondo filtro. Con questo posto carta filtro del piano di taglio anteriore del cervello bloccato su una goccia di cianoacrilato sul piatto di taglio vibratomo, corteccia di fronte alla lama.
- Con il vibratomo, tagliato appena sufficiente del cervello caudale modo che sul display hippcampus (Figura 2C).
- Prendere una ciocca, 2400 μ di spessore in un topo 125 g, 2.700 μ di spessore in 200 g di ratto. Trasferire la sezione usando un batuffolo di cotone sulle carta da filtro in una capsula di Petri(Figura 2D).
- Tagliare e salvare corteccia del cingolo con la lama di un rasoio.
- Con una spatola dentale, spingono nel margine posteriore del corpo calloso per tagliarlo, quindi rimuovere la isocortex.
- Dal suo margine ventolateral, staccare l'ippocampo (Figura 2E).
- Salvare il mesencefalo.
- Prendete una seconda sezione, 2400 micron di spessore in 120 g di ratto, 2.500 micron di spessore in 200 g di ratto. Posizionare la sezione sulla carta da filtro in scatola di Petri (Figura 2F). In alternativa, cinque sezioni 500 micron possono essere adottate a questo punto per elettrofisiologia.
- Tagliare e salvare corteccia del cingolo con la lama di un rasoio.
- Effettuare tagli laterali con la lama di un rasoio a capsula interna per rimuovere l'isocortex (Figura 2F).
- Fare dei tagli obliqui con la lama di un rasoio per rimuovere il amygdali (Figura 2F, G).
- Crea una casella di tagliare con la lama di un rasoio per rimuovere l'ipotalamo. Il lateraletagli sono laterali al nucleo ventromediale dell'ipotalamo, che è visibile. Facciamo il taglio dorsale appena sopra il terzo ventricolo o ventrale tegmentale zona (Figura 2H).
- Spingere spatola nel corpo calloso e tirare via il piccolo pezzo di isocortex attaccato al ippocampo. Posizionare l'estremità più stretta della spatola ventrale alla commissura ippocampale ed aumentare dorsalmente per tirare fuori l'ippocampo.
- Conservazione di RNA e proteine in campioni di tessuto cerebrale e del Sangue:
- Supporti per il dosaggio RNA:
- Cervello: RNAlater RNA reagente stabilizzazione, # 76.106 in provette Eppendorf.
- Sangue: Sangue PAXgene RNA Tube (PreAnalytix, Quagen).
- Supporto per le proteine (CORT) test del sangue: Soluzione d-HBSS, w / o Ca2 + e Mg 2 +, (di qualità biologica, Inc).
- Conservazione:
- Tessuto cerebrale raccolta viene memorizzato in un cesto di ghiaccio secco per non più di 12 ore e poi in congelatore a -70 ° Cper l'impiego entro 6 mesi, la durata dello studio.
- Sangue raccolto viene mantenuta a temperatura ambiente per una notte per consentire reagenti di penetrare, dopo di che viene memorizzato in un freezer a -70 ° C per l'uso entro 6 mesi, la durata dello studio.
- Supporti per il dosaggio RNA:
3. Microarray Gene di geni nucleari e mitocondriali mitocondri connessi
Per studiare le funzioni di ratto mitocondriale nei tessuti del cervello, abbiamo recentemente sviluppato il ratto mitocondrio-neurone focalizzato microarray (rMNChip) e strumenti bioinformatici per l'identificazione rapida di percorsi differenziali nei tessuti cerebrali 18. rMNChip contiene 1.500 geni coinvolti nelle funzioni mitocondriali, la risposta allo stress, ritmi circadiani e trasduzione del segnale. Lo strumento bioinformatica include un algoritmo di calcolo dei geni differenzialmente espressi, e un database per l'interpretazione semplice ed intuitivo per risultati microarray.
- Purification di RNA totale da tessuti (Cat # GPM-2011-1 Kit, GenProMarkers):
- Ratto tessuti cerebrali di nuclei specifici RNA in RNA reagente dopo stabilizzazione (Qiagen).
- Tissue (30 mg in 600 microlitri GPM-L / B tampone) omogeneizzazione con Ultra-Turrax T8 su Dispergierstation (IKA Labortechnik).
- Centrifugare in 1,5 ml provette a Sorvall 21000 rpm per 15 min.
- Decantare il surnatante in una colonna di spin con un 2 ml provetta di raccolta.
- Centrifugare i tubi-colonna a 15.000 rpm per 3 minuti, scartare il flow-through.
- Aggiungere 700 microlitri GPM-B / W tampone a ciascuna delle colonne di spin, centrifugare le colonne-provette a 16.000 rpm per 15 sec, scartare il flow-through.
- Aggiungere 500 pl GPM-W buffer per ciascuna delle colonne di spin, centrifugare le colonne-provette a 16.000 rpm per 15 sec, ripetere una volta.
- Posizionare la colonna in un nuovo tubo di raccolta 1,5 ml.
- Aggiungere 30 microlitri di acqua trattata con DEPC a ciascuna delle colonne di spin, centrifugare a 16.000 rpm per1 min, ripetere una volta.
- Misurare la concentrazione di RNA, regolare la concentrazione di 1 mg / mL con DNasi-e acqua RNase-free, i campioni sono pronti per l'etichettatura microarray.
- Microarray etichettatura e ibridazione (Cat # Array 900, Genisphere):
- 1,0 mcg ratto RNA totale viene utilizzato per la sintesi di cDNA e l'etichettatura microarray seguendo le istruzioni del produttore.
- Ibridazione microarray è condotta su un rMNChip a 65 ° C per 12-16 hr come precedentemente descritto. 18
- Lavaggio Diapositive Microarray ibridati (Cat # GPM0101-6, GenProMarkers):
Soluzione di lavaggio Volume 20 X SSC 10% SDS DDH 2 O 0.5 X SSC/0.01 SDS 500 ml 12,5 ml 0,5 ml fino a 500 ml 0.5 X SSC 500 ml 12,5 ml fino a 500 ml 0,1 x SSC 500 ml 2,5 ml fino a 500 ml 0,01 X SSC 500 ml 0,25 ml fino a 500 ml
Durante il lavaggio i vetrini devono essere protetti dalla luce. Non lasciare asciugare i vetrini, in qualsiasi momento.- Lavare i vetrini in 250 ml di soluzione 1 in un contenitore di Coplin vaso di vetro (Cat #: 70312-20, Scienze della microscopia elettronica, Hatfield, PA) a temperatura ambiente agitando il vaso su una (Molecular Technologies Inc., St. Louis, MO BioShaker ) fino a quando tutti i vetrini cadere i vetrini (Ci vogliono <3 minuti).
- Lavare i vetrini con 250 ml di soluzione 2 in un altro vaso agitando il vaso per 3 min.
- Lavare i vetrini con 250 ml Soluzione 3in un altro vaso ruotando il vaso per 3 min, ripetendo questa operazione per due volte.
- Lavare i vetrini con 250 ml di soluzione 4 in un altro vaso per 10 sec. Immediatamente asciugare i vetrini per centrifugazione i vasi collocati sui PN11779 piastre e ST-H750 in un rotore Sorvall Super T21 centrifugare a 1000 rpm per 5 min.
- Porre i vetrini lavati in una scatola per la scansione appena possibile.
- Microarray la scansione di immagini e l'analisi con microarray ScanArray espresso Scanner (PerkinElmer) seguendo il manuale di istruzioni e concentrarsi su:
- Microarray scansione di immagini: Easy Scan vs scansione protocollo.
- Effetti del LASER metodi potere, PMT e la normalizzazione dei dati sugli esiti.
- Allineamento di file GAL su immagine.
- Allineamento dei punti di griglie con precisione.
- Analisi dei dati: Le procedure personalizzate di calcolo per l'analisi dei dati microarray includere la valutazione dell'immagine microarray, filtraggio dei dati, dimensioni correzione spot, inclusione, normalization e confronto descritto in precedenza 18. Inoltre, i metodi di analisi ontologia, pathway e rete sono gli stessi descritti in precedenza, al fine di assicurare la generazione dei risultati microarray riproducibile e controllabile 2, 22, 25, 19, 20, 8, 23, 18.
4. Prelievo dei campioni di sangue e di plasma misura della concentrazione CORT
- Pre-o post-stress campioni di coda di sangue provenienti da animali anestetizzati sono raccolti il giorno-1, 14, 21 e 30 in provette eparinizzate per la determinazione dei livelli circolanti CORT.
- Campioni di sangue trunk sono anche raccolti in provette eparinizzate dopo gli animali sono sottoposti a eutanasia. Plasma viene estratto e conservato a -70 ° C fino all'analisi.
- Supporto per l'estrazione del plasma:
- I campioni di sangue per l'estrazione di RNA sono raccolti utilizzando PAXgene sangue RNA tubi (PreAnalytix, Quagen)
- I campioni di sangue per l'estrazione del DNA sono raccolti utilizzando PAXgene tubi del DNA del sangue (PreAnalytix, Quagen).
- I campioni di sangue per l'analisi delle proteine sono raccolti con litio eparina Collection tubo capillare (200 pl) da MaketLab # ML5601.
- La concentrazione plasmatica di CORT è testato e analizzato con Active Rat Cort VIA (Diagnostic Systems Labs Inc. http://www.beckmancoulter.com/ ) come segue:
- Contrassegnare le strisce di microtitolazione da utilizzare.
- Preparare Rat soluzione enzimatica CORT coniugato diluendo Rat concentrato di coniugato enzimatico CORT nel diluente per coniugato.
- Pipettare 25 pl standard, controlli e campioni sconosciuti nei pozzetti.
- Aggiungere 100 ml soluzione di coniugato enzimatico in ogni pozzetto usando un distributore semiautomatico. Battere delicatamente il pozzo titolare 5-10 sec.
- Aggiungere 100 microlitri Rat CORT antisiero in ogni pozzetto usando un distributore semiautomatico.
- Incubare a temperatura ambiente, 25 ° C, su un set agitatore a 500-700 rpm per 60 min.
- Aspirare e lavare ogni well 5 volte con soluzione di lavaggio con un lavaggio automatico per micropiastre. Asciugare capovolgendo la piastra su materiale assorbente.
- Aggiungere 100 ml di soluzione di cromogeno TMB in ogni pozzetto usando un distributore semiautomatico.
- Incubare a 15-20 minuti a temperatura ambiente su un agitatore orbitale per micropiastre impostato a 500-700 rpm. Guarda il cambiamento di colore.
- Aggiungere 100 ul di soluzione bloccante in ogni pozzetto usando un distributore semiautomatico.
- Agitare piastra a mano 5-10 sec.
- Leggere l'assorbanza della soluzione in ben entro 30 min.
- Filtro è fissato a 450 nm. * Il kit EIA possono essere acquistati anche presso i Laboratori immunobiologici ( www.ibl-america.com ).
5. Risultati rappresentativi
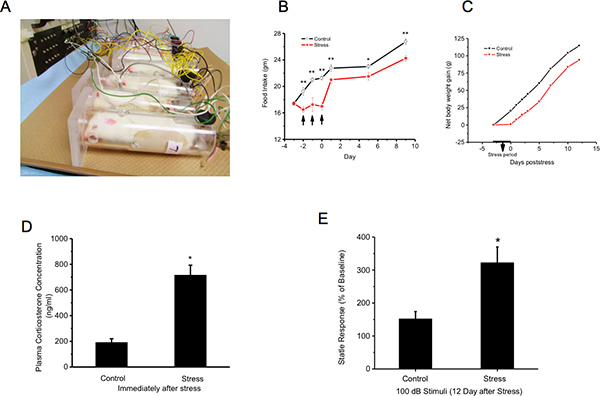
Ratti Figura 1. Vengono trattenuti ed esposti a shock coda. Peso corporeo successiva, La concentrazione plasmatica corticosterone e risposta agli stimoli acustici sono misurati A:. Esposizione allo stress: gli animali vengono immobilizzati da essere immobilizzato in un tubo di plexiglass ventilato. Quaranta scosse elettriche (2 mA, 3 sec durata ;) vengono consegnati alle loro code a semi-casuali intervalli da 150 a 210 secondi B e C:. Stress ritarda aumento del peso corporeo durante la crescita: Peso corporeo e consumo di cibo e acqua sono misurati immediatamente prima di stress (Giorno -3), nel giorno dei tre giorni di stress e poi ogni due giorni ci sarà dopo fino al giorno 14. La mancanza di aumento di peso corporeo durante lo stress non è mai compensata D:.. Stress aumenta la concentrazione plasmatica di corticosterone E: stimoli acustici: gli animali sono testati un giorno prima dello stress (giorno-1) come una lettura di base e 12 giorni dopo l'ultimo giorno del i successivi 3 giorni di stress. I dati per ogni gruppo - Stress e controllo - sono espressi come percentuale di acusticatrasalimento al giorno 12 rispetto al giorno -1. Lo stress aumenta notevolmente il riflesso di trasalimento acustico. Clicca qui per ingrandire la figura .
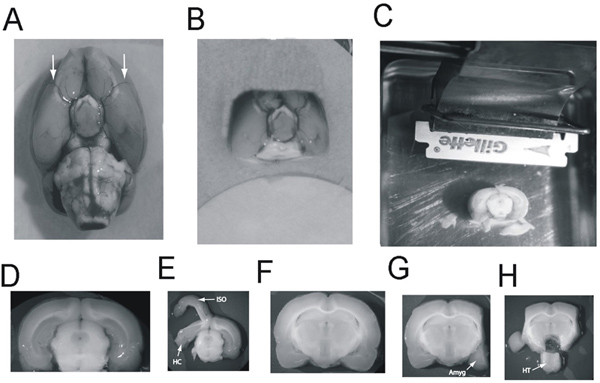
Figura 2 Dissezione della amigdala, ippocampo, ipotalamo e dalla fetta cervello A:.. Cervello di ratto, vista ventrale: Frecce scegliere le arterie cerebrale media B:. Il blocco del cervello, vista ventrale, pronti per essere trasportati al vibratomo. C: Il blocco cervello incollato al vassoio vibratomo, lato caudale up, corteccia di fronte alla lama. Il cervello caudale è già stato tagliato via esponendo l'ippocampo caudale. Il blocco è pronto per i 2500 micron fetta contenente la maggior parte dell'ippocampo da prendere D:. La fetta um 2500 spesso contenente l'ippocampo caudale E:. Tegli isocortex (ISO) è pelato dall'ippocampo (HC) e l'ippocampo pelati dal mesencefalo F:.. La fetta um 2500 spesso contenente l'amigdala e l'ippocampo rostrale G: La isocortex siano state eliminate e la (Amyg) amigdala resecati . H:. L'ipotalamo (HT) è asportato e spostato Clicca qui per ingrandire la figura .
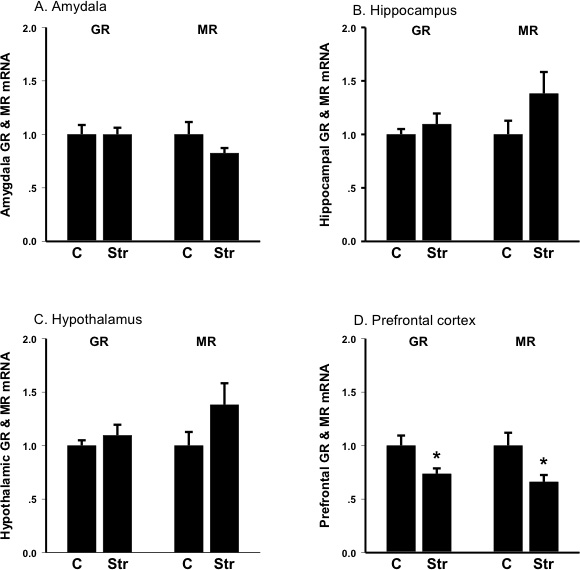
Figura 3. Livelli di espressione di mRNA del recettore di glucocorticoide (GR) e recettore minerocorticoid (MR) in amigdala, ippocampo, ipotalamo e corteccia frontale prima (C, controllo) e dopo (Str) tail-shock stress. Le unità sono parte di controllo; bar sono SEM A: Amigdala: diminuisce lo stress minerocorticoid espressione di mRNA del recettore B: Hippocampus: Increa stress.ses minerocorticoid espressione di mRNA del recettore C:. Ipotalamo:. minerocorticoid Lo stress aumenta l'espressione di mRNA del recettore D: corteccia frontale: Lo stress riduce l'espressione di mRNA del recettore dei glucocorticoidi e minerocorticoid espressione di mRNA del recettore.
| I (121bp) primers per PCR GR di ratto sono: | 1f.CCACTGCAGGAGTCTCACAA 1rAACACCTCGGGTTCAATCAC |
| La (99 bp) primer PCR per ratto MR sono: | 1f.GCCTTCAGCTATGCCACTTC 1rAACGTCGTGAGCACCTTTCT |
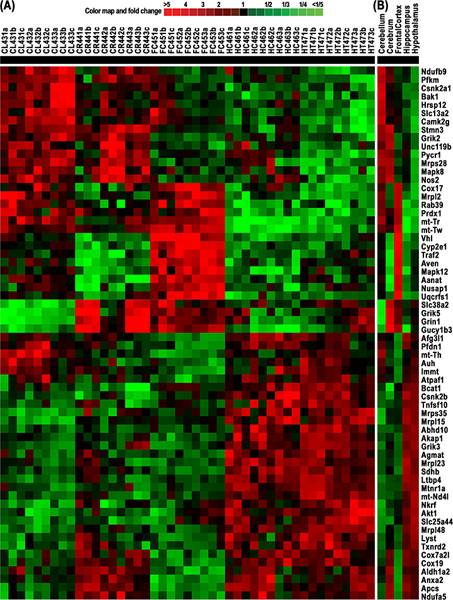
Cluster figura 4. Heatmap e di RNA differenzialmente espressi da 64 geni derivati da tessuti di ratto 5 cerebrali, inclusi cervelletto (CL), cervello (CR), corteccia frontale (FC), ipotalamo (HT), e ippocampo (HC). Mappa a colori indica le modifiche volte per il dproprio (verde) e up-(rosso) geni espressi. (A) e Cluster heatmap delle intensità di segnale normalizzato di 9 misurazioni per ciascuna di 64 geni derivati da 15 esperimenti di microarray per questi tessuti cerebrali cinque. L'espressione di ciascun gene è stata misurata mediante tecniche triplicato e terzine sperimentali. (B) e Cluster heatmap dei livelli medi di RNA di questi 9 misurazioni di ciascuno dei 64 geni. Questi risultati mostrano chiare differenze nell'espressione genica mitocondriale e le funzioni correlate, quindi, che sostengono la nostra ipotesi che le regioni cerebrali diverse hanno esigenze energetiche differenti. Clicca qui per ingrandire la figura .
La nostra applicazione del rMNChip e strumenti bioinformatici portato all'identificazione di un cluster e heatmap di 64 geni differenzialmente espressi con RNA derivati da tessuti cerebrali di ratto 5 compresi cervelletto (CL), cervello (CR), corteccia frontale (FC), hypothaLamus (HT), e ippocampo (HC) (Figura 4). Questi dati dimostrano le nette differenze di espressione genica mitocondriale e quindi le funzioni correlate. I risultati dimostrano che le diverse regioni del cervello richiedono diverse quantità di energia per svolgere funzioni cerebrali corrispondenti.
Discussione
La diagnosi di PTSD si basa sui sintomi riferiti auto psichiatrici (DSM IV) da parte di soggetti potenziali. No biomarcatore ben definito è attualmente disponibile per accedere allo stato fisiopatologico del potenziale PTSD pazienti. PTSD è una malattia provocata da eventi traumatici in pericolo di vita e le principali sintomi psichiatrici rimanere presente nella vita del sopravvissuto per mesi e anche anni dopo gli eventi iniziali. I sintomi più importanti e persistenti rivelate nei pazienti con PTSD sono ipervigilanza, ritardata risposta esagerata trasalimento 14, 15, 16 e un compromesso apparente dell'asse HPA. Negli esseri umani questi sintomi rimangono, o apparire con un ritardo di tre mesi, dopo la cessazione del fattore di stress traumatico 24. Il nostro attuale modello per lo studio dei biomarcatori di PTSD impiega moderazione e ripetuti colpi di coda per tre giorni consecutivi (2 sessioni di 40 ore, 2 tailshocks mA) - l'inevitabile coda-shock modello (ITS) in topi dal peso di 150 grammi. Questo modello è dotato di ITSdimostrato di mimare in misura sostanziale la fisiopatologia di PTSD 17, 7, 4, 10. Il nostro laboratorio e di altri laboratori hanno verificato che il suo modello di stress nei ratti induce alterazioni comportamentali e neurobiologici che sono simili a quelli trovati in soggetti PTSD 17, 7, 10, 9. In particolare, questi ratti stressati presentano (1) una risposta ritardata ed esagerata startle apparire diversi giorni dopo la cessazione fattore di stress, che, data la scala compressa tempo della vita del ratto rispetto ad un uomo, corrisponde al ritardo di uno a tre mesi dei sintomi del PTSD pazienti (DSM-IV-TR PTSD Criterian D / E 13), (2) una maggiore corticosterone plasma (CORT) per alcuni (10) giorni, indicando compromesso dell'asse hypothalamopituitary (HPA), e (3) ritardato aumento di peso corporeo dopo stress cessazione, corrispondente alla disfunzione della regolazione metabolica del PTSD. Non vi sono evidenze in letteratura che l'odore di volpe, l'esposizione predatore, o temono potenziato risposte di allarme, esposibit di questi fenotipi comportamentali persistenti e neuroendocrinologic associato PTSD.
I ratti esposti a una sessione di stress singola (1DS) hanno mostrato transitoria, ma non le anomalie persistenti visualizzati da 3DS ratti 17 Il presente esperimento confrontato la risposta di startle 3DS e 1DS ratti 4, 7, e 10 giorni dopo la sospensione di stress. Coerentemente con il lavoro precedente, ha sottolineato ratti esposti elevati livelli plasmatici basali di CORT il primo stress post giorno 17. Questi livelli di CORT erano sensibili al numero di fattori stressanti con livelli più elevati nei ratti CORT 3DS che in 1DS ratti. Per quanto riguarda la risposta agli stimoli, i ratti 1DS mostrano una risposta esagerata trasalimento dopo 7 giorni di stress, mentre la sensibilizzazione trasalimento diventa evidente solo 10 giorni dopo stress nei ratti 3DS. Così, l'aspetto di una risposta esagerata trasalimento dopo la cessazione stress sembra essere correlato al numero di esposizioni sessione di stress. Il modello 3DS sembra stressataessere utile al fine di conoscere l'alterata espressione di biomarcatori associati con i sintomi di PTSD e delle principali fenotipi misurabili comportamentali associati con il tempo a seguito della cessazione del dolore. Risultati genomiche presentato fornire la prova di principio per l'applicazione di strumenti di rMNChip e bioinformatica per individuare percorsi differenziali, e biomarcatori genica e proteica, che agevolerà notevolmente sistemi biologici studio e la comprensione dei meccanismi molecolari alla base di malattie neurologiche complesse e multifattoriali, tra PTSD.
Mentre il nostro paradigma non approfondire l'aspetti cognitivi e comportamentali più complessi di PTSD, si nota che i modelli di sonno alterati nel suo modello 1 corrispondono alla difficoltà caduta e mantenere il sonno e gli incubi di PTSD pazienti 11 (DSM-IV-TR PTSD Criteri D 13), e le carenze in fuga / evitamento e l'apprendimento di un compito appetitivo nel suo modello 12 corrisponde alle concentrazioni poveri e dei deficit di memoria di PTSD 5 (DSM-IV-TR PTSD criteri C 13). L'attuale modello è ben correlato con i sintomi principali caratteristici del PTSD e fornisce un buon modello per la correlazione di biomarcatori periferici di PTSD, che possono essere prelevati da pazienti, con centrali, biomarcatori meccanicistiche, che non può 6.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dal CDMRP, USUHS Grants G188LE, G188MG, e G188QC (per HL), e il Centro per lo Studio USUHS di stress traumatico.
Riferimenti
- Adrien, J., Dugovic, C., Martin, P. Sleep-wakefulness patterns in the helpless rat. Physiol. Behav. 49, 257-262 (1991).
- Bai, X., Wu, J., Zhang, Q., Alesci, S., Manoli, I., Blackman, M. R., Chrousos, G. P., Goldstein, A. L., Rennert, O. M., Su, Y. A. Third-generation human mitochondria-focused cDNA microarray and its bioinformatic tools for analysis of gene expression. Biotechniques. 42, 365-375 (2007).
- Blaszczyk, J. W. Startle response to short acoustic stimuli in rats. Acta Neurobiol. Exp. (Wars.). 63, 25-30 (2003).
- Braga, M. F., roniadou-Anderjaska, V., Manion, S. T., Hough, C. J., Li, H. Stress impairs alpha(1A) adrenoceptor-mediated noradrenergic facilitation of GABAergic transmission in the basolateral amygdala. Neuropsychopharmacology. 29, 45-58 (2004).
- Bremner, J. D., Vythilingam, M., Vermetten, E., Anderson, G., Newcomer, J. W., Charney, D. S. Effects of glucocorticoids on declarative memory function in major depression. Biol. Psychiatry. 55, 811-815 (2004).
- Garrick, T., Morrow, N., Eth, S., Marciano, D., Shalev, A. Psychophysiologic parameters of traumatic stress disorder in rats. Ann. N.Y. Acad. Sci. 821, 533-537 (1997).
- Garrick, T., Morrow, N., Shalev, A. Y., Eth, S. Stress-induced enhancement of auditory startle: an animal model of posttraumatic stress disorder. Psychiatry. 64, 346-354 (2001).
- Hsiao, Y. H., Su, Y. A., Tsai, H. D., Mason, J. T., Chou, M. C., Man, Y. G. Increased invasiveness and aggressiveness in breast epithelia with cytoplasmic p63 expression. Int. J. Biol. Sci. 6, 428-442 (2010).
- Jiang, X., Xing, G., Yang, C., Verma, A., Zhang, L., Li, H. Stress Impairs 5-HT(2A) Receptor-Mediated Serotonergic Facilitation of GABA Release in Juvenile Rat Basolateral Amygdala. Neuropsychopharmacology. , (2008).
- Jiang, X., Zhang, Z. J., Zhang, S., Gamble, E. H., Jia, M., Ursano, R. J., Li, H. 5-HT2A receptor antagonism by MDL 11,939 during inescapable stress prevents subsequent exaggeration of acoustic startle response and reduced body weight in rats. J. Psychopharmacol. , (2009).
- Maher, H. K. Sleep deprivation: are you a victim. AAOHN. J. 54, 548 (2006).
- Maier, S. F. Exposure to the stressor environment prevents the temporal dissipation of behavioral depression/learned helplessness. Biol. Psychiatry. 49, 763-773 (2001).
- North, C. S., Suris, A. M., Davis, M., Smith, R. P. Toward validation of the diagnosis of posttraumatic stress disorder. Am. J. Psychiatry. 166, 34-41 (2009).
- Orr, S. P., Metzger, L. J., Pitman, R. K. Psychophysiology of post-traumatic stress disorder. Psychiatr. Clin. North Am. 25, 271-293 (2002).
- Orr, S. P., Roth, W. T. Psychophysiological assessment: clinical applications for PTSD. J. Affect. Disord. 61, 225-240 (2000).
- Pitman, R. K., Orr, S. P., Shalev, A. Y., Metzger, L. J., Mellman, T. A. Psychophysiological alterations in post-traumatic stress disorder. Semin. Clin. Neuropsychiatry. 4, 234-241 (1999).
- Servatius, R. J., Ottenweller, J. E., Natelson, B. H. Delayed startle sensitization distinguishes rats exposed to one or three stress sessions: Further evidence toward an animal model of PTSD. Biological Psychiatry. 38, 539-546 (1995).
- Su, Y. A., Zhang, Q., Su, D. M., Tang, M. X. Rat Mitochondrion-Neuron Focused Microarray (rMNChip) and Bioinformatics Tools for Rapid Identification of Differential Pathways in Brain Tissues. Int. J. Biol. Sci. 7, 308-322 (2011).
- Su, D. M., Zhang, Q., Wang, X., He, P., Zhu, Y. J., Zhao, J., Rennert, O. M., Su, Y. A. Two types of human malignant melanoma cell lines revealed by expression patterns of mitochondrial and survival-apoptosis genes: implications for malignant melanoma therapy. Mol. Cancer Ther. , (2009).
- Su, Y. A., Li, H., He, P., Webster, M. J., Zhang, Q., Zhang, L., Wang, X., Su, D. M., Ursano, R. J., Rennert, O. M. Identification of stress-responsive genes, canonical pathways, molecular networks and drug targets in brain tissues of human and animals for systems-biology study of post-traumatic stress disorder. , (2009).
- Su, Y. A., Wu, J., Zhang, L., Zhang, Q., Su, D. M., He, P., Wang, B. D., Li, H., Webster, M. J., Rennert, O. M., Ursano, R. J. Dysregulated mitochondrial genes and networks with drug targets in postmortem brain of patients with posttraumatic stress disorder (PTSD) revealed by human mitochondria-focused cDNA microarrays. Int. J Biol. Sci. 4, 223-235 (2008).
- Su, Y. A., Yang, J., Tao, L., Nguyen, H., He, P. Undetectable and Decreased Expression of KIAA1949 (Phostensin) Encoded on Chromosome 6p21.33 in Human Breast Cancers Revealed by Transcriptome Analysis. J. Cancer. 1, 38-50 (2010).
- Yehuda, R., Yang, R. K., Buchsbaum, M. S., Golier, J. A. Alterations in cortisol negative feedback inhibition as examined using the ACTH response to cortisol administration in PTSD. Psychoneuroendocrinology. 31, 447-451 (2006).
- Zhang, Q., Wu, J., Nguyen, A., Wang, B. D., He, P., Laurent, G. S., Rennert, O. M., Su, A. Molecular mechanism underlying differential apoptosis between human melanoma cell lines UACC903 and UACC903(+6) revealed by mitochondria-focused cDNA microarrays. Apoptosis. 13, 993-1004 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon