Method Article
Der Nachweis von Human-Leukozyten-Antigen Biomarkern bei Brustkrebs Verwendung Markierungsfreie Biosensorik
In diesem Artikel
Zusammenfassung
Intakte Klasse I HLA / Peptid-Komplexe werden von Krebszellen zu vergießen, was einem Potential von Bedeutung sind Krebs-Biomarker. Verwendung markierungsfreie Sensorik und T-Zell-Rezeptor imitiert monoklonalen Antikörpern, Nachweis von Schuppen MIF / HLA-A * 02: 01-Komplexe in MDA-MB-231 Zellüberstände, Stachelhumanserum und Patientenplasma wird gezeigt, so dass die Entwicklung von ein neuer Krebsdiagnoseplattform.
Zusammenfassung
Nach Angaben der American Cancer Society, werden mehr als 200.000 Frauen mit invasivem Brustkrebs pro Jahr diagnostiziert, und rund 40.000 an der Krankheit sterben. Die menschliche Leukozyten-Antigen (HLA) Klasse-I-Peptide, die von Proben proteasomalen Abbau von Zellproteinen abgeleitet und stellt diese Fragmente auf der Zelloberfläche für die Abfrage durch zirkulierende cytotoxische T-Lymphozyten (CTL). Erzeugung von T-Zell-Rezeptor-Mimetikum (TCRM) monoklonale Antikörper (mAbs), die Brustkrebs erkennen spezifische Peptid / HLA-A * 02: 01-Komplexe, wie sie aus Makrophagen-Migration-Hemmfaktor (MIF 19-27) und NY-ESO- abgeleiteten 1, 157-165 aktivieren Erkennung und Zerstörung von Brustkrebs-Zellen in Abwesenheit einer wirksamen Antitumor-CTL-Antwort. Intakte Klasse I HLA / Peptid-Komplexe werden von Brustkrebszellen zu vergießen und stellen möglicherweise relevanten Biomarkern. In dieser Arbeit wurde ein Durchbruch Biomarker-Screening-System für die Krebsdiagnostiks Einbeziehung T-Zell-Rezeptor mimic monoklonalen Antikörper in Kombination mit einem neuartigen, markierungsfreie Biosensor Verwendung Geführte-Mode-Resonanz- (GMR-) Sensor-Technologie dargestellt. Der Nachweis von Schuppen MIF / HLA-A * 02: 01-Komplexe in MDA-MB-231 Zellüberstände, Stachelhumanserum und Patientenplasma wird demonstriert. Die Auswirkungen dieser Arbeit konnte personalisierten Medizin durch die Entwicklung von Begleiterkrankungen Diagnose gezielter Immuntherapien zu revolutionieren.
Einleitung
Die Klasse-I-Human-Leukozyten-Antigen (HLA) Proben Peptide von 8-11 Aminosäuren in der Länge von der proteasomalen Abbau des intrazellulären Proteins Repertoires abgeleitet und stellt diese Peptide auf der Oberfläche jeder kernhaltigen Zelle 1,2. Der HLA-Komplex ist "Natur Biomarker", was den Zustand jeder Zelle (1) zum umlaufenden zytotoxischen T-Lymphozyten (CTL). Die Anerkennung der Krankheit assoziierten Peptiden ergibt Beseitigung des betreffenden Zelle durch CTL. Daher ist die adaptive Immunantwort sehr wirksam zur Beseitigung von viralen Infektionen und Tumoren. Allerdings übt das Immunsystem Druck, der oft fördert Auswahl auf Viren oder Tumor der Lage Umgehung eine effektive CTL-Antwort. T-Zell-Rezeptor nachahmen (TCRM) monoklonale Antikörper (mAbs), die spezifische Peptid / HLA-A * 02 zu erkennen: 01-Komplexe, wie die von Brustkrebs-assoziierten Proteinen, Makrophagenmigration-Hemmfaktor, abgeleitet (MIF19-27) 3 und NY-ESO-1, 157-165, ermöglichen Detektion und Zerstörung von Brustkrebs-Zellen in Abwesenheit einer wirksamen Antitumor-CTL-Reaktion 4,5. Diese repräsentative Arbeiten an HLA-A * 0201-Molekül, das durch bis zu 30% der Population exprimiert wird, konzentriert. Die Identifizierung von anderen relevanten HLA / Peptid-Komplexe, gefolgt von der Herstellung von TCRM ermöglicht jedoch die Entwicklung gezielter Immuntherapien und Begleiterkrankungen Diagnostik, erweitern den Nutzen dieser Arbeit zu einem viel breiteren Bevölkerung.
Ein Teil des Peptid / HLA-Komplexen zur Zelloberfläche gebunden ist, in das Plasma freigesetzt. Aufgrund der hohen Komplexität von Peptid / HLA-Pools, aktuelle Methoden für den Bergbau die immunopeptidome für HLA verbundenen Biomarker sind zeitaufwendig. Dieses Verfahren erfordert die Affinitätsreinigung von löslichem HLA aus Plasma, Abscheidung von HLA assoziierten Peptiden durch Umkehrphasen-Hochdruckflüssigkeitschromatographie(RP-HPLC) und Peptidsequenzierung durch Tandem-Massenspektrometrie (MS / MS) 6,7. Obwohl dieses Verfahren eine praktikable Option für die Entdeckung neuer therapeutischer Ziele, es ist ein schwerfälliger Prozess als Begleiter Diagnose-Tool für HLA damit verbundenen Ziele bereits in der therapeutischen Impfstoff oder biopharmazeutische Pipeline 8-10. TCRM gerichtet gegen diese Ziele stellen die Werkzeuge für die schnelle Entwicklung eines diagnostischen Begleit bei Stratifizierung Patienten in relevanten klinischen Studien und bieten fundierte Therapiemöglichkeiten abzielen.
In dieser Arbeit wird ein Durchbruch Biomarker-Screening-System für die Krebsdiagnostik vorgestellt, TCRM und eine markierungsfreie Bioassay-System, das den biologischen Wechselwirkungen mit minimalen Verarbeitungsschritte überwacht nutzt. Die markierungsfreie Bioassay-System basiert auf einem Verfahren, das die Geführte-Mode-Resonanz- (GMR-) Effekt, der in der dielektrischen Wellenleitergitter 11-14 auftritt nutzt basiert. Bei Breitbandlicht Kontakte die diffraktiveGitter in der für dieses System erforderlichen Platten werden zwei bestimmte Wellenlängen reflektiert. Die Bindungswechselwirkung zwischen einem immobilisierten Rezeptor und seinem Liganden wird in Echtzeit durch Verfolgung der Resonanzwellenlängenverschiebung mit einem Spektrumanalysator 12 überwacht. Separate Resonanzspitzen auftreten, für einfallendes TE (elektrische Vektor senkrecht zur Einfallsebene) und TM (Magnetvektor normal zur Einfallsebene) Polarisationszustände Bereitstellen mehrerer Datenpunkte, die möglicherweise erhöhen Erfassungsgenauigkeit 11,14. Verwendung des Antikörpers vorsensibilisierten Platten in diesem markierungsfreien Assaysystem, das Assay Laufzeit mit der Datenanalyse ist ungefähr 45 min. Darüber hinaus können mehrere Patientenproben in einem 96- oder 384-Well-Format über eine HPLC-MS / MS-basiertes Format abgefragt werden, ist klar im Vorteil.
Protokoll
Ethics Statement: De identifizierten menschlichen Gewebe- und Plasmaproben wurden von Hendrick Medical Center unter einem Institutional Review Board erhalten genehmigten Protokoll.
1. Die Zugabe von biotinylierten Antikörpers
HINWEIS: Die Überwachung dieser Schritt ist optional. Siehe alternative Protokoll, wenn keine Überwachung.
- Besorgen Sie handelsübliche Avidin-Derivat beschichteten Platten (siehe Materialien und Geräte Tabelle).
- Dann werden 50 & mgr; l phosphatgepufferter Salzlösung (PBS) pH 7,2 in die Vertiefungen.
HINWEIS: vorinkubieren PBS bei 28 ° C temperaturabhängige Resonanzverschiebungen zu minimieren. - Öffnen Bioassay-Scanner-Software und folgen Sie den Setup-Assistenten, um das experimentelle Verfahren, die Auswahl von Leer-, Standard- und Proben im Plattenlayout Temperatureinstellung (28 ° C), die Anzahl der Scans pro min umfasst definieren (1), und die Dauer des Experiments ( 150 min, für präparative Schritte unterzubringen).
- Legen Sie die Testplatte vorbereitet in das Etikett frei Bioassay-Scanner und starten Sie den ersten Scan. Wenn der erste Scan abgeschlossen ist, wählen Sie "Selbst Bezug auf starten". Die Grundlinie ist die erste Reihe von Abtastungen zu Beginn des Experiments gesammelt. Wenn dies das erste Lese zu diesem speziellen Platte durchgeführt, damit der Scanner ausführen zu temperieren und zu beseitigen Drift der Basislinie. Abbildung 2 zeigt einen Screenshot einer Baseline, gefolgt von Probenzugabe.
- Nachdem die Grundlinie stabilisiert hat oder zumindest 5-Scans, halten Sie den Lese- und Auswerfen der Platte.
- Entfernen PBS durch das Einbringen in die Spüle und fügen Sie 50 ul RL21A biotinyliertem Antikörper an [10 ug / ml in PBS pH 7,2], um alle außer Kontrolle Vertiefungen auf der Platte. Dann werden 50 & mgr; l PBS zu den Kontrollvertiefungen.
- Legen Sie die Platte wieder in den Bioassay-Scanner und wieder lesen, bis eine Sättigung erreicht ist, etwa 1,5 Stunden.
- Unterbrechen Sie die Lese- und Auswerfen der Platte.
- Waschen Sie die Platte 3-mal mit 200 ul / Vertiefung phosphatgepufferter Kochsalzlösung + 0,05% Tween 20 (PBST) gewaschen, gefolgt von 3 Spülungen mit 200 ul / Vertiefung PBS, pH 7,2. Wiederholen Sie mit PBS. Tippen Sie überschüssiges PBS von Platte auf Küchenpapier vor dem Umzug mit dem nächsten Schritt.
HINWEIS: Dieser Schritt kann auf einem automatischen Plattenwäscher durchgeführt oder waschen Sie die Platte 3-mal mit 200 ul PBST durch das Einbringen von Flüssigkeit in einem Waschbecken und ersetzen PBST mit einer Pipette werden. - In 50 ul PBS pH-Wert 7,2 an alle aktiven Brunnen.
- Legen Sie die Platte wieder in den Bioassay-Scanner und wieder lesen, um nach dem Waschen Resonanz zu überwachen.
- Stoppen Sie den Lese- und Auswerfen der Platte.
Alternatives Protokoll für Schritt 1:
- In 50 ul RL21A biotinyliertem Antikörper an [10 ug / ml PBS] in alle Vertiefungen.
- Inkubiere bei Raumtemperatur für 1,5 h oder über Nacht bei 4 ° C.
- 3-mal waschen Sie die Platte mit 200 ul / von 3 Spülungen mit 200 ul / Vertiefung PBS gut PBST, gefolgt wie in Schritt 1.9.
- Entfernen Sie die PBS und 50 ul pro Vertiefung geeigneter Assay-Puffer. Für diesen Test wurde kommerziell erhältlichen normalen menschlichen Serum 1:20 verdünnt in PBS.
- Öffnen Bioassay-Scanner-Software und folgen Sie den Setup-Assistenten, um experimentelle Verfahren zu definieren.
- Legen Sie die Platte in den Bioassay-Scanner und beginnen eine Baseline zu lesen. Wenn dies das erste Lese zu diesem speziellen Platte durchgeführt, lassen Sie den Scanner laufen zu temperieren und zu beseitigen Drift der Basislinie.
- Nachdem die Grundlinie stabilisiert hat oder zumindest 5-Scans, halten Sie den Lese- und Auswerfen der Platte.
- Entfernen Sie die Testpuffer aus den Vertiefungen.
- Spike Steuerungen mit HLA A * 02: 01 tragendes Monomer relevant (FLSL) oder irrelevante (SLLV, YLEV oder KVL) Peptide bei Konzentrationen von [0,625 bis 10 & mgr; g / ml] in Assay-Puffer. Dann werden 50 ul des Standards in den Kontrollvertiefungen der Platte
- Dann werden 50 ul des Analyten in Testpuffer auf die ProbeVertiefungen der Platte. Für diesen Assay versetzt kommerziell verfügbaren Humanserum verwendet wurde.
- Legen Sie die Platte wieder in den Bioassay-Scanner und wieder lesen, bis eine Sättigung erreicht ist, etwa 30 bis 60 min.
- Unterbrechen Sie die Lese- und Auswerfen der Platte.
- 3-mal waschen Sie die Platte mit 200 ul / von 3 Spülungen mit 200 ul / Vertiefung PBS gut PBST, gefolgt wie in Schritt 1.9.
- In 50 ul Testpuffer auf allen aktiven Brunnen.
- Legen Sie die Platte wieder in den Bioassay-Scanner und wieder lesen, um nach dem Waschen Resonanz zu überwachen.
- Stoppen Sie den Lese- und Auswerfen der Platte.
HINWEIS: Der Assaypuffer konnte PBS, Zellkulturmedium oder Humanserum je nach Ziel des Assays in PBS 1:20 verdünnt werden.
3. Datenanalyse
- Analysieren Sie mit Hilfe der Bioassay-Scanner-Software oder Exportrohdatendateien auf bevorzugte statistische Analyse-Software. Der Bioassay-Scanner-Software generiert automatisch die Bindungskurve, die auf diePlattenlayout im Versuchsaufbau zur Verfügung gestellt.
HINWEIS: Falls nicht mit dem Bioassay-Scanner-Software für die Analyse, die Schritte 3,2-3,4. - Subtrahieren Sie die Grundlinie und Negativkontrolle von jeder weiteren Datenpunkt.
- Berechnen Sie den Mittelwert und Standardabweichung für replizieren Brunnen zu jedem Zeitpunkt.
- Generieren Sie ein Diagramm der Bindungskurve oder wählen Endpunktdaten für Balkendiagramme.
Ergebnisse
Ein repräsentativer Satz von Experimenten wurde unter Verwendung des gut charakterisierten TCRM, RL21A, ein murines IgG2a monoklonaler Antikörper, der spezifisch für ein Peptid (MIF 19-27 oder FLSL) im Rahmen des HLA-A * 02: 01 Molekül 3. Die verwandten Peptid / HLA-Monomer sowie irrelevanten HLA-Monomer 15 wurde verwendet, um das beschriebene Verfahren zu demonstrieren. 3 zeigt den Assay-Format.
RL21A ist spezifisch für die FLSL / HLA-Monomer mit geringer Kreuzreaktivität mit anderen Peptid / HLA-Komplexe 3. Diese Besonderheit wird mit der markierungsfreien Bioassay-System (Abbildung 4) rekapituliert. Die Empfindlichkeit des Etiketts frei Bioassay-System für diesen Versuch ist in niedrigen nanomolaren Bereich durch Titration des RL21A Antikörper immobilisiert auf FLSL / HLA-Monomer (Abbildung 5) bestimmt. Obwohl das Hintergrundsignal wesentlich im Serum erhöht, specific Detektion FLSL / HLA-Monomer in Stachelhumanserum ist in Figur 6 erreicht und ein Konzentrationsgradient ist leicht erkennbar in diesen Proben. Schließlich Stände aus der MDA-MB-231-Zelllinie, die zuvor gezeigt, dass die FLSL / HLA-A * 02 zu präsentieren: 01 Molekül, werden gezeigt, um lösliche FLSL Monomer enthalten mit diesem Etiketten kostenlose Testplattform (Bild 7). Anschließende Zugabe FLSL / HLA-Monomer erhöht das Signal auf RL21A (Abbildung 7). Aufgrund der Empfindlichkeit des Systems, ebenso gut Variation einschließlich negativer Resonanzverschiebungen können als Ergebnis von Temperaturschwankungen auftreten können, wie ersichtlich als Funktion der Standardabweichungen in den 4 und 5. Diese Variationen können dramatisch durch Vorinkubation von allen Proben und dem Bioassay-Plattenleser bei einer Temperatur etwas höher als Raumtemperatur (dh 28 ° C) reduziert werden.
In 8 kurz, 96-Wanne Polystyrol-Platten wurden beschichtet mit [10 ug / ml] RL21A für 2 h bei Raumtemperatur mit PBST gewaschen, mit 0,5% fettarme Milch, mit PBST gewaschen, blockiert, und während 2 Stunden bei Raumtemperatur mit seriellen Verdünnungen inkubiert FLSL HLA-Monomer in normalem Humanserum, 1:10 verdünnt in PBS, eine Standardkurve zu erzeugen oder Patientenplasma verdünnt 1:10 in PBS. Die Platte wurde mit PBST gewaschen, inkubiert 1 h bei Raumtemperatur mit Kaninchen-Anti-Human-β2 Mikroglobulin [1: 5000], um intakte HLA detektieren und in PBST gewaschen. Die Platten wurden dann für 30 min mit Ziege-Anti-Kaninchen IgG [1: 10.000] inkubiert und mit PBST gewaschen. Kolorimetrische Nachweis wurde unter Verwendung von ABTS (2,2'-Azinobis [3-ethylbenzothiazolin-6-sulfonsäure] -diammonium Salz) Substrat mit einer 15 min Inkubationszeit und bei 405 nm auf einem Mikroplattenlesegerät beobachtet. FLSL / HLA wurde in drei Patientenproben nachgewiesen.
In 8B wurde Patientenplasma RL.064 1:20 in PBS verdünnt und fügened zu der Platte und auf der markierungsfreien Detektor für 60 min überwacht. Spezifischer Nachweis von FLSL / HLA-Komplex in Patientenserum wurde durchgeführt. Student t-Test wurde unter Verwendung von Grafiken und Statistik-Software (p <0,05).
In 8C Gewebeschnitte wurden mit 1 & mgr; g / ml mit Maus anti-HLA-A2 (BB7.2) als eine positive Kontrolle, RL21A, IgG2b und IgG2a bzw. als Negativkontrolle angefärbt. Die Färbung wurde mit einem Anti-Maus-Nachweis-Kit, DAB (Diaminobenzidin) und Hämatoxylin QS für die Kernfärbung, wie vom Hersteller gerichtet erkannt. Die Färbung von Tumorgewebe durch RL21A bestätigt Präsentation FLSL / HLA-Komplexen.
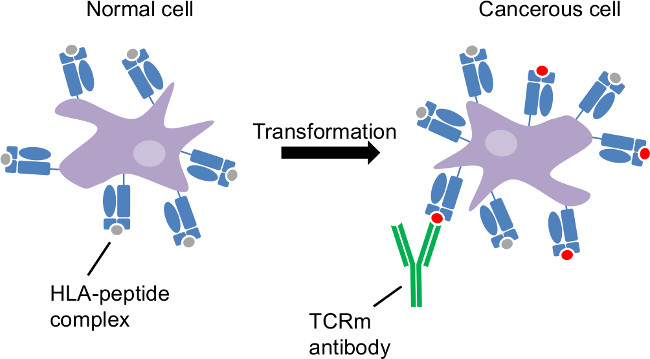
Abb. 1: Tumor-Antigen-Präsentation durch die Klasse-I-Human-Leukozyten-Antigen-Krebs Transformation ist ein intrazelluläres Störung. HLA Probe intracellular Proteine und zeigen krebsbedingte Veränderungen an der Zelloberfläche. CTL und TCRM können Krebszellen durch HLA-Peptid-Komplexe unterscheidbar diesen Zellen zu erkennen.

Abb. 2: Screenshot der Datenerfassung im Biotest-Scanner-Software Beispiel für die Datenerfassung, die die anfänglichen Basis-Scan durch RL21A Antikörper zusätzlich zu einer Platte mit 10 ug / ml FLSL / HLA-Komplex beschichtet gefolgt. Antikörperkonzentrationen sind wie angegeben. Jede Zeile steht für eine Einzelperson gut über die Zeit verfolgt.

Abb. 3: Assay-Format Illustration von Antikörpern auf dem Beugungsgitter Oberfläche der Testplatte Erfassung rel immobilisierteinschlägigen Peptid / HLA-Komplexe in Lösung.

Abbildung 4: Spezifität der RL21A für FLSL / HLA-Komplex Demonstration der Spezifität der biotinyliert RL21A TCRM für seine relevanten (FLSL) HLA-Monomer verglichen mit irrelevanten HLA-Monomer (YLEV, SLLV und KVL).. Biotinylierte RL21A TCRM [10 ug / ml] auf der Avidin beschichtete Assayplattenoberfläche immobilisiert und der Nachweis wurde durchgeführt unter Verwendung von unmarkierten relevant oder irrelevant HLA Monomer [10 & mgr; g / ml] in PBS. RL21A war spezifisch für FLSL / HLA-Komplex. Zwei-Wege-ANOVA wurde mit Grafik und Statistik-Software (p <0,001).

Abb. 5: Die Bindung Empfindlichkeit RL21A zu seinem verwandten Peptid / HLA-Komplex Illustration der Detektiveam Limit und verbindliche Empfindlichkeit RL21A auf die FLSL / HLA-Komplex. Biotinylierte HLA Monomer FLSL [10 ug / ml] wurde auf der Testplatte Oberfläche immobilisiert und unmarkierte RL21A wurde der Platte in seriellen Verdünnungen in PBS wie angegeben zugegeben. Erkennung für dieses System war in niedrigen nanomolaren Bereich.
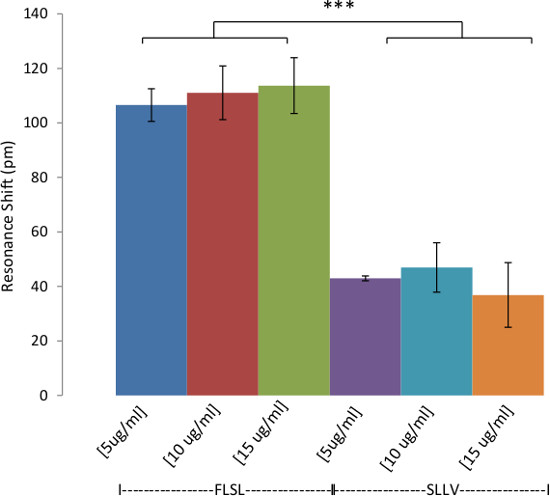
Abbildung 6: Nachweis von HLA-Komplexe in Spitz Human Serum Nachweis der Nachweis von HLA im Humanserum.. Biotinylierte RL21A TCRM [10 ug / ml] auf der Avidin beschichtete Assayplattenoberfläche immobilisiert. Gepoolten normalen Humanserum relevant (FLSL) oder irrelevante (SLLV) HLA-Monomer versetzt wurde 1:20 mit PBS verdünnt und dann zu der Platte und auf der markierungsfreien Detektor für 60 min überwacht. Spezifischer Nachweis von FLSL / HLA-Komplex in Humanserum wurde durchgeführt. In der Regel hoch ist Hintergrundsignal (irrelevant SLLV Monomer)er für verdünnten Serumproben im Vergleich zu reinig Analyten in PBS (siehe Abbildung 4). Zwei-Wege-ANOVA wurde mit Grafik und Statistik-Software (p <0,0001).
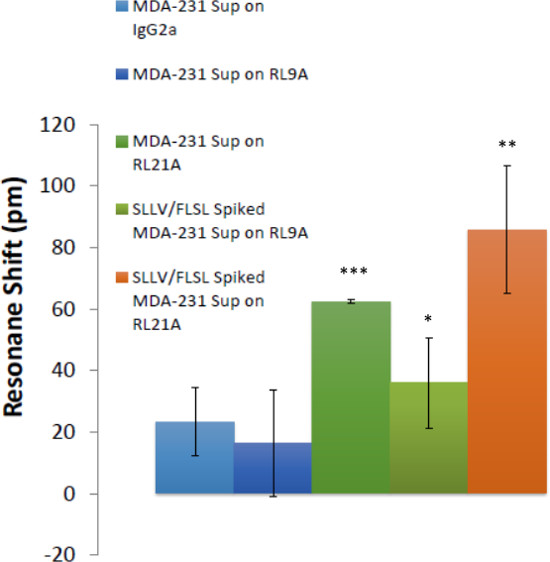
Abb. 7: Lösliche HLA-Komplexe wurden in Brustkrebs-Zellkulturüberständen nachgewiesen Die Fähigkeit, HLA in Brustkrebs-Zellüberständen erkennen demonstriert. Biotinylierte RL21A TCRM, RL9A TCRM (Negativkontrolle) und eine Isotypenkontrolle wurden auf der Testplatte Oberfläche immobilisiert. Spiked [5 & mgr; g / ml] und unspiked MDA-231-Zellkulturüberstände wurden zugegeben, und die Bindung wurde für 60 min auf der markierungsfreien Detektor überwacht. FLSL und SLLV HLA-Monomer aufgestockte Proben repräsentieren positive Kontrollen für RL9A und RL21A verbindlich. Einweg-ANOVA wurde mit Grafik und Statistik-Software (p <0,0001).
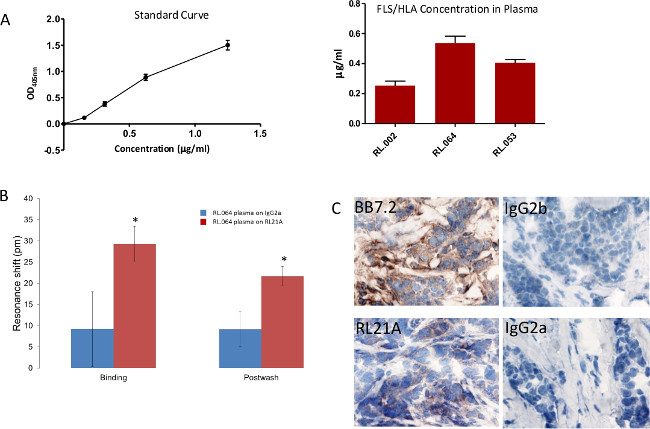
Fig. 8: Spezifische Detektion FLSL / HLA-Komplexe in den Proben (A) Eine traditionelle Enzyme Linked Immunosorbent Assay (ELISA) wurde verwendet, um FLSL / HLA-Komplexe spezifisch in Patientenplasma zu detektieren. (B) Biotinylierte RL21A TCRM oder IgG2a [10 ug / ml] auf der Avidin Assay-Platte immobilisiert. (C) Brusttumorgewebe von Patienten RL.064 war voller Flecken, wie oben beschrieben 3 bis Tumordarstellung des FLSL / HLA-Komplexe zu überprüfen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Diskussion
Das hier beschriebene Verfahren stellt einen Biomarker Screeningsystem für die Krebsdiagnostik, die schnelle Erkennung von löslichen Peptid / HLA-Komplexe in Patientenserum, Plasma, Urin oder Speichel-Proben in einem Hochdurch ermöglichen würde 96- oder 384-Well-Format. Dieses Testsystem unter Verwendung von T-Zell-Rezeptors nachahmt monoklonalen Antikörper und eine markierungsfreie Detektionssystems schneidet die Analysezeit auf weniger als 1 h im Vergleich zu 3,5 Stunden nach herkömmlichen ELISA. Dieses Hochdurchsatz-Ansatz ermöglicht die schnelle Stratifizierung von Patienten mit klinischen Studien für therapeutische Krebsimpfstoffe oder Biopharmazeutika. Derzeitige Verfahren zum Nachweis dieser Krankheitsziele erforderlich Affinitätsreinigung und HPLC-MS / MS individueller Patientenproben, eine mühsame und zeitraubender Prozess. Obwohl dieses Verfahren zugänglich zu herkömmlichen ELISA-Verfahren, gibt es Bedenken, dass sekundäre Nachweisreagenzien wie die anti-β2-Mikroglobulin-Antikörper konnte die Struktur des naszierenden HL verändernEin Molekül, und die Bindung an die TCRM Begrenzungserkennung. Markierungsfreie Detektion lindert diese Bedenken. Dieses Verfahren könnte für die Verwendung auf anderen markierungsfreie Systeme wie ein Oberflächenplasmonresonanz-System modifiziert werden. Dies wäre jedoch erheblich die höhere Durchsatzkapazitäten im Vergleich zum Bioassay-System in dieser Studie verwendet reduzieren.
Dieses Protokoll kann wirksam zum Nachweis von Nicht-HLA-Biomarkern in Patientenserum und Plasma bei Einhaltung einigen kritischen Schritte modifiziert werden. Überwachung der anfänglichen Antikörper-Beschichtungsverfahren ist für die Optimierung der Oberfläche zu empfehlen, da eine <200 pm Verschiebung wird wahrscheinlich bei niedrigen Signal für die nachfolgenden Detektionsschritt führen. Der Studienbeginn und nach dem Waschen liest sind für die Endpunktanalyse als die Fülle von Serumproteinen kann die Bindung von geringer Konzentration Analyt maskieren. Schließlich können Temperaturschwankungen von Proben in Brunnen zu Brunnen Variation führen. Es wird empfohlen, alle Proben vorinkubiert eind das Etikett frei biosassay Einheit Temperaturregler auf 2-3 ° C über der Raumtemperatur eingestellt werden. Gekühlte Proben müssen genügend Zeit, um die Betriebstemperatur zu erreichen gestattet.
Zukünftige Modifikationen dieses Protokolls umfassen Multiplexen TCRM auf der Plattenoberfläche. Das Bioassay-System ist derzeit zugänglich Spek von Vertiefungen in einer Dichte von mindestens 8-plex. Durch die Einführung von 4-8 TCRM in jede Vertiefung, pro Testprobenvolumen reduziert werden und ermöglichen die Erfassung von immer komplexer Daten pro Patient. Diese Fähigkeit könnte weiter Patienten informieren im Hinblick auf Therapiemöglichkeiten.
Offenlegungen
Die Autoren, Debra Wawro Weidanz und Robert Magnusson, jeweils Chief Executive Officer und Chief Technology Officer bei Resonanzsensoren Incorporated, die die Bioassay-Platten-Lesegerät und Testplatten in diesem Artikel verwendet produziert.
Danksagungen
These studies were supported in part by the Development Corporation of Abilene which provides laboratory space and salary support for Experimmune, a Center for Immunotherapeutic Development at Texas Tech University Health Sciences Center and Resonant Sensors Incorporated.
Materialien
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | Comments/Description (optional) |
| ResoSens Label-free Bioassay Detection System | Resonant Sensors Incorporated | ||
| Avidin Sensitized Bionetic 96-well Plates | Resonant Sensors Incorporated | ||
| ResoVu software | Resonant Sensors Incorporated | ||
| RL21A Biotinylated TCRm mAb | PureMHC, LLC | ||
| RL9A Biotinylated TCRm mAb | PureMHC, LLC | ||
| FLSL HLA-A*02:01 Monomer | Experimmune | full peptide sequence: FLSELTQQL | |
| SLLV HLA-A*02:01 Monomer | Experimmune | full peptide sequence: SLLMWITQV | |
| YLEV HLA-A*02:01 Monomer | Experimmune | full peptide sequence: YLEPGPVTV | |
| KVL HLA-A*02:01 Monomer | Experimmune | full peptide sequence: KVLEYVIKV | |
| Pooled Normal Human Serum | ThermoFisher | BP2657100 | |
| MDA-MB-231 Cell Supernatant | ATCC | HTB-26 | Cells grown in IMDM , 10% FBS and 1% penn/strep. Supernatants harvested from 3 day confluent cultures. |
| Iscove's Modification of Dulbecco's Medium (IMDM) | Life Technologies | 12440-053 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10082-147 | |
| Penicillin/Streptomycin | Life Technologies | 15070-63 | |
| Sodium Hydroxide | ThermoFisher | 5318-1 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher | BP665-1 | |
| Phosphate Buffered Saline + 0.05% Tween 20 (PBST) | ThermoFisher | BP337-500 | |
| 2,2’-Azinobis [3-ethylbenzothiazoline-6-sulfonic acid]-diammonium salt (ABTS) | ThermoFisher | 37615 | |
| rabbit anti-human β2 microglobulin | Dako | A0072 | |
| Peroxidase conjugated goat anti-rabbit IgG | Jackson Immunoresearch | 111-035-144 | |
| Nunc microplates | ThermoFisher | 439454 | |
| Synergy 2 microplate reader | Biotek | ||
| Immpress Reagent Kit | Vector | MP-7402 | |
| Immpact DAB | Vector | SK-4105 | |
| Hematoxylin QS | Vector | H3403 | |
| IgG2a | MP BioMedicals | 50328 | |
| IgG2b | MP BioMedicals | 50330 | |
| anti-HLA-A2 (BB7.2) | Experimmune | ||
| Prism 5 | Graphpad |
Referenzen
- Shastri, N., Schwab, S., Serwold, T. Producing nature's gene-chips: the generation of peptides for display by MHC class I molecules. Annu Rev Immunol. 20, 463-493 (2002).
- Peaper, D. R., Cresswell, P. Regulation of MHC class I assembly and peptide binding. Annu Rev Cell Dev Biol. 24, 343-368 (2008).
- Hawkins, O., et al. An HLA-presented fragment of macrophage migration inhibitory factor is a therapeutic target for invasive breast cancer. J Immunol. 186 (11), 6607-6616 (2011).
- Verma, B., et al. TCR mimic monoclonal antibody targets a specific peptide/HLA class I complex and significantly impedes tumor growth in vivo using breast cancer models. J Immunol. 184 (4), 2156-2165 (2010).
- Verma, B., et al. TCR mimic monoclonal antibodies induce apoptosis of tumor cells via immune effector-independent mechanisms. J Immunol. 186 (5), 3265-3276 (2011).
- Bassani-Sternberg, M., et al. Soluble plasma HLA peptidome as a potential source for cancer biomarkers. Proc Natl Acad Sci U S A. 107 (44), 18769-18776 (2010).
- Hickman, H. D., Yewdell, J. W. Mining the plasma immunopeptidome for cancer peptides as biomarkers and beyond. Proc Natl Acad Sci U S A. 107 (44), 18747-18748 (2010).
- Neethling, F. A., et al. Assessing vaccine potency using TCRmimic antibodies. Vaccine. 26 (25), 3092-3102 (2008).
- Mittendorf, E. A., et al. Clinical trial results of the HER-2/neu (E75) vaccine to prevent breast cancer recurrence in high-risk patients: from. US Military Cancer Institute Clinical Trials Group Study I-01 and I-02. Cancer. 118 (10), 2594-2602 (2012).
- Winter, H., Fox, B. A., Ruttinger, D. Future of cancer vaccines. Methods Mol Biol. 1139, 555-564 (2014).
- Magnusson, R., Wawro, D., Zimmerman, S., Ding, Y. Resonant photonic biosensors with polarization-based multiparametric discrimination in each channel. Sensors. 11 (2), 1476-1488 (2011).
- Kaja, S., et al. Detection of novel biomarkers for ovarian cancer with an optical nanotechnology detection system enabling label-free diagnostics. J Biomed Opt. 17 (8), 081412-081411 (2012).
- Magnusson, R., Wang, S. S. New principle for optical filters. Appl. Phys. Lett. 61, 1022-1024 (1992).
- Wawro, D., Tibuleac, S., Magnusson, R., Liu, H. Optical fiber endface biosensor based on resonances in dielectric waveguide gratings. Proc. SPIE. 3911, 86-94 (2000).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten