Method Article
Detecção de Leucócitos Humanos Antigen Biomarkers no cancro da mama Utilizando tecnologia de biossensores livre-Label
Neste Artigo
Resumo
Intactas classe I complexos HLA / péptido são derramadas por células cancerosas, o que representa um potencial biomarcador câncer relevante. Utilizando tecnologia de sensor livre de marcador e do receptor de células T imitando anticorpos monoclonais, a detecção de barracão MIF / HLA-A * 02: 01 complexos em sobrenadantes de células MDA-MB-231, cravado soro humano, e plasma do paciente é demonstrada, permitindo o desenvolvimento de um romance câncer plataforma de diagnóstico.
Resumo
De acordo com a American Cancer Society, mais de 200.000 mulheres serão diagnosticadas com câncer de mama invasivo em cada ano e aproximadamente 40.000 morrerão da doença. A classe I amostras de antigénio de leucócitos humanos (HLA) de péptidos derivados de degradação proteossómica de proteínas celulares e apresenta estes fragmentos na superfície celular para serem interrogados pelo circulantes linfócitos T citotóxicos (CTL). Geração de imitador do receptor de células T (TCRm) anticorpos monoclonais (mAbs) que reconhecem o cancro da mama específico peptídeo / HLA-A * 02: 01 complexos, tais como aqueles derivados de factor de inibição de migração de macrófagos (MIF 19-27) e NY-eso 1 157-165 permitir a detecção e destruição de células de câncer de mama, na ausência de uma resposta eficaz CTL anti-tumor. Intactas classe I complexos HLA / péptido são derramadas por células de câncer de mama e representam biomarcadores de câncer potencialmente relevantes. Neste trabalho, um sistema de triagem avanço biomarcador para o diagnóstico de câncers incorporando receptor de células T anticorpos monoclonais imitam combinados com um romance, livre de marcador de biossensor utilizando ressonância de modo guiado (GMR) tecnologia de sensor é apresentado. Detecção de barracão MIF / HLA-A * 02: 01 complexos em sobrenadantes de células MDA-MB-231, cravado soro humano, e plasma do paciente é demonstrada. O impacto deste trabalho poderia revolucionar a medicina personalizada através do desenvolvimento de diagnósticos de doenças de companhia para immunotherapies alvejados.
Introdução
Os antigénios de classe I de Leucócitos Humanos (HLA) Amostras péptidos de 8-11 aminoácidos de comprimento, derivadas da degradação proteossómica do repertório de proteínas intracelulares e apresenta estes péptidos na superfície de todas as células nucleadas 1,2. O complexo HLA é "biomarcador da natureza", indicando a saúde de cada célula (Figura 1) para circulação de linfócitos T citotóxicos (CTL). Reconhecimento da doença associada peptídeos resulta em eliminação da célula incriminada por CTL. Assim, a resposta imune adaptativa é altamente eficaz na eliminação de infecções virais e tumores. No entanto, o sistema imunitário exerce uma pressão que muitas vezes promove a selecção de vírus ou tumorais capazes de evadir uma resposta de CTL eficaz. Receptor de células T (imitando TCRm) anticorpos monoclonais (mAbs) que reconhecem específico peptídeo / HLA-A * 02: 01 complexos, tais como aqueles derivados a partir de proteínas associadas com cancro da mama, factor de inibição de migração de macrófagos (MIF19-27) 3 e NY-ESO-1 157-165, permitir a detecção e destruição de células de câncer de mama, na ausência de um anti-tumor eficaz CTL de resposta 4,5. Este trabalho representativo é focado sobre a HLA-A * 0201, que é expressa em cerca de 30% da população. No entanto, a identificação de outros complexos de HLA / péptido relevantes, seguida pela produção de TCRm permite o desenvolvimento de imunoterapias para o diagnóstico de doenças visadas e companheiro, expandir a utilidade do presente trabalho para uma população muito mais ampla.
Uma parte dos complexos de péptido / HLA ligados para a superfície da célula é libertado para o plasma. Devido à natureza altamente complexo de peptídeos / piscinas HLA, métodos atuais para a mineração do immunopeptidome de biomarcadores HLA associados são demorados. Este processo requer a purificação por afinidade de HLA solúvel a partir de plasma, a separação de péptidos HLA associados por meio de cromatografia líquida de alta pressão de fase inversa(RP-HPLC) e sequenciação de péptidos por espectrometria de massa em tandem (MS / MS) 6,7. Embora este processo é uma opção viável para a descoberta de novos alvos terapêuticos, é um processo complicado, como uma ferramenta de diagnóstico companheiro para metas associadas HLA já na vacina terapêutica ou gasoduto biofarmacêutica 8-10. TCRm dirigidos contra estes objectivos fornecer as ferramentas para o desenvolvimento de diagnóstico rápido companheiro destinadas a estratificar pacientes em ensaios clínicos relevantes e fornecer opções terapêuticas mais informadas.
Neste trabalho, um sistema de triagem descoberta de biomarcadores para o diagnóstico de câncer é apresentada, que utiliza TCRm e um sistema de bioensaio livre-label que monitora interações biológicas com passos mínimos de processamento. O sistema de bioensaio livre de marcador baseia-se um método, que utiliza o efeito de modo guiado de ressonância (GMR) que ocorre em grelhas de guias de onda dieléctricas 11-14. Quando os contatos de luz de banda larga a difracçãoralar nas placas necessárias para este sistema, dois comprimentos de onda específicos são reflectidas. A interacção da ligação entre um receptor e o seu ligando imobilizado é monitorado em tempo real, seguindo o deslocamento do comprimento de onda de ressonância com um analisador de espectro 12. Picos de ressonância separadas para ocorrer incidente TE (vector eléctrico normal ao plano de incidência) e TM (vector magnético normal ao plano de incidência) estados de polarização que fornecem vários pontos de dados que pode potencialmente aumentar a precisão da detecção 11,14. Usando placas de anticorpo pré-sensibilizados neste sistema de ensaio livre de marcador, o tempo de execução de ensaio com a análise de dados é de aproximadamente 45 min. Além disso, múltiplas amostras pode ser interrogada em um formato de 96 ou de 384 poços, uma clara vantagem sobre um formato baseado em HPLC-MS / MS.
Protocolo
Declaração de Ética: tecidos e amostras de plasma humanos identificados-De foram obtidos a partir Hendrick Medical Center sob um Comitê de Ética aprovou o protocolo.
1. Adição de anticorpo biotinilado
NOTA: O monitoramento desse passo é opcional. Veja protocolo alternativo se não monitoramento.
- Obter derivativos placas revestidas com avidina comercialmente disponíveis (ver Materiais e Equipamentos Tabela).
- Adicionar 50 ul de fosfato tamponado salino (PBS) pH 7,2 aos poços.
NOTA: PBS pré-incubar a 28 ° C para minimizar as mudanças de temperatura de ressonância relacionados. - Abra o software do scanner bioassay e siga o assistente de configuração para definir o procedimento experimental que inclui seleção de espaços em branco, padrões e amostras no layout da placa, ajuste de temperatura (28 ° C), o número de leituras por min (1), e comprimento de experiência ( 150 min para acomodar para as etapas de preparação).
- Insira a placa de ensaio preparado no scanner bioassay livre rótulo e iniciar a primeira verificação. Quando a primeira verificação for concluída, selecione "auto de referência para começar". A linha de base é o conjunto inicial de varreduras recolhidos no início da experiência. Se esta for a primeira leitura realizada nesta placa específica, permitem que o scanner para executar a equilibrar temperatura e eliminar a deriva da linha de base. Veja a Figura 2 para um screenshot de uma linha de base, seguido pela adição de amostra.
- Depois da linha de base se estabilizou, ou, pelo menos, 5 scans, pausar a leitura e ejetar a placa.
- Remover PBS despejando na pia e adicionar 50 ul de anticorpo biotinilado na RL21A [10 ug / ml em PBS pH 7.2], mas a todos os poços de controlo na placa. Adicionar 50 ul de PBS aos poços de controlo.
- Insira a placa de volta ao scanner bioassay e retome a leitura até a saturação é atingido, aproximadamente, 1,5 horas.
- Pausa de leitura e ejetar a placa.
- Lava-se a a placa 3 vezes com 200 ul / poço de solução salina tamponada com fosfato + 0,05% Tween 20 (PBST), seguido por 3 lavagens com 200 ul / poço de PBS pH 7,2. Repita com PBS. Toque o excesso de PBS de placa em papel toalha antes de passar para a próxima etapa.
NOTA: Este passo pode ser realizado em um lavador de placas automático ou lavar a placa 3 vezes com 200 uL de PBST por operações de imersão líquido para uma pia e substituindo PBST com uma pipeta. - Adicionar 50 ul de PBS, pH 7,2 a todos os poços activas.
- Insira a placa de volta ao scanner bioassay e retome a leitura para monitorar ressonância pós-lavagem.
- Pare a leitura e ejetar a placa.
Protocolo alternativo para o Passo 1:
- Adicionar 50 ul de anticorpo biotinilado na RL21A [10 ug / ml de PBS] a todos os poços.
- Incubar à temperatura ambiente durante 1,5 horas ou durante a noite a 4 ° C.
- Lavar a placa 3 vezes com 200 ul / poço de PBST seguido por 3 lavagens com 200 ul / poço de PBS como no passo 1.9.
- Remover o PBS e adicionar 50 ul por poço de tampão de ensaio apropriada. Para este ensaio, disponível comercialmente de soro humano normal foi utilizado diluído 1:20 em PBS.
- Abra o software do scanner bioassay e siga o Assistente de Configuração para definir procedimento experimental.
- Insira a placa no scanner bioassay e começar uma linha de base ler. Se esta é a primeira leitura realizada nesta placa específica, deixar o scanner prazo para equilibrar a temperatura e eliminar deriva na linha de base.
- Depois da linha de base se estabilizou, ou, pelo menos, 5 scans, pausar a leitura e ejetar a placa.
- Remover o tampão de ensaio a partir dos poços.
- Pico controlos com HLA A * 02: 01 monómero tendo relevante (FLSL) ou (SLLV, YLEV, ou péptidos irrelevantes KVL) em concentrações variando de [0,625-10 jig / ml] em tampão de ensaio. Adicionar 50 ul de padrões para os poços da placa de controle
- Adicionar 50 ul de analito em tampão de ensaio para a amostrapoços da placa. Para este ensaio, cravado soro humano disponível comercialmente foi usado.
- Insira a placa de volta ao scanner bioassay e retome a leitura até a saturação é atingido, aproximadamente 30-60 min.
- Pausa de leitura e ejetar a placa.
- Lavar a placa 3 vezes com 200 ul / poço de PBST seguido por 3 lavagens com 200 ul / poço de PBS como no passo 1.9.
- Adicionar 50 ul de tampão de ensaio a todos os poços activas.
- Insira a placa de volta ao scanner bioassay e retome a leitura para monitorar ressonância pós-lavagem.
- Pare a leitura e ejetar a placa.
NOTA: O tampão de ensaio poderia ser PBS, meios de cultura de tecidos, ou soro humano diluído a 1:20 em PBS, dependendo do objetivo do ensaio.
Análise 3. Dados
- Analisar o uso do software do scanner bioassay ou exportar arquivos de dados brutos para software de análise estatística preferido. O software do scanner bioassay gera automaticamente a curva de ligação com base nolayout da placa fornecida durante a configuração experimental.
NOTA: Se não estiver usando o software do scanner bioassay para análise, siga os passos de 3,2-3,4. - Subtraia a linha de base e controle negativo de cada ponto de dados subseqüente.
- Calcula-se a média e desvio padrão para poços em replicado em cada ponto de tempo.
- Gerar um gráfico da curva de ligação ou selecione dados finais para gráficos de barras.
Resultados
Um conjunto representativo de experiências foi realizada utilizando o bem caracterizado TCRm, RL21A, um anticorpo IgG2a monoclonal murino que reconhece especificamente um péptido (MIF ou FLSL 19-27) dentro do contexto de HLA-A * 02: 01 3 molécula. O monómero de péptido / HLA cognato, bem como irrelevante HLA monómero 15, foi usado para demonstrar o procedimento descrito. A Figura 3 ilustra o formato de ensaio.
RL21A é específico para o monómero FLSL / HLA, com pouca reactividade cruzada com o outro péptido / HLA 3 complexos. Esta especificidade, se condensa com o sistema de bioensaio livre de marcador (Figura 4). A sensibilidade do sistema de bioensaio livre etiqueta para esta experiência é na gama nanomolar baixa, tal como determinado por titulação do anticorpo RL21A em FLSL imobilizado / monómero de HLA (Figura 5). Embora o sinal de fundo é aumentada de forma significativa em amostras de soro, sPecific detecção de monómero FLSL / HLA no soro humano cravado é alcançado na Figura 6 e um gradiente de concentração é facilmente discernível nestas amostras. Finalmente, os sobrenadantes de linha celular MDA-MB-231, previamente demonstrado que apresentam o FLSL / HLA-A * 02: 01 molécula, são mostrados para conter monómero solúvel FLSL usando esta plataforma de ensaio isento de etiqueta (Figura 7). A subsequente adição de monómero FLSL / HLA aumenta o sinal em RL21A (Figura 7). Devido à sensibilidade do sistema, bem à variação bem incluindo deslocamentos de ressonância negativos podem ocorrer como resultado das flutuações de temperatura como pode ser visto como uma função dos desvios padrão das Figuras 4 e 5. Estas variações podem ser drasticamente reduzida por pré-incubação de todas as amostras e o leitor de placas de bioensaio a uma temperatura em ligeiro excesso de temperatura ambiente (isto é, 28 ° C).
Na Figura 8, brevemente, 96-bem placas de poliestireno foram revestidos com [10 ug / ml] de RL21A durante 2 horas à temperatura ambiente, lavada com PBST, bloqueadas com 0,5% de leite com baixo teor de gordura, lavados com PBST e incubados durante 2 horas à temperatura ambiente, com diluições em série de FLSL HLA monómero em soro humano normal diluído a 1:10 em PBS, para gerar uma curva padrão, ou plasma do paciente diluído a 1:10 em PBS. A placa foi lavada com PBST, incubadas 1 hora à temperatura ambiente com anticorpo de coelho anti-humano β2 microglobulina [1: 5000] a detectar HLA intacto, e lavou-se em PBST. As placas foram então incubadas durante 30 minutos com anticorpo de cabra anti-IgG de coelho [1: 10.000] e lavadas com PBST. Detecção colorimétrica foi realizada utilizando ABTS (2,2'-azinobis [ácido 3-etilbenzotiazolina-6-sulfónico] sal -diammonium) substrato com um tempo de incubação de 15 min e observado a 405 nm num leitor de microplacas. FLSL / HLA foi detectado em três amostras de doentes.
Na Figura 8B, RL.064 plasma do paciente foi diluída a 1:20 em PBS e, em seguida, adicionared à placa e monitorizada no detector livre de marcador durante 60 min. A detecção específica de complexo FLSL / HLA no soro de um paciente foi realizada. Teste t de Student foi realizado utilizando gráficos e estatísticas de software (p <0,05).
Na Figura 8C, as secções de tecido foram coradas a 1 ug / ml com rato como controlos negativos anti-HLA-A2 (BB7.2) como um controlo positivo, RL21A, IgG2b e IgG2a, respectivamente. A coloração foi detectada utilizando um kit de detecção anti-ratinho, DAB (diaminobenzadina), e hematoxilina QS para a coloração nuclear tal como indicado pelo fabricante. Coloração de tecido tumoral por RL21A confirma a apresentação de complexos de FLSL / HLA.
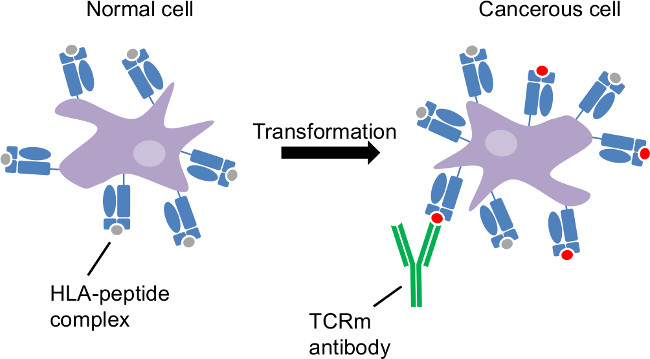
Figura 1:. Tumor apresentação de antígenos pelo antígeno leucocitário humano classe I transformação cancerosa é um distúrbio intracelular. HLA amostra intracellulproteínas AR e revelam mudanças relacionadas ao câncer na superfície da célula. TCRm CTL e são capazes de reconhecer as células cancerosas através de complexos HLA-peptídeo distintas para estas células.

Figura 2:. Tela de aquisição de dados no software do scanner bioensaio Exemplo de aquisição de dados que mostra o varrimento de linha de base inicial, seguido pela adição de anticorpo RL21A para uma placa revestida com 10 ug / ml de complexo FLSL / HLA. As concentrações de anticorpos são como indicado. Cada linha representa um indivíduo bem monitorizados ao longo do tempo.

Figura 3:. Formato de Ensaio de ilustração de anticorpos imobilizados sobre a superfície de grade de difracção da placa de ensaio rel capturanente péptido / complexos de HLA em solução.

Figura 4: Especificidade de RL21A para FLSL / HLA complexo Demonstração da especificidade do biotinilado RL21A TCRm relevante para a sua monómero (FLSL) em relação ao monómero de HLA HLA irrelevante (YLEV, SLLV, e KVL).. Biotinilado RL21A TCRm [10 ug / ml] foi imobilizado na superfície da placa de ensaio revestida de avidina e a detecção foi realizada utilizando monómero não marcado HLA relevante ou irrelevante [10 ug / mL] em PBS. RL21A era específico para Complexo FLSL / HLA. Two-way ANOVA foi realizada por meio de gráficos e estatísticas software (p <0,001).

Figura 5:. A ligação de sensibilidade RL21A ao seu cognato péptido / complexo HLA Ilustração do DETECTIno limite de sensibilidade e de RL21A se ligar ao complexo FLSL / HLA. HLA biotinilado Monómero FLSL [10 ug / ml] foi imobilizado na superfície da placa de ensaio e RL21A não marcada foi adicionada à placa em diluições em série em PBS tal como indicado. Detecção para este sistema foi na faixa de baixo nanomolar.
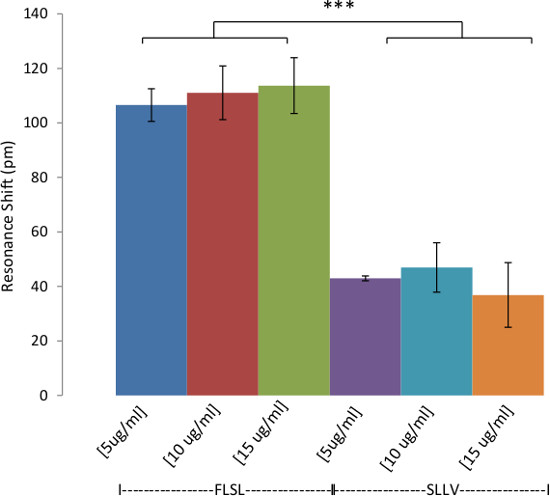
Figura 6: Detecção de complexos de HLA em Soro Humano cravado demonstração da detecção de HLA no soro humano.. Biotinilado RL21A TCRm [10 ug / ml] foi imobilizado na superfície da placa de ensaio revestida de avidina. Soro humano normal reunido com cravado relevante (FLSL) ou irrelevante (SLLV) monómero HLA foi diluído a 1:20 em PBS e, em seguida, adicionado à placa e monitorizada no detector livre de marcador durante 60 min. A detecção específica de complexo FLSL / HLA no soro humano foi realizada. Em geral, o sinal de fundo (monómero SLLV irrelevante) é elevadaer para amostras de soro diluídas em comparação com analitos purificados em PBS (ver Figura 4). Two-way ANOVA foi realizada por meio de gráficos e estatísticas software (p <0,0001).
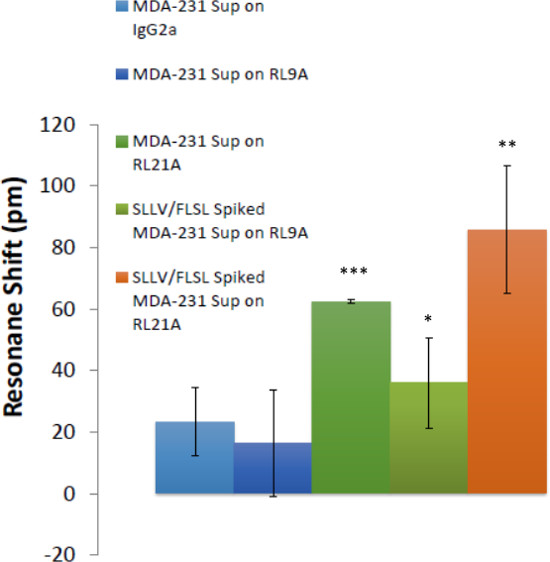
Figura 7:. Complexos HLA solúveis foram detectados em câncer de mama sobrenadantes de cultura de células A capacidade de detectar HLA em sobrenadantes de células de câncer de mama é demonstrada. Biotinilado RL21A TCRm, RL9A TCRm (controlo negativo), e um controlo de isotipo foram imobilizados na superfície da placa de ensaio. Cravada [5 ug / ml] e os sobrenadantes de cultura de células não enriquecido MDA-231 foram adicionados e a ligação foi monitorizada durante 60 min no detector livre de marcador. FLSL e monômero SLLV HLA cravado amostras representam controles positivos para RL9A e RL21A vinculativo. One-way ANOVA foi realizada por meio de gráficos e estatísticas software (p <0,0001).
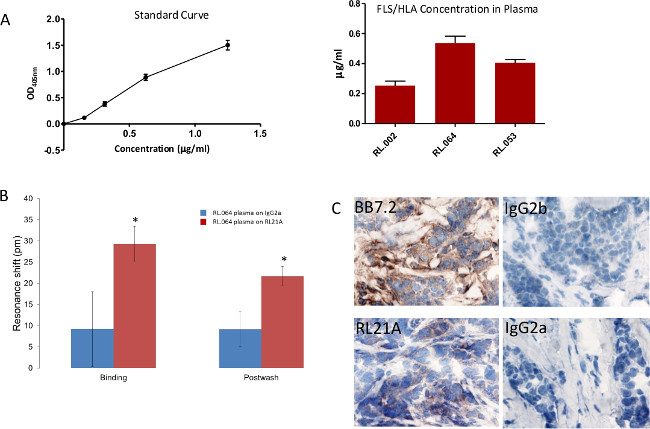
Figura 8:. A detecção específica de complexos FLSL / HLA em amostras de doentes (A) Uma enzima tradicional Linked Immunosorbent Assay (ELISA) foi utilizado para detectar FLSL / HLA complexos específicos no plasma do doente. (B) biotinilado RL21A TCRm ou IgG2a [10 ug / ml] foi imobilizado na placa de ensaio avidina. (C) o tecido do tumor de mama de RL.064 paciente estava manchado como descrito anteriormente 3 para verificar apresentação tumor dos complexos FLSL / HLA. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
O método aqui descrito apresenta um sistema de rastreio para o diagnóstico de cancro biomarcador que permitem a rápida detecção de complexos de péptido / HLA solúveis em soro, plasma, urina ou saliva amostras de pacientes em um alto rendimento de formato de 96 ou de 384 poços. Este sistema de ensaio utilizando o receptor de células T imitando anticorpos monoclonais e de um sistema de detecção livre de etiqueta reduz o tempo de análise para menos de 1 h em comparação com 3,5 h por ELISA convencional. Esta abordagem de alto rendimento permite estratificação rápida de pacientes para ensaios clínicos de vacinas contra o câncer terapêuticos ou biofármacos. Os métodos actuais para a detecção de alvos destas doenças requerem purificação por afinidade e HPLC-MS / MS de amostras de doentes individuais, um processo que consome tempo e complicado. Embora este método é susceptível de técnicas de ELISA convencionais, existe a preocupação de que os reagentes de detecção secundárias, tais como o anticorpo anti-microglobulina β2 poderia alterar a estrutura da HL nascenteUma molécula e inibem a ligação para a detecção de limitação TCRm. Detecção de livre-Label alivia essas preocupações. Este procedimento pode ser modificado para ser utilizado em outros sistemas sem etiqueta, tal como um sistema de ressonância de plasmon de superfície. No entanto, isso iria reduzir consideravelmente a capacidade de rendimento mais elevados em comparação com o sistema de bioensaio usado neste estudo.
Este protocolo pode ser modificado de forma eficaz para a detecção de marcadores não-HLA no soro e no plasma de pacientes com aderência aos poucos passos críticos. A monitorização do processo de revestimento inicial anticorpo é recomendado para a optimização da superfície, como um <200 pm mudança irá provavelmente resultar em baixo do sinal para a etapa de detecção subsequente. A linha de base e pós-lavagem leituras são úteis para a análise de ponto final como a abundância de proteínas séricas podem mascarar a ligação de baixa concentração de analito. Finalmente, a variação da temperatura de amostras pode resultar na variação de poço a poço. Recomenda-se que todas as amostras de ser pré-incubada umad o biosassay livre controlador de temperatura unidade rótulo fixado em 2-3 ° C acima da temperatura ambiente. As amostras refrigeradas deve dispor de tempo suficiente para alcançar a temperatura de funcionamento.
Modificações futuras deste protocolo incluirá multiplexação de TCRm na superfície da placa. O sistema de bioensaio é actualmente passível de manchas de poços a uma densidade de, pelo menos, 8-Plex. Com a introdução de 4-8 TCRm a cada poço, por volumes de amostra de teste são reduzidos e permitir a recolha de dados cada vez mais complexos por paciente. Esta capacidade poderia informar mais pacientes no que diz respeito às opções terapêuticas.
Divulgações
Os autores, Debra Wawro Weidanz e Robert Magnusson, são, respectivamente, Diretor Presidente e Diretor de Tecnologia da Resonant Sensores Incorporated, que produz o leitor e ensaio placa placas bioassay utilizados neste artigo.
Agradecimentos
These studies were supported in part by the Development Corporation of Abilene which provides laboratory space and salary support for Experimmune, a Center for Immunotherapeutic Development at Texas Tech University Health Sciences Center and Resonant Sensors Incorporated.
Materiais
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | Comments/Description (optional) |
| ResoSens Label-free Bioassay Detection System | Resonant Sensors Incorporated | ||
| Avidin Sensitized Bionetic 96-well Plates | Resonant Sensors Incorporated | ||
| ResoVu software | Resonant Sensors Incorporated | ||
| RL21A Biotinylated TCRm mAb | PureMHC, LLC | ||
| RL9A Biotinylated TCRm mAb | PureMHC, LLC | ||
| FLSL HLA-A*02:01 Monomer | Experimmune | full peptide sequence: FLSELTQQL | |
| SLLV HLA-A*02:01 Monomer | Experimmune | full peptide sequence: SLLMWITQV | |
| YLEV HLA-A*02:01 Monomer | Experimmune | full peptide sequence: YLEPGPVTV | |
| KVL HLA-A*02:01 Monomer | Experimmune | full peptide sequence: KVLEYVIKV | |
| Pooled Normal Human Serum | ThermoFisher | BP2657100 | |
| MDA-MB-231 Cell Supernatant | ATCC | HTB-26 | Cells grown in IMDM , 10% FBS and 1% penn/strep. Supernatants harvested from 3 day confluent cultures. |
| Iscove's Modification of Dulbecco's Medium (IMDM) | Life Technologies | 12440-053 | |
| Fetal Bovine Serum (FBS) | Life Technologies | 10082-147 | |
| Penicillin/Streptomycin | Life Technologies | 15070-63 | |
| Sodium Hydroxide | ThermoFisher | 5318-1 | |
| Phosphate Buffered Saline (PBS) | ThermoFisher | BP665-1 | |
| Phosphate Buffered Saline + 0.05% Tween 20 (PBST) | ThermoFisher | BP337-500 | |
| 2,2’-Azinobis [3-ethylbenzothiazoline-6-sulfonic acid]-diammonium salt (ABTS) | ThermoFisher | 37615 | |
| rabbit anti-human β2 microglobulin | Dako | A0072 | |
| Peroxidase conjugated goat anti-rabbit IgG | Jackson Immunoresearch | 111-035-144 | |
| Nunc microplates | ThermoFisher | 439454 | |
| Synergy 2 microplate reader | Biotek | ||
| Immpress Reagent Kit | Vector | MP-7402 | |
| Immpact DAB | Vector | SK-4105 | |
| Hematoxylin QS | Vector | H3403 | |
| IgG2a | MP BioMedicals | 50328 | |
| IgG2b | MP BioMedicals | 50330 | |
| anti-HLA-A2 (BB7.2) | Experimmune | ||
| Prism 5 | Graphpad |
Referências
- Shastri, N., Schwab, S., Serwold, T. Producing nature's gene-chips: the generation of peptides for display by MHC class I molecules. Annu Rev Immunol. 20, 463-493 (2002).
- Peaper, D. R., Cresswell, P. Regulation of MHC class I assembly and peptide binding. Annu Rev Cell Dev Biol. 24, 343-368 (2008).
- Hawkins, O., et al. An HLA-presented fragment of macrophage migration inhibitory factor is a therapeutic target for invasive breast cancer. J Immunol. 186 (11), 6607-6616 (2011).
- Verma, B., et al. TCR mimic monoclonal antibody targets a specific peptide/HLA class I complex and significantly impedes tumor growth in vivo using breast cancer models. J Immunol. 184 (4), 2156-2165 (2010).
- Verma, B., et al. TCR mimic monoclonal antibodies induce apoptosis of tumor cells via immune effector-independent mechanisms. J Immunol. 186 (5), 3265-3276 (2011).
- Bassani-Sternberg, M., et al. Soluble plasma HLA peptidome as a potential source for cancer biomarkers. Proc Natl Acad Sci U S A. 107 (44), 18769-18776 (2010).
- Hickman, H. D., Yewdell, J. W. Mining the plasma immunopeptidome for cancer peptides as biomarkers and beyond. Proc Natl Acad Sci U S A. 107 (44), 18747-18748 (2010).
- Neethling, F. A., et al. Assessing vaccine potency using TCRmimic antibodies. Vaccine. 26 (25), 3092-3102 (2008).
- Mittendorf, E. A., et al. Clinical trial results of the HER-2/neu (E75) vaccine to prevent breast cancer recurrence in high-risk patients: from. US Military Cancer Institute Clinical Trials Group Study I-01 and I-02. Cancer. 118 (10), 2594-2602 (2012).
- Winter, H., Fox, B. A., Ruttinger, D. Future of cancer vaccines. Methods Mol Biol. 1139, 555-564 (2014).
- Magnusson, R., Wawro, D., Zimmerman, S., Ding, Y. Resonant photonic biosensors with polarization-based multiparametric discrimination in each channel. Sensors. 11 (2), 1476-1488 (2011).
- Kaja, S., et al. Detection of novel biomarkers for ovarian cancer with an optical nanotechnology detection system enabling label-free diagnostics. J Biomed Opt. 17 (8), 081412-081411 (2012).
- Magnusson, R., Wang, S. S. New principle for optical filters. Appl. Phys. Lett. 61, 1022-1024 (1992).
- Wawro, D., Tibuleac, S., Magnusson, R., Liu, H. Optical fiber endface biosensor based on resonances in dielectric waveguide gratings. Proc. SPIE. 3911, 86-94 (2000).
- Altman, J. D., et al. Phenotypic analysis of antigen-specific T lymphocytes. Science. 274 (5284), 94-96 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados