Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Sulfate Trennung durch selektive Kristallisation mit einer Bis-iminoguanidinium Ligand
In diesem Artikel
Zusammenfassung
Ein Protokoll für die in situ wässrigen Synthese eines Bis (iminoguanidinium) Liganden und ihre Verwendung in selektiven Trennung der Sulfat dargestellt.
Zusammenfassung
A simple and effective method for selective sulfate separation from aqueous solutions by crystallization with a bis-guanidinium ligand, 1,4-benzene-bis(iminoguanidinium) (BBIG), is demonstrated. The ligand is synthesized as the chloride salt (BBIG-Cl) by in situ imine condensation of terephthalaldehyde with aminoguanidinium chloride in water, followed by crystallization as the sulfate salt (BBIG-SO4). Alternatively, BBIG-Cl is synthesized ex situ in larger scale from ethanol. The sulfate separation ability of the BBIG ligand is demonstrated by selective and quantitative crystallization of sulfate from seawater. The ligand can be recycled by neutralization of BBIG-SO4 with aqueous NaOH and crystallization of the neutral bis-iminoguanidine, which can be converted back into BBIG-Cl with aqueous HCl and reused in another separation cycle. Finally, 35S-labeled sulfate and β liquid scintillation counting are employed for monitoring the sulfate concentration in solution. Overall, this protocol will instruct the user in the necessary skills to synthesize a ligand, employ it in the selective crystallization of sulfate from aqueous solutions, and quantify the separation efficiency.
Einleitung
Selektive Trennung von hydrophilem Oxoanionen (zB Sulfat, Chromat, Phosphat) von wettbewerbsfähigen wässrigen Lösungen stellt eine grundlegende Herausforderung mit Relevanz für die Umweltsanierung, Energieproduktion, und die menschliche Gesundheit. 1,2 Sulfate insbesondere schwierig ist , aus dem Wasser zu extrahieren aufgrund seiner intrinsische Abneigung seiner Hydrathülle zu vergießen und in weniger polaren Umgebungen migrieren. 3 Installieren wässrige Sulfat Extraktion effizienter erfordert in der Regel komplexe Rezeptoren , die schwierig und langwierig zu synthetisieren und zu reinigen, oft toxischen Reagenzien und Lösungsmittel beteiligt sind . 4,5
Die selektive Kristallisation bietet eine einfache , aber effektive Alternative Trennung zu Sulfat aus dem Wasser. 6-9 Obwohl einige Metallkationen wie Ba 2+, Pb 2+ oder Ra 2+ Form sehr unlöslichen Sulfatsalze, deren Verwendung in Sulfat Trennung nicht immer praktisch ist aufgrund ihrer hohen toxiStadt und manchmal niedrig Selektivität. Der Einsatz organischen Liganden als Sulfat Fällmittel nutzt die strukturelle Vielfalt und Ansprechbarkeit zu entwerfen charakteristisch organischen Molekülen. Ein idealer organischen Liganden für wässrige Sulfatkristallisations sollte in Wasser, doch bilden ein unlösliches Sulfatsalz oder -komplex in einer relativ kurzen Zeit und in Gegenwart von hohen Konzentrationen an konkurrierenden Ionen löslich sein. Darüber hinaus sollte es leicht sein, zu synthetisieren und zu recyceln. Einen solchen Liganden, 1,4-Benzol-bis (iminoguanidinium) (BBiG), selbstorganisierende in situ aus zwei im Handel erhältlichen Vorläufern, Terephthalaldehyd sowie Aminoguanidiniumnitrat Chlorid, wurde vor kurzem in wässrigen Sulfattrennung als äußerst wirksam erwiesen. 10 Der Ligand ist in der Chloridform und kristallisiert selektiv mit Sulfat in einem extrem unlösliches Salz, das aus der Lösung durch einfache Filtration leicht entfernt werden kann. wasserlösliche Der BBIG Ligand kann dann durch Deprotonierung mit einem zurückgewonnen werdenqueous NaOH und Kristallisation des neutralen bis-iminoguanidine, die zurück in die Chloridform mit wässrigem HCl umgewandelt werden kann, und in einer weiteren Trennzyklus wiederverwendet. Die Wirksamkeit dieses Liganden in Sulfat aus Wasser entfernt wird so groß, daß in Lösung die verbleibende Sulfatkonzentration Überwachung ist nicht mehr eine triviale Aufgabe, eine fortschrittlichere Technik erfordert die genaue Messung von Spurenmengen des Anions ermöglicht. Zu diesem Zweck wurde radioaktiv markiertes 35 S - Sulfat Tracers in Verbindung mit β Flüssigszintillationszählung verwendet wird , eine Technik , die üblicherweise in Flüssig-Flüssig - Trennungen verwendet extraktiven, und vor kurzem in Überwachungssulfat Kristallisation als wirksam nachgewiesen. 8
Dieses Protokoll zeigt die Ein-Topf - in - situ - Synthese des Liganden BBIG und seine Kristallisation als das Sulfatsalz aus wässrigen Lösungen. Die ex - situ - Synthese des Liganden 11 ist auch als Co präsentiertnvenient Verfahren zur Herstellung größerer Mengen an BBIG-Cl, das in der kristallinen Form gespeichert werden können, bis zur Verwendung. Sulfatentfernung aus dem Meerwasser der zuvor hergestellten BBIG-Cl-Ligand verwendet, wird dann unter Beweis gestellt. Schließlich wird die Verwendung von 35 S-markiertem Sulfat und β Flüssigszintillationszählung zur Messung der Sulfatkonzentration in Meerwasser nachgewiesen. Dieses Protokoll soll eine Anleitung für die im Großen und Ganzen interessiert sich für die Erforschung der Verwendung selektiver Kristallisation für wässrige Anionen-Trennung zur Verfügung zu stellen.
Protokoll
1. Synthese von 1,4-Benzol-bis (iminoguanidinium) -chlorid (BBIG-Cl)
- In - situ - Synthese des 1,4-benzol-bis (iminoguanidinium) -chlorid - Ligand (BBIG-Cl) und seine Kristallisations mit Sulfate
- Hinzufügen 0,067 g Terephthalaldehyd und 2,2 ml einer 0,5 M wässrigen Lösung von Aminoguanidiniumnitrat Chlorid zu 10 ml entionisiertem Wasser in einem 25 ml-Rundkolben mit einem magnetischen Rührstab ausgestattet.
- Rühren Sie die Lösung magnetisch vier Stunden bei 20 ° C. Dies wird eine leicht gelbe Lösung von BBIG-Cl ergeben.
- 0,5 ml einer 1 M wässrigen Lösung von Natriumsulfat. Dies wird in der vorliegenden Fällung von BBIG-SO 4 als kristalliner weißer Feststoff führen.
- Filtern Sie die Feststoff durch Vakuumfiltration zu erholen BBIG-SO 4. Der Feststoff auf dem Filterpapier fünfmal mit 5 ml Aliquoten von Wasser, um die reine Sulfatsalz zu erhalten.
- Überprüfen Sie die Phasenreinheit des kristallinen BBIG-SO 4 durch Pulver-Röntgenbeugungs 12 erhalten. Vergleichen mit dem Muster in Abbildung 1 dargestellt.
- Ex - situ - Synthese von 1,4-Benzol-bis (iminoguanidinium) Chlorid 11
- Hinzufügen 4 g Terephthalaldehyd und 7,26 g Aminoguanidiniumnitrat Chlorid zu 20 ml Ethanol in einem 50 ml-Rundkolben mit einem magnetischen Rührstab ausgestattet.
- Die Lösung wird auf 60 ° C eine Heizplatte mit, und rühren Sie mit einem magnetischen Rührstab für 2 Std. Die Lösung wird auf 20 ° C und lassen Sie es für 3 Stunden sitzen, dann sammeln die Feststoff durch Vakuumfiltration durch einen Filter-Papier ausgestattet Büchner-Trichter.
- Suspend die erhaltenen Feststoff in 20 ml Ethanol und Wärme auf einer Heizplatte bis zum Sieden. Wenn der Feststoff geht nicht vollständig in Lösung an dieser Stelle hinzufügen kleinen Aliquots (1 ml) Ethanol, so dass jedes Mal, wenn die Lösung zu erreichen Temperatur Kochen, bis alle Feststoff gelöst ist.
- Lassen Sie den Kolben auf Raum temperatu abkühlenwieder, dann in einen 0 ° C Gefrierschrank über Nacht. Der Feststoff wird durch Filtrieren durch ein Filterpapier ausgestattet Büchner-Trichter unter Verwendung von Vakuumfiltration.
- Bestätigen Sie die Identität und Reinheit der BBiG-Cl durch 1 H - NMR - Spektroskopie 13. Vergleichen mit dem Spektrum in Figur 2 gezeigt.
2. Sulfate Trennung von Meerwasser
- Sulfate Kristallisation als BBIG-SO 4
HINWEIS: Die Menge an BBIG-Cl notwendig, das Sulfat zu entfernen, hängt von der genauen Menge an Sulfat in dem Meerwasser. Es wurde die Verwendung von 1,5 Äquivalenten BBIG-Cl, bezogen auf Sulfat führt zu 99% Entfernung von Sulfat gefunden. Das Meerwasser in diesem Protokoll verwendet wird, hat eine Konzentration von 30 mM Sulfat, wie 2 durch Titration mit BaCl bestimmt.- Filtern Sie das Meerwasser mit einem 0,22 & mgr; m Spritzenfilter oder Filtrationsmembran mit kleiner Porengröße zu entfernen Schwebstoffe und Bio-Organismen.
- Machen Sie eine 30mM Lösung von BBIG-Cl deionisiertem Wasser und festen BBIG-Cl hergestellt unter Verwendung von wie im vorhergehenden Abschnitt beschrieben.
- Fügen Sie die BBIG-Cl-Lösung zu dem Meerwasser in einem 1,5: 1 (v / v) Verhältnis.
- Rühren Sie die Mischung für einige Stunden quantitative sicherzustellen (> 99%) Entfernung von Sulfat.
- Der Feststoff wird durch Filtrieren durch ein Filterpapier ausgestattet Büchner-Trichter unter Verwendung von Vakuumfiltration. Der Feststoff auf dem Filterpapier fünfmal mit 5 ml Aliquoten von Wasser.
- Trocknen Sie die isolierte Feststoff unter Vakuum und wiegen es um die Ausbeute zu bestimmen.
- Ligand Erholung
- Hinzufügen , 53,1 mg BBIG-SO 4 auf eine 2 ml Lösung von NaOH (10%) in einem 20 ml Szintillationsgefß mit einem magnetischen Rührstab ausgestattet.
- Rühren Sie die Mischung für zwei Stunden bei 20 ° C. Ein leicht gelber Niederschlag bilden.
- Filtern Sie die solide durch ein Filterpapier ausgestattet Büchner-Trichter unter Verwendung von Vakuumfiltration. Der Feststoff wird auf dem Filterpapier mit 0,2ml Wasser, und unter Vakuum getrocknet.
- Charakterisieren Sie das wiedergewonnene Feststoff wird durch 13 - NMR seine Identität als Bis (Guanidin) freie Base zu bestätigen. Vergleichen mit dem NMR - Spektrum in Abbildung 3 dargestellt.
- Bestimmung der Menge an Sulfat aus dem Meerwasser entfernt von ß Flüssigszintillationszählung
ACHTUNG: Diese Technik beinhaltet die Verwendung von Radioisotopen, die als eine andere Klasse von Gefahren darstellen, was in den meisten Labors normalerweise angetroffen wird. Spezielle Strahlenschutzausrüstung ist in der Regel erforderlich, wenn die Radionuklide Handhabung. Daher ist es wichtig, dass das Verfahren sorgfältig befolgt wird und dass ein Sicherheitsbeauftragter für Beratung und Anleitung zu Rate gezogen.- Berechne das Volumen der Vorratslösung des Schwefels-35-Radioisotop (5 mCi / ml) verwendet, um sicherzustellen, dass es mehr als 5 Millionen Zählwerten pro Minute (cpm) pro Milliliter Meerwasser-Lösung, unter Verwendung der folgenden Gleichungen (cpm und Curie (Ci ) sind beide Maßeinheiten foder Radioaktivität):
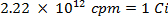
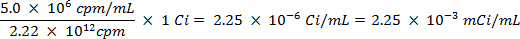
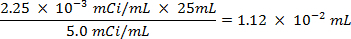
- Spike 25 ml des Seewassers mit 0,0112 ml von 5,0 mCi / ml Lösung von 35 S radioaktiv markiertem Natriumsulfatlösung.
- Bereiten 0, 15, 30, 33, 45 und 60 mM Lösungen von BBIG-Cl in deionisiertem Wasser und kombinieren 0,750 ml dieser Lösungen mit einem gleichen Volumen von 35 S-radiomarkierten Sulfat versetzt Meerwasser in einem 2 ml Zentrifugenröhrchen.
- Rühren Sie die Mischung über ein rotierendes Rad oder Wirbel in einem Inkubator / Luft-Box auf einer konstanten Temperatur gehalten von 25 ± 0,2 ° C für 24 Std.
- Zentrifugiere die Lösung bei 1500 xg für 10 min bei 25 ° C.
- Nach Zentrifugation entfernen 1,2 ml jeder Lösung unter Verwendung einer Spritze, Filter dann durch einen 0,22 & mgr; m Spritzenfilter das suspendierte zu entfernen Präzipitat. Pipette 1,0 ml von jeder dieser Lösungen in 20 ml Szintillationscocktail in Polypropylen Szintillationsgefäße. Die Lösung kein BBIG-Cl (Kontrolllösung) enthält, sollte das Zehnfache mit entionisiertem Wasser vor der Zugabe zu dem Szintillationscocktail verdünnt werden.
- Legen Sie die Szintillationsgefäße mit den Proben und den Szintillationscocktail auf einem Flüssigszintillationszähler und lassen Sie es für 1 Stunde sitzen vor dem Zählen der Proben bis dunkel Anpassung zu lassen.
HINWEIS: Vor der Abtastwerte zu zählen, das Instrument zu kalibrieren, und jede Probe für 30 min zu zählen ermöglichen. Zählen zusätzliche Ampullen, die nur Szintillationscocktail, um eine Hintergrundkorrektur zu ermöglichen, die verwendet wird, wenn die Konzentration von Sulfat in der Lösung zu bestimmen. - Bestimmen Sie die Menge an Sulfat entfernt, die folgenden Gleichungen:
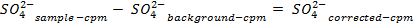
54411 / 54411eq5.jpg "/>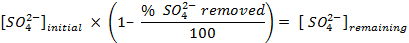
- Berechne das Volumen der Vorratslösung des Schwefels-35-Radioisotop (5 mCi / ml) verwendet, um sicherzustellen, dass es mehr als 5 Millionen Zählwerten pro Minute (cpm) pro Milliliter Meerwasser-Lösung, unter Verwendung der folgenden Gleichungen (cpm und Curie (Ci ) sind beide Maßeinheiten foder Radioaktivität):
Ergebnisse
Das Pulver-Röntgenbeugungsmuster von BBIG-SO 4 (Figur 1) ermöglicht eine unzweideutige Bestätigung der Identität des kristallisierten Feststoffs. Bei einem Vergleich der erhaltenen Muster gegenüber der Referenz ein, zählt Spitzenintensität weniger als der Spitzenpositionierung. Alle starken Peaks in der Referenz gezeigt sollten in der erhaltenen Probe vorhanden sein. Das Auftreten von starken Peaks in der Probe, die in dem Referenzmuster nicht vorhanden...
Diskussion
Diese Technik ist ziemlich tolerant zu viele Abweichungen von der schriftlichen Verfahren, das es recht robust macht. Es gibt jedoch zwei wichtige Schritte, die befolgt werden müssen. Zuerst muss der BBIG-Cl Ligand so rein wie möglich sein. Verunreinigungen werden nicht nur die Kristallisation beeinflusst und die Löslichkeit des erhaltenen Sulfatsalz, sondern es wird auch die Menge schwierig für quantitative Sulfatentfernung aus der Lösung erforderlich zu berechnen. Zweitens, alle Schritte in der β Flüssigszintil...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the U.S. Department of Energy, Office of Science, Basic Energy Sciences, Chemical Sciences, Geosciences, and Biosciences Division. We thank the University of North Carolina Wilmington for providing the seawater.
Materialien
| Name | Company | Catalog Number | Comments |
| Terephthalaldehyde | Sigma | T2207 | |
| Aminoguanidinium Chloride | Sigma | #396494 | |
| Sodium Sulfate | Sigma | #239313 | |
| Barium Chloride | Sigma | #342920 | Highly Toxic |
| Ethanol | Any | Reagent Grade (190 proof) | |
| Sodium Hydroxide | EMD | SX0590-1 | |
| Hydrochloric Acid | Sigma | #258148 | |
| Filter Paper | Any | - | Any qualitative or analytical filter paper will work |
| Syringe Filter (0.22 μm) | Any | - | Nylon filter |
| 35S Labeled Sulfate | Perkin Elmer | NEX041005MC | |
| Ultima Gold Scintillation Cocktail | Perkin Elmer | #6013329 | |
| Polypropylene Vials | Any | - | |
| Disposable Syringe (2-3 ml) | Any | - | Any disposable plastic syringe works |
Referenzen
- Langton, M. L., Serpell, C. J., Beer, P. D. Anion Recognition in Water: Recent Advances from Supramolecular and Macromolecular Perspective. Angew. Chem. Int. Ed. 55, 1974-1987 (2016).
- Busschaert, N., Caltagirone, C., Van Rossom, W., Gale, P. A. Applications of Supramolecular Anion Recognition. Chem. Rev. 115, 8038-8155 (2015).
- Moyer, B. A., Custelcean, R., Hay, B. P., Sessler, J. L., Bowman-James, K., Day, V. W., Sung-Ok, K. A Case for Molecular Recognition in Nuclear Separations: Sulfate Separation from Nuclear Wastes. Inorg. Chem. 52, 3473-3490 (2013).
- Kim, S. K., Lee, J., Williams, N. J., Lynch, V. M., Hay, B. P., Moyer, B. A., Sessler, J. L. Bipyrrole-Strapped Calix[4]pyrroles: Strong Anion Receptors That Extract the Sulfate Anion. J. Am. Chem. Soc. 136, 15079-15085 (2014).
- Jia, C., Wu, B., Li, S., Huang, X., Zhao, Q., Li, Q., Yang, X. Highly Efficient Extraction of Sulfate Ions with a Tripodal Hexaurea Receptor. Angew. Chem. Int. Ed. 50, 486-490 (2011).
- Rajbanshi, A., Moyer, B. A., Custelcean, R. Sulfate Separation from Aqueous Alkaline Solutions by Selective Crystallization of Alkali Metal Coordination Capsules. Cryst. Growth Des. 11, 2702-2706 (2011).
- Custelcean, R. Urea-Functionalized Crystalline Capsules for Recognition and Separation of Tetrahedral Oxoanions. Chem. Commun. 49, 2173-2182 (2013).
- Custelcean, R., Sloop, F. V., Rajbanshi, A., Wan, S., Moyer, B. A. Sodium Sulfate Separation from Aqueous Alkaline Solutions via Crystalline Urea-Functionalized Capsules: Thermodynamics and Kinetics of Crystallization. Cryst. Growth Des. 15, 517-522 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A. Aqueous Sulfate Separation by Crystallization of Sulfate-Water Clusters. Angew. Chem. Int. Ed. 54, 10525-10529 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A., Ivanov, A. S., Bryantsev, V. S. Aqueous Sulfate Separation by Sequestration of [(SO4)(H2O)4]4- Clusters within Highly Insoluble Imine-Linked Bis-Guanidinium Crystals. Chem. Eur. J. 22, 1997-2003 (2016).
- Khownium, K., Wood, S. J., Miller, K. A., Balakrishna, R., Nguyen, T. B., Kimbrell, M. R., Georg, G. I., David, S. A. Novel Endotoxin-Sequestering Compounds with Terephthaldehyde-bis-guanylhydrazone Scaffolds. Bioorg. Med. Chem. Lett. 16, 1305-1308 (2006).
- Pecharsky, V. K., Zavalij, P. Y. . Fundamentals of Powder Diffraction and Structural Characterization of Materials. , (2005).
- Goldenberg, D. P. . Principles of NMR Spectroscopy: An Illustrated Guide. , (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten