Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Séparation Sulfate par Selective Cristallisation avec un Ligand Bis-iminoguanidinium
Dans cet article
Résumé
Un protocole pour la synthèse in situ aqueuse d'un composé bis (iminoguanidinium) un ligand et son utilisation dans la séparation sélective de sulfate est présenté.
Résumé
A simple and effective method for selective sulfate separation from aqueous solutions by crystallization with a bis-guanidinium ligand, 1,4-benzene-bis(iminoguanidinium) (BBIG), is demonstrated. The ligand is synthesized as the chloride salt (BBIG-Cl) by in situ imine condensation of terephthalaldehyde with aminoguanidinium chloride in water, followed by crystallization as the sulfate salt (BBIG-SO4). Alternatively, BBIG-Cl is synthesized ex situ in larger scale from ethanol. The sulfate separation ability of the BBIG ligand is demonstrated by selective and quantitative crystallization of sulfate from seawater. The ligand can be recycled by neutralization of BBIG-SO4 with aqueous NaOH and crystallization of the neutral bis-iminoguanidine, which can be converted back into BBIG-Cl with aqueous HCl and reused in another separation cycle. Finally, 35S-labeled sulfate and β liquid scintillation counting are employed for monitoring the sulfate concentration in solution. Overall, this protocol will instruct the user in the necessary skills to synthesize a ligand, employ it in the selective crystallization of sulfate from aqueous solutions, and quantify the separation efficiency.
Introduction
Séparation sélective des oxoanions hydrophiles (par exemple, le sulfate, chromate, phosphate) à partir de solutions aqueuses concurrentielles représente un défi fondamental présentant de l' intérêt pour l' assainissement environnemental, la production d'énergie, et la santé humaine. 1,2 Sulfate en particulier est difficile à extraire de l' eau en raison de sa la réticence intrinsèque à se débarrasser de sa sphère d'hydratation et de migrer dans des environnements moins polaires. 3 Faire extraction de sulfate aqueuse plus efficace nécessite généralement des récepteurs complexes qui sont difficiles et fastidieux à synthétiser et à purifier, impliquant souvent des réactifs et solvants toxiques. 4,5
Cristallisation sélective offre une alternative simple mais efficace pour sulfater la séparation de l' eau. 6-9 Bien que certains cations métalliques tels que Ba 2+, Pb 2+, ou la forme très insolubles sels de sulfate de Ra, leur utilisation dans la séparation du sulfate est pas toujours pratique en raison de leur haute toxiville et parfois une faible sélectivité. En employant des ligands organiques comme précipitants sulfate tire parti de la diversité structurelle et la susceptibilité à la conception caractéristique des molécules organiques. Un ligand organique idéal pour la cristallisation du sulfate aqueux doit être soluble dans l'eau, mais former un sel de sulfate insoluble ou complexe dans un temps relativement court et en présence de concentrations élevées d'ions concurrents. En outre, il devrait être facile à synthétiser et à recycler. L' un de ces un ligand, le 1,4-benzène-bis (iminoguanidinium) (BBiG) auto-assemblé in situ à partir de deux précurseurs disponibles dans le commerce, téréphtalaldéhyde et du chlorure de aminoguanidinium, ont été récemment révélés être extrêmement efficaces dans la séparation de sulfate aqueuse. 10 Le ligand est sous la forme de chlorures solubles dans l'eau et cristallise sélectivement avec du sulfate en un sel extrêmement insoluble qui peut être facilement éliminé de la solution par simple filtration. Le ligand BBiG peut ensuite être récupéré par déprotonation avecNaOH queous et la cristallisation du bis-iminoguanidine neutre, qui peut être reconverti en la forme chlorure avec du HCl aqueux et réutilisée dans un autre cycle de séparation. L'efficacité de ce ligand pour éliminer le sulfate de l'eau est si grand que le contrôle de la concentration en sulfate restant en solution est plus une tâche triviale, ce qui nécessite une technique plus avancée qui permet une mesure précise des quantités infimes de l'anion. A cet effet, le sulfate radiomarqué 35S traceur conjointement avec β comptage à scintillation liquide a été utilisé, une technique couramment utilisée dans la séparation liquide-liquide d' extraction, et a récemment démontré son efficacité dans la surveillance du sulfate de cristallisation. 8
Ce protocole démontre l'monotope la synthèse in situ du ligand BBiG et sa cristallisation sous forme de sel de sulfate à partir de solutions aqueuses. La synthèse ex situ du ligand 11 est également présenté comme un cométhode nvenient pour la production de plus grandes quantités de BBiG-Cl, qui peuvent être stockées sous la forme cristalline jusqu'à utilisation. élimination Sulfate de l'eau de mer en utilisant le ligand BBiG-Cl préalablement préparé est ensuite démontrée. Enfin, l'utilisation de 35S-sulfate marqués et β le comptage à scintillation liquide pour mesurer la concentration en sulfate dans l' eau de mer est démontrée. Ce protocole est destiné à fournir un tutoriel pour ceux largement intéressés à explorer l'utilisation de cristallisation sélective pour la séparation d'anions aqueux.
Protocole
1. Synthèse de 1,4-benzène-bis (iminoguanidinium) Chloride (BBiG-Cl)
- In Situ Synthèse du 1,4-benzène-bis (iminoguanidinium) Chlorure Ligand (BBiG-Cl) et sa cristallisation avec Sulfate
- Ajouter 0,067 g de téréphtalique et 2,2 ml d'une solution aqueuse 0,5 M de chlorure de aminoguanidinium à 10 ml d'eau déminéralisée dans un 25 ml de ballon à fond rond équipé d'un barreau d'agitation magnétique.
- Agiter la solution magnétiquement pendant quatre heures à 20 ° C. Cela donnera une solution légèrement jaune de BBiG-Cl.
- Ajouter 0,5 ml d'une solution aqueuse 1 M de sulfate de sodium. Cela entraînera la précipitation instantanée de BBiG-SO 4 sous forme de solide cristallin blanc.
- Filtrer le solide par filtration sous vide pour récupérer BBiG-SO 4. Laver le solide sur le papier filtre à cinq reprises avec des aliquotes de 5 ml d'eau pour obtenir le sel de sulfate pur.
- Vérifiez la pureté de phase du BBiG-SO cristallin 4 obtenue par diffraction de poudre aux rayons X 12. Comparer avec le motif représenté sur la figure 1.
- Ex Situ Synthèse de 1,4-benzène-bis (iminoguanidinium) Chloride 11
- Ajouter 4 g de téréphtalique et 7,26 g de chlorure de aminoguanidinium à 20 ml d'éthanol dans un 50 ml de ballon à fond rond équipé d'un barreau d'agitation magnétique.
- Chauffer la solution à 60 ° C en utilisant une plaque chauffante, et remuer avec une barre d'agitation magnétique pendant 2 heures. Refroidir la solution à 20 ° C et laisser reposer pendant 3 heures, puis recueillir le solide par filtration sous vide à travers un entonnoir Büchner papier-filtre équipé.
- Suspendre le solide obtenu dans 20 ml d'éthanol et de la chaleur sur une plaque chauffante jusqu'à ébullition. Si le solide ne va pas complètement dans la solution à ce stade, ajouter de petites aliquotes (1 ml) d'éthanol, ce qui permet à chaque fois que la solution pour atteindre la température d'ébullition, jusqu'à ce que tout solide est dissous.
- Laisser refroidir le ballon à la chambre tempérare, puis placer dans un congélateur C 0 ° pendant une nuit. Recueillir le solide par filtration à travers un papier-filtre équipé Büchner entonnoir en utilisant la filtration sous vide.
- Confirmer l'identité et la pureté des BBiG-Cl par RMN 1 H spectroscopie 13. Comparer avec le spectre représenté sur la figure 2.
2. Séparation Sulfate de Seawater
- Cristallisation Sulfate comme BBiG-SO 4
NOTE: La quantité de BBiG-Cl nécessaire pour éliminer le sulfate dépend de la quantité exacte de sulfate dans l'eau de mer. Il a été constaté que l'utilisation de 1,5 équivalents de BBiG-Cl par rapport aux résultats de sulfate dans 99% d'élimination de sulfate. L'eau de mer utilisée dans ce protocole a une concentration de 30 mM de sulfate, tel que déterminé par titrage avec BaCl 2.- Filtrer l'eau de mer avec un filtre à seringue de 0,22 um ou membrane de filtration avec une petite taille de pores pour éliminer les particules en suspension et d'organismes biologiques.
- Faire un 30solution mM de BBiG-Cl avec de l'eau déminéralisée et solide BBiG-Cl préparé comme décrit dans la section précédente.
- Ajouter la solution BBiG-Cl à l'eau de mer 1,5 (v / v) la proportion 1.
- On agite le mélange pendant quelques heures pour s'assurer quantitative (> 99%) l'élimination du sulfate.
- Recueillir le solide par filtration à travers un papier-filtre équipé Büchner entonnoir en utilisant la filtration sous vide. Laver le solide sur le papier filtre à cinq reprises avec aliquotes de 5 ml d'eau.
- Sécher le solide isolé sous vide et peser pour déterminer le rendement.
- ligand Recovery
- Ajouter 53,1 mg de BBiG-SO 4 à une solution de 2 ml de NaOH (10%) dans un flacon de 20 ml de scintillation équipé d'un barreau d'agitation magnétique.
- Agiter le mélange pendant deux heures à 20 ° C. Un précipité légèrement jaune se forme.
- Filtrer le solide à travers un papier-filtre équipé Büchner entonnoir en utilisant la filtration sous vide. Laver le solide sur le papier filtre avec 0,2ml d'eau et on sèche sous vide.
- Caractériser le solide récupéré par RMN 13 pour confirmer son identité en tant que bis (guanidine) base libre. Comparer avec le spectre de RMN représenté sur la figure 3.
- Détermination de la quantité de sulfate Retiré de l'eau de mer par ß scintillation liquide Comptage
ATTENTION: Cette technique implique l'utilisation de radioisotopes, qui constituent une autre classe de risques que ce qui est normalement rencontré dans la plupart des laboratoires. équipement de protection contre les rayonnements spécial est habituellement exigé lors de la manipulation des radionucléides. Ainsi, il est essentiel que la procédure est suivie attentivement et que l'agent de sécurité est consulté pour obtenir des conseils et des orientations.- Calculer le volume de la solution mère du soufre-35 radioisotope (5 mCi / ml) utilisé pour assurer qu'il n'y a plus de 5 millions de coups par minute (cpm) par millilitre de solution d'eau de mer, en utilisant les équations suivantes (cpm et curies (Ci ) sont les deux unités de mesure fou radioactivité):
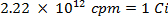
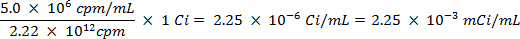
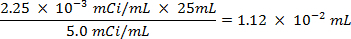
- Spike 25 ml de l'eau de mer avec 0,0112 ml de 5,0 mCi / ml , solution de 35S radiomarqué de la solution de sulfate de sodium.
- Préparer 0, 15, 30, 33, 45, et 60 solutions mM BBiG-Cl dans de l' eau déminéralisée et combiner 0,750 ml de ces solutions avec un volume égal de sulfate 35S radiomarqué dopés eau de mer dans un tube de 2 ml de la centrifugeuse.
- Incorporer le mélange par l'intermédiaire d'une roue ou vortex tournant dans un / boîte à air incubateur maintenu à une température constante de 25 ± 0,2 ° C pendant 24 heures.
- Centrifuger les solutions à 1500 xg pendant 10 min à 25 ° C.
- Après centrifugation, retirer 1,2 ml de chaque solution à l'aide d'une seringue, puis le filtrer à travers un filtre de seringue de 0,22 um pour éliminer la suspension précipité. Introduire à la pipette 1,0 ml de chacune de ces solutions dans 20 ml de cocktail de scintillation dans des flacons en polypropylène à scintillation. La solution ne contenant pas BBiG-Cl (la solution de contrôle) doivent être dilués dix fois avec de l'eau déminéralisée avant l'addition du cocktail de scintillation.
- Placer les flacons de scintillation contenant les échantillons et le cocktail de scintillation sur un compteur à scintillation liquide et laisser reposer pendant 1 heure avant de compter pour permettre aux échantillons à foncé adapter.
NOTE: Avant de compter les échantillons, calibrer l'instrument et permettre à chaque échantillon à compter pendant 30 min. Nombre de flacons supplémentaires ne contenant qu'un cocktail de scintillation afin de permettre une correction de fond qui est utilisé pour déterminer les concentrations de sulfate dans la solution. - Déterminer la quantité de sulfate éliminé, en utilisant les équations suivantes:
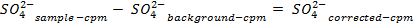
54411 / 54411eq5.jpg "/>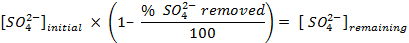
- Calculer le volume de la solution mère du soufre-35 radioisotope (5 mCi / ml) utilisé pour assurer qu'il n'y a plus de 5 millions de coups par minute (cpm) par millilitre de solution d'eau de mer, en utilisant les équations suivantes (cpm et curies (Ci ) sont les deux unités de mesure fou radioactivité):
Résultats
Le X-ray diagramme de diffraction de poudre de BBiG-SO 4 (Figure 1) permet de confirmer sans ambiguïté de l'identité du solide cristallisé. En comparant le modèle obtenu par rapport à la référence d'une intensité crête importe moins que le positionnement de pointe. Tous les pics forts indiqués dans la référence doivent être présents dans l'échantillon obtenu. L'apparition des pics forts de l'échantillon qui sont absents dan...
Discussion
Cette technique est relativement tolérante à de nombreux écarts par rapport à la procédure écrite, ce qui le rend très robuste. Il y a cependant deux étapes essentielles qui doivent être suivies. Tout d'abord, le ligand BBiG-Cl doit être aussi pur que possible. Impuretés non seulement affecter la cristallisation et la solubilité du sel de sulfate résultant, mais aussi il est difficile de calculer la quantité requise pour l'élimination du sulfate quantitative de la solution. Deuxièmement, toutes l...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the U.S. Department of Energy, Office of Science, Basic Energy Sciences, Chemical Sciences, Geosciences, and Biosciences Division. We thank the University of North Carolina Wilmington for providing the seawater.
matériels
| Name | Company | Catalog Number | Comments |
| Terephthalaldehyde | Sigma | T2207 | |
| Aminoguanidinium Chloride | Sigma | #396494 | |
| Sodium Sulfate | Sigma | #239313 | |
| Barium Chloride | Sigma | #342920 | Highly Toxic |
| Ethanol | Any | Reagent Grade (190 proof) | |
| Sodium Hydroxide | EMD | SX0590-1 | |
| Hydrochloric Acid | Sigma | #258148 | |
| Filter Paper | Any | - | Any qualitative or analytical filter paper will work |
| Syringe Filter (0.22 μm) | Any | - | Nylon filter |
| 35S Labeled Sulfate | Perkin Elmer | NEX041005MC | |
| Ultima Gold Scintillation Cocktail | Perkin Elmer | #6013329 | |
| Polypropylene Vials | Any | - | |
| Disposable Syringe (2-3 ml) | Any | - | Any disposable plastic syringe works |
Références
- Langton, M. L., Serpell, C. J., Beer, P. D. Anion Recognition in Water: Recent Advances from Supramolecular and Macromolecular Perspective. Angew. Chem. Int. Ed. 55, 1974-1987 (2016).
- Busschaert, N., Caltagirone, C., Van Rossom, W., Gale, P. A. Applications of Supramolecular Anion Recognition. Chem. Rev. 115, 8038-8155 (2015).
- Moyer, B. A., Custelcean, R., Hay, B. P., Sessler, J. L., Bowman-James, K., Day, V. W., Sung-Ok, K. A Case for Molecular Recognition in Nuclear Separations: Sulfate Separation from Nuclear Wastes. Inorg. Chem. 52, 3473-3490 (2013).
- Kim, S. K., Lee, J., Williams, N. J., Lynch, V. M., Hay, B. P., Moyer, B. A., Sessler, J. L. Bipyrrole-Strapped Calix[4]pyrroles: Strong Anion Receptors That Extract the Sulfate Anion. J. Am. Chem. Soc. 136, 15079-15085 (2014).
- Jia, C., Wu, B., Li, S., Huang, X., Zhao, Q., Li, Q., Yang, X. Highly Efficient Extraction of Sulfate Ions with a Tripodal Hexaurea Receptor. Angew. Chem. Int. Ed. 50, 486-490 (2011).
- Rajbanshi, A., Moyer, B. A., Custelcean, R. Sulfate Separation from Aqueous Alkaline Solutions by Selective Crystallization of Alkali Metal Coordination Capsules. Cryst. Growth Des. 11, 2702-2706 (2011).
- Custelcean, R. Urea-Functionalized Crystalline Capsules for Recognition and Separation of Tetrahedral Oxoanions. Chem. Commun. 49, 2173-2182 (2013).
- Custelcean, R., Sloop, F. V., Rajbanshi, A., Wan, S., Moyer, B. A. Sodium Sulfate Separation from Aqueous Alkaline Solutions via Crystalline Urea-Functionalized Capsules: Thermodynamics and Kinetics of Crystallization. Cryst. Growth Des. 15, 517-522 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A. Aqueous Sulfate Separation by Crystallization of Sulfate-Water Clusters. Angew. Chem. Int. Ed. 54, 10525-10529 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A., Ivanov, A. S., Bryantsev, V. S. Aqueous Sulfate Separation by Sequestration of [(SO4)(H2O)4]4- Clusters within Highly Insoluble Imine-Linked Bis-Guanidinium Crystals. Chem. Eur. J. 22, 1997-2003 (2016).
- Khownium, K., Wood, S. J., Miller, K. A., Balakrishna, R., Nguyen, T. B., Kimbrell, M. R., Georg, G. I., David, S. A. Novel Endotoxin-Sequestering Compounds with Terephthaldehyde-bis-guanylhydrazone Scaffolds. Bioorg. Med. Chem. Lett. 16, 1305-1308 (2006).
- Pecharsky, V. K., Zavalij, P. Y. . Fundamentals of Powder Diffraction and Structural Characterization of Materials. , (2005).
- Goldenberg, D. P. . Principles of NMR Spectroscopy: An Illustrated Guide. , (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon