È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Separazione solfato da selettiva cristallizzazione con un legante bis-iminoguanidinium
In questo articolo
Riepilogo
Un protocollo per la sintesi in situ acquosa di un bis (iminoguanidinium) ligando e il suo utilizzo nella separazione selettiva di solfato è presentato.
Abstract
A simple and effective method for selective sulfate separation from aqueous solutions by crystallization with a bis-guanidinium ligand, 1,4-benzene-bis(iminoguanidinium) (BBIG), is demonstrated. The ligand is synthesized as the chloride salt (BBIG-Cl) by in situ imine condensation of terephthalaldehyde with aminoguanidinium chloride in water, followed by crystallization as the sulfate salt (BBIG-SO4). Alternatively, BBIG-Cl is synthesized ex situ in larger scale from ethanol. The sulfate separation ability of the BBIG ligand is demonstrated by selective and quantitative crystallization of sulfate from seawater. The ligand can be recycled by neutralization of BBIG-SO4 with aqueous NaOH and crystallization of the neutral bis-iminoguanidine, which can be converted back into BBIG-Cl with aqueous HCl and reused in another separation cycle. Finally, 35S-labeled sulfate and β liquid scintillation counting are employed for monitoring the sulfate concentration in solution. Overall, this protocol will instruct the user in the necessary skills to synthesize a ligand, employ it in the selective crystallization of sulfate from aqueous solutions, and quantify the separation efficiency.
Introduzione
La separazione selettiva di oxoanions idrofili (ad esempio, solfato, cromato, fosfato) da soluzioni acquose competitive rappresenta una sfida fondamentale rilevante di risanamento ambientale, produzione di energia, e la salute umana. 1,2 solfato, in particolare, è difficile da estrarre dall'acqua a causa della sua riluttanza intrinseca a spargere la sua sfera di idratazione e migrare in ambienti meno polari. 3 Fare estrazione di solfato acquoso più efficiente in genere richiede recettori complessi che sono difficili e noioso per sintetizzare e purificare, che spesso coinvolgono reagenti tossici e solventi. 4,5
Cristallizzazione selettiva offre una semplice alternativa ma efficace per solfato di separazione dall'acqua. 6-9 Sebbene alcuni cationi metallici quali Ba 2+, Pb 2+, o Ra 2+ forma solfati molto insolubili, il loro uso nella separazione solfato non è sempre pratico a causa della loro elevata toxicittà e talvolta-bassa selettività. Utilizzando leganti organici come precipitanti solfato sfrutta la diversità strutturale e subordinazione al caratteristico design di molecole organiche. Un legante organico ideale per acquosa cristallizzazione solfato deve essere solubile in acqua, ma formare un sale solfato insolubile o complessa in un tempo relativamente breve e in presenza di alte concentrazioni di ioni concorrenti. Inoltre, dovrebbe essere facile da sintetizzare e riciclare. Uno di questi un ligando, 1,4-benzene-bis (iminoguanidinium) (BBIG), auto-assemblati in situ da due precursori disponibili in commercio, terephthalaldehyde e cloruro aminoguanidinium, è stato recentemente scoperto di essere estremamente efficace nella acquosa separazione solfato. 10 Il legante è in forma di cloruro solubile in acqua, e cristallizza selettivamente con solfato in un sale estremamente insolubile che può essere facilmente rimosso dalla soluzione per semplice filtrazione. Il legante BBIG può quindi essere recuperato per deprotonazione conqueous NaOH e cristallizzazione del neutro bis-iminoguanidine, che può essere riconvertito in forma di cloruro con HCl acquoso, e riutilizzato in un altro ciclo di separazione. L'efficacia di questo ligando nel rimuovere solfato dall'acqua è così grande che il monitoraggio della concentrazione di solfato rimanente in soluzione non è un compito banale, che richiede una tecnica più avanzata che consente la misurazione accurata di tracce di anione. A questo scopo, radiomarcato 35 S solfato tracciante in combinazione con β conteggio in scintillazione liquida è stata impiegata una tecnica comunemente utilizzata in separazioni estrattive liquido-liquido, e recentemente dimostrato di essere efficace nel controllo solfato di cristallizzazione. 8
Questo protocollo dimostra la one-pot nella sintesi situ del ligando BBIG e la sua cristallizzazione come sale solfato da soluzioni acquose. La sintesi ex situ del legante 11 è presentato anche come un coMetodo nvenient per la produzione di grandi quantità di BBIG-Cl, che possono essere memorizzati in forma cristallina fino al momento dell'uso. rimozione solfato dall'acqua di mare utilizzando il preparato in precedenza ligando BBIG-CL è quindi dimostrata. Infine, è dimostrato l'uso di 35 S-etichettati solfato e β conteggio in scintillazione liquida per misurare la concentrazione di solfato in acqua di mare. Questo protocollo è destinato a fornire un tutorial per quelli ampiamente interessati ad esplorare l'uso di cristallizzazione selettiva per acquosa separazione anione.
Protocollo
1. Sintesi di 1,4-Benzene-bis (iminoguanidinium) cloruro (BBIG-Cl)
- In Situ sintesi del 1,4-Benzene-bis (iminoguanidinium) Cloruro Ligand (BBIG-Cl) e la sua cristallizzazione con solfato
- Aggiungere 0,067 g di terephthalaldehyde e 2,2 ml di una soluzione acquosa 0,5 M di cloruro aminoguanidinium a 10 ml di acqua deionizzata in un 25 ml pallone da fondo dotati di ancoretta magnetica.
- Agitare la soluzione magneticamente per quattro ore a 20 ° C. Ciò produrrà una soluzione leggermente giallo BBIG-Cl.
- Aggiungere 0,5 ml di una soluzione acquosa 1 M di solfato di sodio. Ciò comporta la precipitazione istante di BBIG-SO 4 come solido cristallino bianco.
- Filtrare il filtrazione sotto vuoto usando solido di recuperare BBIG-SO 4. Lavare il solido sul filtro di carta cinque volte con 5 ml aliquote di acqua per ottenere il sale solfato puro.
- Controllare la purezza fase del cristallino BBIG-SO 4 ottenuto dalla polvere diffrazione di raggi X 12. Confronto con il modello mostrato in figura 1.
- Ex Situ Sintesi di 1,4-benzene-bis (iminoguanidinium) Cloruro 11
- Aggiungere 4 g di terephthalaldehyde e 7,26 g di cloruro di aminoguanidinium a 20 ml di etanolo in 50 ml pallone da fondo dotato di ancoretta magnetica.
- Riscaldare la soluzione a 60 ° C con una piastra, e mescolate con un ancoretta magnetica per 2 ore. Raffreddare la soluzione a 20 ° C e lasciate riposare per 3 ore, poi raccoglie il solido per filtrazione sotto vuoto attraverso un imbuto Buchner carta filtro attrezzato.
- Sospendere solido ottenuto in 20 mi di etanolo e di calore su una piastra riscaldante fino bollente. Se il solido non va completamente nella soluzione a questo punto, aggiungere piccole aliquote (1 ml) di etanolo, consentendo ogni volta la soluzione per raggiungere la temperatura di ebollizione, finché tutto solido viene sciolto.
- Lasciare raffreddare il pallone a camera temperi, poi posto in un congelatore C 0 ° durante la notte. Raccogliere il solido per filtrazione attraverso un filtro di carta attrezzato Büchner mediante filtrazione sotto vuoto.
- Confermare l'identità e la purezza del BBIG-Cl da 1 H spettroscopia NMR 13. Confronto con lo spettro illustrato nella figura 2.
2. Separazione solfato da acqua di mare
- Cristallizzazione solfato come BBIG-SO 4
NOTA: La quantità di BBIG-Cl necessario rimuovere il solfato dipende l'esatta quantità di solfato nell'acqua di mare. Si è constatato che con 1,5 equivalenti di BBIG-Cl rispetto ai risultati solfato di rimozione 99% di solfato. L'acqua di mare utilizzata in questo protocollo ha una concentrazione di 30 mM solfato, come determinato mediante titolazione con BaCl 2.- Filtrare l'acqua di mare con un filtro siringa da 0,22 micron o membrana filtrante con di piccola dimensione dei pori per rimuovere le particelle in sospensione e organismi biologici.
- Fare un 30soluzione mM di BBIG-Cl con acqua deionizzata e solido BBIG-Cl preparato come descritto nella sezione precedente.
- Aggiungere la soluzione BBIG-Cl all'acqua di mare in 1.5: (v / v) proporzione 1.
- Mescolare la miscela per alcune ore per garantire (> 99%) rimozione quantitativa di solfato.
- Raccogliere il solido per filtrazione attraverso un filtro di carta attrezzato Büchner mediante filtrazione sotto vuoto. Lavare il solido sul filtro di carta per cinque volte con aliquote di 5 ml di acqua.
- Asciugare il solido isolato sotto vuoto e pesare per determinare la resa.
- ligand recupero
- Aggiungere 53,1 mg di BBIG-SO 4 Ad una soluzione di NaOH (10%) 2 ml in un flaconcino 20 ml scintillazione munito di ancoretta magnetica.
- Mescolare la miscela per due ore a 20 ° C. Un precipitato leggermente giallo si formerà.
- Filtrare il solido attraverso un filtro di carta attrezzato Büchner imbuto con filtrazione a vuoto. Lavare il solido sul filtro di carta con 0.2ml di acqua, e asciugare sotto vuoto.
- Caratterizzare il solido recuperato mediante NMR 13 di confermare la sua identità come il bis (guanidina) base libera. Confronto con lo spettro NMR mostrato in figura 3.
- Determinazione della quantità di solfato Rimosso dal acqua di mare da ß scintillazione liquida conteggio
ATTENZIONE: Questa tecnica prevede l'utilizzo di radioisotopi, che pongono una diversa classe di pericoli di quello che viene normalmente incorrono nella maggior parte dei laboratori. Attrezzature speciali di protezione dalle radiazioni è di solito necessario quando si maneggiano i radionuclidi. Pertanto, è essenziale che la procedura è seguita con attenzione e che un responsabile della sicurezza è consultato per consulenza e orientamento.- Calcolare il volume della soluzione di riserva dello zolfo-35 radioisotopi (5 mCi / ml) utilizzato per assicurarsi che ci sia più di 5 milioni di conteggi per minuto (cpm) per millilitro di soluzione di acqua di mare, utilizzando le seguenti equazioni (cpm e curie (Ci ) sono entrambe le unità di misura fo radioattività):
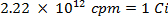
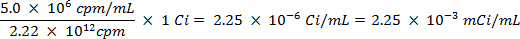
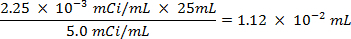
- Spike 25 ml di acqua di mare con 0,0112 ml di 5,0 / ml soluzione mCi di 35 S radiomarcato soluzione di solfato di sodio.
- Preparare 0, 15, 30, 33, 45, e 60 mM di soluzioni BBIG-Cl in acqua deionizzata e combinare 0.750 ml di queste soluzioni con un volume uguale di solfato di 35 S-radiomarcato spillo acqua marina in una provetta da centrifuga da 2 ml.
- Mescolare la miscela tramite una ruota girevole o vortice in un / air-box incubatore mantenuto ad una temperatura costante di 25 ± 0,2 ° C per 24 ore.
- Centrifugare le soluzioni a 1.500 xg per 10 min a 25 ° C.
- Dopo la centrifugazione, rimuovere 1,2 ml di ciascuna soluzione con una siringa, poi filtrare attraverso un filtro a siringa da 0,22 micron per rimuovere la sospensione precipitato. Pipettare 1,0 ml di ognuna di queste soluzioni in 20 ml di cocktail di scintillazione in fiale di scintillazione polipropilene. La soluzione non contenente BBIG-Cl (la soluzione di controllo) devono essere diluiti dieci volte con acqua deionizzata prima dell'aggiunta al cocktail di scintillazione.
- Posizionare le fiale di scintillazione contenenti i campioni e il cocktail di scintillazione su un contatore a scintillazione liquido e lasciate riposare per 1 ora prima di contare fino a consentire ai campioni di dark-adattamento.
NOTA: Prima di contare i campioni, calibrare lo strumento e consentire ogni campione di contare per 30 min. Contare fiale aggiuntivo contenente solo cocktail di scintillazione per consentire una correzione del fondo che viene utilizzato per determinare le concentrazioni di solfato in soluzione. - Determinare la quantità di solfato rimossa, utilizzando le seguenti equazioni:
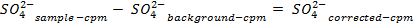
54411 / 54411eq5.jpg "/>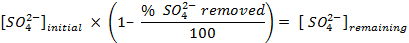
- Calcolare il volume della soluzione di riserva dello zolfo-35 radioisotopi (5 mCi / ml) utilizzato per assicurarsi che ci sia più di 5 milioni di conteggi per minuto (cpm) per millilitro di soluzione di acqua di mare, utilizzando le seguenti equazioni (cpm e curie (Ci ) sono entrambe le unità di misura fo radioattività):
Risultati
La polvere a raggi X diffrazione di BBIG-SO 4 (Figura 1) permette la conferma inequivocabile l'identità del solido cristallizzato. Nel confrontare il pattern ottenuto contro quella di riferimento, l'intensità di picco importa meno di posizionamento picco. Tutti i picchi forti indicati in riferimento dovrebbero essere presenti nel campione ottenuto. La comparsa di forti picchi del campione che sono assenti nel modello di riferimento indica la presenza...
Discussione
Questa tecnica è piuttosto tollerante a molte deviazioni dalla procedura scritta, il che rende abbastanza robusto. Ci sono però due passaggi critici che devono essere seguite. Innanzitutto, il ligando BBIG-Cl deve essere il più puro possibile. Le impurezze non solo influenzerà la cristallizzazione e la solubilità del sale solfato risultante, ma sarà anche rendere difficile calcolare la quantità necessaria per la rimozione solfato quantitativa dalla soluzione. In secondo luogo, hanno bisogno di tutti i passaggi ne...
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by the U.S. Department of Energy, Office of Science, Basic Energy Sciences, Chemical Sciences, Geosciences, and Biosciences Division. We thank the University of North Carolina Wilmington for providing the seawater.
Materiali
| Name | Company | Catalog Number | Comments |
| Terephthalaldehyde | Sigma | T2207 | |
| Aminoguanidinium Chloride | Sigma | #396494 | |
| Sodium Sulfate | Sigma | #239313 | |
| Barium Chloride | Sigma | #342920 | Highly Toxic |
| Ethanol | Any | Reagent Grade (190 proof) | |
| Sodium Hydroxide | EMD | SX0590-1 | |
| Hydrochloric Acid | Sigma | #258148 | |
| Filter Paper | Any | - | Any qualitative or analytical filter paper will work |
| Syringe Filter (0.22 μm) | Any | - | Nylon filter |
| 35S Labeled Sulfate | Perkin Elmer | NEX041005MC | |
| Ultima Gold Scintillation Cocktail | Perkin Elmer | #6013329 | |
| Polypropylene Vials | Any | - | |
| Disposable Syringe (2-3 ml) | Any | - | Any disposable plastic syringe works |
Riferimenti
- Langton, M. L., Serpell, C. J., Beer, P. D. Anion Recognition in Water: Recent Advances from Supramolecular and Macromolecular Perspective. Angew. Chem. Int. Ed. 55, 1974-1987 (2016).
- Busschaert, N., Caltagirone, C., Van Rossom, W., Gale, P. A. Applications of Supramolecular Anion Recognition. Chem. Rev. 115, 8038-8155 (2015).
- Moyer, B. A., Custelcean, R., Hay, B. P., Sessler, J. L., Bowman-James, K., Day, V. W., Sung-Ok, K. A Case for Molecular Recognition in Nuclear Separations: Sulfate Separation from Nuclear Wastes. Inorg. Chem. 52, 3473-3490 (2013).
- Kim, S. K., Lee, J., Williams, N. J., Lynch, V. M., Hay, B. P., Moyer, B. A., Sessler, J. L. Bipyrrole-Strapped Calix[4]pyrroles: Strong Anion Receptors That Extract the Sulfate Anion. J. Am. Chem. Soc. 136, 15079-15085 (2014).
- Jia, C., Wu, B., Li, S., Huang, X., Zhao, Q., Li, Q., Yang, X. Highly Efficient Extraction of Sulfate Ions with a Tripodal Hexaurea Receptor. Angew. Chem. Int. Ed. 50, 486-490 (2011).
- Rajbanshi, A., Moyer, B. A., Custelcean, R. Sulfate Separation from Aqueous Alkaline Solutions by Selective Crystallization of Alkali Metal Coordination Capsules. Cryst. Growth Des. 11, 2702-2706 (2011).
- Custelcean, R. Urea-Functionalized Crystalline Capsules for Recognition and Separation of Tetrahedral Oxoanions. Chem. Commun. 49, 2173-2182 (2013).
- Custelcean, R., Sloop, F. V., Rajbanshi, A., Wan, S., Moyer, B. A. Sodium Sulfate Separation from Aqueous Alkaline Solutions via Crystalline Urea-Functionalized Capsules: Thermodynamics and Kinetics of Crystallization. Cryst. Growth Des. 15, 517-522 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A. Aqueous Sulfate Separation by Crystallization of Sulfate-Water Clusters. Angew. Chem. Int. Ed. 54, 10525-10529 (2015).
- Custelcean, R., Williams, N. J., Seipp, C. A., Ivanov, A. S., Bryantsev, V. S. Aqueous Sulfate Separation by Sequestration of [(SO4)(H2O)4]4- Clusters within Highly Insoluble Imine-Linked Bis-Guanidinium Crystals. Chem. Eur. J. 22, 1997-2003 (2016).
- Khownium, K., Wood, S. J., Miller, K. A., Balakrishna, R., Nguyen, T. B., Kimbrell, M. R., Georg, G. I., David, S. A. Novel Endotoxin-Sequestering Compounds with Terephthaldehyde-bis-guanylhydrazone Scaffolds. Bioorg. Med. Chem. Lett. 16, 1305-1308 (2006).
- Pecharsky, V. K., Zavalij, P. Y. . Fundamentals of Powder Diffraction and Structural Characterization of Materials. , (2005).
- Goldenberg, D. P. . Principles of NMR Spectroscopy: An Illustrated Guide. , (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon