Method Article
Induktion von Lähmung und visuelles System Verletzungen bei Mäusen durch T-Zellen spezifisch für Neuromyelitis Optica Autoantigen Aquaporin-4
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll zur Lähmung und Opticospinal Entzündung durch Übertragung von Aquaporin-4 (AQP4) induzieren-spezifischen T-Zellen von AQP4- / - Mäusen in WT-Mäuse. Darüber hinaus führen wir serielle optische Kohärenztomographie verwenden, um visuelle System Funktionsstörung zu überwachen.
Zusammenfassung
Während es erkannt wird, dass Aquaporin-4 (AQP4)-spezifischen T-Zellen und Antikörper zu beteiligen, in der Pathogenese der Neuromyelitis Optica (NMO), menschliche Zentralnervensystem (ZNS) demyelinisierende Autoimmunerkrankung, Schaffung eines Modells AQP4 gezielt mit den beiden klinische und histologische Manifestationen von CNS Autoimmunität bewährt herausfordernd. Immunisierung der Wildtyp (WT) Mäuse mit AQP4 Peptide löste T-Zell-Proliferation, obwohl diese T-Zellen nicht Krankheit auf naive Empfänger Mäuse übertragen könnte. Vor kurzem, zwei Roman AQP4 T Zelle Epitope, Peptid (p) 135-153 und p201-220, wurden identifiziert als Studium Immunantworten auf AQP4 in AQP4-defizienten (AQP4- / -) Mäuse, was auf T-Zell-Reaktivität auf diese Epitope normalerweise durch Zebrafischembryonen gesteuert wird negative Auslese. AQP4- / - Th17 polarisiert T-Zellen grundiert, p135-153 oder p201-220 induzierte Paralyse im Empfänger WT Mäuse, die überwiegend Leptomeningeal Entzündung des Rückenmarks und des Sehnerven zugeordnet war. Umliegenden Sehnerven Entzündung und Beteiligung der Netzhaut Innenlagen (IRL) wurden durch Änderungen in serielle Optische Kohärenztomografie (OCT) manifestiert. Hier zeigen wir die Ansätze zur Erstellung dieses neue in-Vivo -Modell von AQP4-bezogene CNS Autoimmunität (ATCA), die jetzt eingesetzt werden können, um Mechanismen zu studieren, die Entwicklung der pathogenen AQP4-spezifischen T-Zellen und wie sie mit B zusammenarbeiten können zulassen Zellen in der Pathogenese der NMO.
Einleitung
Neuromyelitis Optica (NMO) ist ein zentrales Nervensystem (ZNS) entzündliche demyelinisierende Autoimmunerkrankung, die wiederkehrende Episoden von Lähmung und Sehverlust führt zu dauerhafter neurologischer Behinderung1verursacht. NMO gilt heute in erster Linie auf eine humorale Autoimmunerkrankung2 sein, da sie Antikörper (Igs) gezielt Aquaporin-4 (AQP4), einem Wasserkanal ausgedrückt reichlich am Astrozyten3,4zugeordnet ist. CNS Entzündung ist jedoch eine Voraussetzung für CNS-Eintrag von AQP4 Ig5,6. So war es nicht möglich, ein Modell der NMO durch Übertragung von Anti-AQP4 Igs allein zu etablieren. Die Ergebnisse, dass (1) Pathogene AQP4-spezifische Igs in NMO Patienten IgG11,2sind, ist eine T-Zell-abhängigen Ig Unterklasse7 (2) T-Zellen in NMO Läsionen8,9 (3) NMO identifiziert werden verbunden mit bestimmten MHC-II-Gene (z. B. HLA-DR17 (DRB1 * 0301))10und (4) proinflammatorischen AQP4-reaktive DR-eingeschränkte Th17 Zellen werden in NMO Patienten11,12 alle erweitert geht hervor, dass AQP4-spezifischen T-Zellen eine wichtige Rolle in NMO Pathogenese. Daher ist es wichtig, entwickeln Tiermodelle um festzustellen, wie AQP4-spezifischen T-Zellen zur NMO Pathogenese beitragen können.
Vor einigen Jahren wurden mehrere AQP4 T Zelle Epitope in Wildtyp (WT) Mäuse13,14 und Ratten15identifiziert. Während es beobachtet wurde, dass AQP4-reaktive T-Zellen Opticospinal Entzündung im naive Empfänger Ratten15,16auslösen könnte, wurden deutliche klinische Anzeichen der CNS Krankheit nicht beobachtet. In ähnlicher Weise direkte Immunisierung von Mäusen, WT mit Peptiden mit AQP4 T Zelle Epitope14,17, oder Übertragung von proinflammatorischen T-Zellen gezielt jene Determinanten17, nicht die Ursache für klinische Symptome oder histologische Nachweis der CNS Autoimmunität.
Vor kurzem, es wurde beobachtet, dass Immunisierung von Mäusen C57BL/6 AQP4-defizienten (AQP4- / -) mit AQP4-Peptid (p) 135-153 oder p201-220, zwei Determinanten binden MHC-II (I-A-b) voraussichtlich mit hoher Affinität18, löste starke CD4 + T-Zell-Antworten-17. Im Gegensatz dazu löste diese zwei Peptide nur bescheidene proliferative Reaktionen bei WT-Mäusen. Darüber hinaus war der T-Zell-Rezeptor (TCR) Repertoire zur Anerkennung dieser Determinanten von T-Zellen von AQP4- / - Mäusen einzigartig. Diese Feststellungen zufolge gemeinsam Zebrafischembryonen negative Auslese T Zelle Anerkennung von AQP4 geregelt ist. AQP4 p135-153 oder p201-220-spezifische Th17 Zellen von AQP4- / - Spender Mäusen induzierte Paralyse in fast 100 % der naive Empfänger WT Mäuse; Dies war verbunden mit Opticospinal Infiltrate von T-Zellen, B-Zellen und Monozyten. Serielle Opticospinal Kohärenztomografie (OCT) demonstriert dynamische visuelle System Beteiligung. Mäuse mit T-Zell-vermittelten AQP4-bezogene CNS Autoimmunität (ATCA) von Lähmung und visuelles System Verletzungen erholt. Im Gegensatz zu EAE induziert durch Myelin Oligodendrozyt Glykoprotein (MOG) p35-55-spezifische T-Zellen, was zu persistent klinischen Erkrankung führte, war ATCA induziert durch T-Zellen allein nicht axonalen Verlust oder Reduzierung der retinalen Ganglienzellen (Routinggruppenconnectors) zugeordnet. Unsere Ergebnisse haben deutlich gezeigt, dass gibt es mehrere Pathogene AQP4 T Zelle Determinanten. Dieses neue Modell der ATCA eignet sich für die Untersuchung der Mechanismen, die Entwicklung der pathogenen AQP4-spezifischen T-Zellen, lernen, wie diese Zellen CNS Entzündung auslösen und wie sie zusammenarbeiten können, mit AQP4-spezifische B-Zellen und Antikörper, NMO Pathogenese zu fördern .
In diesem Bericht beschreiben wir die verwendeten Protokolle zum induzieren und T-Zell-induzierte ATCA zu bewerten. Wir beginnen mit den Techniken für Immunisierung, T-Zell-Kultur und Th17 Polarisation zur Erzeugung von pathogener AQP4-spezifischen T-Zellen, Flow-Zytometrie-Analyse, Polarisation und Adoptiveltern Übertragung dieser T-Zellen zu bestätigen. Wir beschreiben dann Methoden zur Bewertung von klinischen und histologischen Krankheit und die Verwendung von seriellen OCT, visuelle System Verletzungen im Empfänger Mäuse zu überwachen.
Protokoll
alle tierischen Eingriffe wurden in Übereinstimmung mit den experimentellen Leitlinien von der University of California, San Francisco institutionelle Animal Care und Use Committee genehmigt. Weibliche Mäusen C57BL/6 (h-2 b), 8 Wochen alt, wurden gekauft und C57BL/6 AQP4 - / - Mäuse wurden von A. Verkman.
1. Immunisierung von Mäusen mit AQP4 Peptide
- bereiten Sie komplette Freund ' s Adjuvans (CFA) Arbeit Lager.
- Fein mahlen eine ausgetrocknete Vorbereitung von M. Tuberculosis (H37Ra) mit einem Mörser und Pistill.
- Add Boden H37Ra, unvollständige Freund ' s adjuvante, eine Endkonzentration von 4 mg/mL. CFA kann bis zu 6 Monate bei 4 ° C gelagert werden.
- Auflösen lyophilisiert Antigen (Ag) AQP4 Peptid in Phosphat gepufferte Kochsalzlösung (PBS), eine Endkonzentration von 1 mg/mL. Halten bei 4 ° C oder auf Ice
- Bereiten Sie die Baugruppe 2 Luer-Lock Spritzen, verbunden mit einem Absperrhahn mit CFA/Peptid Emulsion.
- Attach Glas Luer-Lock Spritze ohne Kolben, um eine 3-Wege-Nylon-Absperrhahn mit 2 männlichen Luer-Lock-Verbindungen. Schließen Sie den Absperrhahn durch den Wechsel der Hebel gegen die Spritze. Positionieren Sie das offene Ende der Spritze auf, so dass die Spritze, als ein Reagenzglas zu handeln. Platzieren Sie diese in einem Rohr Rack für zusätzliche Stabilität.
- Vortex CFA arbeiten Lager und die Ag-Lösung. Fügen Sie ein 1:1 Volumen von Peptid / CFA an der offenen Spritze. 200 µL der CFA/Ag (4 x 50 µL) ist per Mausklick erforderlich.
Hinweis: In der Regel etwa 1 mL der Vorbereitung der Absperrhahn verliert die zur Immunisierung reduzieren wird. Daher ist es wichtig, dies in die Berechnung des Gesamtvolumens erforderlich zu integrieren.
Beispiel: für die Immunisierung von Mäusen, 5: (200 µL/Tier X 5 Tiere) + 1 mL extra Volumen = 2 mL insgesamt CFA/Ag erforderlich. - Legen Sie den Glas-Kolben in die Spritze und während es in Position zu halten, drehen Sie die Spritze, so dass der Absperrhahn nach oben ausgerichtet ist. Wechseln Sie den Absperrhahn Hebel zur ungenutzten weiblichen Verbindung. Vorsichtig Druck auf das Glas Kolben um überschüssige Luft aus der Spritze entfernen. Die Flüssigkeit füllt die zweite männliche Luer-Lock-Verbindung von der Absperrhahn.
- Legen eine zweite Glasspritze (Kolben vollständig eingesteckt) auf der zweiten männlichen Luer-Lock-Verbindung von den Absperrhahn. Dies sollte ein geschlossenes System von 2 Glas Spritzen mit einem Absperrhahn mit als wenig überschüssige Luft wie möglich verbunden.
- , Eine Emulsion zu schaffen durch drücken die Kolben übergeben der Flüssigkeit abwechselnd zwischen die 2 Spritzen für ca. 2 min. Chill die Spritzen auf Eis für ca. 10 min. Wiederholen Sie die kühlen und mischen, bis eine klare der Viskosität der Zubereitung Änderung mischen , was zu einem sehr steifen, weiße Emulsion. Die Spritzen mit der Emulsion bei 4 ° C im Kühlschrank oder auf Eis zu halten
- Transfer aller der Emulsion zu einer Glasspritze Luer-Lock, die leere Glasspritze entfernen und ersetzen Sie es mit einer 1 mL-Luer-Lock-Spritze für die Injektion. Füllen Sie die neue Spritze mit Emulsion, entfernen Sie es aus dem Hahn und befestigen Sie eine Nadel (25 X 5/8).
- " Wasser-Test " die Emulsion auf Konsistenz. Einen Tropfen der Emulsion in eine kleine Schüssel mit Wasser zu vertreiben. Die Emulsion sollte nicht zerstreuen, darauf hinweist, dass es geeignet für die Injektion ist.
- Wenn die Emulsion verteilt, ist es nicht bereit zur Injektion; die Flüssigkeit zurück in das Glas Spritzen und weiter mischen und dann wieder entspannen, bis die Emulsion steif ist.
- Die Emulsion wieder zu testen, bis die richtige Konsistenz erreicht worden ist.
- Spender AQP4 - / - Mäusen subkutan zu injizieren (s.c.) mit Emulsion mit AQP4-Peptid. Jede Maus erhält 4 x 50 µL s.c. Injektionen (200 µL Gesamt (100 µg Peptid)). Die 4 Seiten sind Seiten des Unterleibs, die in die inguinalen Lymphknoten (LN) abtropfen lassen, und beide Seiten der Brustwand medial jeder Achsel, die in axillären LN zu entwässern Die Adoptiveltern Übertragung erfordert 1-2 immunisierten Spender Mäuse pro Empfänger Maus.
2. T-Zell-Kultur und Proinflammatory T-Zell-Polarisation
- 10-12 Tage nach der Impfung, kassiere die Mäuse in LN.
- In eine Eiswürfelschale bereiten 60 mm Petrischalen mit einer Zelle Sieb (Gitter Größe 70 µm) ausgestattet, gekühlte RPMI Medium mit 10 % Hitze-inaktivierten fetalen bovine Serum (FBS) und 100 U/mL Penicillin-100 µg/mL Streptomycin (Stift-Strep) (RFPS) enthalten.
- Einschläfern Mäuse durch die Einwirkung von CO 2, gefolgt von zervikale Dislokation. Mäuse in 70 % igem Ethanol Tauchen und dann pin jedes Straßenräuber gegenüber einer Dissektion.
- Schneiden einen Mittellinie Hautschnitt von der Leiste bis zum Hals und unten jedes Bein. Ziehen Sie die Haut von dem Bauchfell und Heften Sie es straff auf dem Brett. Leisten- und axillären LN zu sezieren und in der Petrischale mit RFPS auf Eis legen. 19
- für Adoptiveltern Transfer Experimente kombinieren LN von allen Tieren innerhalb der gleichen Gruppe Immunisierung. Für Flow durchflusszytometrischen Analyse der Vβ Nutzung, LN trennen einzelner Tiere.
- Die Zelle Sieb mit der LN auf eine 50 mL Zentrifugenröhrchen mit Angebotsanfragen zu platzieren. Verwenden Sie das flache Ende des Spritzenkolbens eine sterile 5 mL drücken, die LN-Zellen durch das Sieb, waschen mit 20-30 mL RFPs, Wiederherstellung der Zellen zu erleichtern. LN-Zellen auf Eis während der Verarbeitung bis Zeit für Kultur zu erhalten.
- Waschen zweimal, bei 393 X g für 5 min zentrifugieren. Nach der zweiten Wäsche Aufschwemmen der LN-Zellen in T-Zell-Medien (TCM). TCM enthält RPMI mit 10 % Hitze-inaktivierten FBS, 292 µg/mL L-Glutamin, 110 µg/mL Natrium Pyruvat und 55 µM 2-Mercaptoethanol und Stift-Strep. In der Regel ein Volumen von 5 mL TCM pro Spender Maus verwendet.
- Zählen die LN-Zellen. Erwartete Rendite ist ca. 3-6 x 10 7 LN Zellen pro immunisierten Maus Spender. Beiseite von 3-4 x 10 6 für eine Verbreitung-Assay (siehe Abschnitt 3).
- Richten Sie polarisieren Kulturen für Adoptiv-Transfer (Abschnitt 6).
- Bereiten eine Th17 polarisierende Kultur von 5 x 10 6 LN Zellen pro mL mit 10 µg/mL Ag, 20 ng/mL rekombinanter Maus Interleukin (IL)-23 und 10 ng/mL rekombinanter Maus IL-6 in der TCM.
- Alternativ Th1 Polarisation, Vorbereitung einer Kultur von 5 x 10 6 LN Zellen pro mL mit 10 µg/mL Ag und 10 ng/mL rekombinanter Maus IL-12 in der TCM.
- Fügen Sie 2 mL (1 x 10 7 Zellen) pro Bohrloch der polarisierende Kultur Mischung in ein 12-Well-Platte. Die LN-Zellen von 2-4 Spender Mäusen werden ein 12-Well-Platte füllen. Pflegen Kulturen in einem befeuchteten Inkubator bei 37 ° C mit 5 % CO 2 für 72 h
- Eine Sichtkontrolle der LN Zellen in der Kultur für die Aktivierung bei 48 h und 72 h. aktivierten Zellen bilden umfangreiche Cluster und die T-Zellen in der Größe, immer mehr pleomorphen erhöhen. Die Steigerung des Stoffwechsels bewirkt eine Absenkung des pH-Wertes in den Medien, Wechsel von Pfirsich, Orange. Ist der pH-Wert niedrig genug, um die Medien zu vergilben, fügen Sie 1 mL frische TCM gegen Toxizität auf die Zellen in den verbleibenden 24 Std. Fahren Sie mit Abschnitt 6
- für Adoptiveltern übertragen. Polarisation Effizienz kann durch intrazelluläre Zytokin Färbung (ICS), als Descr überprüft werdeniBed in Abschnitt 5.
- Richten Sie Kulturen mit LN aus einzelnen Mäusen für durchflusszytometrischen Analyse der Vβ Oberflächenexpression (Abschnitt 4).
- 5 x 10 6 LN Zellen pro mL mit 10 µg/mL Ag in der TCM vorzubereiten.
- Add 2 mL (1 x 10 7 Zellen) der Kultur pro Bohrloch in einer 12-Well-Platte. Kulturen ist für 10 Tage in einem befeuchteten Inkubator bei 37 ° C mit 5 % CO 2 aufzubewahren. Fahren Sie mit Abschnitt 4.
3. Verbreitung Assay
Hinweis: Dies wird fortgesetzt, aus Abschnitt 2.4.
- Bereiten 3-4 mL LN Zellen in einer Röhre, 2 x 10 6 Zellen pro mL in der TCM.
- Vorsichtig mischen die Zellen durch das Rohr mehrmals umdrehen, und übertragen Sie dann auf einem sterilen Trog.
- Verwendung eines Mehrkanal-Pipette, Platte 100 µL Zellen pro Bohrloch in einer 96-Well-Runde Bodenplatte Gewebekultur. In der Regel Platte 15 Brunnen zu Testzwecken dreifacher 4 Ag-Konzentrationen und keine Referenz Ag.
- Verdünnen die Ag in TCM bei verschiedenen Konzentrationen, in der Regel 80, 20, 5, 1 und 0 µg/mL (für 2 X Bestände). Fügen Sie 100 µL jeder Konzentration in dreifacher Ausführung für eine Endkonzentration von 40, 10, 2.5. 0,5 und 0 µg/mL. Brüten etwa 72 Stunden bei 37 ° c
Hinweis: Schritte 3.5 bis 3.7 umfassen radioaktive Stoffe. Ordnungsgemäße Verwendung, Überwachung und Entsorgung von radioaktiven Stoffen durchgeführt werden, gemäß den institutionellen und staatlichen Vorschriften. - Bereiten eine arbeiten-Stammlösung von 3 H-Thymidin (40 µCi/mL) mit 25 mL RPMI 1 mCi 3 H-Thymidin hinzu, und speichern Sie diese auf 4 ° C. Pipettieren 0,5 mL der Arbeitslösung in einen sterilen Trog.
- Fügen Sie 25 µL 3 H-Thymidin (1 µCi) pro auch mit einem Mehrkanal-pipettieren. Inkubieren Sie für weitere 18 h bei 37 ° c
- Zellen auf ein Glas Filtermatte mit einer 96-Well-Zelle-Erntemaschine zu ernten und mit 70 % Ethanol spülen. Nach dem Trocknen, versiegeln Sie die Filtermatte in einen Kunststoff Probe Beutel mit 5 mL funkeln Flüssigkeit. Maßnahme Radioaktivität in jeder gut mit einem Szintillationszähler.
4. Flow Cytometry Analysis für Zelle Oberfläche TCR Vβ Ausdruck
Hinweis: Dies wird fortgesetzt, von Abschnitt 2.6. Antikörper gegen Maus TCR Vβ 2, 3, 4, 5.1 und 5.2, 6, 7, 8.1 und 8.2, 8.3, 9, 10, 11, 12, 13, 14 und 17a sind kommerziell zum Testen des TCR Vβ-Ausdrucks zur Verfügung.
- Für die Erkennung von TCR Vβ, T-Zellen aus der Kultur-Platte durch Pipettieren mehrmals zu verdrängen und Zellen auf einem Rohr übertragen.
- Mit FACS Puffer (FB), enthält 2 % FBS, 0,1 % Natriumazid und 2 mM EDTA in PBS waschen.
- Transfer-Zellen zu einem V-Boden-96-Well-Platte bei einer Dichte von 1 x 10 5 bis 3 x 10 6 Zellen pro Bohrloch. Wenn das gesamte Vβ-Panel getestet wird, sollten die Zellen in mehrere Vertiefungen (einen Brunnen pro Vβ getestet) verteilt werden.
- Tote Zellen von der durchflusszytometrischen Analyse durch Färbung mit einem LIVE/DEAD Lebensfähigkeit Farbstoff, das mit freien Amine durch nekrotische Zellen ausgesetzt reagiert ausschließen. Folgen Sie den Hersteller ' s Gebrauchsanweisung Zentrifugation und Wiederfreisetzung in Lebensfähigkeit Farbstoff. Inkubieren Sie für 10-20 min. in die Zelle Färbung Verfahren auf Eis, Zellen vor Licht schützen und halten Sie auf Ice
- Nach der Inkubation, waschen Sie die Platte einmal in FB. Um TCR Vβ erkennen, aussetzen der Zellen in 100 µL der FB mit einer 1: 100 Verdünnung der Antikörper für CD4 (Klon RM4-5) und TCR Vβ. Inkubieren Sie für 15-60 min auf Ice
- Waschen Sie die Platte einmal in FB und befestigen Sie die Zellen durch Zugabe von 200 µL 4 % Paraformaldehyd in PBS verdünnt. Inkubieren Sie für 20 min auf Eis. Waschen Sie die Platte in der FB und analysieren von Durchflusszytometrie.
5. Durchflusszytometrischen Analyse für intrazellulären Produktion von Zytokinen fließen
- für intrazelluläre Zytokin Färbung (ICS), T-Zell-Kulturen mit einer 1:1,000-Verdünnung von Protein Transport Inhibitor Reagenz (z. B. GolgiPlug) behandeln in der TCM 4 h vor der ICS zu verhindern Zytokin-Sekretion. Zu diesem Zeitpunkt aktivieren, T-Zellen mit 50 ng/mL Phorbol Myristate-12 13-Acetat (PMA) und 500 ng/mL Ionomycin um Protein-Produktion induzieren.
- Nach 4 h der Kultur bei 37 ° C, verdrängen Zellen aus der Kultur-Platte durch Pipettieren rauf und runter, und übertragen Sie auf eine Zentrifugenröhrchen (15 oder 50 mL).
- Waschen mit FB. Zellen in FB und Transfer zu einem V-Boden-96-Well-Platte bei einer Dichte von 5 x 10 5 bis 3 x 10 6 Zellen pro Bohrloch Aufschwemmen.
- Fleck Zellen mit Lebensfähigkeit Farbstoff wie beschrieben (Abschnitt 4.2). Nach der Inkubation, waschen Sie die Platte einmal in FB.
- Antikörpern zum Nachweis von Oberflächenmarker wie folgt hinzufügen:
- für die Erkennung von Oberflächenmarker, aussetzen der Zellen in 100 µL der FB mit einer 1: 100 Verdünnung der Antikörper für CD4 (Klon RM4-5).
- Optional gehören Antikörper für B220 (Klon 30-F11) und CD11b (Klon M1/70) bei einer 1: 100 Verdünnung Anspritzung von B-Zellen und Monozyten/Makrophagen, bzw. zu verbessern. In der Regel funktionieren PE-Cy7 Anti-CD4, FITC Anti-B220 und PerCP-Cy5.5 Anti-CD11b gut. Wahl der Antikörper/Fluorochrom Konjugate sollte geführt werden, durch Konfiguration des Durchflusszytometer für Analyse verwendet werden, und optimale Konzentrationen von Antikörpern sollte empirisch ermittelt werden.
- Inkubieren Sie für 15-60 min auf Eis.
- Waschen Sie die Platte mit FB und Aufschwemmen der Zellen in 200 µL Fixierung/Permeabilisierung Lösung für 20 min auf Eis. Dies die Zellen zu beheben und die Membranen permeabilize.
- Um die Permeabilisierung der Zellmembranen während die intrazelluläre Färbung zu erhalten verwenden anstelle von FB Perm/Waschpuffer (PW) (verdünnte 01:10 von 10 X Lager). Waschen Sie die Brunnen in 200 µL PW.
- Für ICS, bereiten Sie eine 1: 100 Verdünnung der Antikörper für Interferon (IFN)-γ und IL-17A mit 1 X PW. Eine Option ist APC Anti-IFN-γ (Klon XMG1.2) und PE Anti-IL-17A (Klon eBio17B7) die gut funktioniert. Zellen in 100 µL des intrazellulären Antikörpers cocktail Aufschwemmen und dann mindestens 15 min inkubieren. Es ist auch möglich, weiterhin die Färbung über Nacht bei 4 ° c
- Waschen die Brunnen in 200 µL PW und Wiederfreisetzung in FB für Durchflusszytometrie.
- Parallel, bereiten eine ungefärbte Probe (Zellen in FB ohne Antikörper) Detektor Spannungen und Single-gefärbten Proben für jede einzelne Fluorochrom (d. h. Zellen oder Entschädigung Perlen gefärbt mit nur einem Antikörper/Fluorochrom) zu optimieren bestimmen Spillover Ausgleichswerte.
- Mit einem Durchflusszytometer, erwerben ≥ 10.000 Zellen (Veranstaltungen), gating auf tragfähige (LIVE/DEAD-negativ) CD4 + Zellen. Um genaue Anspritzung von T-Zellen zu gewährleisten, schließen die B220 + und CD11b + Zellen (B-Zellen und Monozyten/Makrophagen, beziehungsweise). Innerhalb der CD4 + T Zelle Subpopulation, bestimmen, den Anteil der Zellen mit dem Ausdruck IFN-γ (Th1-Linie) oder IL-17A (Th17 Abstammung).
6. Adoptiveltern übertragen Pathogene AQP4-spezifischen T-Zellen
Hinweis: Diese Schritt ergibt sich aus Abschnitt 2.5: T-Zell-Kultur und proinflammatorischen T-Zell-Polarisation.
- Recover polarisierten Zellen von 12-Well-Platten durch Pipettieren rauf und runter um zu verdrängen, und ihre Übertragung auf eine 50 mL-Tube. MaIntain auf dem Eis bis Injektionen.
- Der Zellen zu zählen, zweimal in kaltem PBS waschen und vorbereiten eine Suspension von 1 x 10 8 Zellen/mL in PBS. In der Regel injizieren Zellen innerhalb einer Stunde.
- Sanft die Zellen durch Umschwenken mischen und auf eine 1 mL Spritze zum Zeitpunkt der Injektion übertragen. Verwalten von 200 µL der Zellen (2 x 10 7) intravenös (i.v.) für jede Maus durch den Schweif Vene.
- Spritzen jeder Empfänger Maus i.p mit 200 ng von B. Pertussis-Toxin in 200 µL PBS verdünnt, an diesem Tag und 2 Tage später. Überwachen Sie Mäuse täglich auf Anzeichen einer klinischen Erkrankung.
7. Klinische Bewertung von ATCA
- Examine Empfänger Mäuse täglich auf klinische Anzeichen von CNS Autoimmunität. Im Allgemeinen werden Mäuse CNS Autoimmunität 5-8 Tage nach Adoptiveltern Übertragung von AQP4-spezifischen T-Zellen aufweisen. Die Mäuse zeigen klinische Symptome einer neurologischen Dysfunktion. Es ist hilfreich, die Auswertungen auf eine naiv-Maus, die normale Fähigkeit einer Maus zu definieren.
- Evaluate Mäuse für den Verlust der Rute Ton. Halten Sie die Mäuse sanft an der Unterseite der Rute und heben Sie aufrecht. Ein Heck, dass Droops wird kontinuierlich als Verlust der Rute Ton (Ergebnis 1). Verlust der Rute Ton ist oft das erste Zeichen der klinischen Erkrankung.
- Test für aufrichtenden Reflex indem Maus auf dem Rücken auf einer flachen Oberfläche. Langsam aufrichten, ist ein Zeichen von Herzkreislaufkrankheiten Koordinationsstörungen (Score von 2). Eine naiv-Maus wird komplett widerstehen jeder Versuch, legen Sie sie auf den Rücken, damit Langsamkeit in der Fähigkeit zu Recht als Dysfunktion erzielt wird. Es ist typisch für die Maus 3 - 4 Mal für diesen Reflex testen.
- Evaluate Körperhaltung und Mobilisation. Mäuse beginnen, um eine Änderung in der Haltung führt zu einer Senkung oder ziehen der Hüften während der Mobilisation (Score von 2,5). Weitere Krankheit führt zu Monoplegia, vollständige Lähmung einer Hirschkuh Gliedmaßen (Score von 3.0) und Paraplegie, vollständige Lähmung der beiden hinteren Gliedmaßen (Score von 3,5). Moderate Quadraparesis, alle vier Extremitäten, Schwäche führt zu sehr langsame Vorwärtsbewegung (Score von 4). Schwere Quadraparesis lässt fast keine Vorwärtsbewegung (Score von 4,5). Schließlich können sie mit schweren Erkrankungen zu moribund oder sterben (5 Punkte).
- Verwalten, Mäuse, die die Fähigkeit verlieren, flüssige oder feste Nahrung 1 mL 5 % Glukose in Kochsalzlösung i.p Alternativ erwerben Verwendung Supplementierung mit Flüssigkeit gel Tassen, hohen kalorischen Gel und Speck Softies, Austrocknung und Nahrungsmangel entgegenzuwirken. Moribund Mäuse einschläfern.
8. Gewebe-Vorbereitung und Histologie
- Mäuse mit 100 mg/kg Ketamin und 10 mg/kg Xylazin zu betäuben und dann pin jedes Straßenräuber gegenüber einer Dissektion.
- Open auf der Brust, das Herz aussetzen. Einschneiden der Leber Blut Abfluss ermöglichen. Legen Sie eine Butterfly-Nadel auf das Rohr einer Miniflow drehzahlgeregelte Pumpe mit einem separaten Behälter für PBS und 10 % Formalin. Stechen Sie die Nadel in den linken Ventrikel des Herzens und mit 5 mL PBS, gefolgt von 25 mL 10 % Formalin perfundieren.
- Den Kopf und dann die Augen entfernen. Prozess-Augen und Netzhaut wie zuvor 20 beschrieben. Quer durch die Augenhöhlen, legen Sie die Schere an der Nase und schneiden den Schädel anterior Posterior auf jeder Seite.
- Den Schädel zu entfernen, setzen Sie die Sehnerven, schneiden Optik Chiasmus und in einer Kassette zwischen 2 Schaumstoff-Pads.
- Tauchen in 10 % Formalin (24 h), und dann 50 % Ethanol (24 h) und übertragen Sie dann mit 70 % Ethanol.
- Gehirn und Wirbelsäule zu entfernen und in 10 % Formalin. Seriell Abschnitt Gehirne in der koronalen Ebene; Sektion Wirbelsäule Schnüre in sagittaler (etwa die Hälfte) und serielle koronalen Flugzeuge (ca. 20 Querschnitte per Mausklick).
- Prozess CNS Proben routinemäßig für Paraffin einbetten. Fleck 8 µm dicke Abschnitte mit Hämatoxylin und Eosin (Sehnerven) oder Luxol schnelles blau-Hämatoxylin und Eosin (Gehirn und Rückenmark).
- Bewerten Sehnerven auf das Vorhandensein von Entzündungen innerhalb der Nerven und der umgebenden Hirnhäute (Optikusneuritis) oder überwiegend in der umgebenden Hirnhäute (optische Perineuritis).
- Zählen meningealen und parenchymatösen entzündliche Herde (> 10 gruppierten mononukleären Zellen) in das Gehirn und Rückenmark Proben für jede Maus.
9. In Vivo Retinale Bildgebung durch Optische Kohärenztomografie (OCT)
Hinweis: Spectral-Domain OCT Netzhaut Bildgebung von Mäusen erfolgt mit kommerziellen Geräten (z. B. Spectralis mit TruTrack Eye-Tracker), konsequente Okular zu erreichen Orientierung und reduziert Bewegungsartefakte.
- 5 min. vor Bildgebung, erweitern Schülerinnen und Schüler mit 1 % Tropicamid (ein Tropfen pro Auge) und legen Sie Maus, um in der Anästhesie-Induktion-Kammer, abgebildet mit einem stetigen Strom von 2 l / min (1,5 % Isofluran). Schalten Sie Wärme Matte und bereiten Sie den Post-Narkose Erholung Käfig.
- Platzieren Sie den Mauszeiger auf die Bildgebung Zylinder und leiten die Anästhesie Ablauf entsprechend. Schützen Sie die Augen mit 0,3 % Hydroxypropyl Methylcellulose, das Auge feucht zu halten und Brechung Kontinuität zu gewährleisten. Legen Sie eine benutzerdefinierte Kontaktlinse auf das Auge untersucht werden.
- Führungen durch das Infrarot-Fundus-Bild direkt den Laser auf das Auge, sicherzustellen, dass der Strahl auf den Sehnerv Kopf zentriert ist. Vertikale und horizontale OCT Scans sollten sicherstellen, dass die Netzhaut senkrecht zum Laser legt.
- Führen Sie 25 B-Scans im hochauflösenden Modus und Rastern von 30 gemittelt Bildfenster.
- Nach imaging beide Augen, Kontaktlinsen entfernen und ophthalmologische Gel auftragen. Maus im Käfig warm Erholung lassen.
10. Verarbeitung und Analyse von OCT
- verwenden das modulare imaging-Software für die automatisierte Segmentierung.
- Manuell richtigen Segmente entsprechend der Inneres Begrenzung der Membran (ILM) und inneren plexiformen Schicht (IPL), repräsentiert die Grenzen der inneren Netzhaut "layers" (IRL) 21.
- Überprüfen, die der retinalen Nervenfaserschicht (RNFL) und das Ganglion Zellschicht (GCL) befinden sich innerhalb der Grenzen der IRL und sich nicht überschneiden.
- Berechnen IRL stärken das frühe Behandlung diabetischer Retinopathie Studie (ETDRS) 2 Gitter mit einem Durchmesser von 1, 2 und 3 mm zentriert auf die Papille und Export in eine Kalkulationstabelle verwenden. Die Software berechnet die Dicke der einzelnen Schichten der Netzhaut durch Mittelung jedes Raster-Sektor. Daher ist das mittlere Segment, entsprechend des Sehnervenkopfes ausgeschlossen.
- Analysieren statistischen Unterschiede zwischen den Gruppen zu jedem Zeitpunkt. Analysieren beide Augen für jede Maus, die mit generalisierten Schätzung Gleichungen mit einer austauschbaren Korrelationsmatrix und Anpassungen für Intra unterliegt Inter Auge Korrelationen 21.
Ergebnisse
In diesem Protokoll verwendeten wir Spenderzellen T von C57BL/6 AQP4- / - Mäusen. Subkutane Immunisierung von diesen Mäusen mit AQP4 p135-153 oder p201-220, die pathogenen T-Zell-Epitope enthalten, löste starke proliferative T-Zell-Reaktionen in Lymphknoten (Abbildung 1), während diese beiden Peptide viel schwächeren T-Zellen induziert Verbreitung in WT-Mäuse. Im Vergleich, Immunisierung mit AQP4 p91-110, die ein nicht-pathogenen AQP4 T Zelle bestimmende13oder MOG p35-55, ein Myelin-Peptid, die T-Zellen aktiviert, die experimentelle autoimmune Enzephalomyelitis (EAE)22,23 verursachen ,24, induzierte ähnlichen Größenordnung der T-Zell-Proliferation in AQP4- /- und WT-Mäuse. Analyse der TCR Auslastung von Flow Cytometry Färbung für individuelle Vβ oder Vβ Familien gezeigt, dass p135-153 und p201-220-spezifische T-Zellen von AQP4- / - Mäusen einzigartige TCR Repertoire genutzt. Selektive hyper-Proliferation von AQP4 p135-153 und p201-220 in AQP4- / - Mäusen, sowie die einzigartige TCR Auslastung (Abbildung 2), darauf hingewiesen, dass die pathogenen T-Zell-Reaktionen zu dieser Determinanten wird normalerweise durch Zebrafischembryonen negativ reguliert Auswahl, unterstreicht die Bedeutung für die Verwendung von AQP4- / - Spender T-Zellen in diesem Protokoll.
Vor Adoptiv Übertragung für die Induktion von ATCA waren Lymphknotenzellen von AQP4 Peptid-vorbereitete Mäusen Th17 oder Th1 polarisierenden Bedingungen für drei Tage in vitro kultiviert. Das Ausmaß der Polarisierung des Spenders CD4+ T Zellen bestätigt durch intrazelluläre Zytokin Färbung (ICS) und Durchflusszytometrie (Abbildung 3) gemessen wurde. Naive Empfänger Mäuse wurden mit 2 x 107 Spender AQP4-Peptid-spezifischen T-Zellen intravenös injiziert. Nach etwa sechs Tagen entwickelt fast 100 % der Empfänger Mäuse klinische Anzeichen von CNS Autoimmun-Krankheit, einschließlich schlaff Hind Leib und Schweif Lähmung (Abbildung 4). TH17-polarisierten AQP4-spezifischen T-Zellen induziert schwerere klinische Krankheit als Th1-polarisierte AQP4-spezifischen T-Zellen. Video 1zeigt eine repräsentative Maus, die Th17 AQP4-Peptid-spezifische erhalten und entwickelt komplette Hind Extremität Lähmung (Paraplegie). Im Gegensatz zu Mäusen, die EAE nach Verabreichung von MOG-spezifische Th17-Zellen entwickelt, erholte sich Empfänger Mäuse von klinischen Erkrankung durch AQP4-spezifische Th17-Zellen induziert. Wie bei EAE durch MOG p35-55-spezifische Th17 Zellen induziert klinische Krankheit induziert durch AQP4 p135-153-spezifische oder p201-220-spezifische Th17 Zellen wurde im Zusammenhang mit Infiltration von mononukleären Zellen im CNS Parenchym und Hirnhaut (Abbildung 5). Läsionen waren häufiger in der Hirnhäute als in das Parenchym für CNS Autoimmunität durch AQP4-spezifische Th17-Zellen induziert.
Sehnerv Beteiligung zeigte sich durch histologische Auswertung und von seriellen OCT. AQP4-spezifische und MOG-spezifische Th17 Zellen beide induzierte Sehnerv Entzündung, die durch Anwesenheit von mononukleären Zellen gekennzeichnet war. Während AQP4-spezifische Th17 Zellen faseroptische Perineuritis verursacht, induziert MOG-spezifische Th17-Zellen schwere Optikusneuritis (Abbildung 5). Mit seriellen OCT, Sehnerv Entzündung zeigte sich durch Schwellungen und erhöhte innere Netzhaut (IRL) Schichtdicke für klinische Krankheit induziert durch AQP4-spezifische oder MOG-spezifische Th17 Zellen (Abbildung 6). Für CNS AQP4 Th17-induzierte Autoimmunität, IRL Dicke wieder zum Ausgangswert als Mäuse von klinischen Erkrankung erholt. Im Gegensatz dazu Persistenz von EAE induziert durch MOG-spezifische Th17 korrespondierte mit IRL Ausdünnung und wie wir bisher17, nachgewiesen wurde im Zusammenhang mit Verlust von retinalen Ganglienzellen.
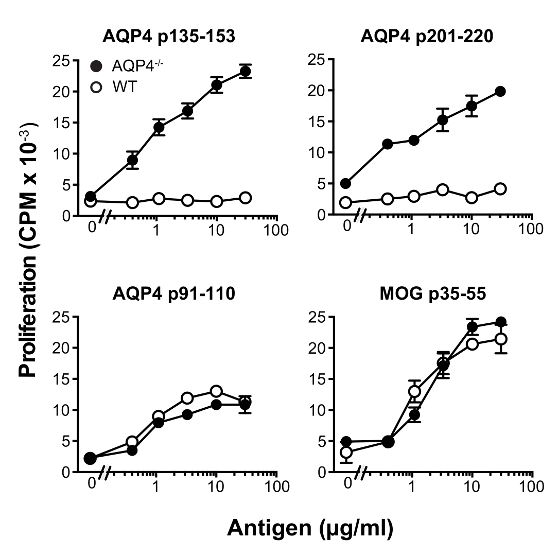
Abbildung 1 : AQP4 p135-153 und p201-220 entlocken robuste T-Zell-Proliferation in AQP4- / - Mäuse, aber nicht WT Mäuse. Mäuse wurden immunisiert s.c. mit der angegebenen Peptide in CFA. Elf Tage später, wurden Lymphknoten entfernt, und dann gezüchtet mit entweder kein Antigen oder das Peptid für Immunisierung verwendet. Verbreitung wurde durch 3H-Thymidin Einbau (Mittelwert ± SEM, Vertreter von 5 Experimenten) gemessen. Bitte klicken Sie hier für eine größere Version dieser Figur.
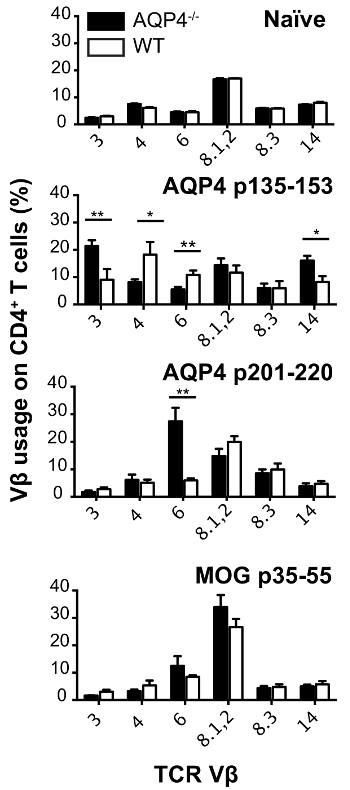
Abbildung 2 : AQP4-spezifischen T-Zellen von AQP4- / - Mäusen nutzen einzigartige TCR Repertoire. AQP4- /- und WT-Mäusen wurden mit den angegebenen Peptide immunisiert. Elf Tage später, wurden Lymphknoten entfernt und mit Peptid zur Immunisierung kultiviert. Zellen wurden geerntet. TCR Vβ Nutzung wurde durch Durchflusszytometrie analysiert (meine ± SEM, n = 5). Bitte klicken Sie hier für eine größere Version dieser Figur.
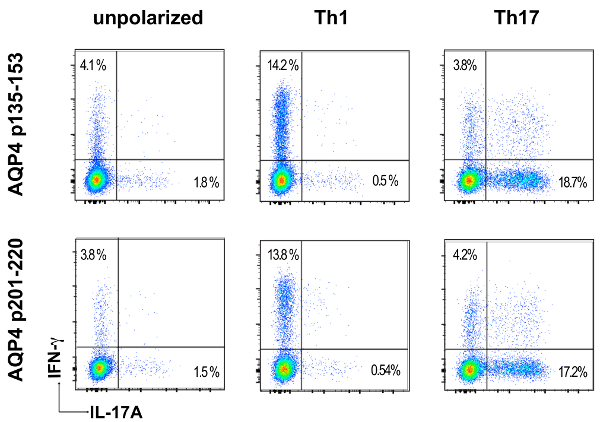
Abbildung 3 : Proinflammatorischen Polarisierung der Spenderzellen AQP4-spezifischen T. Elf Tage nach der Immunisierung mit AQP4 p135-153 oder p201-220, wurden Lymphknotenzellen geerntet und mit das Peptid zur Immunisierung in nicht polarisierenden Bedingungen, Th1 oder Th17-polarisierende Art kultiviert. TH17 oder Th1 Polarisation wurde von ICS und Flow Cytometry für IL-17 oder IFN-γ, untersucht. Bitte klicken Sie hier für eine größere Version dieser Figur.
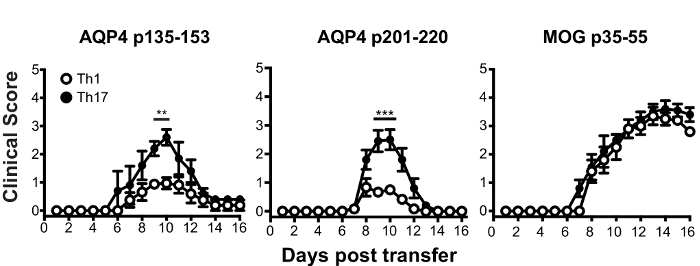
Abbildung 4 : Th17-polarisierten AQP4-spezifischen T-Zellen induzieren Lähmung im Empfänger Mäuse WT. WT Empfänger Mäuse erhielt 2 x 107 Spender Th17-polarisierten AQP4 p135-153 oder p201-220-spezifische T-Zellen von AQP4- / - Mäusen. TH17-polarisierten MOG-spezifischen T-Zellen als positive Kontrolle diente. Ergebnisse sind repräsentativ für 8 Experimente (n = 5/Gruppe). * p < 0,05, ** p < 0,01, *** p < 0,001. Bitte klicken Sie hier für eine größere Version dieser Figur.
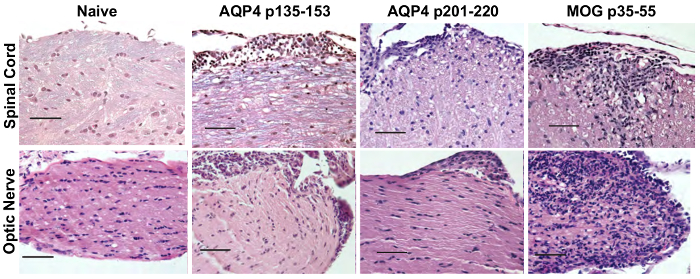
Abbildung 5 : AQP4-spezifische Th17-Zellen induzieren Opticospinal Entzündung bei Mäusen WT. Empfänger Mäuse erhielten 2 x 107 Spender Th17 AQP4 p135-153 - oder p201-220-grundiert Th17 Zellen von AQP4- / - Mäusen oder Th17 MOG p35-55-spezifische und 10 Tage später geopfert wurden. Rückenmark und Sehnerven Gewebe wurden vorbereitet und befleckt mit H & E/LFB auf Anzeichen von Entzündungen und Demyelinisierung bewerten, beziehungsweise. Ergebnisse sind repräsentativ für 5 Mäuse/Gruppe. Maßstabsleiste = 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
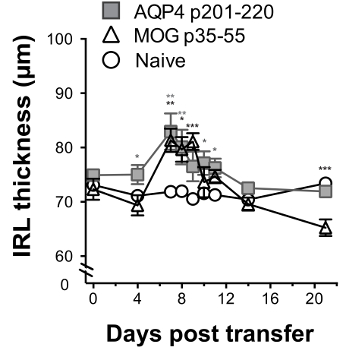
Abbildung 6 : Sehnerv Entzündung durch AQP4-spezifische Th17-Zellen induziert durch longitudinale retinalen Okt. überwacht werden kann WT Empfänger Mäuse erhielten 2 x 107 Spender Th17-polarisierten AQP4 p201-220-spezifische oder MOG p35-55-spezifische T-Zellen am Tag 0. Sie wurden von OCT am Tag 0 (vor der Verabreichung von T-Zellen) geprüft und dann an Tagen 4, 7, 8, 9, 10, 11 14 und 21. IRL-Dicke wurde gemessen (Mittelwert ± SEM). Statistiken zeigen einen Vergleich mit naiv-Steuerung. Ergebnisse sind repräsentativ für 3 Versuche (5 Mäuse/Gruppe). * p < 0,05, ** p < 0,01, *** p < 0,001. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
AQP4 wurde als das primäre Ziel in NMO-IgG in 20053identifiziert. Dann wurde es erkannt, dass es wichtig wäre, AQP4-bezogene Tiermodell der CNS Autoimmunität zu etablieren. Ein solches Modell könnte nützlich sein, zu untersuchen, wie AQP4-spezifischen T- und B-Zellen in der Entwicklung von CNS Autoimmunität teilnehmen und Kandidat Therapeutika für NMO zu testen. Obwohl die Identifikation von AQP4-spezifischen T-Zell Epitope in Wildtyp Mäusen zuerst in 201013, T-Zellen reagieren auf diese Epitope berichtet wurde histologische oder klinische Krankheit14,17nicht verursacht haben. Die Unfähigkeit, ein Modell von CNS Autoimmunität basierend auf immune Reaktivität, AQP4 erzeugen blieb ein Rätsel bis 2015 bei Jones, Et Al. 25 entdeckt, dass Spender AQP4-p135-153-grundiert-T-Zellen von AQP4- / - Mäusen verursacht klinischen und histologische Zeichen der CNS Autoimmunität bei WT Mäusen konnten. Von Interesse dürfte AQP4 p135-153 MHC-II (I-A-b) binden mit hoher Affinität17. Nur eine andere AQP4 Aminosäure-Sequenz, 201-220, wird voraussichtlich-Ab mit ähnlich hoher Affinität zu binden. In der Tat haben wir beobachtet, dass AQP4 p135-153 und p201-220 sowohl robuste Verbreitung in AQP4- / -, aber nicht WT, Mäuse zu entlocken. Hier haben wir gezeigt, wie man isolieren und insgesamt Th17 AQP4 p135-153 - und p201-220-reaktive T-Zellen von AQP4- / - Mäusen zu erweitern. Wenn in WT Empfänger Mäuse übertragen, induzierte AQP4-reaktive Th17 Spenderzellen Lähmung, begleitet von mononukleären Zellen Infiltrate in Rückenmark und Sehnerven. Afferenten Sehsystem Verletzungen ist bei Patienten mit AQP4-seropositiv NMOSD26bekannt. Hier beobachteten wir, dass Sehnerv Entzündung induziert durch AQP4-reaktive und MOG-reaktive Th17-Zellen deutlich wurde. Während AQP4-spezifische Th17-Zellen faseroptische Perineuritis induziert, induziert MOG-spezifische Th17-Zellen schwere Optikusneuritis. Wir haben auch die Techniken zur Überwachung der Sehnerv Entzündung durch AQP4-spezifische und MOG-spezifischen T-Zellen induziert serielle OCT beschrieben. Andere Forscher sollte nun in der Lage, die Protokolle, die hier beschrieben, um ihre eigenen Studien konzentrierte sich auf pathogene Mechanismen der ATCA voraus.
Leicht kann man vermeiden, dass drei potenzielle Fallstricke in unserem Protokoll. Erstens die Adoptiveltern Übertragung von ATCA erfordert Verwendung von AQP4-spezifischen T-Zellen von AQP4- / - Spender-Mäusen. Insbesondere WT AQP4 p135-153-spezifische T-Spenderzellen nicht ATCA Empfänger WT Mäusen die Ursache. Zweitens ist es wichtig, eine "Wasser-Test" mit einem Tropfen das Peptid/CFA-Emulsion vor Immunisierung von AQP4- / - Mäusen (Protokoll Schritt 1.5) durchzuführen. Die Emulsion sollte nicht im Wasser zerstreuen, wenn es zur s.c. Injektion geeignet ist. Wenn die Emulsion verteilt, sollte eine mischen die Emulsion wieder, wieder entspannen und wiederholen Sie den Wasser-Test. Zu guter Letzt induzieren aktivierten Spender CNS antigenspezifischen T-Zellen CNS Autoimmunität effizienter als ruhenden T-Zellen. Man sollte diese Kulturen unter dem Lichtmikroskop vor der Ernte der Spender-T-Zellen für Adoptiveltern Transfer Sichtkontrolle. Sich schnell teilenden Zellen kann Cluster bilden, die leicht identifiziert werden. Auch, wenn Kulturen viele aktivierte T-Zellen enthalten, können die Medien von Rosa zu Orange oder sogar gelb, durch Reduzierung des pH-Wertes Übergang. Eine kann auch Aktivierung von Spender AQP4 grundiert Lymphknoten T-Zellen zur Vermehrung von 3H-Thymidin Gesellschaftsgründung, bewerten, wie im Protokoll Schritt 3 beschrieben.
Unsere Entdeckung, dass die beiden pathogenen AQP4 T Zelle Epitope (1) vorhergesagt werden zu binden MHC-II mit hoher Affinität und (2) entlocken potente proliferative Reaktionen in AQP4- / -, aber nicht WT, Mäuse empfehlen T-Zellen gezielt jene Determinanten sind in der Regel Zebrafischembryonen negative Auslese17gesteuert. Die TCR-Repertoire genutzt für die Anerkennung von AQP4 p135-153 und p201-220 in AQP4- / - Mäuse sind einzigartig (Abbildung 2), das steht auch im Einklang mit klonalen Löschung durch Zebrafischembryonen medullären Epithelzellen vermittelt. Andere tolerogene Mechanismen können normalerweise Immunantworten auf AQP4 zurückhalten. Im Anschluss an unseren ersten Bericht17eine andere Gruppe auch gezeigt, dass AQP4 p201-220 ein insgesamt T Zelle bestimmende27enthält. Wenn α/β (TCRα- / -) T-Zell-defizienten Mäusen wurden mit AQP4- / - CD4 rekonstituiert+ T-Zellen, war es möglich, ein insgesamt AQP4-spezifischen T-Zell-Antwort, aber keine AQP4-spezifische humorale Antwort, was bedeutet, dass in entlocken WT-Mäuse AQP4-spezifische B-Zell-Antworten, ähnlich wie AQP4-spezifischen T-Zell-Antworten, unterliegen der negativen Auslese. In der Tat erfordern Verlust des Rückenmarks Axone und Routinggruppenconnectors, die nicht im WT Mäuse mit ATCA induziert durch AQP4-spezifischen T-Zellen allein zu beobachten war, Beteiligung von pathogenen AQP4-spezifischen Antikörpern. Es ist klar, dass die Maus-Modellen von AQP4-bezogene CNS Autoimmunität weiterhin entwickeln, wie wir lernen, mehr zu tolerogene Mechanismen normalerweise Steuerung AQP4-spezifischen T-Zellen und B-Zell-Immunität.
Auch andere Modelle von AQP4-bezogene CNS Autoimmunität werden entwickelten6,16,28,29,30. Jeder kann bieten Vorteile für das Studium besondere Aspekte, die für NMO Pathogenese sind. AQP4-spezifischen T-Zellen wurden im WT Ratten6,16,29nachgewiesen. Diese AQP4-spezifische T-Zellen verursacht histologische Veränderungen der CNS Autoimmunität, aber ähnlich wie bei Beobachtungen in den Mäusen, WT-Ratte-AQP4-spezifischen T-Zellen verursachen keine deutliche Anzeichen einer klinischen Erkrankung. Daher werden die Mechanismen der Toleranz, die Einschränkung der T-Zellen und B-Zellen AQP4-spezifische Immunantworten bei WT Mäusen auch in Ratten. Unabhängig davon sollte man nicht unterschätzen die Macht im Umgang mit Maus-Modellen für die Untersuchung von Mechanismen in der Pathogenese der Krankheit. Der Reichtum der Knock-out-transgenen und Reporter Mäuse kann vorteilhaft sein. Es sollte auch anerkannt werden, dass mehrere grundlegende Entdeckungen in der Autoimmunität mit EAE Mausmodellen vorgenommen wurden. Z. B. Demonstration, dass T-Zell-Klone für ein selbst-Antigen spezifischen Autoimmunerkrankung31,32, Identifizierung von die Rolle des T-Zell-Costimulation Autoimmunität33 und die Entdeckung der vermitteln kann die Developmental Weg für Th17 Differenzierung34 wurden erstmals beschrieben mit EAE Mausmodellen. Mit der Maus-Modell der ATCA, die wir entwickelt haben, muss man nun die Mittel zur Entwicklung und Regulierung der pathogenen AQP4-spezifische Immunantworten in vivo Studie die wichtige Erkenntnisse im Zusammenhang mit NMO Pathogenese bieten sollte.
Offenlegungen
S.A. Sagan, A. Cruz-Herranz, C.M. Spencer, P.P. Ho, L. Steinman, a.j. Green und R.A. Sobel Berichten keine Angaben. S.s. Zamvil ist stellvertretender Chefredakteur der Neurologie, Neuroimmunologie und Neuroinflammation und ist Mitglied des advisory Board für die internationale Gesellschaft der Neuroimmunologie. Er ist Mitglied des Editorial Boards des Journal of Clinical Investigation, The Journal of Immunology und The Journal der neurologischen Wissenschaftenund wurde Gründungsmitglied des Zuschusses Review Committee für den nationalen Ämtern der Gesundheit (NIH) klinische Neuroimmunologie und Gehirn Tumoren (CNBT) Studie Abschnitt und der National Multiple Sclerosis Society (NMS). Er diente als Berater und erhielt Honorare von Biogen Idec, EMD Serono, Genzyme, Novartis, Roche/Genentech und Teva Pharmaceuticals, Inc., und diente oder dient auf Data Safety Monitoring Boards für Lilly, BioMS, Teva und Opexa Therapeutika. Derzeit erhält Dr. Zamvil Forschung Zuschüsse vom NIH, NMS, der Maisin Foundation, Biogen und Celgene.
Danksagungen
S.S.Z. war durch das National Institute of Health (RO1 AI073737 und RO1 NS092835-01), National Multiple Sclerosis Society (RG 4768, RG 5179 und RG 5180), Maisin Foundation und Guthy Jackson Charitable Foundation unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| M. tuberculosis H37Ra | BD Difco | 231141 | Dessicated, killed M. tuberculosis |
| Incomplete Freund's Adjuvant | BD Difco | 263910 | |
| AQP4 peptide p135-153 | Genemed | Custom Synthesis | Peptide sequence: LVTPPSVVGGLGVTMVHGN |
| AQP4 peptide p201-220 | Genemed | Custom Synthesis | Peptide sequence: HLFAINYTGASMNPARSFGP |
| MOG peptide p35-55 | Genemed / Auspep | Custom Synthesis | Peptide sequence: MEVGWYRSPFSRVVHLYRNGK |
| 3-way Stopcock | Kimble | 420163-4503 | |
| HyClone Fetal Bovine Serum (Characterized) | GE Healthcare Life Sciences | SH30071 | |
| Recombinant Mouse IL-23 | R&D Systems (BioTechne) | 1887-ML | |
| Recombinant Mouse IL-6 | R&D Systems (BioTechne) | 406-ML | |
| Recombinant Mouse IL-12 | R&D Systems (BioTechne) | 419-ML | |
| Thymidine [Methyl-3H] | PerkinElmer | NET027 | |
| Glass Fiber Filtermats | PerkinElmer | 1450-421 | |
| Anti-mouse antibodies | eBioscience (Affymetrix) | [various] | |
| Anti-mouse TCR Vβ Screening Panel | BD Biosciences | 557004 | |
| LIVE/DEAD Fixable Dead Cell Stain | ThermoFisher Scientific | [various] | |
| Paraformaldehyde (16%) | Electron Microscopy Sciences | 15710 | |
| Fixation/Permeabilization Solution Kit with GolgiPlug | BD Biosciences | 555028 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | P8139 | |
| Iomomycin (calcium salt) | Sigma-Aldrich | I0634 | |
| Pertussis Toxin from B. pertussis | List Biological Laboratories | 181 | |
| 10% Formalin | VWR | 89370-094 | |
| Variable-Flow Peristaltic Pump | Fisher Scientific | 13-876-2 | |
| Foam Biopsy Pads, Rectangular | Fisher Scientific | 22-038-221 | |
| Isothesia (isoflurane, USP) | Henry Schein Animal Health | 050033 | NDC : 11695-0500-2 |
| Tropicamide Ophthalmic Solution, USP (1%) | Akorn | NDC: 17478-102-12 | |
| Spectralis Diagnostic Imaging Platform | Heidelberg Engineering |
Referenzen
- Hardy, T. A., et al. Atypical inflammatory demyelinating syndromes of the CNS. Lancet Neurol. 15 (9), 967-981 (2016).
- Lennon, V. A., et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet. 364 (9451), 2106-2112 (2004).
- Lennon, V. A., Kryzer, T. J., Pittock, S. J., Verkman, A. S., Hinson, S. R. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med. 202 (4), 473-477 (2005).
- Zamvil, S. S., Slavin, A. J. Does MOG Ig-positive AQP4-seronegative opticospinal inflammatory disease justify a diagnosis of NMO spectrum disorder. Neurol Neuroimmunol Neuroinflamm. 2 (1), 62 (2015).
- Bennett, J. L., et al. Intrathecal pathogenic anti-aquaporin-4 antibodies in early neuromyelitis optica. Ann Neurol. 66 (5), 617-629 (2009).
- Bradl, M., et al. Neuromyelitis optica: pathogenicity of patient immunoglobulin in vivo. Ann Neurol. 66 (5), 630-643 (2009).
- Nurieva, R. I., Chung, Y. Understanding the development and function of T follicular helper cells. Cell Mol Immunol. 7 (3), 190-197 (2010).
- Lucchinetti, C. F., et al. The pathology of an autoimmune astrocytopathy: lessons learned from neuromyelitis optica. Brain Pathol. 24 (1), 83-97 (2014).
- Zekeridou, A., Lennon, V. A. Aquaporin-4 autoimmunity. Neurol Neuroimmunol Neuroinflamm. 2 (4), 110 (2015).
- Brum, D. G., et al. HLA-DRB association in neuromyelitis optica is different from that observed in multiple sclerosis. Mult Scler. 16 (1), 21-29 (2010).
- Varrin-Doyer, M., et al. Aquaporin 4-specific T cells in neuromyelitis optica exhibit a Th17 bias and recognize Clostridium ABC transporter. Ann Neurol. 72 (1), 53-64 (2012).
- Vaknin-Dembinsky, A., et al. T-cell responses to distinct AQP4 peptides in patients with neuromyelitis optica (NMO). Mult Scler Relat Disord. 6, 28-36 (2016).
- Nelson, P. A., et al. Immunodominant T cell determinants of aquaporin-4, the autoantigen associated with neuromyelitis optica. PLoS One. 5 (11), 15050 (2010).
- Kalluri, S. R., et al. Functional characterization of aquaporin-4 specific T cells: towards a model for neuromyelitis optica. PLoS One. 6 (1), 16083 (2011).
- Pohl, M., et al. Pathogenic T cell responses against aquaporin 4. Acta Neuropathol. 122 (1), 21-34 (2011).
- Zeka, B., et al. Highly encephalitogenic aquaporin 4-specific T cells and NMO-IgG jointly orchestrate lesion location and tissue damage in the CNS. Acta Neuropathol. 130 (6), 783-798 (2015).
- Sagan, S. A., et al. Tolerance checkpoint bypass permits emergence of pathogenic T cells to neuromyelitis optica autoantigen aquaporin-4. Proc Natl Acad Sci U S A. 113 (51), 14781-14786 (2016).
- Vita, R., et al. The immune epitope database (IEDB) 3.0. Nucleic Acids Res. 43, 405-412 (2015).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J Immunol Methods. 332 (1-2), 170-174 (2008).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized protocol for retinal wholemount preparation for imaging and immunohistochemistry. J Vis Exp. (82), e51018 (2013).
- Cruz-Herranz, A., et al. The APOSTEL recommendations for reporting quantitative optical coherence tomography studies. Neurology. 86 (24), 2303-2309 (2016).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. Eur J Immunol. 25 (7), 1951-1959 (1995).
- Shetty, A., et al. Immunodominant T-cell epitopes of MOG reside in its transmembrane and cytoplasmic domains in EAE. Neurol Neuroimmunol Neuroinflamm. 1 (2), 22 (2014).
- Molnarfi, N., et al. MHC class II-dependent B cell APC function is required for induction of CNS autoimmunity independent of myelin-specific antibodies. J Exp Med. 210 (13), 2921-2937 (2013).
- Jones, M. V., Huang, H., Calabresi, P. A., Levy, M. Pathogenic aquaporin-4 reactive T cells are sufficient to induce mouse model of neuromyelitis optica. Acta Neuropathol Commun. 3, 28 (2015).
- Oertel, F. C., et al. Microstructural visual system changes in AQP4-antiboby-seropositive NMOSD. Neurol. Neuroimmunol. Neuroinflamm. 4, 72 (2017).
- Vogel, A. L., et al. Deletional tolerance prevents AQP4 directed autoimmunity in mice. Eur J Immunol. , (2017).
- Zhang, H., Verkman, A. S. Longitudinally extensive NMO spinal cord pathology produced by passive transfer of NMO-IgG in mice lacking complement inhibitor CD59. J Autoimmun. 53, 67-77 (2014).
- Zeka, B., et al. Aquaporin 4-specific T cells and NMO-IgG cause primary retinal damage in experimental NMO/SD. Acta Neuropathol Commun. 4 (1), 82 (2016).
- Felix, C. M., Levin, M. H., Verkman, A. S. Complement-independent retinal pathology produced by intravitreal injection of neuromyelitis optica immunoglobulin G. J Neuroinflammation. 13 (1), 275 (2016).
- Zamvil, S., et al. T-cell clones specific for myelin basic protein induce chronic relapsing paralysis and demyelination. Nature. 317 (6035), 355-358 (1985).
- Zamvil, S. S., et al. Encephalitogenic T cell clones specific for myelin basic protein. An unusual bias in antigen recognition. J Exp Med. 162 (6), 2107-2124 (1985).
- Kuchroo, V. K., et al. B7-1 and B7-2 costimulatory molecules activate differentially the Th1/Th2 developmental pathways: application to autoimmune disease therapy. Cell. 80 (5), 707-718 (1995).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten