Method Article
Induction de paralysie et de lésion du système visuel chez la souris par le particulier de cellules T pour Neuromyélite optique autoantigènes Aquaporin-4
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons ici un protocole pour provoquer l’inflammation de paralysie et opticospinal de transfert de l’aquaporin-4 (AQP4)-des cellules T spécifiques de AQP4- / - souris dans des souris WT. En outre, nous démontrons comment utiliser tomographie par cohérence optique série pour surveiller le dysfonctionnement du système visuel.
Résumé
S’il est reconnu que l’aquaporine-4 (AQP4)-des anticorps et des cellules T spécifiques participent à la pathogenèse de la Neuromyélite optique (NMO), une maladie démyélinisante auto-immune humaines du système nerveux central (CNS), la création d’un modèle AQP4 ciblées à la fois les manifestations cliniques et histologiques de l’auto-immunité CNS s’est avérée difficile. Immunisation des souris de type sauvage (WT) avec des peptides AQP4 a provoqué la prolifération des cellules T, bien que ces cellules T pourraient transférer pas la maladie pour les bénéficiaires souris naïves. Récemment, deux nouveaux épitopes T AQP4, peptide (p) 135-153 et p201-220, ont été identifiés lors de l’étude des réponses immunitaires à AQP4 chez les souris déficientes en AQP4 (AQP4- / -), suggérant la réactivité des lymphocytes T de ces épitopes est normalement contrôlée par thymique sélection négative. AQP4- / - Th17 polarisé des lymphocytes T sensibilisés p135-153 ou p201-220 induit une paralysie destinataires souris WT, qui était associé à prédominance méningées inflammation de la moelle épinière et les nerfs optiques. Nerfs optiques environnantes de l’inflammation et l’implication des couches rétiniennes internes (IRL) sont manifestent par des changements dans la tomographie à cohérence optique série (OCT). Ici, nous illustrons les approches utilisées pour créer ce nouveau modèle in vivo de l’auto-immunité CNS AQP4 ciblées (ATCA), qui peut maintenant être employée pour étudier les mécanismes qui permettent le développement de cellules T spécifiques AQP4 pathogènes et comment ils peuvent coopérer avec B cellules dans la pathogenèse NMO.
Introduction
Neuromyélite optique (NMO) est une système nerveux central (SNC) inflammatoire démyélinisante chronique maladie auto-immune qui provoque des épisodes récurrents de paralysie et perte visuelle conduisant à une déficience neurologique permanente1. NMO est actuellement considérée comme essentiellement une maladie auto-immune humorale2 car elle est associée à des anticorps (Igs) ciblant aquaporin-4 (AQP4), un canal d’eau exprimé abondamment les astrocytes3,4. Toutefois, l’inflammation du SNC est une condition préalable à l’entrée de la CNS de Ig AQP45,6. Ainsi, il n’a pas été possible d’établir un modèle de NMO par transfert d’Ig anti-AQP4 seul. Les conclusions que (1) pathogènes spécifiques AQP4 Igs chez les patients NMO sont IgG11,2, une Ig dépendant des lymphocytes T, lymphocytes T de la sous-classe7 (2) sont identifiés dans NMO lésions8,,9 (3) NMO est associée avec certains gènes du CMH II (p. ex. HLA-DR17 (DRB1 * 0301))10et (4) pro-inflammatoires DR AQP4-réactif-Th17 restreint cellules sont développées du NMO patients11,12 tous indiquent que les cellules T spécifiques AQP4 ont un rôle clé dans la pathogenèse NMO. Ainsi, il est important de développer des modèles animaux pour déterminer comment les lymphocytes T spécifiques AQP4 pourraient contribuer à NMO pathogenèse.
Il y a plusieurs années plusieurs épitopes de AQP4 T ont été identifiés dans le type sauvage (WT) souris13,rats et14 15. Alors qu’il a été observé que les cellules T AQP4-réactive pouvaient induire opticospinal inflammation chez naïve des rats destinataire15,16, des signes cliniques de maladie du SNC n’ont pas observés. De même, directement l’immunisation des souris WT avec peptides contenant des épitopes de cellules AQP4 T14,17, ou transfert de cellules pro-inflammatoires T ciblant ces déterminants17, n’a pas causé de signes cliniques ou histologiques preuve de l’auto-immunité CNS.
Récemment, il a été observé que l’immunisation de souris C57BL/6 AQP4-déficientes (AQP4- / -) avec AQP4 peptide (p) 135-153 ou p201-220, deux déterminants prédites pour lier le CMH II (I-A,b) avec une affinité élevée18, a suscité de fortes CD4 + Des lymphocytes T réponses17. En revanche, ces deux peptides obtenue seulement modestes réponses prolifératives chez les souris WT. En outre, le répertoire de récepteur (TCR) de lymphocytes T utilisé pour la reconnaissance de ces déterminants par les cellules de T de AQP4- / - souris était unique. Collectivement, ces résultats indiquent que reconnaissance des lymphocytes T de AQP4 est régulée par une sélection négative du thymus. AQP4 p135-153 ou p201-220-spécifique des cellules Th17 de souris de donateurs- / - AQP4 induite par paralysie dans presque 100 % des bénéficiaires souris naïves WT ; Ceci a été associé d’opticospinal des infiltrats de lymphocytes T, les lymphocytes B et les monocytes. Tomographie par cohérence de série opticospinal (OCT) démontrée du système visuel dynamique. Souris avec auto-immunité induite par des lymphocytes T de CNS AQP4 ciblées (ATCA) extraite de paralysie et de lésion du système visuel. Contrairement aux EAE induite par la myéline oligodendrocyte glycoprotéine (MOG) spécifique du p35-55 cellules T, qui a conduit à la maladie clinique persistante, ATCA induite par les cellules T seuls n’était pas associée à une perte axonale ou réduction des cellules ganglionnaires rétiniennes (CGR). Nos résultats ont clairement démontré qu’il existe de multiples déterminants de cellules T AQP4 pathogènes. Ce nouveau modèle de ATCA est utile pour l’étude des mécanismes qui contrôlent le développement des cellules T spécifiques AQP4 pathogènes, apprendre comment ces cellules induisent inflammation du SNC et comment ils peuvent coopérer avec cellules spécifiques AQP4 B et anticorps pour promouvoir la pathogenèse NMO .
Dans le présent rapport, nous décrivons les protocoles utilisés pour induire et évaluer l’ATCA induite par des lymphocytes T. Nous commençons par les techniques utilisées pour la vaccination, de la culture de cellules de T et de polarisation Th17 pour générer des cellules T spécifiques AQP4 pathogènes, analyse en cytométrie en flux pour confirmer la polarisation et transfert adoptif de ces cellules T. Nous décrivons ensuite les méthodes utilisées pour évaluer la maladie clinique et histologique et l’utilisation de série OCT pour surveiller la lésion du système visuel chez les bénéficiaires.
Protocole
toutes les procédures d’animaux ont été exercées dans le respect d’expérimentales directives approuvées par la University of California, San Francisco animalier institutionnel et utilisation. Des souris femelles C57BL/6 (H-2 b), 8 semaines d’âge, ont été achetés et C57BL/6 AQP4 - / - souris ont été fournis par A. Verkman.
1. immunisation de souris avec des Peptides AQP4
- préparer Freund complet ' stock de travail pour le traitement adjuvant (CFA) s.
- Broyé finement une préparation desséchée de M. tuberculosis (H37Ra) à l’aide d’un mortier et un pilon.
- Ajouter la terre H37Ra de Freund incomplet ' adjuvant de s à une concentration finale de 4 mg/mL. CFA peut être stocké à 4 ° C jusqu'à 6 mois.
- Dissoudre lyophilisé peptide AQP4 antigène (Ag) dans une solution saline tamponnée au phosphate (PBS) à une concentration finale de 1 mg/mL. Conserver à 4 ° C ou sur glace
- Préparer l’assemblage de 2 seringues luer-lock, s’est joint avec un robinet d’arrêt, contenant l’émulsion CFA/peptide.
- Attacher une seringue luer lock en verre sans piston pour un robinet à 3 voies en nylon avec 2 raccords luer-lock mâle. Fermer le robinet en basculant le levier vers la seringue. Positionner l’extrémité ouverte de la seringue vers le haut, ce qui permet de la seringue d’agir comme un tube à essai. Placez-la dans un portoir pour une stabilité accrue. Stock de travail
- vortex la CFA et la solution Ag. Ajouter un volume de 1:1 du peptide / CFA à la seringue ouverte. 200 µL de CFA/Ag (4 x 50 µL) est requise par la souris.
Remarque : En général, environ 1 mL de préparation se perd dans le robinet d’arrêt, ce qui réduira le montant disponible pour la vaccination. Par conséquent, il est important d’intégrer cela dans le calcul du volume total requis.
Exemple : pour l’immunisation des 5 souris : (animaux de 200 µL/animal x 5) + 1 mL volume supplémentaire = 2 mL total CFA/Ag nécessaire. - Insérer le piston de verre dans la seringue et tout en le maintenant en place, inverser la seringue pour que le robinet est orienté vers le haut. Basculez le levier du robinet au raccord femelle inutilisé. Soigneusement exercer pression sur le piston de verre afin d’enlever l’excès d’air de la seringue. Le liquide remplit la deuxième connexion luer-lock mâle de robinet.
- Fixer une deuxième seringue en verre (piston complètement enfoncé) vers la seconde connexion luer-lock mâle du robinet d’arrêt. Cela devrait être un système fermé de 2 seringues de verre connecté avec un robinet d’arrêt contenant comme petit excès d’air que possible.
- Pour créer une émulsion, mélanger en repoussant les pistons pour passer le liquide en alternance entre les 2 seringues pour environ 2 min. Chill répéter les seringues sur la glace pendant 10 minutes environ le refroidissement et le mélange jusqu'à ce qu’il y a un net changement dans la viscosité de la préparation , résultant en une émulsion très raide, blanche. Réfrigérer les seringues contenant l’émulsion à 4 ° C ou maintenir sur glace
- Transférer la totalité de l’émulsion à seringue luer-lock un verre, enlevez la seringue de verre vide et remplacez-la par une seringue de 1 mL luer-lock pour injection. Remplir la seringue de nouveau avec l’émulsion, retirez-la du robinet d’arrêt et attacher une aiguille (25 x 5/8).
- " eau-test " l’émulsion par souci de cohérence. Expulser une goutte de l’émulsion dans un petit plat d’eau. L’émulsion ne doit pas se disperser, indiquant qu’il est approprié pour injection.
- Si l’émulsion se disperse, il n’est pas prête pour injection ; retransfère le liquide dans le verre seringues et continuer à mélanger et puis refroidir à nouveau jusqu'à ce que l’émulsion est raide.
- Tester l’émulsion à nouveau jusqu'à ce que la consistance adéquate a été atteint.
- Injecter souris - / - des donateurs AQP4 par voie sous-cutanée (s.c.) avec émulsion contenant le peptide AQP4. Chaque souris reçoit des injections de s.c. 4 x 50 µL (200 µL de total (100 µg peptide)). Les 4 sites comprennent deux côtés du bas-ventre, qui se jettent dans les ganglions inguinaux (LN), et les deux côtés de la paroi thoracique médiale à chaque aisselle, qui se jettent dans LN. axillaire Le transfert adoptif exigera des souris immunisées donneur 1-2 par destinataire souris.
2. Culture de cellules de T et Proinflammatory T cell polarisation
- 10-12 jours après la vaccination, rassembler LN des souris.
- Dans un bac à glace, préparer des plats de Pétri de 60 mm équipé d’un filtre à tamis cellulaire (maille taille 70 µm) et contenant des médias RPMI réfrigérés avec 10 % inactivés par la chaleur bovine sérum fœtal (SVF) et 100 U/mL la pénicilline-100 µg/mL de streptomycine (strep-stylo) (DP).
- Souris euthanasier par l’exposition au CO 2, suivi par dislocation cervicale. Immerger la souris dans l’éthanol à 70 % et la broche puis chaque coussinet plantaire à un Conseil de dissection.
- Couper une incision cutanée de la ligne médiane de l’aine jusqu’au cou et bas de chaque jambe. Tirez la peau loin du péritoine et épinglez-le fortement au Conseil d’administration. Disséquer LN inguinal et axillaire et placer dans la boîte de Pétri contenant des appels d’offres, sur la glace. 19
- pour des expériences de transfert adoptif, combiner LN de tous les animaux du même groupe d’immunisation. Pour les analyses de cytométrie en flux d’utilisation Vβ, séparer LN des animaux individuels.
- Placer la crépine de la cellule contenant la LN sur un tube à centrifuger de 50 mL contenant des appels d’offres. Utilisez l’extrémité plate d’un piston de seringue stérile 5 mL pour presser les cellules LN à travers la passoire, laver avec 20-30 mL d’appels d’offres pour faciliter la récupération des cellules. Maintenir sur la glace tout au long du traitement jusqu’au temps de la culture, les cellules de LN.
- Laver deux fois, centrifugation à 393 x g pendant 5 min. Après le deuxième lavage, remettre en suspension les cellules LN dans les médias de lymphocytes T (TCM). TCM contient RPMI avec 10 % inactivés par la chaleur FBS, 292 µg/mL L-glutamine, pyruvate de sodium µg/mL, 110 et 55 µM 2-mercaptoéthanol et strep-stylo. En général, un volume de 5 mL TCM par souris donneur sert.
- Compter les cellules de LN. Rendement escompté est environ 3-6 x 10 cellules de 7 LN / donneur de souris immunisées. Mettre de côté 3-4 x 10 6 pour une analyse de prolifération (voir la Section 3 ci-dessous).
- Mis en place la polarisation des cultures pour transfert adoptif (Section 6).
- Préparer une culture polarisation Th17 de 5 x 10 6 LN cellules / mL 10 µg/ml Ag, 20 ng/mL souris recombinant interleukine (IL) -23 et 10 recombinante ng/mL de souris IL-6 en MTC.
- Alternativement, pour polarisation Th1, préparer une culture de 5 x 10 6 LN cellules / mL 10 µg/ml Ag et 10 recombinante ng/mL de souris IL-12 en MTC.
- Ajouter 2 mL (1 x 10 7 cellules) / puits du polarisant mélange culture dans une plaque de 12 puits. Les cellules de LN de 2-4 donateurs souris remplira une plaque de 12 puits. Maintenir les cultures dans un incubateur humidifié à 37 ° C, avec 5 % de CO 2 pendant 72 h.
- Vérifier visuellement les cellules LN en culture pour l’activation après 48 h et 72 h. activé cellules formeront une vaste amas et les cellules T vont augmenter en taille, devenant plus pléomorphes. L’augmentation du métabolisme provoque un abaissement du pH dans les médias, changeant de pêche à l’orange. Si le pH est assez bas pour jaunir les médias, ajouter 1 mL de TCM frais pour éviter la toxicité pour les cellules dans le restant des 24 h.
- Passer à la Section 6 pour transfert adoptif. Efficacité de polarisation peut être vérifiée par des cytokines intracellulaires (ICS), une coloration comme descrarbitr dans la Section 5.
- Mis en place des cultures à LN de souris individuels pour cytométrie de modelé Vβ (Section 4).
- Préparer à 5 x 10 6 cellules LN / mL 10 µg/ml Ag en MTC.
- Ajouter 2 mL (1 x 10 7 cellules) de la culture / puits dans une plaque de 12 puits. Cultures devraient être maintenues dans une étuve humidifiée à 37 ° C, avec 5 % de CO 2 pendant 10 jours. Passez à la Section 4.
3. Essai de prolifération
Remarque : cela continue de la Section 2.4.
- Préparer à 3-4 mL de cellules LN dans un tube à 2 x 10 6 cellules / mL dans une TCM.
- Mélanger doucement les cellules en renversant le tube plusieurs fois et puis les transférer dans un abreuvoir stérile. Plaque de culture de tissu de fond
- utiliser une pipette multicanaux à plaque 100 µL de cellules par puits dans un cycle de 96 puits. En général, la plaque 15 puits pour les essais en triple de 4 Ag concentrations et aucune référence Ag.
- Diluer l’Ag à TCM à différentes concentrations, typiquement 80, 20, 5, 1 et 0 µg/mL (pour les stocks de x 2). Ajouter 100 µL de chaque concentration en triple exemplaire pour une concentration finale de 40, 10, 2.5. 0,5 et 0 µg/mL. Incuber pendant environ 72 heures à 37 ° C.
Remarque : étapes 3,5 à 3,7 impliquent des matières radioactives. L’usage correct, le suivi et l’élimination des matières radioactives doivent être faites, conformément règlements institutionnels et gouvernementaux. - Préparer une solution travail 3 H-thymidine (40 µCi/mL) par l’ajout de 1 mCi 3 H-thymidine à 25 mL RPMI et stocker à 4 ° C. pipette 0,5 mL de la solution de travail dans une Auge stérile.
- Ajouter 25 µL de 3 H-thymidine (1 µCi) / bien à l’aide d’une pipette multicanaux. Incuber pendant 18 h supplémentaires à 37 ° C.
- Récolter les cellules sur un tapis de filtre de verre avec une abatteuse de cellule de 96 puits et rincer avec de l’éthanol à 70 %. Après séchage, sceller la natte filtrante dans un sac de prélèvement en plastique avec liquide de scintillation de 5 mL. Radioactivité de mesure dans chaque bien en utilisant un compteur à scintillation.
4. Flow Cytometry Analysis for Cell Surface TCR Vβ Expression
Remarque : cela continue de la Section 2.6. Anticorps de souris TCR Vβ 2, 3, 4, 5.1 et 5.2, 6, 7, 8.1 et 8.2, 8.3, 9, 10 b, 11, 12, 13, 14 et 17 sont disponibles dans le commerce pour tester l’expression TCR Vβ.
- Pour la détection de TCR Vβ, déloger les cellules de T de la plaque de culture en pipettant également plusieurs fois et transférer des cellules dans une éprouvette.
- Laver avec du tampon de FACS (FB) contenant 2 % de FBS, 0,1 % d’azide de sodium et 2 mM EDTA dans du PBS.
- Cellules de transfert à une plaque de fond en V 96 puits à une densité de 1 x 10, 5, 3 x 10 6 cellules par puits. Si la totalité du panel Vβ est testé, les cellules doivent être répartis dans plusieurs puits (un puits par Vβ testée).
- Exclure les cellules mortes de la cytométrie par coloration avec un colorant de viabilité LIVE/DEAD, qui réagit avec les amines libres exposés par les cellules nécrotiques. Suivez le fabricant ' s directives pour la centrifugation et la remise en suspension dans la teinture de viabilité. Incuber sur glace pendant 10 à 20 min. dans toute la cellule procédures de coloration, de protéger les cellules de lumière et de conserver en Ice.
- Après l’incubation, laver la plaque une fois dans FB. Pour détecter les TCR Vβ, suspendre les cellules dans 100 µL de FB contenant une dilution au 1/100 d’anticorps pour CD4 (clone RM4-5) et TCR Vβ. Incuber pendant 15 à 60 min sur glace
- Laver la plaque une fois dans FB et fixer les cellules en ajoutant 200 µL de paraformaldéhyde 4 % dilué dans du PBS. Incuber pendant 20 min sur la glace. Laver la plaque dans FB et analyser par cytométrie.
5. Analyse de cytométrie de flux pour la Production de cytokines intracellulaires d’écoulement
- pour intracellulaire cytokine coloration (ICS), traiter les cultures de cellules de T avec une dilution de 1 : 1 000 de réactif inhibiteur de protéine transport (p. ex., GolgiPlug) en MTC, 4 h avant l’ICS pour empêcher sécrétion de cytokines. A cette époque, activer les lymphocytes T avec 50 ng/mL phorbol 12-myristate 13-acétate (PMA) et 500 ng/mL ionomycine afin d’induire la production de protéines.
- Après 4 h de culture à 37 ° C, déloger les cellules de la plaque de culture en pipettant également de haut en bas et transférer dans un tube à centrifuger (15 ou 50 mL).
- Lavage avec FB. Remettre en suspension les cellules à FB et transfert à une plaque de fond en V 96 puits à une densité de 5 x 10, 5, 3 x 10 6 cellules / puits.
- Cellules teinté avec colorant viabilité comme décrit ci-dessus (section 4.2). Après l’incubation, laver la plaque une fois dans FB.
- Ajouter des anticorps pour la détection de marqueurs de surface comme suit :
- pour la détection de marqueurs de surface, suspendre les cellules dans 100 µL de FB contenant une dilution au 1/100 d’anticorps pour CD4 (clone RM4-5).
- Le cas échéant, inclure des anticorps pour B220 (clone 30-F11) et CD11b (clone M1/70) à une dilution au 1/100 pour améliorer les processus de blocage des lymphocytes B et des monocytes/macrophages, respectivement. PE-Cy7 anti-CD4, FITC anti-B220 et PerCP-Cy5.5 anti-CD11b fonctionnent généralement bien. Choix des anticorps/fluorochrome conjugués devrait être guidé par la configuration du cytomètre en flux à utiliser pour l’analyse, et des concentrations optimales des anticorps doivent être déterminées empiriquement.
- Incuber pendant 15 à 60 minutes sur la glace.
- Laver la plaque avec FB et remettre en suspension les cellules dans 200 µL de solution de Fixation/perméabilisation pendant 20 min sur la glace. Cela va fixer les cellules et permeabilize membranes.
- Afin de maintenir la perméabilisation de la membrane cellulaire pendant la coloration intracellulaire, utiliser le tampon de Perm/lavage (PW) (dilué 01:10 sur le stock de X 10) au lieu de FB. Laver les puits dans 200 µL de PW.
- Pour ICS, préparer une dilution au 1/100 de l’anticorps pour l’interféron (IFN)-γ et d’IL-17 a utiliser 1 x PW. Une option est APC anti-IFN-γ (clone XMG1.2) et PE anti-IL-17 a (clone eBio17B7) qui fonctionne bien. Remettre en suspension des cellules dans 100 µL de l’anticorps intracellulaire cocktail et puis incuber pendant au moins 15 minutes. Il est également possible de poursuivre la coloration durant la nuit à 4 ° C.
- Laver les puits dans 200 µL de PW et resuspension dans FB pour cytométrie.
- En parallèle, préparer un échantillon non coloré (cellules dans FB sans anticorps) pour optimiser les tensions détecteur et des échantillons colorés à l’unique pour chaque fluorochrome individuel (c'est-à-dire des cellules ou des perles de compensation colorées avec un seul anticorps/fluorochrome) à déterminer les valeurs de débordement de compensation.
- à l’aide d’un cytomètre en flux, acquérir ≥ 10 000 cellules (événements), blocage sur viable (LIVE/DEAD-négatif) CD4 + cellules. Pour assurer le blocage précis des cellules T, exclure la B220 + et CD11b + cellules (lymphocytes B et des monocytes/macrophages, respectivement). Au sein de la CD4 + T sous-population de cellules, de déterminer le pourcentage de cellules exprimant l’IFN-γ (lignée Th1) ou IL-17 a (Th17 lineage).
6. Cellules de transfert de pathogènes spécifiques AQP4 T adoptifs
Remarque : cette étape résulte de l’article 2.5 : T cell culture et proinflammatoires polarisation de lymphocytes T.
- Recover polarized cellules de 12 plats de pipetage de haut en bas pour déloger et les transvaser dans un tube de 50 mL. Matient sur la glace jusqu'à ce que les injections.
- Compter les cellules non vides, laver deux fois dans du PBS froid et préparer une suspension de 1 x 10 8 cellules/mL dans du PBS. En règle générale, injecter des cellules dans l’heure.
- Délicatement mélanger les cellules en agitant et transférer dans une seringue de 1 mL au moment de l’injection. Administrer 200 µL de cellules (2 × 10-7) par voie intraveineuse (i.v.) de chaque souris, par le biais de la queue veineuse.
- Injecter chaque i.p. souris bénéficiaire avec 200 ng de b. pertussis toxine dilué dans 200 µL de PBS ce jour-là et 2 jours plus tard. Contrôler la souris tous les jours des signes de maladie clinique.
7. Évaluation clinique de l’ATCA
souris destinataires- examiner tous les jours pour les signes cliniques de l’auto-immunité CNS. En général, souris vont montrer des signes d’auto-immunité CNS 5-8 jours après transfert adoptif de cellules T spécifiques AQP4. Les souris vont montrer des signes cliniques de dysfonctionnement neurologique. Il est utile effectuer les évaluations sur une souris naïves pour définir la capacité normale d’une souris. Ton
- Evaluate souris pour la perte de la queue. Tenez les souris doucement à la base de la queue et lever debout. Une queue que s’affaisse en continu est décrit comme une perte de la queue de tonalité (note 1). Perte de tonus de la queue est souvent le premier signe de maladie clinique.
- Test pour redresser réflexe en plaçant la souris sur le dos sur une surface plane. Un redressement lent est un signe d’incoordination tronculaire (note 2). Une souris naïves complètement résistera à toute tentative de le placer sur le dos, donc toute lenteur dans la capacité à droite est marqué comme un dysfonctionnement. Il est typique pour tester la souris 3 - 4 fois pour ce réflexe.
- Evaluate posture et déambulation. Souris commencent à montrer un changement dans la posture, ce qui entraîne un abaissement ou en faisant glisser des hanches au cours de la marche (score de 2,5). D’autres résultats dans monoplégie, paralysie complète d’un postérieur d’un membre (score de 3.0) et paraplégie, paralysie complète des deux postérieurs des membres (score de 3,5). Quadraparesis modérée, faiblesse de tous les quatre extrémités, correspond à un mouvement vers l’avant très lent (note 4). Quadraparesis sévère ne permet quasiment aucun mouvement vers l’avant (note de 4,5). Enfin, souffrant de maladies graves, ils peuvent devenir moribondes ou mourir (score de 5).
- Administrer à des souris qui perdent la capacité d’acquérir des aliments liquides ou solides 1 mL de glucose 5 % chez les i.p. saline alternativement, utilisation de supplémentation avec du liquide gel tasses, haute calorique gel et bacon softies pour lutter contre la déshydratation et la privation de nourriture. Euthanasier souris moribondes.
8. Préparation du tissu et l’histologie
- d’offrir une souris avec la kétamine 100 mg/kg et 10 mg/kg de xylazine, et puis épingler chaque coussinet plantaire à un Conseil de dissection.
- Ouverte vers le haut de la poitrine, exposant ainsi le cœur. Inciser le foie afin de permettre l’écoulement de sang. Fixer une aiguille à ailettes sur le tube d’une pompe à vitesse variable miniflow utilisant un réservoir séparé pour PBS et 10 % de formol. Insérer l’aiguille dans le ventricule gauche du cœur et perfuse avec 5 mL de PBS, suivie de 25 mL de formol 10 %.
- , Retirer la tête, puis les yeux. Yeux de processus et rétines comme décrit plus haut 20. Recoupent des orbites, insérer des ciseaux au niveau du nez et couper le crâne antérieur postérieur de chaque côté.
- Enlever le crâne, exposer les nerfs optiques, couper le chiasma optique et placer dans une cassette entre 2 coussinets en mousse.
- Plonger dans 10 % de formol (24h) et puis de 50 % d’éthanol (24h) et puis transfert à l’éthanol à 70 %.
- Enlever le cerveau et la colonne vertébrale et placer dans 10 % de formol. Section en série des cerveaux dans le plan coronal ; section de moelle cordons en sagittal (environ la moitié) et série coronale avions (environ 20 sections par souris).
- Échantillons de processus CNS régulièrement pour l’enrobage de paraffine. Tache de 8 µm de coupes épaisses à l’hématoxyline et éosine (nerfs optiques) ou Luxol rapide bleu-hématoxyline et éosine (cerveau et moelle épinière).
- Évaluer les nerfs optiques de la présence d’une inflammation du nerf et méninges environnantes (névrite optique) ou principalement dans les méninges environnantes (optique perineuritis).
- Compter les foyers inflammatoires méningés et parenchymateuses (> 10 cellules mononucléaires cluster) dans les échantillons de cerveau et la moelle épinière pour chaque souris.
9. In Vivo Rétine d’imagerie par tomographie à cohérence optique (OCT)
Remarque : imagerie rétinienne de domaine Spectral OCT de souris est effectué en utilisant un appareil commercial (p. ex., Spectralis avec Traqueur d’oeil TruTrack) pour atteindre oculaire conforme orientation et réduire les artefacts de mouvement.
- 5 min avant l’imagerie, dilater les pupilles avec tropicamide 1 % (un pour chaque oeil) et placez la souris pour être photographié dans la salle d’induction de l’anesthésie, fournissant un flux constant de 2 litres / min (1,5 % isoflurane). Tourner sur les tapis de chaleur et préparer la cage de récupération après anesthésie.
- Placer la souris sur le cylindre d’imagerie et de rediriger le flux de l’anesthésie en conséquence. Protéger les yeux avec 0,3 % hydroxypropyl méthylcellulose pour garder le œil humide et d’assurer la continuité de la réfraction. Placer une lentille de contact personnalisée sur le œil pour être examiné.
- Guidée par l’image de fond d’oeil infra-rouge, diriger le laser sur le œil, assurant le faisceau est centré sur la tête du nerf optique. Verticales et horizontales des scans OCT devraient confirmer que la rétine pose perpendiculaire au laser.
- Effectuer 25 B-scans en mode haute résolution et pixellisation de 30 en moyenne des A-Scans.
- Après les deux yeux de l’imagerie, enlever les lentilles de contact et appliquez le gel ophtalmique. Laissez la souris dans la cage de récupération chaud.
10. Traitement et analyse des OCT
- utiliser le modulaire logiciel de segmentation automatique d’imagerie.
- Segments manuellement correctes correspondant à l’exception interne limitant la membrane (ILM) et la couche plexiforme interne (IPL), qui représente les limites de la rétine interne des couches (IRL) 21.
- Vérifier que la couche des fibres nerveuses rétiniennes (CFNR) et la couche de cellules de ganglion (GCL) résident dans les limites de l’IRL et ne se chevauchent pas.
- Épaisseurs IRL calculer à l’aide de la grille de 2 début traitement Diabetic Retinopathy Study (ETDRS) avec un diamètre de 1, 2 et 3 mm centré sur le disque optique et les exporter dans un fichier de feuille de calcul. Le logiciel calcule l’épaisseur de chaque couche rétinienne par une moyenne de chaque secteur de grille. Par conséquent, le segment central, correspondant à la tête du nerf optique, est exclu.
- Analyser les différences statistiques entre les groupes à chaque instant. Analyser les deux yeux pour chaque souris, en utilisant les équations avec une matrice de corrélation échangeables et des ajustements pour les corrélations inter-oeil intra-sujet 21 d’estimation généralisées.
Résultats
Dans ce protocole, nous avons utilisé les cellules donneuses T de C57BL/6 AQP4- / - souris. Vaccination sous-cutanée de ces souris avec AQP4 p135-153 ou p201-220, qui contiennent des épitopes T pathogènes, a suscité de fort proliférative lymphocytes T dans les ganglions lymphatiques de drainage (Figure 1), alors que ces deux peptides induit beaucoup plus faible des lymphocytes T prolifération de souris WT. En comparaison, la vaccination par AQP4 p91-110, contenant un non pathogène AQP4 T cellule déterminant13ou MOG p35-55, un peptide de la myéline qui active les cellules T qui causent l’encéphalomyélite allergique expérimentale (EAE)22,23 ,24, induite par le même ordre de grandeur de la prolifération des cellules T dans AQP4- / - et souris WT. Analyse de l’utilisation de TCR par coloration de cytométrie de flux pour de Vβ individuels ou familles Vβ, a démontré que p135-153 et p201-220-T lymphocytes spécifiques de AQP4- / - souris utilisées unique répertoire TCR. Hyper-prolifération sélective de AQP4 p135-153 et p201-220 en AQP4- / - souris, ainsi que l’utilisation unique de la TCR (Figure 2), a indiqué que lymphocytes T pathogènes à ces déterminants est normalement réglé par négatif du thymus sélection, soulignant l’importance pour l’utilisation de cellules de donneur T AQP4- / - dans le présent protocole.
Avant transfert adoptif pour l’induction de l’ATCA, a cultivé des cellules de ganglion lymphatique de souris AQP4 peptide in vitro dans des conditions polarisation Th17 ou Th1 pendant trois jours. La mesure de la polarisation du donneur CD4+ T cellules a été confirmé par cytokine intracellulaire (ICS) de coloration et mesurée par cytométrie en flux (Figure 3). Les bénéficiaires souris naïves ont injecté par voie intraveineuse avec cellules de T de 2 x 107 donneur AQP4 peptide spécifique. Après environ six jours, presque 100 % des souris bénéficiaires a développé des signes cliniques d’une maladie auto-immune CNS, y compris la paralysie de queue et le membre postérieur molle (Figure 4). Polarisation Th17 de cellules T spécifiques AQP4 induit une maladie clinique plus sévère que les cellules de polarisation Th1 spécifiques AQP4 T. Une souris représentative qui a reçu AQP4-peptide-specific Th17 et développé la paralysie complète des membres postérieurs (paraplégie) est sur la vidéo 1. Contrairement aux souris qui développent EAE après administration des cellules Th17 MOG spécifiques, souris destinataires extraite des cliniques de la maladie induite par les cellules Th17 AQP4 spécifiques. En ce qui concerne les EAE induite par des cellules Th17 de MOG spécifique du p35-55, cliniques de la maladie induite par AQP4 p135-153-spécifiques ou cellules Th17 p201-220-spécifiques a été associée à l’infiltration de cellules mononucléées dans le parenchyme de la CNS et des méninges (Figure 5). Les lésions sont plus abondantes dans les méninges que dans le parenchyme d’auto-immunité CNS induite par les cellules Th17 AQP4 spécifiques.
MOG spécifiques Th17 cellules deux inflammation induite nerf optique, qui se caractérise par la présence de cellules mononucléaires et implication du nerf optique a été démontrée par une évaluation histologique et de serial OCT. AQP4 spécifiques. Alors que les cellules Th17 AQP4 spécifique a provoqué perineuritis optique, cellules Th17 MOG spécifique induite par névrite optique grave (Figure 5). À l’aide de série OCT, inflammation du nerf optique était évidente par le gonflement et augmente l’épaisseur de la couche rétinienne interne (IRL) pour les cliniques de la maladie induite par la AQP4 spécifiques ou des cellules Th17 MOG spécifique (Figure 6). D’auto-immunité induite par le AQP4 Th17 CNS, épaisseur IRL revient à la base comme souris extraite des cliniques de la maladie. En revanche, la persistance de l’EAE induite par le MOG spécifiques Th17 a correspondu avec l’IRL éclaircie et, comme nous avons démontré précédemment17, a été associée à la perte des cellules ganglionnaires rétiniennes.
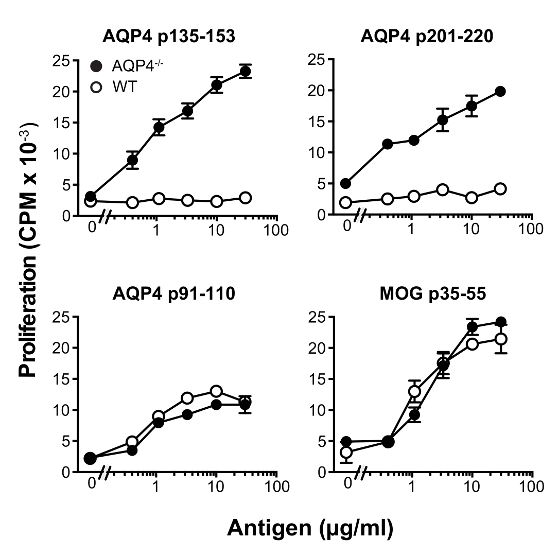
Figure 1 : AQP4 p135-153 et p201-220 induire la prolifération des cellules de T robuste en AQP4- / - souris, mais pas les souris WT. Souris ont été immunisées s.c. avec les peptides indiquées en CFA. Onze jours plus tard, les ganglions lymphatiques ont été enlevés et puis cultivés soit aucun antigène, ou avec le peptide utilisés pour l’immunisation. La prolifération a été mesurée par l’incorporation de 3H-thymidine (moyenne ± SEM, représentant de 5 expériences). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
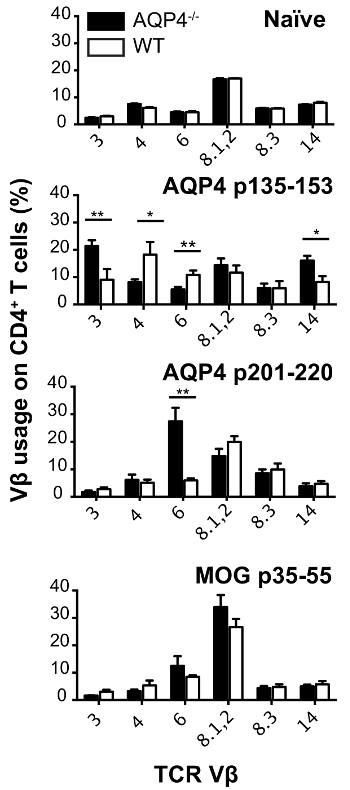
Figure 2 : Les cellules T AQP4 spécifiques des AQP4- / - souris utilisent unique répertoire TCR. AQP4- / - et souris WT ont été immunisés avec les peptides indiquées. Onze jours plus tard, les ganglions lymphatiques ont été enlevés et cultivées avec peptides utilisés pour l’immunisation. Les cellules ont été récoltées. Utilisation de TCR Vβ a été analysée par cytométrie en flux (moyenne ± SEM, n = 5). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
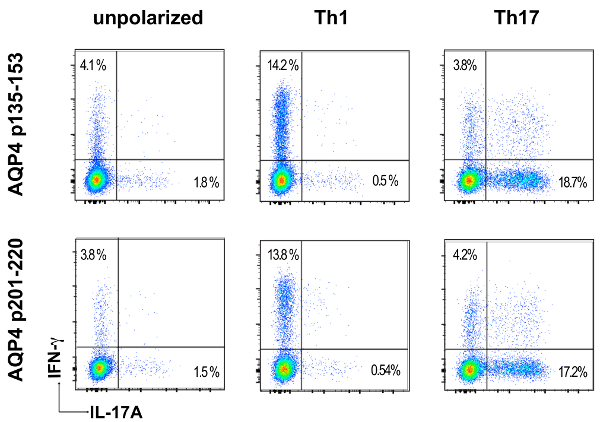
Figure 3 : Pro-inflammatoires polarisation des cellules donneuses spécifiques AQP4 T. Onze jours après la vaccination avec AQP4 p135-153 ou p201-220, cellules de ganglion lymphatique ont été récoltés et mis en culture avec le peptide utilisé pour l’immunisation dans des conditions non polarisant, conditions polarisation Th1 ou Th17. Polarisation Th17 ou Th1 a été examinée par l’ICS et écoulement cytometry pour IL-17 ou IFN-γ, respectivement. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
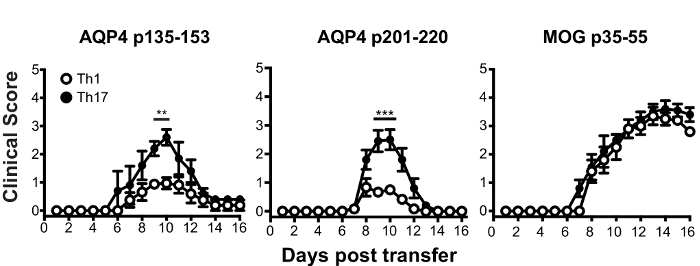
Figure 4 : Cellules de polarisation Th17 spécifiques AQP4 T induisent paralysie chez les bénéficiaires souris WT. Les bénéficiaires souris WT provenant de 2 x 107 donneur AQP4 polarisation Th17 p135-153 ou lymphocytes T spécifiques à p201-220 AQP4- / - souris. Polarisation Th17 de cellules T spécifiques MOG a servi de témoin positif. Résultats sont représentatifs des 8 expériences (n = 5/groupe). * p < 0,05, ** p < 0,01, *** p < 0,001. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
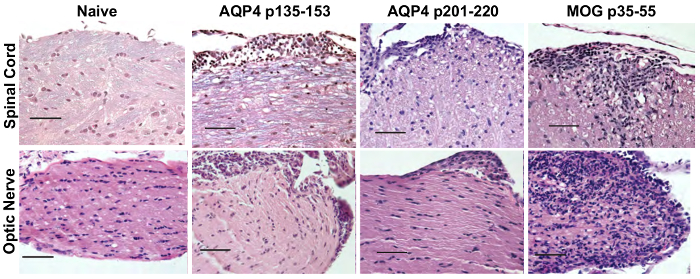
Figure 5 : Cellules Th17 spécifiques AQP4 induisent opticospinal l’inflammation chez les souris WT. Souris destinataires a reçu 2 x 107 AQP4 Th17 p135-153 - ou p201-220-amorcé Th17 cellules donneuses de AQP4- / - souris ou des cellules Th17 MOG p35-55-spécifiques et ont été sacrifiés à 10 jours plus tard. Tissus de la moelle épinière et nerf optique ont été préparés et colorés avec H & E/BF pour évaluer des preuves de l’inflammation et la démyélinisation, respectivement. Résultats sont représentatifs des 5 souris/groupe. Echelle = 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
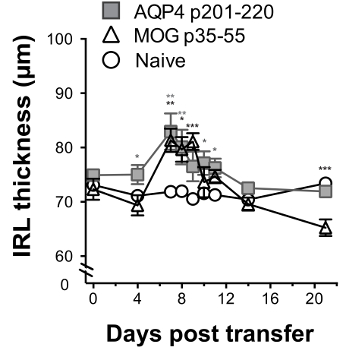
Figure 6 : Nerf optique inflammation induite par les cellules Th17 AQP4 spécifiques peut être surveillée par longitudinale rétinienne Oct Les bénéficiaires souris WT a reçu 2 x 107 donneur AQP4 polarisation Th17 p201-220-spécifiques ou cellules de T MOG p35-55-spécifiques au jour 0. Ils ont été examinés par OCT au jour 0 (avant l’administration de lymphocytes T) et puis les jours 4, 7, 8, 9 10, 11, 14 et 21. Épaisseur de l’IRL a été mesurée (moyenne ± SEM). Les statistiques indiquent une comparaison avec le contrôle de naïve. Résultats sont représentatifs des 3 expériences (5 souris/groupe). * p < 0,05, ** p < 0,01, *** p < 0,001. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
AQP4 a été identifié comme la principale cible de NMO IgG en 20053. Ensuite, on a reconnu qu’il serait important d’établir un modèle animal AQP4 ciblée de l’auto-immunité CNS. Un tel modèle pourrait être utile d’étudier comment les cellules T spécifiques AQP4 et B participent à l’élaboration de l’auto-immunité CNS et pour tester la thérapeutique candidat NMO. Bien que l’identification des épitopes chez les souris de type sauvage a été signalée en 201013, lymphocytes T répondant à ces épitopes des lymphocytes de T AQP4-spécifiques ne cause pas de maladie clinique ou histologique14,17. L’incapacité de générer un modèle d’auto-immunité CNS basée sur la réactivité immunitaire à AQP4 est resté une énigme jusqu’en 2015 quand Jones, et al. 25 a découvert que donneur AQP4 p135-153-amorcé des cellules de T de AQP4- / - souris étaient susceptibles de provoquer des signes cliniques et histologiques de l’auto-immunité CNS dans souris WT. D’intérêt, AQP4 p135-153 est prédit pour lier le CMH II (I-A,b) avec une affinité élevée17. Qu’un seul autre AQP4 séquence d’acides aminés, 201-220, est censée pour lier I-Ab avec une affinité élevée similaire. En effet, nous avons observé que AQP4 p135-153 et p201-220 fois provoquer la prolifération robuste en AQP4- / -, mais pas de WT, souris. Ici, nous avons montré comment on peut isoler et développez encephalitogenic AQP4 Th17 NKT p135-153 - et p201-220-réactif de AQP4- / - souris. Lorsque transférés dans les destinataires souris WT, cellules Th17 réactifs AQP4 donneur induit par paralysie, qui était accompagnée par des infiltrats de cellules mononucléées dans la moelle épinière et du nerf optique. Lésion du système visuel afférente est bien connue chez les patients séropositifs AQP4 NMOSD26. Ici, nous avons observé que le nerf optique inflammation induite par les cellules AQP4-réactive et Th17 MOG-réactive était distincte. Tandis que les cellules Th17 AQP4 spécifique induite perineuritis optique, cellules Th17 MOG spécifique induite par névrite optique sévère. Nous avons également décrit les techniques utilisées pour surveiller le nerf optique inflammation induite par les cellules T MOG spécifiques et des AQP4 spécifiques par série OCT. Autres chercheurs devraient maintenant être en mesure d’appliquer les protocoles décrits ici pour faire avancer leurs propres études axées sur les mécanismes pathogéniques de l’ATCA.
On peut facilement éviter trois écueils potentiels dans notre protocole. Premier transfert adoptif de ATCA requiert l’utilisation des cellules T spécifiques AQP4 de AQP4- / - souris de donateurs. Plus précisément, cellules donneuses WT AQP4 p135-153-specific T n’a pas causé ATCA dans destinataires souris WT. Deuxièmement, il est important d’effectuer une « analyse de l’eau » avec une goutte de l’émulsion de peptide/CFA avant la vaccination des AQP4- / - souris (protocole étape 1.5). L’émulsion doit se disperse pas dans l’eau lorsqu’il est adapté pour injection s.c.. Si l’émulsion se disperse, on doit mélanger l’émulsion une fois de plus, refroidir à nouveau et répéter l’analyse de l’eau. Enfin, activés CNS cellules T spécifiques de l’antigène induisent l’auto-immunité CNS plus efficacement que les cellules T de repos. On devrait inspecter visuellement ces cultures en microscopie avant leur récolte les cellules de T de donateurs pour transfert adoptif. Cellules à division rapide peuvent former des grappes, qui sont facilement identifiables. Aussi, lorsque les cultures contiennent de nombreux lymphocytes T activés, les médias peuvent transition du rose à l’orange ou même au jaune, en raison de la diminution du pH. On peut aussi évaluer activation de cellules de ganglion AQP4-amorcé T du donneur pour la prolifération par l’incorporation de 3H-thymidine, tel que décrit à l’étape 3 de protocole.
Notre découverte que les deux épitopes pathogènes AQP4 T (1) devraient lier MHC II avec une haute affinité et (2) susciter les réponses prolifératives puissantes dans AQP4- / -, mais pas de WT, souris suggèrent que les cellules T ciblant ces déterminants sont normalement contrôlée par une sélection négative thymique17. Les répertoires TCR utilisés pour la reconnaissance des AQP4 p135-153 et p201-220 AQP4- / - souris sont unique (Figure 2), qui est également compatible avec délétion clonale médiée par les cellules épithéliales thymiques médullaires. Autres mécanismes tolérogène peuvent normalement empêcher les réponses immunitaires à AQP4. À la suite de notre rapport initial17, un autre groupe a également démontré que AQP4 p201-220 contienne un encephalitogenic déterminant de lymphocytes T27. Quelle souris α/β (TCRα- / -) de lymphocytes T-déficientes ont été reconstitués avec AQP4- / - CD4+ T cellules, il a été possible d’obtenir une réponse des lymphocytes T encephalitogenic AQP4 spécifiques, mais pas une réponse humorale AQP4 spécifiques, ce qui implique que, dans Des souris WT AQP4 des lymphocytes B réponses, semblables aux lymphocytes T spécifiques AQP4, font l’objet de sélection négative. En effet, perte des axones de la moelle épinière et les CGR, qui n’a pas observé chez des souris WT avec ATCA induite par les cellules T spécifiques AQP4 seuls, peut exiger la participation de pathogènes anticorps AQP4 spécifiques. Il est clair que les modèles murins d’auto-immunité CNS AQP4 ciblées continuera d’évoluer comme nous l’apprend davantage quant aux mécanismes tolérogène contrôler normalement l’immunité AQP4 spécifique des lymphocytes T et les lymphocytes B.
Autres modèles de l’auto-immunité CNS AQP4 ciblées sont également étant développés6,16,28,29,30. Chacun d’eux peut offrent des avantages pour l’étude des aspects particuliers qui se rapportent à la pathogenèse NMO. Cellules T AQP4-spécifiques ont été identifiés dans WT rats6,16,29. Ces cellules T spécifiques AQP4 a provoqué des modifications histologiques de l’auto-immunité CNS mais, semblables aux observations chez des souris, cellules T spécifiques AQP4 WT rat ne provoquent pas des signes de la maladie clinique. Par conséquent, les mécanismes de tolérance limitant les cellules T et cellules B AQP4 spécifique des réponses immunitaires chez les souris WT ne fonctionnent également chez les rats. Malgré tout, il ne faut pas sous-estimer la puissance à l’aide de modèles murins pour l’étude des mécanismes impliqués dans la pathogenèse de la maladie. La richesse des knock out, transgénique et souris journaliste peut être avantageuse. Il faut aussi reconnaître que plusieurs découvertes fondamentales dans l’auto-immunité ont été faites à l’aide de modèles de souris EAE. Par exemple, démonstration, cette cellule T clones spécifiques pour un self-antigène peut médier maladie auto-immune31,32, identification du rôle des lymphocytes T costimulation en auto-immunité33 et la découverte de la voie de développement pour Th17 différenciation34 première description à l’aide de modèles de souris EAE. En utilisant le modèle de souris de l’ATCA que nous avons élaborée, un a maintenant les moyens d’étudier le développement et la réglementation des pathogènes spécifiques AQP4 immunitaire réponses in vivo, qui devrait fournir des renseignements importants associés à la pathogenèse NMO.
Déclarations de divulgation
Sagan S.A., A. Cruz-Herranz, C.M. Spencer, P.P. Ho, L. Steinman, A.J. Green et R.A. Sobel ne rapportent aucune divulgation. S.S. Zamvil est rédacteur en chef adjoint de neurologie, neuro-immunologie et neuro-inflammation et est un membre du Conseil consultatif de la société internationale de neuro-immunologie. Il a siégé au Comité de rédaction du Journal of Clinical Investigation, The Journal of Immunology et The Journal of Neurological Scienceset a été membre fondateur du Comité d’étude des instituts nationaux de la subvention neuro-immunologie clinique de la santé (NIH) et les tumeurs de cerveau (CNBT) étude de section et la société nationale de sclérose en plaques (SMN). Il a servi comme consultant et a reçu des honoraires de Biogen-Idec-EMD Serono, Genzyme, Novartis, Roche/Genentech et Teva Pharmaceuticals, Inc. et a servi ou siège données sécurité surveillance conseils pour Lilly, BioMS, Teva et Opexa Therapeutics. Actuellement, Dr Zamvil bénéficie du soutien de subvention de recherche du NIH, SMN, la Fondation de Maisin, Biogen et Celgene.
Remerciements
Soutien a été fourni aux S.S.Z. par le National Institute of Health (AI073737 RO1 et RO1 NS092835-01), National Multiple Sclerosis Society (4768 RG, RG 5179 et RG 5180), Fondation Maisin et Guthy Jackson Charitable Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| M. tuberculosis H37Ra | BD Difco | 231141 | Dessicated, killed M. tuberculosis |
| Incomplete Freund's Adjuvant | BD Difco | 263910 | |
| AQP4 peptide p135-153 | Genemed | Custom Synthesis | Peptide sequence: LVTPPSVVGGLGVTMVHGN |
| AQP4 peptide p201-220 | Genemed | Custom Synthesis | Peptide sequence: HLFAINYTGASMNPARSFGP |
| MOG peptide p35-55 | Genemed / Auspep | Custom Synthesis | Peptide sequence: MEVGWYRSPFSRVVHLYRNGK |
| 3-way Stopcock | Kimble | 420163-4503 | |
| HyClone Fetal Bovine Serum (Characterized) | GE Healthcare Life Sciences | SH30071 | |
| Recombinant Mouse IL-23 | R&D Systems (BioTechne) | 1887-ML | |
| Recombinant Mouse IL-6 | R&D Systems (BioTechne) | 406-ML | |
| Recombinant Mouse IL-12 | R&D Systems (BioTechne) | 419-ML | |
| Thymidine [Methyl-3H] | PerkinElmer | NET027 | |
| Glass Fiber Filtermats | PerkinElmer | 1450-421 | |
| Anti-mouse antibodies | eBioscience (Affymetrix) | [various] | |
| Anti-mouse TCR Vβ Screening Panel | BD Biosciences | 557004 | |
| LIVE/DEAD Fixable Dead Cell Stain | ThermoFisher Scientific | [various] | |
| Paraformaldehyde (16%) | Electron Microscopy Sciences | 15710 | |
| Fixation/Permeabilization Solution Kit with GolgiPlug | BD Biosciences | 555028 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | P8139 | |
| Iomomycin (calcium salt) | Sigma-Aldrich | I0634 | |
| Pertussis Toxin from B. pertussis | List Biological Laboratories | 181 | |
| 10% Formalin | VWR | 89370-094 | |
| Variable-Flow Peristaltic Pump | Fisher Scientific | 13-876-2 | |
| Foam Biopsy Pads, Rectangular | Fisher Scientific | 22-038-221 | |
| Isothesia (isoflurane, USP) | Henry Schein Animal Health | 050033 | NDC : 11695-0500-2 |
| Tropicamide Ophthalmic Solution, USP (1%) | Akorn | NDC: 17478-102-12 | |
| Spectralis Diagnostic Imaging Platform | Heidelberg Engineering |
Références
- Hardy, T. A., et al. Atypical inflammatory demyelinating syndromes of the CNS. Lancet Neurol. 15 (9), 967-981 (2016).
- Lennon, V. A., et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet. 364 (9451), 2106-2112 (2004).
- Lennon, V. A., Kryzer, T. J., Pittock, S. J., Verkman, A. S., Hinson, S. R. IgG marker of optic-spinal multiple sclerosis binds to the aquaporin-4 water channel. J Exp Med. 202 (4), 473-477 (2005).
- Zamvil, S. S., Slavin, A. J. Does MOG Ig-positive AQP4-seronegative opticospinal inflammatory disease justify a diagnosis of NMO spectrum disorder. Neurol Neuroimmunol Neuroinflamm. 2 (1), 62 (2015).
- Bennett, J. L., et al. Intrathecal pathogenic anti-aquaporin-4 antibodies in early neuromyelitis optica. Ann Neurol. 66 (5), 617-629 (2009).
- Bradl, M., et al. Neuromyelitis optica: pathogenicity of patient immunoglobulin in vivo. Ann Neurol. 66 (5), 630-643 (2009).
- Nurieva, R. I., Chung, Y. Understanding the development and function of T follicular helper cells. Cell Mol Immunol. 7 (3), 190-197 (2010).
- Lucchinetti, C. F., et al. The pathology of an autoimmune astrocytopathy: lessons learned from neuromyelitis optica. Brain Pathol. 24 (1), 83-97 (2014).
- Zekeridou, A., Lennon, V. A. Aquaporin-4 autoimmunity. Neurol Neuroimmunol Neuroinflamm. 2 (4), 110 (2015).
- Brum, D. G., et al. HLA-DRB association in neuromyelitis optica is different from that observed in multiple sclerosis. Mult Scler. 16 (1), 21-29 (2010).
- Varrin-Doyer, M., et al. Aquaporin 4-specific T cells in neuromyelitis optica exhibit a Th17 bias and recognize Clostridium ABC transporter. Ann Neurol. 72 (1), 53-64 (2012).
- Vaknin-Dembinsky, A., et al. T-cell responses to distinct AQP4 peptides in patients with neuromyelitis optica (NMO). Mult Scler Relat Disord. 6, 28-36 (2016).
- Nelson, P. A., et al. Immunodominant T cell determinants of aquaporin-4, the autoantigen associated with neuromyelitis optica. PLoS One. 5 (11), 15050 (2010).
- Kalluri, S. R., et al. Functional characterization of aquaporin-4 specific T cells: towards a model for neuromyelitis optica. PLoS One. 6 (1), 16083 (2011).
- Pohl, M., et al. Pathogenic T cell responses against aquaporin 4. Acta Neuropathol. 122 (1), 21-34 (2011).
- Zeka, B., et al. Highly encephalitogenic aquaporin 4-specific T cells and NMO-IgG jointly orchestrate lesion location and tissue damage in the CNS. Acta Neuropathol. 130 (6), 783-798 (2015).
- Sagan, S. A., et al. Tolerance checkpoint bypass permits emergence of pathogenic T cells to neuromyelitis optica autoantigen aquaporin-4. Proc Natl Acad Sci U S A. 113 (51), 14781-14786 (2016).
- Vita, R., et al. The immune epitope database (IEDB) 3.0. Nucleic Acids Res. 43, 405-412 (2015).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J Immunol Methods. 332 (1-2), 170-174 (2008).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized protocol for retinal wholemount preparation for imaging and immunohistochemistry. J Vis Exp. (82), e51018 (2013).
- Cruz-Herranz, A., et al. The APOSTEL recommendations for reporting quantitative optical coherence tomography studies. Neurology. 86 (24), 2303-2309 (2016).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. Eur J Immunol. 25 (7), 1951-1959 (1995).
- Shetty, A., et al. Immunodominant T-cell epitopes of MOG reside in its transmembrane and cytoplasmic domains in EAE. Neurol Neuroimmunol Neuroinflamm. 1 (2), 22 (2014).
- Molnarfi, N., et al. MHC class II-dependent B cell APC function is required for induction of CNS autoimmunity independent of myelin-specific antibodies. J Exp Med. 210 (13), 2921-2937 (2013).
- Jones, M. V., Huang, H., Calabresi, P. A., Levy, M. Pathogenic aquaporin-4 reactive T cells are sufficient to induce mouse model of neuromyelitis optica. Acta Neuropathol Commun. 3, 28 (2015).
- Oertel, F. C., et al. Microstructural visual system changes in AQP4-antiboby-seropositive NMOSD. Neurol. Neuroimmunol. Neuroinflamm. 4, 72 (2017).
- Vogel, A. L., et al. Deletional tolerance prevents AQP4 directed autoimmunity in mice. Eur J Immunol. , (2017).
- Zhang, H., Verkman, A. S. Longitudinally extensive NMO spinal cord pathology produced by passive transfer of NMO-IgG in mice lacking complement inhibitor CD59. J Autoimmun. 53, 67-77 (2014).
- Zeka, B., et al. Aquaporin 4-specific T cells and NMO-IgG cause primary retinal damage in experimental NMO/SD. Acta Neuropathol Commun. 4 (1), 82 (2016).
- Felix, C. M., Levin, M. H., Verkman, A. S. Complement-independent retinal pathology produced by intravitreal injection of neuromyelitis optica immunoglobulin G. J Neuroinflammation. 13 (1), 275 (2016).
- Zamvil, S., et al. T-cell clones specific for myelin basic protein induce chronic relapsing paralysis and demyelination. Nature. 317 (6035), 355-358 (1985).
- Zamvil, S. S., et al. Encephalitogenic T cell clones specific for myelin basic protein. An unusual bias in antigen recognition. J Exp Med. 162 (6), 2107-2124 (1985).
- Kuchroo, V. K., et al. B7-1 and B7-2 costimulatory molecules activate differentially the Th1/Th2 developmental pathways: application to autoimmune disease therapy. Cell. 80 (5), 707-718 (1995).
- Bettelli, E., et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 441 (7090), 235-238 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon