Method Article
Rasche Fluoreszenz basierende Charakterisierung der einzelnen extrazelluläre Vesikel im menschlichen Blut mit Nanopartikel-Tracking Analyse
In diesem Artikel
Zusammenfassung
In diesem Protokoll beschreiben wir den kompletten Workflow für die schnelle Isolierung von extrazellulären Vesikeln aus menschlichen Vollblut und Charakterisierung spezifischer Marker durch Fluoreszenz-basierte Nanopartikel-Tracking-Analyse. Die vorgestellten Ergebnisse zeigen ein hohes Maß an Reproduzierbarkeit und Zelle Kultur Überstände angepasst werden können.
Zusammenfassung
Extrazelluläre Vesikel (EVs), einschließlich Exosomen, sind spezialisierte häutigen Nanogrösse Vesikel in Körperflüssigkeiten, die konstitutiv von vielen Zelltypen freigesetzt werden und spielen eine zentrale Rolle bei der Regulierung der Zell-Zell-Kommunikation und ein vielfältiges Angebot an gefunden biologische Prozesse. Viele verschiedene Methoden für die Charakterisierung des EFD sind beschrieben worden. Die meisten dieser Methoden haben jedoch den Nachteil, dass die Herstellung und Charakterisierung der Proben sehr zeitaufwendig sind, oder es extrem schwierig ist, spezifische Marker des Interesses aufgrund ihrer geringen Größe und aufgrund des Fehlens von diskreten analysieren Populationen. Während Methoden für die Analyse des Europäischen Freiwilligendienstes im letzten Jahrzehnt deutlich verbessert wurden, gibt es noch keine standardisierte Methode zur Charakterisierung der einzelnen EVs. Hier zeigen wir ein semi-automatischen Verfahren zur Charakterisierung der einzelnen EVs durch Fluoreszenz-basierte Nanopartikel-Tracking-Analyse. Das Protokoll, das präsentiert wird das gemeinsame Problem vieler Forscher auf diesem Gebiet und bietet den kompletten Workflow für schnelle Lokalisierung der EVs und Charakterisierung mit PKH67, eine allgemeine Zellmembran Linker sowie solche bestimmte Oberflächenmarker als CD63, CD9 Vimentin und lysosomale verbundenen Membranprotein 1 (Lampe-1). Die vorgestellten Ergebnisse zeigen ein hohes Maß an Reproduzierbarkeit durch andere Methoden, z.B. Western Blot bestätigt. In der durchgeführten Versuche wir ausschließlich EVs aus humanem Serumproben isoliert, aber diese Methode ist auch geeignet für Plasma oder anderen Körperflüssigkeiten und Charakterisierung von EVs aus Zelle Kultur Überstände angepasst werden kann. Unabhängig von den weiteren Verlauf der Forschung über EV Biologie sieht das Protokoll, das hier vorgestellt wird eine schnelle und zuverlässige Methode für schnelle Charakterisierung der einzelnen EVs mit spezifischer Marker.
Einleitung
Extrazelluläre Vesikel (EVs), einschließlich Exosomen, sind spezialisierte häutigen Nanogrösse Vesikel (20-150 nm) enthalten bestimmte Kombinationen von Lipiden, Haftung und interzellulären Signalmoleküle sowie andere cytosolischen Funktionskomponenten wie MicroRNA (MiRNA) und mRNA und spielen eine entscheidende Rolle bei der Regulierung der Zell-Zell-Kommunikation-1,-2. Elektrofahrzeuge werden in ihrer Umgebung aus vielen verschiedenen Zelltypen, z. B. Endothelzellen, Immunzellen und Tumor-Zellen freigesetzt und in Körperflüssigkeiten wie Sperma Serum, Urin, Muttermilch, Speichel oder Liquor cerebrospinalis3, detektiert werden 4. zunehmende Anzahl von Studien unterstreichen die vielfältigen Beitrag des EFD als potenzielle Biomarker für die Früherkennung von mehreren Krankheiten bzw. Vorhersage von Krankheit Fortschreiten5,6. Exosomen werden oft durch die Anwesenheit von Molekülen beschrieben, die sie ausdrücklich zugeordnet, unabhängig von der Art der Zelle, die sie aus7ableiten. Zum Beispiel Exosomen enthalten verschiedene Tetraspanins (CD9, CD63, CD81), major Histocompatibility complex-Klasse ich (MHC ich) Moleküle, verschiedene transmembranen Proteine, typische cytosolischen Proteine (Tubulin und Aktin), Moleküle beteiligt () multivesicular Körper MVB) Biogenese (TSG101 und Alix), heat Shock-Proteine (HSP-70 und HSP 90), und Proteine, die Teilnahme an signal-Transduktion (Proteinkinasen)8.
Viele unterschiedliche Methoden wurden zur Charakterisierung der EVs9beschrieben. Die häufigste und weit verbreitet Methoden zur EV Analyse sind Flow Cytometry10, Scannen von Rasterelektronenmikroskopie (SEM) und Übertragung Elektronenmikroskopie (TEM)11. Die etabliertesten und häufig verwendete Methode für die biochemische Charakterisierung der EV Inhalt ist Western Blot-12,13. Während SEM und TEM für die Erkennung des EFD über das gesamte Größenspektrum zu ermöglichen, ist die sehr begrenzte Identifizierung spezifischer Oberfläche Proteine ein besonderer Nachteil von dieser Methoden. Im Gegensatz dazu Durchflusszytometrie ist ein leistungsfähiges Werkzeug zur Identifizierung von spezifischen EV Oberflächenmarker, aber die Schwelle dieser Methode schränkt die Analyse zum EFD mit eine Größe größer als 500 nm. Analyse der isolierten EVs mit Erkennung von bestimmten Oberflächenmarker ist daher derzeit nicht über jede dieser drei etablierten Methoden zugänglich. Ein weiterer sehr empfindliche Methode zur Visualisierung und Analyse von EVs, Nanopartikel-Tracking-Analyse (NTA)14zuvor beschrie- Kurz, diese Methode kombiniert zwei verschiedene physikalische Prinzipien. Erstens streuen Partikel das Licht wenn sie mit einem Laserstrahl bestrahlt werden, und der zweite Grundsatz, bekannt als Brownsche Bewegung impliziert, dass die Verbreitung von verschiedenen Teilchen in einer flüssigen Suspension ist umgekehrt proportional zu ihrer Größe. Die semi-automatischen Desktop-Nanopartikel-Analysegerät für flüssige Proben besteht aus das Teilchen tracking Analyzer eine Software-basierte Analyse wo sind digitale Bilder von Streulicht aus einzelnen Partikeln aufgenommen. Die Partikel und die Bewegung der Teilchen werden durch eine Laser-Streuung-Mikroskop mit einer Videokamera erfasst. Der Laserstrahl orientiert sich vertikal, während die optische Achse horizontal und konzentrierte sich in der Zelle-Kanal mit der Probe gefüllt ist. Die Angaben von Parzellen des zerstreuten Lichtpunkte und ihre Geschwindigkeit der Bewegung ermöglichen die Bestimmung der gesamten Partikelverteilung Anzahl und Größe. Nach der Bestrahlung mit dem Laser, die Partikel streuen das Licht, das ist aufgezeichnet von einer digitalen Videokamera per Mikroskop14. Die Weiterentwicklung unserer ehemaligen Methode ist das Einsetzen von 500 nm langen Welle-Pass (LWP) Cut-off-Filter zwischen der Laser (Wellenlänge von 488 nm) und die Zelle-Kanal, der die direkte Analyse von Fluoreszenz-markierten Partikeln (Abbildung 1) ermöglicht. Unser Protokoll befasst sich die allgemeine Nachfrage vieler Forscher auf diesem Gebiet für eine schnelle Charakterisierung der einzelnen EVs, z. B. nach ihrem elterlichen Ursprung. In diesem Protokoll beschreiben wir den kompletten Workflow für die schnelle Isolierung des EFD vom menschlichen Vollblut und schnelle Charakterisierung spezifischer Marker durch Fluoreszenz-basierte Nanopartikel-Tracking-Analyse. EFD können durch Färbung mit PKH67, eine allgemeine Zellmembran Linker, sowie spezifische Exosomal Marker, z. B. CD63, CD9 und Vimentin nachgewiesen werden. Unser Protokoll eignet sich auch für EDTA und citrated Plasma, als auch andere Körperflüssigkeiten und Zelle Kultur Überstände.
Protokoll
Der institutionellen ethischen Verwaltungsrat der Universität Düsseldorf hat die Experimente, die in dieser Arbeit präsentierte genehmigt (Referenznummer: 3381).
(1) EV Isolation aus menschlichen Vollblut
- EVs mit Exosom Niederschlag Lösung zu isolieren.
- Sammeln Sie 2 mL der menschlichen Vollblut in Trennung von Serum Röhrchen (SST) über Venenpunktion und inkubieren Sie das Rohr für 15 min bei Raumtemperatur (RT) bis Koagulation abgeschlossen ist.
- Zentrifugieren Sie das SST bei 1.700 X g für 10 min bei RT Serum Zellen trennen und 1 mL Serum auf einen 1,5 mL Reaktionsgefäß übertragen. Zentrifugieren Sie Platelet-Rich Plasma (PRP), bei 3.000 X g für 15 min bei 4 ° C Thrombozyten zu entfernen und 100 μL des Thrombozyten-Armen Plasmas (PPP) auf eine neue 1,5 mL Reaktionsgefäß übertragen.
- Fügen Sie gründlich 25 µL Exosom Niederschlag-Lösung (4 Teile PPP, 1 Teil Exosom Niederschlag Lösung) und Wirbel. Inkubation der Probe für 30 min auf Eis. Das Rohr aufrecht zu halten und nicht drehen oder das Rohr während der Inkubationszeit zu mischen.
- Zentrifugieren Sie die Probe bei 1.500 X g für 30 min bei 4 ° C zu den EVs zu Pellets. Nach Zentrifugation erscheinen die EVs als ein Beige oder weiß Pellet an der Unterseite des Schiffes. Den Überstand abgesaugt und Zentrifugieren der Probe bei 1.500 X g für 5 min bei 4 ° C.
- Entfernen Sie alle Spuren von Flüssigkeit und wieder auszusetzen Sie das Pellet in 100 µL der Phosphat-gepufferte Kochsalzlösung (PBS) durch häufig Pipettieren rauf und runter. Speichern Sie die EV-Aussetzung bei-80 ° C wenn Analyse nicht sofort ausgeführt wird.
Hinweis: Wenn Sie EVs aus Plasma isolieren, Fibrinogen und Fibrin behindern können effiziente Rückgewinnung und Wiederfreisetzung ist schwerer und dauert länger.
- Isolieren Sie EVs mit Ultrazentrifugation.
- Nehmen Sie den vorgekühlten Rotor (TLA-55 behoben-Winkel) aus dem Kühlschrank und Abkühlen der Ultrazentrifuge vor Gebrauch.
- Transfer 1,25 mL PPP (vorbereitet in Schritt 1.1) zu einem geeigneten 1,5 mL Ultrazentrifugation Schlauch mit Kappe und Zentrifugieren der Probe bei 110.000 X g für 90 min bei 4 ° C. Stellen Sie sicher, dass der Rotor-vor dem Start Lastenausgleich.
- Den Überstand abgießen und Ort Rohr umgedreht auf ein Papiertuch für 2 min. wieder auszusetzen das Pellet in 500 μl PBS und Zentrifugieren die Probe bei 110.000 X g für 90 min bei 4 ° c
- Den Überstand abgesaugt und erneut aussetzen das Pellet in 50 μL der PBS.
Hinweis: Verwenden Sie nur Rotoren und Zubehör für Ultrazentrifugen, die verwendet wird. Vortest die Rohre in den Rotor durch die Verwendung von Wasser, da die Stärke der Rohre zwischen viel variieren kann.
(2) Färbung der Proben
- Färben Sie Proben mit PKH67.
- Bereiten Sie die Färbelösung durch Zugabe von 1 μl der PKH67 ethanolische Farbstofflösung zu 50 μL Verdünnungsmittel c (im Kit enthalten vor) in einer 1,5 mL Reaktionsgefäß und Mischung gründlich.
- 10 μL der Färbelösung auf 20 μl der EV-Suspension (vorbereitet in Schritt 1.1) in das Reaktionsgefäß übertragen, gründlich mischen und 5 min bei RT im Dunkeln inkubieren.
- Verdünnen Sie 50 μL der gefärbten EV Suspension mit 2,5 mL destilliertem Wasser in einer 15 mL Reaktionsgefäß, mischen Sie gründlich und nutzen Sie diese letzte Aussetzung für Partikel Messung.
Hinweis: Es ist entscheidend für Wasser als Verdünnungsmittel für die EV-Aussetzung zu verwenden, da andere Verdünnungsmittel (z.B. PBS) die Messung beeinträchtigen können. Wenn EV-Fahrwerk mit gespeichert werden, die Proben auf Eis auftauen und vor Verschmutzung gründlich mischen.
- Führen Sie Proben mit spezifischen Antikörpern zu Flecken.
- 10-20 μl der EV-Suspension (vorbereitet in Schritt 1.1) mit 50 μl destilliertes Wasser in einem 1,5 mL Reaktionsgefäß und Mischung gründlich zu verdünnen.
- Das Reaktionsgefäß 2,5-5 μL der spezifischen Antikörper (Tabelle 1) hinzufügen, mischen und 30 min bei RT im Dunkeln inkubieren.
- 50 μL der gefärbten EV Suspension auf 2,5-10 mL destilliertem Wasser (Tabelle 1) in einem 15 mL Reaktionsgefäß übertragen, gut durchmischen und nutzen diese letzte Aussetzung für Partikel Messung.
Hinweis: Unter bestimmten Umständen muss die Konzentration der verwendeten Antikörper werden angepasst (Tabelle 1).
3. die Verarbeitung der Proben
Hinweis: Die Grundlagen dieser Methode wurden ausgiebig vorher und unter das Protokoll konzentriert sich auf die spezifischen Schritte für die Analyse von Fluoreszenz-markierten EVs14beschrieben.
- Führen Sie die Startprozedur.
- Drücken Sie den Fluoreszenz-Filter in den Strahlengang des Mikroskops und Kamera. Starten Sie das Programm und folgen Sie den Anweisungen auf dem Bildschirm für die automatisierte Umsetzung.
- Wählen Sie die richtige Zellenzahl (Z158_C1149_Fluor) in der "Handy-Check" Registerkarte "(Zelldefinition) für Fluoreszenzmessung. Wählen Sie die Referenz für die Optik um sicherzustellen, dass Laser und Mikroskop in einen gemeinsamen Fokus (Laser und Mikroskop automatisch in dieser Position verschieben) sind.
- Spülen Sie die Zelle-Kanal mit einer Spritze mit 10 mL destilliertem Wasser gefüllt. Sicherstellen Sie, dass die Messzelle frei von Luftblasen und injizieren Sie Luftblasen nicht in das System.
- Bereiten Sie eine Kalibrierung Suspension mit einheitlichen 200 nm Größe Fluoreszenz-markierten Polystyrol Partikel, die Carboxylat-Gruppen auf ihrer Oberfläche haben. Verdünnen Sie 10 μL der Partikel mit 990 μL destilliertem Wasser. Verdünnen Sie dann 10 μL dieser Partikel-Lösung in einer 15 mL Tube mit 10 mL destilliertem Wasser auf die gewünschte Konzentration zu erhalten.
- 2,5 mL der Lösung verdünnt Partikel in die Zelle-Kanal zu injizieren, und klicken Sie auf "Optimieren Fokus" die Kamera einstellen.
- Messen der Probenmaterials.
- Spülen des Zelle-Kanals mehrmals mit einer Spritze mit 10 mL destilliertem Wasser vor jeder Probenmessung gefüllt. Injizieren Sie die gefärbte EV-Suspension (vorbereitet in Schritt 2) in der Zelle-Kanal.
- Stellen Sie folgende Hauptkamera Parameter in der Registerkarte ""Zelle Check"" in der Software als benötigt (Tabelle 2). Verwenden der Referenzposition oder 0.41193 um die Parameter zu positionieren.
- Für Empfindlichkeit, finden den optimalen Empfindlichkeitsbereich durch Anklicken des Buttons "Anzahl der Partikel vs. Sensibilität" um eine Kurve der gemessenen Partikel pro Bildschirm für verschiedene Empfindlichkeitsstufen anzuzeigen.
Hinweis: - Verschluss passen Sie in die Zeit, die der Kamera Licht für einen festgelegten Zeitraum passieren kann.
- Nach der Übernahme Parameter, wählen Sie eine minimale Helligkeit von 20, eine Mindestgröße von 20 nm und einer maximalen Größe von 500 nm für die Messung.
- Für Empfindlichkeit, finden den optimalen Empfindlichkeitsbereich durch Anklicken des Buttons "Anzahl der Partikel vs. Sensibilität" um eine Kurve der gemessenen Partikel pro Bildschirm für verschiedene Empfindlichkeitsstufen anzuzeigen.
- Hinweis: die Anzahl der detektierten Partikel in das Sichtfeld aus der Anzeige gezählt. Die Streuung Bar muss das Grün auf orange Bereich (50-300 Partikel). Wenn die Streuung Bar rot ist, wird die Streuung einzelner Partikel Sicherung und zählen sie als ein einzelnes Teilchen, so zu falschen Ergebnissen führt. In einem solchen Fall weiter verdünnen der Probe zur Vermeidung von Überschneidungen der Partikel oder die Empfindlichkeit zu senken.
- Klicken Sie auf "Check Partikel Drift bei 0 V" im Reiter "Handy-Check" vor Beginn der Messung. Wenn die Drift höher als 5 μm/s ist, warten Sie, bis die Probe fließt stoppt um die Messung fortzusetzen.
Hinweis: Wenn die Drift zu Beginn der Messung zu hoch ist, die wiederholten Messungen können abweichen und sophisticate die Ergebnisse. Aufgrund der zugrunde liegenden Prinzipien der NTA kann eine relevante Drift in der ermittelten Partikelgröße, wie Sie von der Software berechnet auswirken. - Klicken Sie auf "Run Video Acquisition" in die "Messung" Registerkarte "wählen Sie die Anzahl der Experimente (3-5) und die zeitliche Verzögerung zwischen ihnen (0 min.).
- Definieren Sie die Anzahl der Positionen (individuelle Subvolume)-(11) und die Anzahl der Zyklen (Messung) (10) bei jeder Messposition, wo Partikel analysiert werden sollte
- Wählen Sie einen Ordner, erstellen Sie einen neuen Dateinamen ein, und klicken Sie auf "OK", um die Messung zu starten.
4. Interpretation der Ergebnisse
- Die Ergebnisse und Parameter nach der Messung auf der Registerkarte "Analyse" anzeigen. Überprüfen Sie die folgenden Parameter nach der Analyse vor der Reinigung des Zelle Kanals: durchschnittliche Anzahl der Teilchen pro Position, Gesamtzahl der aufgenommenen Partikel und Partikelkonzentration, die breite Verteilung der Partikel (X10, X50 und X90 Werte), Wert Mittelwert und Standardabweichung. Wiederholen Sie die Messung der Probe, falls erforderlich.
Hinweis: Die Ergebnisse sind auch als PDF oder txt-Datei gespeichert. - Klicken Sie auf die Registerkarte "Analyse", zeigt das Diagramm berechnet nach der Messung, die die Verteilung der detektierten Partikel nach Größe zeigt. Klicken Sie auf "Anzeigen" in der Registerkarte "Analyse" und verwenden Sie die Symbole anpassen und ändern Sie die Grafikeinstellungen für besondere Anforderungen.
5. Validierung über EV Erkennung durch westliche Beflecken
- Auflösen der EV Pellets (vorbereitet in Schritt 1) in RIPA-lyse und Extraktion-Puffer, pipette gründlich und zu klären die lysate und den Überstand zu übertragen, zu einem neuen Schlauch auf Eis für 30 min. Zentrifuge der Probe bei 8.000 X g für 10 min bei 4 ° C inkubieren.
- Messen Sie die gesamte-Protein durch ein Lowry Protein Assay Kit. Verdünnen Sie 1 μL der isolierten EV Suspension mit 49 μL des RIPA Puffer und verwenden Sie 5 μL in Triplicates für die Analyse. Verdünnen Sie die EV-Aufhängung mit 2 X Laemmli laden-Puffer auf eine Endkonzentration von 2 µg/μl und Wärme für 10 min bei 95 ° C.
- Laden Sie 20 µg Protein pro Bohrloch. Trennen und die Proteine von Polyacrylamid Gelelektrophorese und beflecken nach Standardprotokollen Tank zu übertragen.
- Die Membran (0,2 μm Polyvinylidene Difluoride) mit Rindern Milchpulver (5 %) für 1 h bei RT zu blockieren und die Membran mit spezifischen primären Antikörpern (CD9, CD63 und Vimentin) über Nacht bei 4 ° c inkubieren
Hinweis: Der primäre Antikörper sind bei einer 1:1,000-Verdünnung verwendet. - Waschen Sie die Membran mit TBST 3 x 5 min und inkubieren Sie die Membran mit Meerrettich-Peroxidase (HRP)-konjugierten Sekundärantikörper (01:20, 000 in TBST) für 60 min bei RT
- Waschen Sie die Membran mit TBST 3 x 5 min und die Proteine durch Chemilumineszenz mit einer hohen Empfindlichkeit-Substrat-Lösung auf ein bildgebendes System zu erkennen.
Hinweis: Da CD63 Antigen umfangreich ist und variabel glykosylierten, das Molekulargewicht variieren können und Bands können zwischen 40-65 kDa erscheinen.
Ergebnisse
EVs wurden isoliert von Vollblut und zeichnet sich durch Nanopartikel tracking-Analyse mit fluoreszierenden Reagenzien. Die optimale Empfindlichkeit für die Messung der ungefärbten Partikel wurde zu 70 % bei unseren Experimenten identifiziert. Die fluoreszierenden Perlen verwendet zur Justierung und Kalibrierung der Messung zeigte eine optimale Einstellung auf eine Sensitivität von 85 % (Abbildung 2A). Eine Sensitivität von 70 % bis 90 % stieg die Anzahl der detektierten Partikel schnell, während weitere Erhöhung der Empfindlichkeit führen kann zu einer Verschlechterung der Partikelgrößenverteilung wo ist die Anzahl der Teilchen wieder fallen. Die Einstellungen der Kamera angezeigt ein scharfes Bild (Abb. 2 b) und wiederholte Messungen zeigten geringe Standardabweichung (Abbildung 2). Insofern war das Protokoll für die Bearbeitung der Proben des EFD so eingestellt, dass alle Messungen mit den selben Einstellungen (Tabelle 2) durchgeführt werden konnte. Die Breite der Verteilung wird durch drei Werte auf der x-Achse, die X10, X50 und X90 definiert. Die X50 oder mittlere Partikelgröße ist der Durchmesser, die Hälfte der Bevölkerung unter diesem Wert liegt. Ebenso zeigen die X10 und X90 den Durchmesser bei dem 10 % und 90 % der detektierten Partikel unter die gemeldete Größe sind. Färbung mit PKH67 Zelle Linker Kit, einschließlich einen fluoreszierenden Zelle Linker, der einen grünen Fluoreszenzfarbstoff mit langen aliphatischen Schwänzen in Lipid-Regionen von der Zellmembran integriert zeigten eine starke Korrelation zwischen der Empfindlichkeit und der Anzahl der Partikel gemessen (Abb. 3A). PKH67 wird häufig verwendet, für die Überwachung der Verbreitung, sondern hat sich auch für die Überwachung der Exosom oder Liposomen Aufnahme ebenso wie für in Vivo Zelle Handel bewährt. Aufgrund der unspezifischen Markierung des PKH67, kann eine Vielzahl von EVs beschriftet und erkannt werden. Die Verteilung der Partikel war in einem Bereich zwischen 266 nm (x10) und 1946 nm (x90) mit Peakmaximum bei 857 nm (x50) und mit einer niedrigen Standardabweichung zwischen den Messungen (28,1 nm). Lampe-1, befinden sich auch bekannt als Membran Lysosomen-assoziierte Glykoprotein 1 und CD107a in erster Linie über lysosomale Membranen. Nach der Färbung mit einem Alexa Fluor 488 spezifischen Antikörper gegen Lampe-1 gekennzeichnet, die Verteilung der Partikel reicht von 220 nm (x10), 1145 nm (x90) mit Peakmaximum bei 541 nm (x50) und einer Standardabweichung von 11,7 nm (Abb. 3 b). Zur Charakterisierung des EFD wir nutzten Alexa Fluor 488 beschriftet Antikörper gegen gemeinsame Exosomal Marker und bestätigte unsere Ergebnisse durch westliche Beflecken. Nach der Färbung mit Alexa Fluor 488 beschriftet CD9-Antikörper, die Verteilung der Partikel reicht von 251 nm (x10), 1139 nm (x90) mit Peakmaximum in 548 nm und eine zweite kleinere Peak bei etwa 25 nm (Abb. 4A). Färbung mit Alexa Fluor 488 CD63 gekennzeichnet (Abbildung 4 b) und Vimentin (Abbildung 4) ergab ähnliche Ergebnisse. Western Blot-Analyse belegt unser positive Ergebnis für die hier verwendeten Antikörper. Wiederholte Messungen zeigte reproduzierbare Ergebnisse für alle in diesem Bericht verwendeten Antikörper. Als Steuerelemente gebeizt wir Vesikel-freies Wasser mit entsprechenden Antikörpern (Abb. 5A), wo PKH67 und LAMP1 Antikörper praktisch keine EV bis zu einer Empfindlichkeit nahezu 100 % erkannt. Mit dem Beispiel von Vimentin, stieg hoher Empfindlichkeit die Zahl der aufstrebenden Artefakte, auch wenn die Probe im Wesentlichen frei von Partikeln ist. Wenn die Messung gestartet wird, wenn die Drift noch zu hoch ist (> 5 µm/s), die einzelnen Wiederholungen deutlich abweichen untereinander (Abb. 5 b). Mit drei verschiedenen Antikörpern vertreten, ist es entscheidend, dass die Drift so gering wie möglich ist, vor Beginn der Messung. Nach unseren Erfahrungen führt mit Fluorescein erfolgt (FITC) als Fluorochrom Messungen, die nicht präzise und reproduzierbare weil FITC anfällig für schnelle Foto Bleichen (Abbildung 5). Daher empfehlen wir ausschließlich Alexa Fluor 488 beschriftet Antikörper für EV Charakterisierung. In diesem Protokoll wurden durch eine Polymer-basierten Exosom Niederschlag Lösung mit Polyethylenglykol EVs lokalisiert. Um sicherzustellen, dass unsere Ergebnisse durch die angewandte Isolationsmethode nicht gefälscht sind, gekennzeichnet wir EVs nach Isolierung mit Ultrazentrifugation. Mit PKH67 und zwei verschiedene Antikörper (CD63 und Lampe-1) vertreten, sind die Ergebnisse unserer angewandten Isolation mit Exosom Niederschlag Lösung (Abb. 6A) vergleichbar mit EVs isoliert per Ultrazentrifugation (Abbildung 6 b ). Leider muss wegen der schlechten Ausbeute des EFD nach Ultrazentrifugation der Anfangssatz von Serum für die Isolierung deutlich höher in die Isolation mit Exosom Niederschlag Lösung verglichen werden.
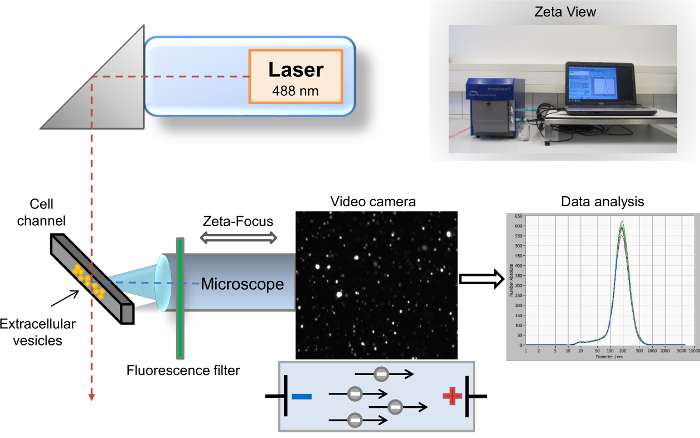
Abbildung 1: schematische Aufbau der Nanopartikel tracking Analyse. Das Mikroskop/Video Achse und Laser Beam orientieren sich orthogonal zueinander, Kreuzung an der Zelle Kanal Querschnitt. Zwischen der Zelle-Kanal und dem Mikroskop befindet sich ein Fluoreszenz-Filter. Die Partikel gestreute Licht wird im Fenster "live-View" der Software angezeigt. Nach der Übernahme werden die Ergebnisse als Größe Verteilung Kurve Koordinatensystem angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
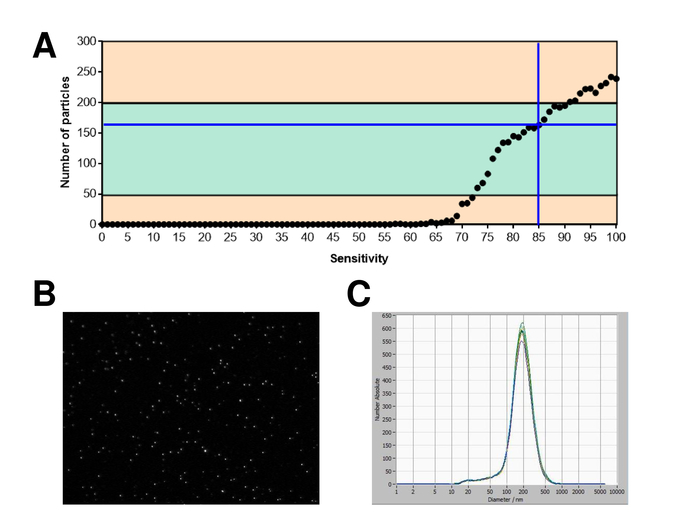
Abbildung 2: Kalibrierung mit Fluoreszenz beschriftet Perlen. (A) die Anzahl der Partikel vs. Empfindlichkeitskurve zeigt die Partikel in einer Position an einem Punkt in der Zeit während eines Scans automatische Empfindlichkeit. (B) Darstellung der Partikel auf dem live-View-Bildschirm. (C) Korngröße Verteilung nach wiederholten Messungen. Bitte klicken Sie hier für eine größere Version dieser Figur.
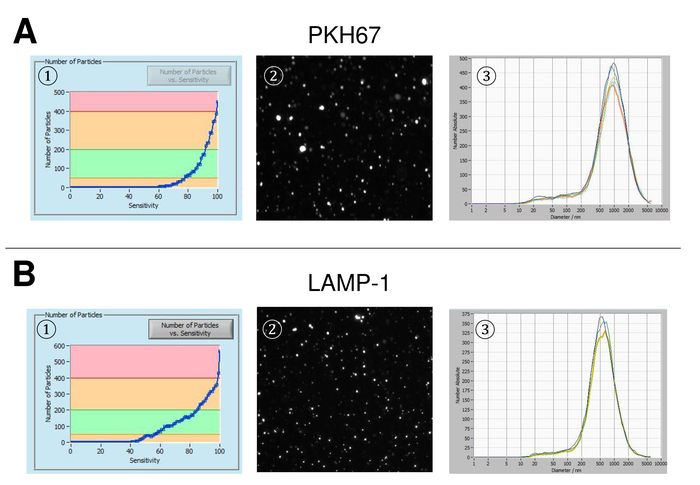
Abbildung 3: Vertreter ergibt sich nach der Färbung mit PKH67 und Lampe-1. Anzahl der Partikel vs. Empfindlichkeitskurve (1), Visualisierung von Partikeln auf die live-View-Bildschirm (2) und Partikel Größenverteilung (3) nach der Färbung mit PKH67 (A) und Lampe-1 (B). Eine ähnliche Größenverteilung der Partikel wird bei Änderungen in der Empfindlichkeitseinstellung führen zu einer ähnlichen, aber noch nicht vollkommen identisch Veränderung der detektierten Partikel beobachtet. Bitte klicken Sie hier für eine größere Version dieser Figur.
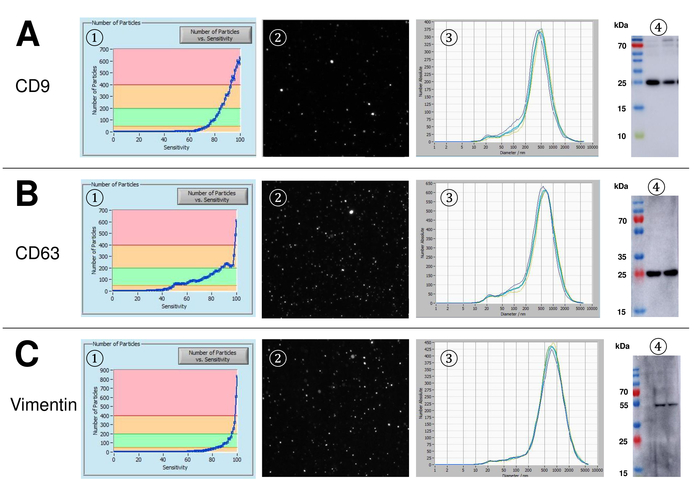
Abbildung 4: Vertreter ergibt sich nach der Färbung mit Alexa Fluor 488 CD9, CD63 und Vimentin beschriftet. Anzahl der Partikel vs. Empfindlichkeitskurve (1), Visualisierung von Partikeln auf die live-View-Bildschirm (2), Korngrößenverteilung (3) und repräsentative Western Blots von zwei verschiedenen EV Suspensionen (4) für CD9 (24-27 kDa, A), CD63 (26 kDa, ( B), und Vimentin (54 kDa, C). Späten Auftreten von Teilchen Signale entlang der zunehmenden Sensibilität (x-Achse) korreliert mit niedrigeren Signalintensität in der westlichen blot Analyse bestätigt den niedrigeren Betrag der jeweiligen Partikel Oberfläche Marker (z. B. Vimentin vs. CD63). Beachten Sie die fast identischen Kurven der repräsentativen Messungen für alle untersuchten Marker zeigt hohen Reproduzierbarkeit (3). Bitte klicken Sie hier für eine größere Version dieser Figur.
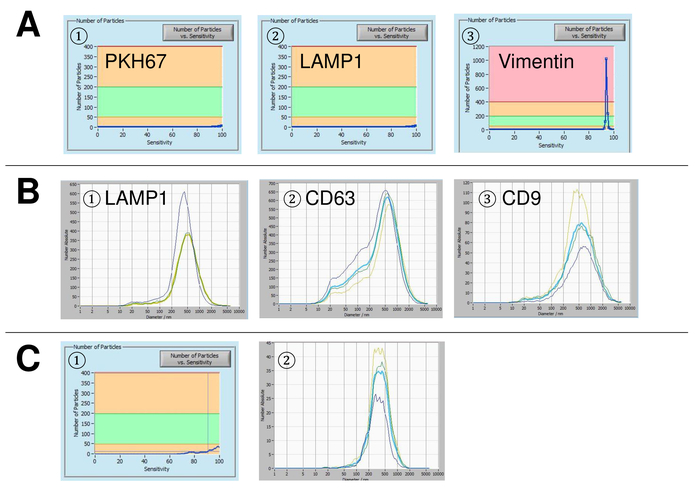
Abbildung 5: Vertreter ergibt sich für verwendete Steuerelemente und mögliche Fehlerquellen. (A) Vesikel-freies Wasser gefärbt mit PKH67 (1), Lampe-1 (2) und Vimentin (3) als Kontrollen. (B) repräsentative Partikelgrößenverteilungen nach Färbung mit Lampe-1 (1), CD63 (2), und CD9 (3), und Messungen durchgeführt, wenn Aussetzung Drift noch zu hoch ist. (C) Anzahl der Partikel vs. Empfindlichkeitskurve (1) und Korngrößenverteilung (2) nach der Färbung mit CD63 FITC-markierte Antikörper. Eine klare bleichende Wirkung wird nach jeder Messung, wodurch immer niedrigere Teilchenzahlen beobachtet. Bitte klicken Sie hier für eine größere Version dieser Figur.
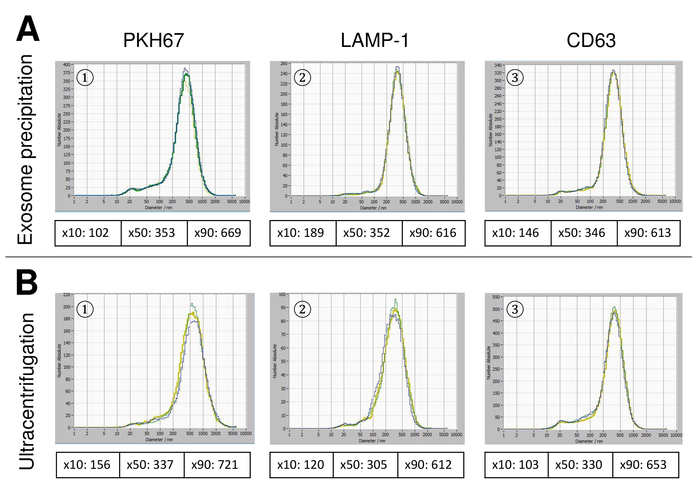
Abbildung 6: Vergleich der verschiedenen Isolationsmethoden für EVs. Partikelgrößenverteilung des EFD isoliert mit Exosom Niederschlag Lösung (A) und Ultrazentrifugation (B) nach der Färbung mit PKH67 (1), Lampe-1 (2) und CD63 (3). Bitte klicken Sie hier für eine größere Version dieser Figur.
| LAMPE-1 | CD9 | CD63 | Vimentin | |
| Antikörper (µL) | 5 | 2.5-5 | 2.5-5 | 5 |
| EV-Aufhängung (µL) | 10 | 20 | 10 | 10 |
| H2O (µL) zum Beizen | 50 | 50 | 50 | 50 |
| Volumen (mL) | 5-10 | 2.5-5 | 5 | 10 |
Tabelle 1: Liste der verwendeten Antikörper und Verdünnung von Proben.
| Aufnahmeparameter | |
| Empfindlichkeit (%) | 85 |
| Auslöser | 70 |
| Min. Helligkeit | 20 |
| Max. Größe (nm) | 500 |
| Min. Größe (nm) | 20 |
| Polarität | Negative |
| Spannung | Ab |
| Partikel-Drift bei 0 V (µm/s) | < 5 |
| Positionen | 11 |
| Zyklen | 10 |
| Mehreren Akquisitionen | 3-5 |
| Zeitverzögerung (min) | 0 |
Tabelle 2: Aufnahmeparameter für Nanopartikel tracking Analyse.
Diskussion
Wir zeigen ein detailliertes Protokoll zur Isolierung der EVs aus Vollblut und schnelle Charakterisierung der spezifischen Oberflächenmarker mit Fluoreszenz-basierte Nanopartikel tracking-Analyse. In der durchgeführten Versuche wir ausschließlich EVs von Serumproben isoliert, aber diese Methode ist auch geeignet für Ethylenediaminetetraacetic Säure (EDTA) und citrated Plasma und kann auch auf andere Körperflüssigkeiten wie Urin, Speichel, Muttermilch erweitert werden, Liquor cerebrospinalis und Sperma. Darüber hinaus kann dieses Protokoll für die Charakterisierung des EFD vom Zelle Kultur Überstände eingestellt werden. In diesem Protokoll EV Aussetzung wurde generiert aus 100 μL Serum verwenden eine Exosom Niederschlag Reagenz, das eine proprietäre Polymer enthält, die sanft Exosomen und EVs fällt nach einem korpuskulären Größe zwischen 30 nm auf 200 nm, wobei 10-20 μl der EVs wurden zur Charakterisierung der einzelnen Oberfläche Marker ernannt. Leider ist die Isolierung Schritt unvermeidlich, weil die hohe Menge an Protein in Serumproben (z. B. Albumin und Globulin) mischt sich mit dem Antikörper Färbeverfahren und zu hohen Hintergrund und anspruchsvolle Ergebnisse führt. Darüber hinaus muss basierend auf die biologische Verfügbarkeit von Exosomen in den Proben, die Menge der eingesetzten EV-Aufhängung sowie die Verdünnung vor der Verarbeitung für andere Ausgangsmaterialien angepasst werden. Um mehrere Proben zu vergleichen, ist ein standardisiertes Vorgehen für die Verdünnung von Proben sowie konsequente Aufnahmeparameter (Empfindlichkeit, Verschlusszeit usw.)notwendig. Ein weiterer wichtiger Punkt ist, dass die Messungen nicht gestartet werden, bis die Drift niedrig (in unseren Händen, < 5 μm/s). Wenn die Drift zu hoch war, wiederholte Messungen der Probe ergab hohe Standardabweichung untereinander, aber mit einem niedrigen Drift, die resultierenden Daten waren sehr konsistent und bestätigt ein hohes Maß an Reproduzierbarkeit. Es ist wichtig, dass die ausgewählte Antikörper eine entsprechende Fluorochrom haben. Antikörper müssen mit Alexa Fluor 488, konjugiert werden, weil FITC eine hohe Rate von Foto-bleichen hat. Möglicherweise wird stabiler Fluophores sicherlich zu erhöhten Assay Stabilität in der Zukunft führen. Normalerweise verwenden Sie viele Forscher PBS als ein Verdünnungsmittel für EVs. Für dieses Protokoll ist es entscheidend für die Verwendung von destilliertem Wasser als ein Verdünnungsmittel für die EV-Suspensionen. Wenn EVs mit fluoreszierenden Farbstoffen, die hohe Osmolalität und Ionen-Konzentration von anderen Verdünnungsmitteln wie PBS, beschriftet werden kann die Messung stören und führen zu verändert Ergebnisse.
Während Methoden für die Analyse des Europäischen Freiwilligendienstes im letzten Jahrzehnt deutlich verbessert wurden, gibt es noch keine standardisierten Verfahren zur Isolierung und Charakterisierung von EVs. Der größte Nachteil der Durchflusszytometrie, wo EVs oft an Perlen gebunden sind, eine größere Oberfläche bereitzustellen, ist, dass viele Elektrofahrzeuge an der Oberfläche zu einer starken und nachweisbar Signal10andocken. SEM und TEM haben den Nachteil, dass die Vorbereitung der Proben zeitaufwändig ist und EVs nur durch ihre Größe und Morphologie11unterschieden werden können. Bis heute die etabliertesten und häufig verwendete Methode zur qualitativen (d. h. biochemische) ist EV Charakterisierung Western blotting, wo Proteine mit spezifischen Antikörpern12,13analysiert werden können. Allerdings liegen die Nachteile dieser Methoden in der Unfähigkeit, einzelne EVs für bestimmte Oberflächenmarker zu analysieren. Darüber hinaus beinhalten die langen Bearbeitungszeiten und lange waschen/Isolation Verfahren von vielen der aktuellen Protokolle arbeitsintensive Schritte, so dass sie nicht geeignet für hohen Probendurchsatz und Charakterisierung der einzelnen EVs. Unser Protokoll bietet einen kompletten Workflow für schnelle Isolierung und Charakterisierung der einzelnen EVs mit spezifischen Oberflächenmarker CD63, CD9, Vimentin, wie CD107a, und für ein breites Spektrum an anderen Oberflächenmarker zur Bestimmung des Ursprungs von erweiterbar freigegebene EVs. Durch eine ständige technische Weiterentwicklung der NTA-Gerät haben wir unsere Erkenntnisse in Zusammenarbeit mit dem Hersteller mit dem neuesten Analyzer bestätigt. Unabhängig von den weiteren Verlauf der Forschung über EV Biologie, insbesondere in Bezug auf Exosomen versorgen das Protokoll, das hier vorgestellt wird eine schnelle und zuverlässige Methode zur Charakterisierung der einzelnen EVs mit spezifischer Marker. Da Aggregation der EVs in die Isolation und Färbeverfahren bisher unvermeidbar ist, sollten zukünftige Forschung konzentrieren, auf die Entwicklung von Methoden zur Verhütung EV Aggregation und ermöglichen eine genaue Größenbestimmung von Leuchtstoff-Label EVs.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Particle Metrix GmbH für teilweise Kostenübernahme der Veröffentlichung dieser Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| Serum-separation tube | BD | 366882 | BD Vacutainer |
| Ampuwa water | Fresenius Kabi | 10060 | |
| Dulbecco's phosphate-buffered saline | Sigma | 56064C | |
| Falcon tube, 15 mL | Greiner Bio One | 188271 | |
| Falcon tube, 50 mL | Greiner Bio One | 227270 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 30120086 | Speciality tubes for ultra centrifugation |
| Tube with Snap-On Cap 1.5 mL | Beckman Coulter | 357448 | |
| Polybeads Microspheres 0.2 µm | Polysciences, Inc. | 7304 | Alignment Solution |
| Fluoresbrite YG Carboxylate Microspheres beads 0.2 µm | Polysciences, Inc. | 09834-10 | Alignment Solution |
| Syringe, 2 mL | Braun | 4606027V | |
| Syringe, 10 mL | Braun | 4606728V | |
| Exoquick | SBI | EXOQ20A-1 | EV precipitation solution |
| Laemmli Sample Buffer (2x) | BioRad | 1610737 | |
| DC Protein Assay Kit II | BioRad | 5000112 | Lowry prtein assay |
| PKH67 Green Fluorescent Cell Linker Kit | Sigma | PKH67GL-1KT | For general membrane labelling |
| Alexa Fluor 488 anti-human CD107a Antibody | BioLegend | 328609 | Lysosomal-associated membrane protein-1 (LAMP-1) |
| Human CD9-Alexa Fluor 488 | R&D Systems | FAB1880G | |
| Anti-CD9 Antibody | SBI | EXOAB-CD9A-1 | |
| CD63-Alexa Fluor 488 | ThermoFisher | MA5-18149 | |
| FITC anti-human CD63 Antibody | BioLegend | 353005 | |
| CD63. Antibody, polyclonal | SantaCruz | Sc-15363 | |
| Alexa Fluor 488 anti-vimentin Antibody | BioLegend | 677809 | |
| Anti-Vimentin Antibody | SBI | EXOAB-VMTN-1 | |
| Goat anti mouse IgG + IgM | Jackson Immuno | 315-035-048 | |
| Goat anti rabbit IgG | Dianova | 111-035-003 | |
| SuperSignal West Femto Maximum Sensitivity Substrate | ThermoFisher | 34094 | |
| ZetaView | Particle Metrix | PMX 100, Type | |
| Centrifuge | Eppendorf | 5804R | |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | |
| Chemiluminescence Imager | GE Healthcare | Amersham Imager 600 |
Referenzen
- Ibrahim, A., Marban, E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology. Annual Review of Physiology. 78, 67-83 (2016).
- Su, S. A., et al. Emerging role of exosome-mediated intercellular communication in vascular remodeling. Oncotarget. 8 (15), 25700-25712 (2017).
- Lasser, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9, 9(2011).
- Li, M., et al. Analysis of the RNA content of the exosomes derived from blood serum and urine and its potential as biomarkers. Philosophical Transactions of The Royal Society B Biological Sciences. 369 (1652), (2014).
- Lin, J., et al. Exosomes: novel biomarkers for clinical diagnosis. The Scientific World Journal. 2015, 657086(2015).
- Properzi, F., Logozzi, M., Fais, S. Exosomes: the future of biomarkers in medicine. Biomarkers in Medicine. 7 (5), 769-778 (2013).
- Thery, C., Zitvogel, L., Amigorena, S. Exosomes: composition, biogenesis and function. Nature Reviews Immunology. 2 (8), 569-579 (2002).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , Chapter 3 Unit 3 22 (2006).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. (97), (2015).
- Wu, Y., Deng, W., Klinke, D. J. 2nd Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. Analyst. 140 (19), 6631-6642 (2015).
- Bianco, N. R., Kim, S. H., Morelli, A. E., Robbins, P. D. Modulation of the immune response using dendritic cell-derived exosomes. Methods in Molecular Biology. 380, 443-455 (2007).
- Conde-Vancells, J., et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes. Journal of Proteome Research. 7 (12), 5157-5166 (2008).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments. (95), 50974(2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten