Method Article
Caracterização de baseada em fluorescência rápida das vesículas extracelulares única no sangue humano, com análise de acompanhamento de nanopartículas
Neste Artigo
Resumo
Neste protocolo, descrevemos o fluxo de trabalho completo para isolamento rápido das vesículas extracelulares de sangue total humano e caracterização de marcadores específicos pela análise de controle de nanopartículas baseada em fluorescência. Os resultados apresentados mostram um elevado nível de reprodutibilidade e podem ser ajustados para sobrenadantes de cultura de células.
Resumo
Vesículas extracelulares (EVs), incluindo exosomes, são especializadas vesículas membranosas nanométricas encontradas em fluidos corporais que são constitutivamente liberados de muitos tipos de células e desempenham um papel crucial na regulação da comunicação célula-célula e uma gama diversificada de processos biológicos. Muitos métodos diferentes para a caracterização de EVs têm sido descritos. No entanto, a maioria desses métodos têm a desvantagem de que a preparação e caracterização das amostras são muito demorados, ou é extremamente difícil analisar marcadores específicos de interesse devido ao seu pequeno tamanho e devido à falta de discreta populações. Enquanto os métodos de análise de EVs melhoraram consideravelmente na última década, não há ainda nenhum método padronizado para a caracterização da única EVs. Aqui, vamos demonstrar um método semi-automático para caracterização de EVs único pela análise de controle de nanopartículas baseada em fluorescência. O protocolo que é apresentado aborda o problema comum de muitos pesquisadores neste campo e fornece o fluxo de trabalho completo para isolamento rápido de EVs e caracterização com PKH67, um vinculador geral da membrana celular, bem como com superfície marcadores específicos tais como CD63, CD9, vimentina e proteína de membrana lisossomal-associado 1 (lâmpada-1). Os resultados apresentados mostram um elevado nível de reprodutibilidade, como confirmado por outros métodos, tais como a mancha ocidental. Nos experimentos realizados, usamos exclusivamente EVs isoladas de amostras de soro humano, mas esse método também é apropriado para o plasma ou outros fluidos corporais e pode ser ajustado para a caracterização de EVs de sobrenadantes de cultura de células. Independentemente do progresso futuro da pesquisa sobre a biologia de EV, o protocolo que é apresentado aqui fornece um método rápido e confiável para a rápida caracterização da única EVs com marcadores específicos.
Introdução
Vesículas extracelulares (EVs), incluindo exosomes, são especializadas membranosas nanométricas vesículas (20-150 nm) contendo certas combinações de lipídios, adesão e moléculas de sinalização intercelulares, bem como outros componentes citosólico funcionais como microRNA (miRNA) e mRNA e desempenham um papel crucial na regulação da célula-célula comunicação1,2. Sve é liberados em seu ambiente de muitos diferentes tipos de células, por exemplo, células endoteliais, células imunes e células tumorais e pode ser detectado em fluidos corporais, como sêmen de soro, urina, leite materno, saliva ou líquido cefalorraquidiano3, 4. um número crescente de estudos realçar a contribuição diversa das EVs como potenciais biomarcadores para diagnóstico precoce de diversas doenças e/ou previsão de progressão de doença5,6. Exosomes são frequentemente descritos pela presença de moléculas que estão especificamente associadas, independentemente do tipo de célula que derivam de7. Por exemplo, o exosomes conter diferentes tetraspanins (CD9, CD63, CD81), major classe complexo histocompatibilidade eu (MHC eu) moléculas, várias proteínas transmembranares, típico de proteínas citosólica (tubulina e actina), moléculas envolvidas no corpo multivesiculares ( Biogênese MVB) (TSG101 e alix), aqueça as proteínas de choque (HSP 70 e 90 HSP), e proteínas que participam do sinal de transdução (quinase de proteína)8.
Diversos métodos têm sido descritos para a caracterização de EVs9. Os métodos mais comuns e mais prevalentes, usados para análise de EV são fluxo cytometry10, varredura, microscopia eletrônica de varredura (MEV) e microscopia eletrônica de varredura (TEM) de transmissão11. O método melhor e comumente utilizado para a caracterização bioquímica de conteúdo EV é12,13de mancha ocidental. Enquanto SEM e TEM permitam a detecção de EVs em todo o espectro de todo tamanho, muito limitada identificação das proteínas de superfície específicas é uma desvantagem particular desses métodos. Em contraste, citometria de fluxo é uma ferramenta poderosa para identificação de marcadores de superfície específicos EV, mas o limiar deste método limita a análise para EVs com um tamanho superior a 500 nm. Portanto, análise de EVs isolados com detecção de marcadores de superfície específicos não atualmente é acessível através de qualquer um desses três métodos bem estabelecida. Descrevemos anteriormente outro método altamente sensível para visualização e análise de EVs, análise de controle de nanopartículas (NTA)14. Brevemente, este método combina dois princípios físicos diferentes. Primeiro, as partículas dispersam a luz quando eles são irradiados com um feixe de laser, e o segundo princípio, conhecido como movimento Browniano, implica que a difusão de diferentes partículas em suspensão líquida é inversamente proporcional ao seu tamanho. O instrumento de análise de nanopartículas desktop semi-automático para amostras líquidas consiste da partícula rastreamento analisador com uma análise baseada em software, onde imagens digitais de luz dispersa de partículas única são registradas. As partículas e o movimento das partículas são detectados por um microscópio de dispersão de laser com uma câmera de vídeo. O feixe de laser é orientado verticalmente, enquanto o eixo óptico é horizontal e orientada para o canal de célula preenchido com a amostra. Os dados fornecidos por parcelas de manchas dispersas de luz e sua velocidade de movimento permitem a determinação da distribuição de tamanho e contagem total de partículas. Após a irradiação pelo laser, as partículas dispersam a luz, que é gravada por uma câmera de vídeo digital através do microscópio14. O avanço de nosso método antigo é a inserção de um filtro de corte de onda-passe longo (LWP) nm 500 entre o laser (comprimento de onda de 488 nm) e o canal de célula, que permite a análise direta de partículas de fluorescência-etiquetada (Figura 1). Nosso protocolo aborda a demanda comum de muitos pesquisadores neste campo para uma rápida caracterização do EVs único, por exemplo, de acordo com sua origem parental. Neste protocolo, descrevemos o fluxo de trabalho completo para isolamento rápido de EVs de sangue total humano e rápida caracterização de marcadores específicos pela análise de controle de nanopartículas baseada em fluorescência. SVE pode ser detectada pela coloração com PKH67, um vinculador geral da membrana celular, bem como com marcadores específicos exosomal, por exemplo, CD63, CD9 e vimentina. Nosso protocolo é também adequado para EDTA e plasma citratado, bem como outros fluidos corporais e sobrenadantes de cultura de células.
Protocolo
Conselho ético institucional da Universidade de Dusseldorf aprovou as experiências apresentadas neste trabalho (número de referência: 3381).
1. EV isolamento de sangue total humano
- Isole o EVs com solução de precipitação de exossomo.
- Coletar 2 mL de sangue total humano em soro-separando os tubos (SST) através de punção venosa e incubar o tubo durante 15 minutos à temperatura ambiente (RT) até que seja concluída a coagulação.
- Centrifugue a SST a 1.700 x g durante 10 minutos a RT para separar as células do soro e transferir 1 mL do soro para um tubo de reação de 1,5 mL. Centrifugar o plasma rico em plaquetas (PRP) a 3.000 x g por 15 min a 4 ° C para remover as plaquetas e transferir 100 μL de plasma pobre em plaquetas (PPP) para um novo tubo de reação de 1,5 mL.
- Adicione 25 µ l de solução de precipitação do exossomo (PPP de 4 partes, 1 parte exossomo solução de precipitação) e vórtice completamente. Incube a amostra por 30 min no gelo. Mantenha o tubo na posição vertical e não girar ou misturar o tubo durante o período de incubação.
- Centrifugar a amostra a 1.500 x g durante 30 min a 4 ° C para o SVE de Pelotas. Após a centrifugação, as EVs aparecem como um sedimento branco ou bege na parte inferior do vaso. Aspirar o sobrenadante e centrifugar a amostra a 1.500 x g por 5 min a 4 ° C.
- Remover todos os vestígios de líquido e ressuspender o sedimento em 100 µ l de tampão fosfato salino (PBS) frequentemente pipetando acima e para baixo. Armazene a suspensão de EV a-80 ° C quando a análise não é executada imediatamente.
Nota: Quando isolando EVs do plasma, fibrinogênio e fibrina podem impedir a recuperação eficiente e ressuspensão é mais pesado e leva mais tempo.
- Isole o EVs com ultracentrifugação.
- Leve o rotor pre-cooled (TLA-55 fixo-angular) da geladeira e esfriar a se antes do uso.
- Transferência de 1,25 mL de PPP (preparado na etapa 1.1) para um tubo de ultracentrifugação apropriado 1,5 mL com tampa e centrifugar a amostra a 110.000 x g durante 90 min a 4 ° C. Certifique-se que a carga do rotor é equilibrada antes de começar.
- Decante o sobrenadante e lugar tubo de ponta-cabeça em uma toalha de papel para 2 min. Ressuspender o pellet em 500 µ l de PBS e centrifugar a amostra a 110.000 x g durante 90 min a 4 ° C.
- Aspirar o sobrenadante e ressuspender o sedimento em 50 µ l de PBS.
Nota: Utilize apenas rotores e acessórios projetados para a se que está em uso. Pré-teste os tubos no rotor usando água porque a força dos tubos pode variar entre lotes.
2. a coloração das amostras
- Mancha de amostras com PKH67.
- Prepare a solução de coloração, adicionando 1 μL da solução etanólica de corante PKH67 para 50 μL de diluente C (incluído no kit) em um tubo de reação de 1,5 mL e misture completamente.
- Transferir 10 μL da solução de coloração para 20 μL da suspensão EV (preparada na etapa 1.1) no tubo de reação, homogeneizar e incubar durante 5 min à RT no escuro.
- Diluir 50 µ l da suspensão EV manchada com 2,5 mL de água destilada em um tubo de reação de 15 mL, misture bem e use esta suspensão final para medição de partículas.
Nota: É essencial usar a água como diluente para a suspensão de EV, porque outros diluentes (por exemplo, PBS) podem prejudicar a medição. Quando usando armazenados EV-suspensão, descongelar as amostras no gelo e misture bem antes de coloração.
- Mancha de amostras com anticorpos específicos.
- Dilua 10-20 μL da suspensão de EV (preparada na etapa 1.1) com 50 μL de água destilada em um tubo de reação de 1,5 mL e misture completamente.
- Adicionar 2,5-5 μL do anticorpo específico (tabela 1) no tubo de reação, homogeneizar e incubar durante 30 min à RT no escuro.
- Transferir 50 μL de suspensão de EV da manchada para 2,5-10 mL de água destilada (tabela 1) em um tubo de reação de 15 mL, misture bem e use esta suspensão final para medição de partículas.
Nota: Em algumas circunstâncias, a concentração do anticorpo usado deve ser ajustado (tabela 1).
3. processamento das amostras
Nota: Os fundamentos deste método foram extensivamente descritos anteriormente e abaixo o protocolo concentra-se sobre as etapas específicas necessárias para a análise de fluorescência-etiquetada EVs14.
- Execute o procedimento de inicialização.
- Empurre o filtro de fluorescência no caminho óptico do microscópio e câmera. Inicie o programa e siga as instruções na tela para implementação automatizada.
- Selecione o número correto (Z158_C1149_Fluor) em "Ver célula" guia (definição de célula) para medição de fluorescência. Selecione a posição de referência para a ótica garantir a laser e microscópio em um foco comum (laser e microscópio se até esta posição automaticamente).
- Irrigue o canal da célula com uma seringa cheia com 10 mL de água destilada. Certifique-se de que a célula de medição esteja livre de bolhas de ar e não injectar bolhas de ar no sistema.
- Prepare uma suspensão de calibração contendo uniforme 200 nm tamanho marcado com fluorescência poliestireno partículas que têm grupos carboxilato na sua superfície. Diluir 10 μL das partículas com 990 μL de água destilada. Em seguida dilua 10 μL desta solução de partículas em um tubo de 15 mL com 10 mL de água destilada para obter a concentração necessária.
- Injetar 2,5 mL da solução diluída de partícula no canal da célula e clique em "Otimizar o foco" para ajustar a câmera.
- Medir a amostra.
- Irrigue o canal celular várias vezes com uma seringa cheia com 10 mL de água destilada antes de cada medição de amostra. Injete a suspensão manchada de EV (preparada na etapa 2) para o canal de célula.
- Ajuste os seguintes parâmetros de câmera principal na aba "Ver célula" no software como necessário (tabela 2). Usar a posição de referência ou 0.41193 para ajustar os parâmetros de posição.
- Para sensibilidade, encontrar a faixa de sensibilidade ideal, clicando no botão "Número de partículas vs sensibilidade" para exibir uma curva de partículas medidas por tela para níveis diferentes de sensibilidade.
Nota: - Para o obturador, ajuste o período de tempo que a câmera permite que a luz passe para um determinado intervalo.
- Para parâmetros de pós-aquisição, escolher um brilho mínimo de 20, um tamanho mínimo de 20 nm e um tamanho máximo de 500 nm para medição.
- Para sensibilidade, encontrar a faixa de sensibilidade ideal, clicando no botão "Número de partículas vs sensibilidade" para exibir uma curva de partículas medidas por tela para níveis diferentes de sensibilidade.
- Observe o número de partículas detectadas contado do campo de visão do visor. O bar de dispersão deve ser no verde para faixa laranja (50-300 partículas). Se a barra de espalhamento é vermelha, o scatter irá fundir partículas individuais e eles são contados como uma única partícula, conduzindo assim a resultados falsos. Nesse caso, ainda mais, diluir a amostra para evitar a sobreposição das partículas ou diminuir a sensibilidade.
- Clique em "Check partícula deriva em 0 V" na aba "Ver célula" antes de iniciar a medição. Se o desvio for superior a 5 μm/s, espere até que a amostra para fluindo para continuar a medição.
Nota: Se a tração for muito elevada no início da medição, as medições repetidas podem diferir e sophisticate os resultados. Devido aos princípios subjacentes da NTA, uma deriva relevante pode ter impacto em determinada granulometria, conforme calculado pelo software. - Clique em "Executar a aquisição" na guia "Medição" Selecione o número de experimentos (3-5) e o tempo de atraso entre eles (0 min).
- Definir os vários cargos (individual subvolume-) (11) e o número de ciclos (medição) (10) em cada posição de medição, onde as partículas devem ser analisadas
- Selecione uma pasta, criar um novo nome de arquivo e clique em "Okey" para iniciar a medição.
4. interpretação dos resultados
- Exibir os resultados e parâmetros na guia "Análise" após a medição. Verifique os seguintes parâmetros após a análise antes de limpar o canal da célula: número médio de partículas por posição, o número total de partículas rastreadas e concentração de partículas, a largura de distribuição das partículas (valores x90, x50 e x10), valor de média e desvio padrão. Se necessário, repita a medição da amostra.
Nota: Os resultados também são salvos como um arquivo. pdf ou. txt. - Clique na guia "Análise" para exibir o gráfico calculado após a medição, o que mostra a distribuição das partículas detectadas pelo tamanho. Clique em "Exibir" na aba "Análise" e usar os ícones para ajustar e alterar as configurações de gráfico para requisitos específicos.
5. validação via EV deteção pela mancha ocidental
- Dissolva a pelota de EV (preparada na etapa 1) em tampão de Lise e extração de RIPA, pipetar cuidadosamente e incubar no gelo por 30 min. centrifugar a amostra a 8.000 x g durante 10 minutos a 4 ° C para esclarecer o lisado e transferir o sobrenadante para um tubo novo.
- Medir a proteína total por um kit de ensaio de proteína de Lowry. Diluir 1 μL da suspensão EV isolada com 49 μL de tampão RIPA e usar 5 μL em triplica para análise. Diluir a suspensão de EV com tampão de carregamento x Laemmli 2 para uma concentração final de 2 µ g / µ l e calor durante 10 minutos a 95 ° C.
- Carga 20 μg de proteína por bem. Separar e transferir as proteínas por eletroforese em gel de poliacrilamida e tanque mancha de acordo com protocolos padrão.
- Bloquear a membrana (difluoreto de polivinilideno 0,2 μm), com pó de leite bovino (5%) por 1h no RT e incubar a membrana com anticorpos primários específicos (CD9, CD63 e vimentina) durante a noite a 4 ° C.
Nota: Os anticorpos primários são usados em uma diluição de 1:1,000. - Lavar a membrana com TBST 3 x 5 min e incubar a membrana com peroxidase de rábano (HRP)-anticorpo secundário conjugado (01:20, 000 em TBST) por 60 min em RT
- Lavar a membrana com TBST 3 x 5 min e detectar as proteínas por quimioluminescência com uma solução de substrato de alta sensibilidade em um sistema da imagem latente.
Nota: Porque CD63 antígeno é extensivamente variàvel glicosilados, o peso molecular pode variar e bandas podem aparecer entre 40-65 kDa.
Resultados
SVE foram isoladas de sangue total e caracteriza-se pela análise com reagentes fluorescentes de rastreamento de nanopartículas. A sensibilidade ideal para medição de partículas imaculadas foi identificada a gama em 70% durante nossas experiências. Os grânulos fluorescentes usados para ajuste e calibração da medição mostraram um ajuste ideal em uma sensibilidade de 85% (Figura 2A). Entre uma sensibilidade de 70% e 90%, o número de partículas detectados aumentou rapidamente, enquanto aumentando ainda mais a sensibilidade pode levar a uma deterioração da distribuição do tamanho de partícula onde o número de partículas é re-caindo. As configurações da câmera exibida uma imagem nítida (Figura 2B) e repetidas medições mostraram baixo desvio padrão (Figura 2). Na medida em que, o protocolo para o processamento das amostras de SVE foi ajustado para que todas as medições podem ser realizadas com as mesmas configurações (tabela 2). A largura de distribuição é definida por três valores no eixo x, o x10, x50 e x90. O x50, ou tamanho de partícula médio é o diâmetro em que metade da população encontra-se abaixo deste valor. Da mesma forma, o x10 e x90 indicam o diâmetro em que 10% e 90% das partículas detectadas estão sob o tamanho relatado. Coloração com kit de vinculador da célula PKH67, incluindo um vinculador de célula fluorescente que incorpora uma tintura fluorescente verde com caudas longa alifáticas em regiões lipídica da membrana celular, demonstrou uma forte correlação entre a sensibilidade e o número de partículas medido (Figura 3A). PKH67 é usado frequentemente para monitoramento de proliferação, mas também provou ser útil para monitorar a captação exossomo ou lipossoma tão bem quanto na vivo celular tráfico. Devido a não-específicas de rotulagem do PKH67, uma grande variedade de EVs pode ser rotulada e detectada. A distribuição das partículas foi em um intervalo entre 266 nm (x10) 1946 nm (x90) com um pico máximo em 857 nm (x50) e com um baixo desvio padrão entre as medições (28,1 nm). LÂMPADA-1, também conhecida como glicoproteína de membrana do lisossomo-associado 1 e CD107a residem principalmente através das membranas dos lisossomos. Após coloração com uma Alexa Fluor 488 etiquetado anticorpo específico contra a lâmpada-1, a distribuição das partículas varia de 220 nm nm (x10) de 1145 (x90) com um pico máximo em 541 nm (x50) e um desvio padrão de 11,7 nm (Figura 3B). Para a caracterização de EVs, usamos Alexa Fluor 488 rotulado anticorpos contra marcadores exosomal comuns e confirmou nossas descobertas pela mancha ocidental. Depois da coloração com Alexa Fluor 488-rotulado CD9-anticorpo, a distribuição das partículas varia de 251 nm nm (x10) de 1139 (x90) com um pico máximo em 548 nm e um segundo pico menor em aproximadamente 25 nm (Figura 4A). Coloração com Alexa Fluor 488 rotulado CD63 (Figura 4B) e vimentina (Figura 4) produziu resultados semelhantes. Análise de mancha ocidental fundamentado nosso resultado positivo para anticorpos usados aqui. Medições repetidas mostraram resultados reprodutíveis para todos os anticorpos utilizados neste relatório. Como controles, nós manchadas de água livre de vesículas com respectivos anticorpos (Figura 5A), onde PKH67 e LAMP1 anticorpos praticamente não detectado nenhum EV até uma sensibilidade próxima de 100%. Usando o exemplo da vimentina, alta sensibilidade aumentou o número de artefatos emergentes, mesmo quando a amostra é essencialmente livre de partículas. Se a medição é iniciada quando o drift ainda é muito alto (> 5 µm/s), as repetições individuais distintamente desviar-se entre si (Figura 5B). Conforme representado com três diferentes anticorpos, é fundamental que a tração é tão mínima quanto possível antes de iniciar a medição. De acordo com nossa experiência, usando o isotiocianato de fluoresceína (FITC) como fluorocromo resulta em medidas que não são precisos e reprodutíveis porque FITC é propenso a foto rápida branqueamento (Figura 5). Portanto, recomendamos o uso exclusivamente Alexa Fluor 488 rotulado anticorpos para caracterização de EV. Neste protocolo, EVs foram isolados por uma solução de precipitação de exossomo baseado em polímero contendo polietileno glicol. Para garantir que nossos resultados não são falsificados pelo método de isolamento aplicadas, nós caracterizada EVs após isolamento com ultracentrifugação. Conforme representado com PKH67 e dois anticorpos diferentes (CD63 e lâmpada-1), os resultados de nosso isolamento aplicado com solução de precipitação de exossomo (figura 6A) são comparáveis com EVs isoladas através de ultracentrifugação (Figura 6B ). Infelizmente, por causa do rendimento pobre de EVs após ultracentrifugação, o conjunto inicial de soro para isolamento deve ser nitidamente superior em comparação com isolamento com solução de precipitação de exossomo.
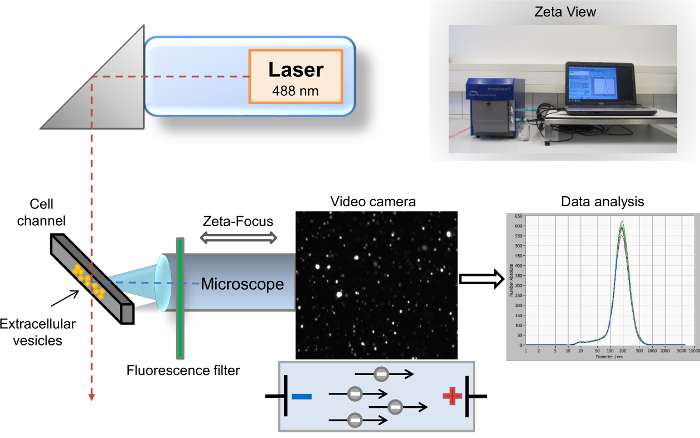
Figura 1: configuração esquemática de análise de rastreamento a nanopartículas. O feixe de laser e eixo do microscópio/vídeo são orientativos ortogonalmente ao outro, cruzando na célula seção transversal do canal. Um filtro de fluorescência é colocado entre o canal de célula e o microscópio. Luz espalhada pelas partículas é exibida na janela de "live-view" do software. Após a aquisição, os resultados são exibidos como um sistema de coordenadas de curva de distribuição de tamanho. Clique aqui para ver uma versão maior desta figura.
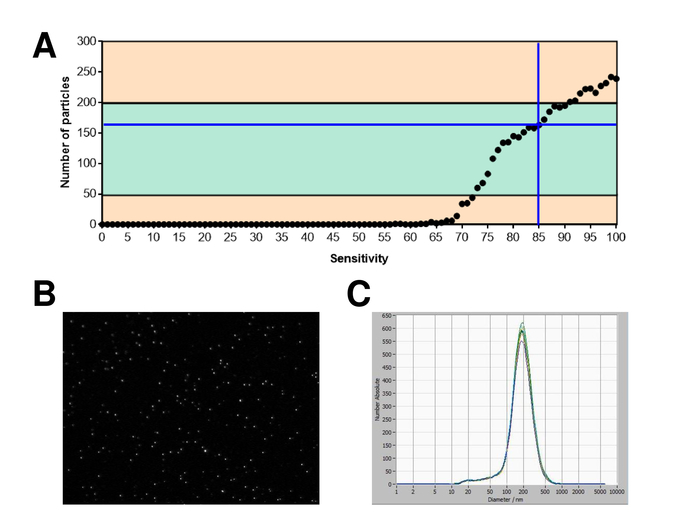
Figura 2: calibração com fluorescência rotulado grânulos. (A), o número de partículas vs sensibilidade curva exibe as partículas em uma posição em um ponto no tempo durante uma verificação automática de sensibilidade. (B) a visualização de partículas na tela de visualização ao vivo. Distribuição após repetidas medições de tamanho de partícula (C). Clique aqui para ver uma versão maior desta figura.
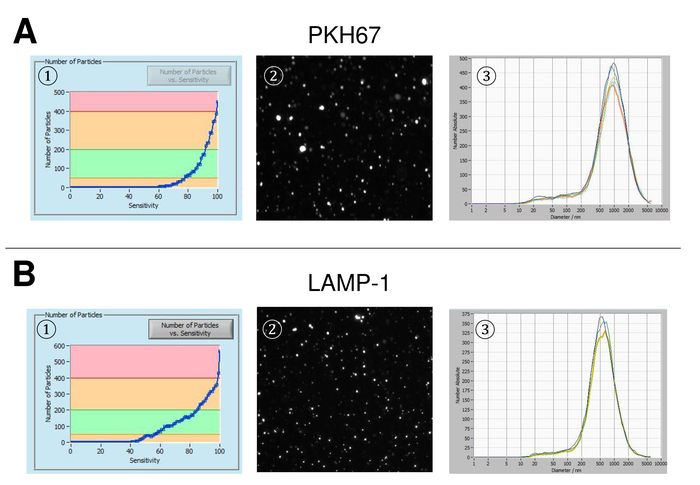
Figura 3: representante resulta após coloração com PKH67 e lâmpada-1. Número de partículas vs curva de sensibilidade (1), visualização de partículas na visualização ao vivo tela (2) e partículas tamanho distribuição (3) depois da coloração com PKH67 (A) e (B) lâmpada-1. Observa-se uma distribuição similar de tamanho de partículas, enquanto alterações na configuração principal para uma mudança semelhante, mas ainda não totalmente idêntica de partículas detectadas a sensibilidade. Clique aqui para ver uma versão maior desta figura.
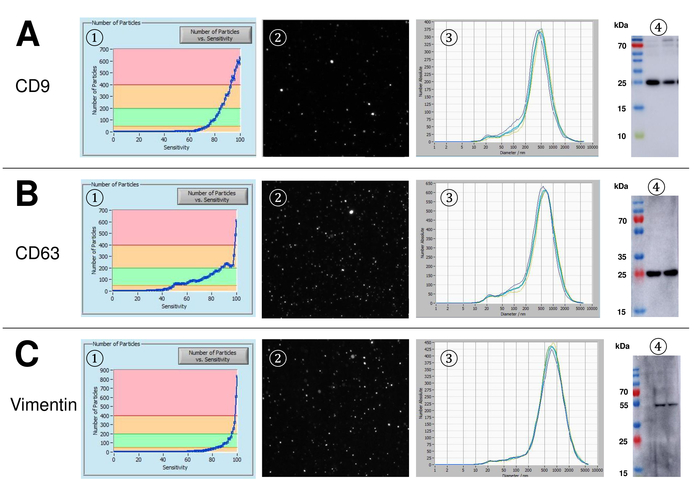
Figura 4: representante resultados após coloração com Alexa Fluor 488 rotulado CD9, CD63 e vimentina. Número de partículas vs curva de sensibilidade (1), visualização de partículas na tela de visualização ao vivo (2), distribuição de tamanho de partícula (3) e representante borrões ocidentais de dois diferentes suspensões de EV (4) para CD9 (24-27 kDa, A), CD63 (26 kDa, B) e vimentina (54 kDa, C). Ocorrência final da partícula sinais ao longo da crescente sensibilidade (eixo x) correlaciona-se com menor intensidade de sinal no Western blot análise, confirmando a menor quantidade do marcador de superfície respectiva partícula (por exemplo, vimentina vs CD63). Observe as curvas quase idênticas das medições representativas para todos os marcadores analisados, indicando grande reprodutibilidade (3). Clique aqui para ver uma versão maior desta figura.
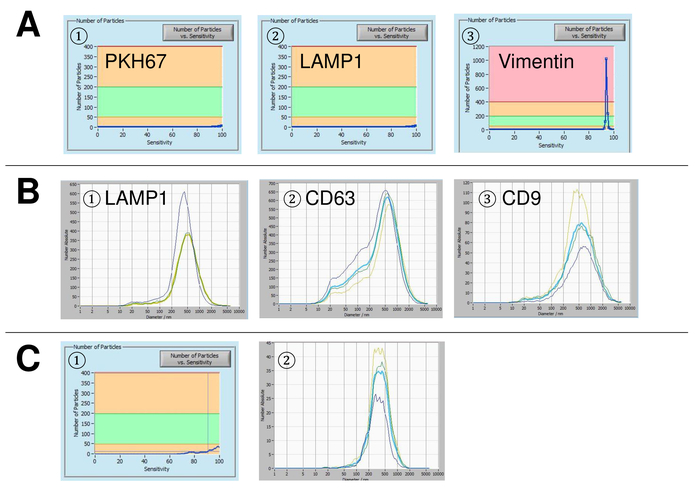
Figura 5: resultados da representante por controles usados e fontes de erro possível. (A) livre de vesículas água manchada de PKH67 (1), lâmpada-1 (2) e vimentina (3) como controles. (B) distribuições de tamanho de partícula representativa após coloração com lâmpada-1 (1), CD63 (2) e CD9 (3), e as medições realizadas quando deriva de suspensão ainda é muito alta. (C) número de partículas vs curva de sensibilidade (1) e a distribuição de tamanho de partícula (2) após coloração com o anticorpo marcado com FITC CD63. Um claro efeito de branqueamento é observado após cada medição, resultando em números de partículas progressivamente menores. Clique aqui para ver uma versão maior desta figura.
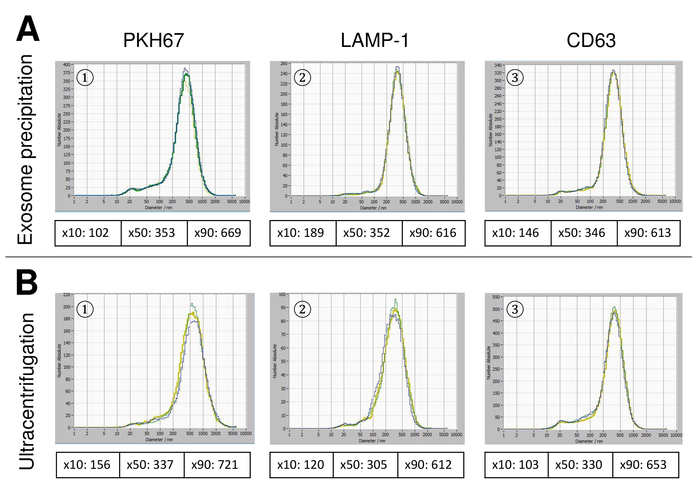
Figura 6: comparação dos métodos de isolamento diferente para EVs. Distribuição granulométrica de EVs isolado com solução de precipitação de exossomo (A) e ultracentrifugação (B) depois da coloração com PKH67 (1), lâmpada-1 (2) e CD63 (3). Clique aqui para ver uma versão maior desta figura.
| LÂMPADA-1 | CD9 | CD63 | Vimentina | |
| Anticorpo (µ l) | 5 | 2,5-5 | 2,5-5 | 5 |
| Suspensão de EV (µ l) | 10 | 20 | 10 | 10 |
| H2O (µ l) para a coloração | 50 | 50 | 50 | 50 |
| Volume final (mL) | 5-10 | 2,5-5 | 5 | 10 |
Tabela 1: Lista de anticorpos usados e escala de diluição das amostras.
| Parâmetros de aquisição | |
| Sensibilidade (%) | 85 |
| Obturador | 70 |
| Brilho de min. | 20 |
| Max. Tamanho (nm) | 500 |
| Min. tamanho (nm) | 20 |
| Polaridade | Negativo |
| Tensão | Fora |
| Deriva de partícula em 0 V (µm/s) | < 5 |
| Posições | 11 |
| Ciclos de | 10 |
| Aquisições múltiplas | 3-5 |
| Atraso de tempo (min) | 0 |
Tabela 2: Parâmetros de aquisição para análise de rastreamento de nanopartículas.
Discussão
Vamos demonstrar um protocolo detalhado para isolamento de EVs de sangue total e rápida caracterização de marcadores de superfície específicos com nanopartículas baseada em fluorescência, análise de controle. Nos experimentos realizados, usamos exclusivamente EVs isoladas de amostras de soro, mas esse método também é apropriado para o ácido etilenodiaminotetracético (EDTA) e plasma citratado e também pode ser expandido para outros fluidos corporais, tais como urina, leite materno, saliva, líquido cefalorraquidiano e sêmen. Além disso, este protocolo pode ser ajustado para a caracterização de EVs de sobrenadantes de cultura de células. Neste protocolo, a suspensão de EV foi gerada a partir de 100 μL de soro usando um reagente de precipitação exossomo, que contém um polímero proprietário que precipita-se suavemente exosomes e EVs de acordo com um tamanho corpuscular que variam de 30 nm a 200 nm, segundo a qual 10-20 μL de EVs foram nomeados para a caracterização de cada marcador de superfície. Infelizmente, a etapa de isolamento é inevitável, pois a alta quantidade de proteína em amostras de soro (por exemplo, albumina e globulina) interfere com o anticorpo que mancham o procedimento e resulta em alto nível de plano de fundo e resultados sofisticados. Além disso, com base na disponibilidade biológica do exosomes nas amostras, a quantidade de suspensão EV independente, bem como a diluição antes do processamento deve ser ajustada para outras matérias-primas. Para comparar várias amostras, é necessária uma abordagem padronizada para a diluição de amostras, bem como parâmetros de aquisição consistente (sensibilidade, obturador, etc.). Outro ponto importante é que as medições não são iniciadas até que a tração é baixa (em nossas mãos, < 5 μm/s). Se a deriva era demasiado elevada, medidas repetidas da amostra renderam alto desvio-padrão entre si, mas com uma baixa deriva, os dados resultantes foram altamente consistentes e confirmaram um alto nível de reprodutibilidade. É importante que os anticorpos selecionados com um fluorocromo apropriado. Anticorpos devem ser conjugados com Alexa Fluor 488, porque FITC tem uma taxa elevada de foto-clareamento. Possivelmente mais estável fluophores certamente levará a ensaio maior estabilidade no futuro. Normalmente, muitos pesquisadores usam PBS como diluente para EVs. Para este protocolo, é fundamental usar água destilada como diluente para as suspensões de EV. Quando EVs são rotulados com corantes fluorescentes, a alta osmolalidade e a concentração de íons de outros diluentes, como a PBS, podem interferir com a medição e chumbo para alterou os resultados.
Enquanto os métodos de análise de EVs melhoraram consideravelmente na última década, não existe ainda método padronizado para isolamento e caracterização de EVs. A grande desvantagem de citometria de fluxo, onde EVs frequentemente ligados ao grânulos para fornecer uma superfície maior, é que muitos EVs dock para a superfície para fornecer um sinal forte e detectável10. SEM e TEM tem a desvantagem de que a preparação das amostras é demorada e EVs só podem ser distinguidos pelo seu tamanho e morfologia de11. Até à data, o método melhor e comumente utilizado para qualitativa (i.e., Bioquímica) caracterização de EV é mancha, onde as proteínas podem ser analisadas com anticorpos específicos12,13ocidental. No entanto, as desvantagens de todos estes métodos deite-se na incapacidade de analisar único EVs para marcadores de superfície específicas. Além disso, os longos tempos de processamento e procedimentos de lavagem/isolamento longo usados por muitos dos protocolos atuais envolvem as etapas de trabalho intensivos, tornando-os não é adequado para amostra alto throughput e caracterização da única EVs. Nosso protocolo fornece um fluxo de trabalho completo para rápido isolamento e caracterização de EVs único com marcadores de superfície específicos tais como CD63, CD9, vimentina e CD107a e pode ser expandido para um amplo espectro de outros marcadores de superfície para determinar a origem de lançado EVs. Por causa de um avanço técnico permanente do dispositivo NAT, confirmamos nossas descobertas em cooperação com o fabricante com o mais novo analisador. Independentemente do progresso futuro da pesquisa sobre a biologia de EV, nomeadamente em matéria exosomes, o protocolo que é apresentado aqui irá fornecer um método rápido e confiável para a caracterização de EVs único com marcadores específicos. Porque a agregação de EVs durante o isolamento e o procedimento de coloração até agora é inevitável, pesquisas futuras devem centrar-se no desenvolvimento de métodos para prevenir a agregação de EV e permitem uma determinação do tamanho exato da fluorescente-etiquetadas EVs.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores Agradecemos a partícula Metrix GmbH parcialmente cobrindo os custos de publicação deste trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| Serum-separation tube | BD | 366882 | BD Vacutainer |
| Ampuwa water | Fresenius Kabi | 10060 | |
| Dulbecco's phosphate-buffered saline | Sigma | 56064C | |
| Falcon tube, 15 mL | Greiner Bio One | 188271 | |
| Falcon tube, 50 mL | Greiner Bio One | 227270 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 30120086 | Speciality tubes for ultra centrifugation |
| Tube with Snap-On Cap 1.5 mL | Beckman Coulter | 357448 | |
| Polybeads Microspheres 0.2 µm | Polysciences, Inc. | 7304 | Alignment Solution |
| Fluoresbrite YG Carboxylate Microspheres beads 0.2 µm | Polysciences, Inc. | 09834-10 | Alignment Solution |
| Syringe, 2 mL | Braun | 4606027V | |
| Syringe, 10 mL | Braun | 4606728V | |
| Exoquick | SBI | EXOQ20A-1 | EV precipitation solution |
| Laemmli Sample Buffer (2x) | BioRad | 1610737 | |
| DC Protein Assay Kit II | BioRad | 5000112 | Lowry prtein assay |
| PKH67 Green Fluorescent Cell Linker Kit | Sigma | PKH67GL-1KT | For general membrane labelling |
| Alexa Fluor 488 anti-human CD107a Antibody | BioLegend | 328609 | Lysosomal-associated membrane protein-1 (LAMP-1) |
| Human CD9-Alexa Fluor 488 | R&D Systems | FAB1880G | |
| Anti-CD9 Antibody | SBI | EXOAB-CD9A-1 | |
| CD63-Alexa Fluor 488 | ThermoFisher | MA5-18149 | |
| FITC anti-human CD63 Antibody | BioLegend | 353005 | |
| CD63. Antibody, polyclonal | SantaCruz | Sc-15363 | |
| Alexa Fluor 488 anti-vimentin Antibody | BioLegend | 677809 | |
| Anti-Vimentin Antibody | SBI | EXOAB-VMTN-1 | |
| Goat anti mouse IgG + IgM | Jackson Immuno | 315-035-048 | |
| Goat anti rabbit IgG | Dianova | 111-035-003 | |
| SuperSignal West Femto Maximum Sensitivity Substrate | ThermoFisher | 34094 | |
| ZetaView | Particle Metrix | PMX 100, Type | |
| Centrifuge | Eppendorf | 5804R | |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | |
| Chemiluminescence Imager | GE Healthcare | Amersham Imager 600 |
Referências
- Ibrahim, A., Marban, E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology. Annual Review of Physiology. 78, 67-83 (2016).
- Su, S. A., et al. Emerging role of exosome-mediated intercellular communication in vascular remodeling. Oncotarget. 8 (15), 25700-25712 (2017).
- Lasser, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9, 9(2011).
- Li, M., et al. Analysis of the RNA content of the exosomes derived from blood serum and urine and its potential as biomarkers. Philosophical Transactions of The Royal Society B Biological Sciences. 369 (1652), (2014).
- Lin, J., et al. Exosomes: novel biomarkers for clinical diagnosis. The Scientific World Journal. 2015, 657086(2015).
- Properzi, F., Logozzi, M., Fais, S. Exosomes: the future of biomarkers in medicine. Biomarkers in Medicine. 7 (5), 769-778 (2013).
- Thery, C., Zitvogel, L., Amigorena, S. Exosomes: composition, biogenesis and function. Nature Reviews Immunology. 2 (8), 569-579 (2002).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , Chapter 3 Unit 3 22 (2006).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. (97), (2015).
- Wu, Y., Deng, W., Klinke, D. J. 2nd Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. Analyst. 140 (19), 6631-6642 (2015).
- Bianco, N. R., Kim, S. H., Morelli, A. E., Robbins, P. D. Modulation of the immune response using dendritic cell-derived exosomes. Methods in Molecular Biology. 380, 443-455 (2007).
- Conde-Vancells, J., et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes. Journal of Proteome Research. 7 (12), 5157-5166 (2008).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments. (95), 50974(2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados