Method Article
Rapida caratterizzazione basata sulla fluorescenza delle singole vescicole extracellulari nel sangue umano con analisi Nanoparticle tracking
In questo articolo
Riepilogo
In questo protocollo, descriviamo il flusso di lavoro completo per rapido isolamento delle vescicole extracellulari da sangue umano intero e la caratterizzazione di marcatori specifici di analisi di fluorescenza-basata nanoparticle tracking. I risultati presentati mostrano un elevato livello di riproducibilità e possono essere regolati per i surnatanti di coltura cellulare.
Abstract
Vescicole extracellulari (EVs), tra cui esosomi, sono specializzate membranose nanometriche vescicole trovate in fluidi corporei che costitutivamente vengono rilasciati da molti tipi di cellule e svolgono un ruolo fondamentale nella regolazione della comunicazione della cellula-cellula e una vasta gamma di processi biologici. Sono stati descritti diversi metodi per la caratterizzazione del SVE. Tuttavia, la maggior parte di questi metodi hanno lo svantaggio che la preparazione e la caratterizzazione dei campioni sono richiede molto tempo, oppure è estremamente difficile analizzare gli indicatori specifici di interesse grazie alle loro piccole dimensioni e a causa della mancanza di discreti popolazioni. Mentre i metodi per l'analisi del SVE sono state notevolmente migliorate nell'ultimo decennio, ancora non esiste un metodo standardizzato per la caratterizzazione del singolo EVs. Qui, dimostriamo un metodo semi-automatico per la caratterizzazione del singoli SVE da analisi di fluorescenza-basata nanoparticle tracking. Il protocollo che si è presentato il problema comune di molti ricercatori in questo campo si rivolge e fornisce il flusso di lavoro completo per l'isolamento rapido di EVs e caratterizzazione con PKH67, un linker generale della membrana cellulare, così come con marcatori di superficie specifici tali come CD63, CD9, il vimentin e proteine di membrana lisosomiale-collegata 1 (lampada-1). I risultati presentati mostrano un elevato livello di riproducibilità, come confermato da altri metodi, come ad esempio Western blotting. Negli esperimenti condotti, abbiamo usato esclusivamente EVs isolati da campioni di siero umano, ma questo metodo è adatto anche per plasma o altri fluidi del corpo e può essere regolato per la caratterizzazione del SVE da surnatanti di coltura cellulare. Indipendentemente dal fatto i progressi futuri della ricerca sulla biologia di EV, il protocollo che qui viene presentato fornisce un metodo rapido e affidabile per la caratterizzazione rapida del singoli SVE con marcatori specifici.
Introduzione
Vescicole extracellulari (EVs), tra cui esosomi, sono specializzate membranose nanometriche vescicole (20-150 nm) che contengono determinate combinazioni di lipidi, adesione e molecole di segnalazione intercellulare, nonché altri componenti citosoliche funzionali come microRNA (miRNA) e mRNA e gioca un ruolo fondamentale nella regolazione cellulare comunicazione1,2. SVE vengono rilasciati nel loro ambiente da molti tipi differenti delle cellule, per esempio, cellule endoteliali, cellule immunitarie e le cellule del tumore e possono essere individuati nei fluidi corporei come sperma di siero, urina, latte materno, saliva o liquido cerebrospinale3, 4. numero crescente di studi evidenzia il contributo vario di EVs come potenziali biomarcatori per la diagnosi precoce di malattie diverse e/o previsione di malattia progressione5,6. Gli esosomi sono spesso descritti dalla presenza di molecole che sono specificamente associati, indipendentemente dal tipo di cella che derivino da7. Ad esempio, esosomi contenere diversi tetraspannine (CD9, CD63, CD81), major classe complesso maggiore di istocompatibilità ho (MHC io) molecole, varie proteine transmembrane, tipico proteine citosoliche (tubulina e actina), molecole coinvolte nel corpo multivesicular ( Biogenesi MVB) (TSG101 e alix), proteine da shock (HSP 70 e HSP 90) di calore, e proteine che partecipano a segnale di trasduzione (protein chinasi)8.
Molti metodi differenti sono state descritte per la caratterizzazione di EVs9. I metodi più comuni e diffusi, utilizzati per l'analisi di EV sono flusso cytometry10, microscopia elettronica (SEM), e trasmissione microscopia elettronica (TEM)11. Il metodo affermato e comunemente usato per la caratterizzazione biochimica di EV contenuto è Western blotting12,13. Mentre SEM e TEM consentono la rilevazione di EVs in tutto lo spettro di dimensione intera, l'identificazione molto limitata di specifiche proteine di superficie è una posizione di particolare svantaggio di questi metodi. Al contrario, citometria a flusso è un potente strumento per l'identificazione di specifici marcatori di superficie di EV, ma la soglia di questo metodo limita l'analisi allo SVE con una dimensione superiore a 500 nm. Quindi, analisi del SVE isolati con rilevazione di specifici marcatori di superficie non è al momento accessibile attraverso uno di questi tre metodi consolidati. Precedentemente abbiamo descritto un altro metodo altamente sensibile per la visualizzazione e l'analisi del SVE, nanoparticle tracking analysis (NTA)14. Brevemente, questo metodo combina due diversi principi fisici. In primo luogo, le particelle diffondono luce quando essi vengono irradiate con un fascio laser, e il secondo principio, noto come moto browniano, implica che la diffusione di diverse particelle in una sospensione liquida è inversamente proporzionale alle loro dimensioni. Lo strumento di analisi semi-automatizzato delle nanoparticelle desktop per campioni liquidi si compone della particella rilevamento analizzatore con un'analisi basata su software, dove vengono registrate le immagini digitali di luce diffusa da singole particelle. Le particelle e il movimento delle particelle vengono rilevati da un microscopio di scattering laser con una videocamera. Il raggio laser è orientato verticalmente, mentre l'asse ottico è orizzontale e focalizzata nel canale cella riempito con il campione. I dati forniti da appezzamenti di macchie sparse di luce e la loro velocità di movimento consentono la determinazione della distribuzione di numero e dimensione delle particelle totale. Dopo irradiazione con il laser, le particelle di disperdono la luce, che è registrata da una videocamera digitale tramite il microscopio14. L'avanzamento al nostro metodo ex è l'inserimento di un filtro di cut-off di passa-onda lunga (LWP) nm 500 tra il laser (lunghezza d'onda di 488 nm) e il canale di cella, che consente l'analisi diretta delle particelle fluorescenza-etichetta (Figura 1). Il nostro protocollo risolve la richiesta comune di molti ricercatori in questo campo per una caratterizzazione veloce del SVE singoli, ad esempio, secondo la loro origine parentale. In questo protocollo, descriviamo il flusso di lavoro completo per rapido isolamento dello SVE da sangue umano intero e veloce caratterizzazione di marcatori specifici di analisi di rilevamento delle nanoparticelle basata sulla fluorescenza. SVE possono essere rilevati mediante colorazione con PKH67, un linker generale della membrana cellulare, così come con exosomal specifici marcatori, per esempio, CD63, CD9 e il vimentin. Il nostro protocollo è anche adatto per EDTA e plasma citrato, così come altri fluidi corporei e surnatanti della cultura delle cellule.
Protocollo
Il Consiglio di etico istituzionale dell'Università di Düsseldorf ha approvato gli esperimenti presentati in questo lavoro (numero di riferimento: 3381).
1. EV isolamento da sangue umano intero
- Isolare gli EVs con soluzione di precipitazione di esosomi.
- Raccogliere 2 mL di sangue umano intero in siero-separazione tubi (SST) tramite prelievo venoso e incubare la provetta per 15 min a temperatura ambiente (TA) fino al termine della coagulazione.
- Centrifugare la SST a 1.700 x g per 10 min a RT per separare le cellule dal siero e trasferire 1 mL di siero in una provetta di reazione da 1,5 mL. Centrifugare il plasma ricco di piastrine (PRP) a 3.000 x g per 15 min a 4 ° C per rimuovere le piastrine e trasferire 100 μL del plasma della piastrina-poveri (PPP) a un nuovo tubo di reazione da 1,5 mL.
- Aggiungere 25 µ l di soluzione di precipitazione da esosomi (4 parti PPP, 1 parte da esosomi precipitazioni soluzione) e vortex accuratamente. Incubare il campione per 30 min in ghiaccio. Tenere il tubo in posizione verticale e non ruotare o mescolare il tubo durante il periodo di incubazione.
- Centrifugare il campione a 1.500 x g per 30 min a 4 ° C a pellet sve. Dopo centrifugazione, il server virtuale di Exchange vengono visualizzati come un pellet beige o bianco nella parte inferiore della nave. Aspirare il supernatante e centrifugare il campione a 1.500 x g per 5 min a 4 ° C.
- Rimuovere tutte le tracce di liquido e risospendere il pellet in 100 µ l di tampone fosfato salino (PBS) pipettando frequentemente su e giù. Conservare la sospensione di EV a-80 ° C quando l'analisi non viene eseguita immediatamente.
Nota: Quando isolando SVE da plasma, fibrinogeno e la fibrina può ostacolare recupero efficiente e risospensione è più pesante e richiede più tempo.
- Isolare gli EVs con ultracentrifugazione.
- Prendere il rotore pre-raffreddato (TLA-55 fisso-angolato) dal frigo e raffreddare l'ultracentrifuga prima dell'uso.
- Trasferire 1,25 mL di PPP (preparata al punto 1.1) in una provetta di ultracentrifugazione adatto da 1,5 mL con tappo e centrifugare il campione a 110.000 x g per 90 min a 4 ° C. Assicurarsi che il carico del rotore è bilanciato prima di iniziare.
- Decantare il supernatante e risospendere il pellet in 500 μL di PBS di posto tubo capovolto su un tovagliolo di carta per 2 min e centrifugare il campione a 110.000 x g per 90 min a 4 ° C.
- Aspirare il supernatante e risospendere il pellet in 50 µ l di PBS.
Nota: Utilizzare solo rotori e accessori progettati per l'ultracentrifuga che è in uso. Priori le provette nel rotore utilizzando acqua perché la forza dei tubi può variare tra i lotti.
2. colorazione dei campioni
- Macchia di campioni con PKH67.
- Preparare la soluzione colorante aggiungendo 1 μL della soluzione etanolica tintura PKH67 a 50 μL di diluente C (incluso nel kit) in una provetta di reazione da 1,5 mL e mescolare accuratamente.
- Trasferire 10 μL di soluzione colorante a 20 μL della sospensione EV (preparata al punto 1.1) al tubo di reazione, mescolare accuratamente e incubare per 5 min a RT nel buio.
- Diluire 50 μL della sospensione EV macchiata con 2,5 mL di acqua distillata in una provetta di reazione da 15 mL, mescolare accuratamente e utilizzare questa sospensione definitiva per la misurazione delle particelle.
Nota: È fondamentale usare acqua come diluente per la sospensione di EV, perché altri diluenti (ad es., PBS) possono alterare la misurazione. Quando si utilizzano stored EV-sospensione, scongelare i campioni su ghiaccio e mescolare accuratamente prima della colorazione.
- Macchia di campioni con anticorpi specifici.
- Diluire 10-20 μL della sospensione EV (preparata al punto 1.1) con 50 μL di acqua distillata in una provetta di reazione da 1,5 mL e mescolare accuratamente.
- Aggiungere 2,5-5 µ l di anticorpo specifico (tabella 1) al tubo di reazione, mescolare accuratamente e incubare per 30 min a temperatura ambiente al buio.
- Trasferire 50 μL della sospensione EV macchiata a 2,5-10 mL di acqua distillata (tabella 1) in una provetta di reazione da 15 mL, mescolare accuratamente e utilizzare questa sospensione definitiva per la misurazione delle particelle.
Nota: In alcune circostanze, la concentrazione dell'anticorpo usato deve essere regolato (tabella 1).
3. il trattamento dei campioni
Nota: I fondamenti di questo metodo sono stati ampiamente descritto in precedenza e sotto il protocollo si concentra sui passaggi specifici necessari per l'analisi di fluorescenza-labeled EVs14.
- Eseguire la procedura di avvio.
- Inserire il filtro di fluorescenza il percorso ottico del microscopio e della fotocamera. Avviare il programma e seguire le istruzioni sullo schermo per implementazione automatizzata.
- Selezionare il numero di cella corretto (Z158_C1149_Fluor) nella scheda "Verifica di cella" (definizione di cella) per la misura della fluorescenza. Selezionare la posizione di riferimento per l'ottica per assicurarsi che il laser e microscopio sono a un fuoco comune (laser e microscopio spostare automaticamente in questa posizione).
- Scarico per la cella con una siringa riempita con 10 mL di acqua distillata. Assicurarsi che la cella di misura è privo di bolle d'aria e non iniettare bolle d'aria nel sistema.
- Preparare una sospensione di calibrazione contenente 200 nm dimensioni fluorescenza-etichettati polistirolo particelle uniformi che hanno gruppi carbossilato sulla loro superficie. Diluire 10 μL delle particelle con 990 μL di acqua distillata. Diluire 10 µ l di questa soluzione di particelle in una provetta da 15 mL con 10 mL di acqua distillata per ottenere la concentrazione necessaria.
- Iniettare 2,5 mL della soluzione diluita della particella nel canale della cella e fare clic su "Ottimizzare la messa a fuoco" per regolare la fotocamera.
- Misurare il campione.
- Lavare il canale di cella più volte con una siringa riempita con 10 mL di acqua distillata prima di ogni misurazione del campione. Iniettare la sospensione EV macchiata (preparata al punto 2) il canale di cella.
- Regolare i seguenti parametri di fotocamera principale nella scheda "Cella verifica" nel software come necessario (tabella 2). Utilizzare la posizione di riferimento o 0.41193 per regolare i parametri di posizione.
- Per sensibilità, trovare la gamma di sensibilità ottimale facendo clic sul pulsante "Numero di particelle vs sensibilità" per visualizzare una curva di particelle misurate per schermo per livelli di sensibilità diverse.
Nota: - Per l'otturatore, regolare il periodo di tempo in cui la fotocamera permette alla luce di passare per un determinato intervallo.
- Per i parametri di post-acquisizione, scegliere una luminosità minima di 20, una dimensione minima di 20 nm e una dimensione massima di 500 nm per la misurazione.
- Per sensibilità, trovare la gamma di sensibilità ottimale facendo clic sul pulsante "Numero di particelle vs sensibilità" per visualizzare una curva di particelle misurate per schermo per livelli di sensibilità diverse.
- Nota il numero di particelle rilevate contati nel campo di visibilità dal display. Il bar di dispersione deve essere nel verde a fascia arancia (particelle di 50-300). Se la barra di scattering è rossa, la dispersione fonderanno singole particelle ed essi vengono conteggiati come una singola particella, così conducendo a risultati falsi. In tal caso, ulteriormente diluire il campione per evitare la sovrapposizione delle particelle o abbassare la sensibilità.
- Fare clic su "Check deriva delle particelle a 0 V" nella scheda "Cella verifica" prima di iniziare la misurazione. Se la deriva è superiore a 5 μm/s, attendere fino a quando il campione viene interrotto il flusso per continuare la misurazione.
Nota: Se la deriva è troppo alta all'inizio della misurazione, le misurazioni ripetute possono differire e sofisticato i risultati. A causa dei principi sottostanti di NTA, una deriva pertinente può avere ripercussioni nella dimensione determinata particella, come calcolato dal software. - Fare clic su "Eseguire l'acquisizione dei Video" nella scheda "Misura" selezionare il numero di esperimenti (3-5) e il tempo di ritardo tra di loro (0 min).
- Definire il numero di posizioni (singoli sottovolume-) (11) e il numero di cicli (misura) (10) in ogni posizione di misura, dove dovrebbero essere analizzate particelle
- Selezionare una cartella, creare un nuovo nome file e fare clic su "OK" per avviare la misurazione.
4. interpretazione dei risultati
- Mostra i risultati e i parametri nella scheda "Analisi" dopo la misurazione. Controllare i seguenti parametri dopo l'analisi prima di pulire il canale di cella: numero medio di particelle per posizione, numero totale di particelle tracciate e concentrazione di particelle, la larghezza di distribuzione delle particelle (valori x10, x50 e x90), valore di media e deviazione standard. Se necessario, ripetere la misurazione del campione.
Nota: I risultati vengono anche salvati come file. pdf o. txt. - Fare clic sulla scheda "Analisi" per visualizzare il grafico calcolato dopo la misurazione, che mostra la distribuzione delle particelle rilevate dalla dimensione. Fare clic su "Visualizzazione" nella scheda "Analisi" e utilizzare le icone per regolare e cambiare le impostazioni del grafico per esigenze particolari.
5. convalida via EV rilevamento mediante Western Blotting
- Dissolva la pallina di EV (preparata nel passaggio 1) nel buffer di lisi ed estrazione di RIPA, pipettare accuratamente e incubare in ghiaccio per 30 min. Centrifugare il campione a 8.000 x g per 10 min a 4 ° C per chiarire il lisato e trasferire il surnatante in una nuova provetta.
- Misurare la proteina totale di un kit di dosaggio della proteina di Lowry. Diluire 1 μL della sospensione EV isolata con 49 μL di tampone di RIPA e utilizzare 5 μL in triplici copie per l'analisi. Diluire la sospensione di EV con 2 tampone di caricamento x Laemmli ad una concentrazione finale di 2 µ g / µ l e calore per 10 minuti a 95 ° C.
- Carico 20 µ g di proteina per pozzetto. Separare e trasferire le proteine dal gel di poliacrilammide e serbatoio macchiare secondo protocolli standard.
- Bloccare la membrana (0,2 μm polivinilidene difluoruro) con polvere di latte bovina (5%) per 1 h a RT e incubare la membrana con specifici anticorpi primari (CD9, CD63 e il vimentin) durante la notte a 4 ° C.
Nota: Gli anticorpi primari sono usati ad una diluizione di 1:1,000. - Lavare la membrana con TBST 3 x 5 min e incubare la membrana con perossidasi di rafano (HRP)-anticorpo secondario coniugato (01:20, 000 in TBST) per 60 minuti a TA.
- Lavare la membrana con TBST 3 x 5 min e rilevare le proteine da chemiluminescenza con una soluzione di substrato ad alta sensibilità su un sistema di imaging.
Nota: Perché CD63 antigene è ampiamente e variamente glicosilato, il peso molecolare può variare, e bande possono apparire tra 40-65 kDa.
Risultati
SVE sono sono isolati da sangue intero e caratterizzate da nanoparticle tracking analysis con reagenti fluorescenti. La sensibilità ottima per la misurazione delle particelle senza macchiate è stata identificata alla gamma al 70% durante i nostri esperimenti. Le perline fluorescenti utilizzate per la regolazione e la calibrazione della misura ha mostrato un'impostazione ottimale a una sensibilità dell'85% (Figura 2A). Tra una sensibilità del 70% e 90%, il numero di particelle rilevate aumentato rapidamente, mentre aumentando ulteriormente la sensibilità può portare a un deterioramento della distribuzione di dimensione delle particelle, dove il numero di particelle è ri-cadere. Le impostazioni della telecamera visualizzata un'immagine tagliente (Figura 2B) e ripetono misurazioni ha mostrati bassa deviazione standard (Figura 2). Nella misura in cui, il protocollo per il trattamento dei campioni di EVs è stato regolato in modo che tutte le misurazioni potrebbero essere condotte con le stesse impostazioni (tabella 2). La larghezza di distribuzione è definita da tre valori sull'asse x, il x10, x50 e x90. La x50, o granulometria mediano è il diametro in cui metà della popolazione si trova sotto questo valore. Allo stesso modo, il x10 e x90 indicano il diametro al quale 10% e il 90% delle particelle rilevate sono sotto la dimensione segnalata. La macchiatura con kit del linker PKH67 delle cellule, tra cui un linker di cellule fluorescenti che incorpora un colorante fluorescente verde con code lunghe alifatici in regioni del lipido della membrana cellulare, ha dimostrato una forte correlazione tra la sensibilità e il numero di particelle misurate (Figura 3A). PKH67 è spesso utilizzato per il monitoraggio di proliferazione, ma ha anche dimostrato utile per monitorare l'assorbimento esosomi o liposoma pure per quanto riguarda in vivo delle cellule traffico. Dovuto il contrassegno non specifico di PKH67, un'ampia varietà di SVE può essere etichettata e rilevata. La distribuzione delle particelle è oscillato tra 266 nm (x10) e 1946 nm (x90) con un picco massimo a 857 nm (x50) e con una bassa deviazione standard tra le misurazioni (28,1 nm). LAMPADA-1, noto anche come glicoproteina di membrana lysosome-collegata 1 e CD107a risiedono principalmente attraverso le membrane lisosomiali. Dopo colorazione con un Alexa Fluor 488 etichettati anticorpo specifico contro lampada-1, la distribuzione delle particelle vanno da 220 nm (x10) a 1145 nm (x90) con un picco massimo a 541 nm (x50) e una deviazione standard di 11,7 nm (Figura 3B). Per la caratterizzazione del SVE, abbiamo utilizzato Alexa Fluor 488 etichettato anticorpi contro gli indicatori comuni di exosomal e ha confermato i nostri risultati mediante Western blotting. Dopo colorazione con CD9-anticorpo marcato con Alexa Fluor 488, la distribuzione delle particelle vanno da 251 nm (x10) a 1139 nm (x90) con un picco massimo a 548 nm e un secondo picco minore circa 25 nm (Figura 4A). Colorazione con Alexa Fluor 488 etichettato CD63 (Figura 4B) e il vimentin (Figura 4) ha dato risultati simili. Analisi macchiante occidentale hanno convalidato il nostro risultato positivo per gli anticorpi usati qui. Misurazioni ripetute hanno mostrato risultati riproducibili per tutti gli anticorpi utilizzati nella presente relazione. Come controlli, abbiamo macchiato di acqua priva di vescicola con rispettivi anticorpi (Figura 5A), dove gli anticorpi PKH67 e LAMP1 non rilevati praticamente EV fino a una sensibilità vicina al 100%. Utilizzando l'esempio di vimentina, alta sensibilità aumentato il numero di manufatti emergenti, anche quando il campione è essenzialmente priva di particelle. Se la misurazione viene avviato quando la deriva è ancora troppo alto (> 5 µm/s), le ripetizioni individuali si discostano nettamente tra di loro (figura 5B). Come rappresentato con tre diversi anticorpi, è fondamentale che la deriva è minima come possibile prima di iniziare la misurazione. Secondo la nostra esperienza, utilizzando isotiocianato di fluorescina (FITC) come fluorocromo comporta misure che non sono accurati e riproducibili perché FITC è soggetta a rapida foto candeggio (Figura 5). Pertanto, si consiglia di utilizzare esclusivamente Alexa Fluor 488 etichettato anticorpi per la caratterizzazione di EV. In questo protocollo, EVs sono stati isolati da una soluzione di precipitazione a base di polimeri da esosomi contenente glicole polietilenico. Per garantire che i nostri risultati non sono falsificati dal metodo applicato isolamento, abbiamo caratterizzato EVs dopo l'isolamento con ultracentrifugazione. Come rappresentato con PKH67 e due anticorpi differenti (CD63 e lampada-1), i risultati del nostro isolamento applicato con soluzione di esosomi precipitazione (Figura 6A) sono paragonabili con EVs isolato tramite ultracentrifugazione (Figura 6B ). Purtroppo, a causa del rendimento scadente di EVs dopo ultracentrifugazione, il set iniziale di siero per l'isolamento deve essere nettamente superiore rispetto al isolamento con soluzione di precipitazione di esosomi.
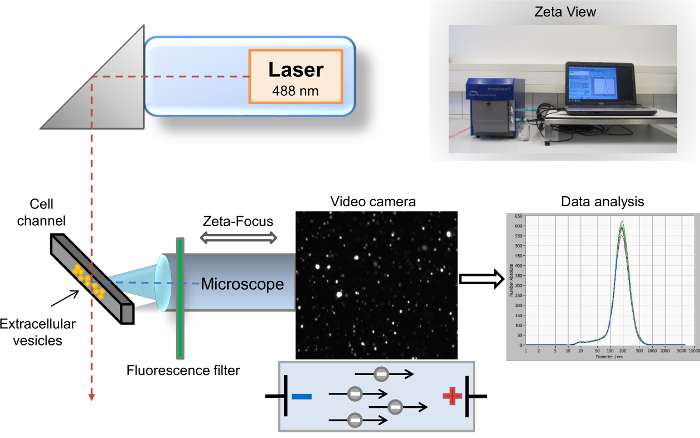
Figura 1: Configurazione schematica di nanoparticle tracking analysis. Il fascio di laser e asse del microscopio/video sono orientati ortogonalmente a vicenda, attraversato dalla cella canale sezione trasversale. Un filtro di fluorescenza è posta tra il canale di cella e il microscopio. Luce diffusa dalle particelle viene visualizzato nella finestra di "live-view" del software. Dopo l'acquisizione, i risultati vengono visualizzati come un sistema di coordinate dimensioni curva di distribuzione. Clicca qui per visualizzare una versione più grande di questa figura.
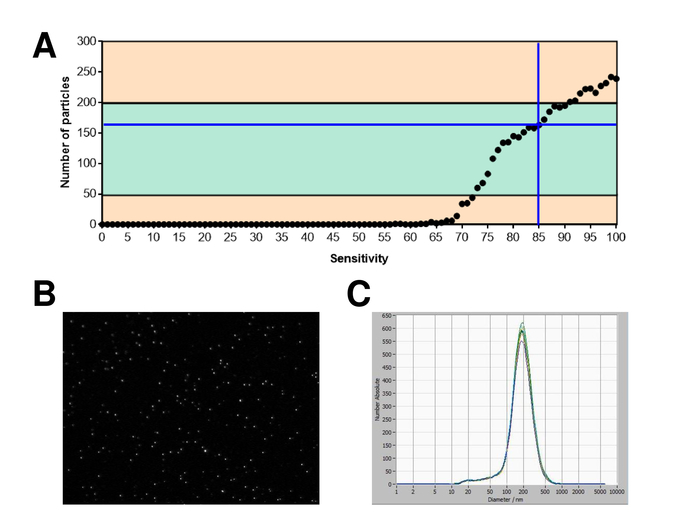
Figura 2: calibrazione con fluorescenza etichettato perline. (A) il numero di particelle vs sensibilità curve Visualizza le particelle in una posizione ad un certo punto nel tempo durante un'analisi di sensibilità automatica. (B) visualizzazione di particelle dal vivo sullo schermo. (C) granulometria distribuzione dopo misurazioni ripetute. Clicca qui per visualizzare una versione più grande di questa figura.
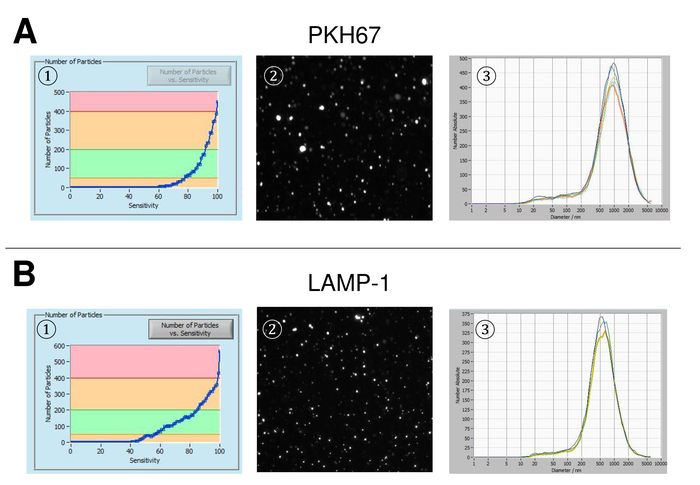
Figura 3: rappresentante risultati dopo colorazione con PKH67 e lampada-1. Numero di particelle vs curva di sensibilità (1), visualizzazione di particelle sulla distribuzione delle dimensioni dello schermo (2) e la particella vista dal vivo (3) dopo colorazione con PKH67 (A) e lampada-1 (B). Una simile distribuzione di dimensione delle particelle è osservata, mentre cambiamenti nella sensibilità impostazione piombo ad un cambiamento simile, ma ancora non del tutto identico di particelle rilevate. Clicca qui per visualizzare una versione più grande di questa figura.
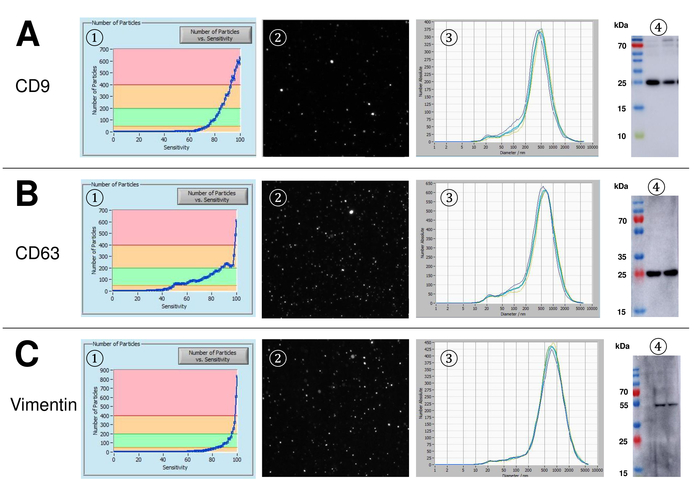
Figura 4: rappresentante risultati dopo colorazione con Alexa Fluor 488 etichettato CD9, CD63 e il vimentin. Numero di particelle vs curva di sensibilità (1), visualizzazione di particelle sul schermo live view (2), distribuzione di dimensione delle particelle (3) e le macchie occidentali rappresentative di due diverse sospensioni di EV (4) per CD9 (24-27 kDa, A), CD63 (26 kDa, B) e il vimentin (54 kDa, C). Avvenimento ritardato di particella segnali lungo la crescente sensibilità (asse x) correla con bassa intensità di segnale nel Western blot analisi, confermando l'importo inferiore tra il marcatore di superficie rispettiva particella (ad esempio, il vimentin vs CD63). Notare le curve quasi identiche di misurazioni rappresentative per tutti gli indicatori analizzati, che indica un'elevata riproducibilità (3). Clicca qui per visualizzare una versione più grande di questa figura.
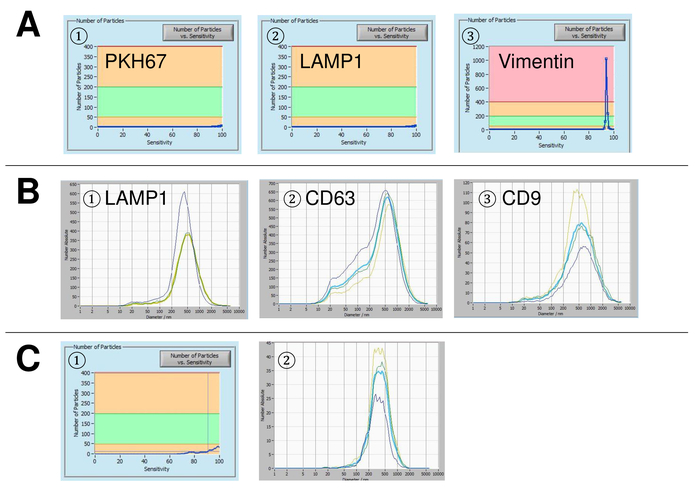
Figura 5: rappresentante risultati per controlli utilizzati e possibili fonti di errore. (A) privo di vescicola acqua macchiato con PKH67 (1), lampada-1 (2) e il vimentin (3) come controlli. Distribuzioni di dimensione delle particelle rappresentative (B) dopo colorazione con lampada-1 (1), CD63 (2) e CD9 (3), e le misure realizzate quando sospensione drift è ancora troppo alto. (C) numero di particelle vs curva di sensibilità (1) e la distribuzione di dimensione delle particelle (2) dopo la colorazione con l'anticorpo marcato con FITC CD63. Un chiaro effetto sbiancante è osservato dopo ogni misurazione, conseguente progressivamente più bassi numeri di particelle. Clicca qui per visualizzare una versione più grande di questa figura.
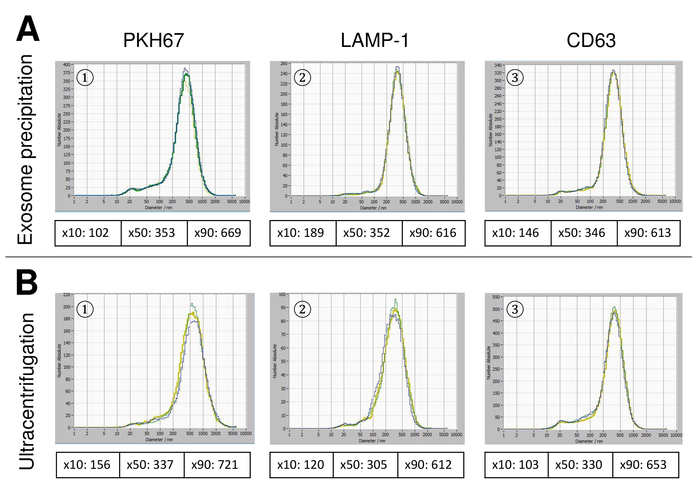
Figura 6: confronto dei metodi di isolamento diverso per SVE. Distribuzione granulometrica del SVE isolato con esosomi precipitazioni soluzione (A) e (B) ultracentrifugazione dopo colorazione con PKH67 (1), lampada-1 (2) e CD63 (3). Clicca qui per visualizzare una versione più grande di questa figura.
| LAMPADA-1 | CD9 | CD63 | Vimentin | |
| Anticorpo (µ l) | 5 | 2.5-5 | 2.5-5 | 5 |
| Sospensione di EV (µ l) | 10 | 20 | 10 | 10 |
| H2O (µ l) per la colorazione | 50 | 50 | 50 | 50 |
| Volume finale (mL) | 5-10 | 2.5-5 | 5 | 10 |
Tabella 1: Elenco degli anticorpi usati e gamma di diluizione di campioni.
| Parametri di acquisizione | |
| Sensibilità (%) | 85 |
| Dell'otturatore | 70 |
| Luminosità min. | 20 |
| Max. Dimensioni (nm) | 500 |
| Dimensione minima (nm) | 20 |
| Polarità | Negativo |
| Tensione | Fuori |
| Deriva delle particelle a 0 V (µm/s) | < 5 |
| Posizioni | 11 |
| Cicli | 10 |
| Acquisizioni multiple | 3-5 |
| Tempo di ritardo (min) | 0 |
Tabella 2: Parametri di acquisizione per nanoparticle tracking analysis.
Discussione
Dimostriamo un protocollo dettagliato per l'isolamento del SVE da sangue intero e veloce caratterizzazione di specifici marcatori di superficie con nanoparticelle di fluorescenza-basata analisi di rilevamento. Negli esperimenti condotti, abbiamo usato esclusivamente EVs isolati da campioni di siero, ma questo metodo è adatto anche per acido etilendiamminotetraacetico (EDTA) e plasma citrato e può anche essere esteso ad altri fluidi corporei quali urina, latte materno, saliva, liquido cerebrospinale e lo sperma. Inoltre, questo protocollo può essere regolato per la caratterizzazione del SVE da surnatanti di coltura cellulare. In questo protocollo, la sospensione di EV è stata generata da 100 μL di siero da esosomi un reagente precipitazione, che contiene un polimero proprietario che precipita delicatamente esosomi ed EVs secondo una dimensione corpuscolare che vanno da 30 nm ai 200 nm, per cui 10-20 μL dello SVE sono stati nominati per la caratterizzazione di ogni superficie dell'indicatore. Purtroppo, il passo di isolamento è inevitabile, perché l'elevata quantità di proteine in campioni di siero (per esempio, albumina e globulina) interferisce con l'anticorpo procedura di colorazione e si traduce in alto livello di sfondo e risultati sofisticati. Inoltre, basato sulla disponibilità biologica di esosomi nei campioni, la quantità di sospensione EV autonomo come pure la diluizione prima dell'elaborazione deve essere regolato per altri materiali di origine. Per confrontare campioni multipli, è necessario un approccio standardizzato per la diluizione dei campioni, nonché i parametri di acquisizione coerente (sensibilità, otturatore, ecc.). Un altro punto importante è che le misurazioni non vengono avviate fino a quando la deriva è bassa (nelle nostre mani, < 5 μm/s). Se la deriva era troppo alta, misurazioni ripetute del campione ha reso alta deviazione standard tra di loro, ma con una bassa deriva, i dati risultanti sono stati altamente coerenti e ha confermato un elevato livello di riproducibilità. È importante che gli anticorpi selezionati hanno un fluorocromo appropriato. Gli anticorpi devono coniugarsi con Alexa Fluor 488, perché FITC ha un alto tasso di foto-sbiancamento. Possibilmente più stabile fluophores porterà certamente a dosaggio maggiore stabilità in futuro. Generalmente, molti ricercatori usano PBS come un diluente per EVs. Per questo protocollo, è fondamentale utilizzare acqua distillata come diluente per le sospensioni di EV. Quando SVE sono etichettati con coloranti fluorescenti, l'alta osmolalità e concentrazione di ioni di altri diluenti, come PBS, può interferire con la misurazione e alterati portano a risultati.
Mentre metodi di analisi di SVE sono state notevolmente migliorate nell'ultimo decennio, non esiste ancora un metodo standardizzato per isolamento e caratterizzazione di EVs. Il principale svantaggio di citometria a flusso, dove SVE sono spesso associati a perline per fornire una superficie più grande, è che molti sve ancorare sulla superficie per fornire un segnale forte e rilevabile10. SEM e TEM hanno lo svantaggio che la preparazione dei campioni è che richiede tempo e SVE si possono distinguere solo dalla loro dimensione e morfologia11. Fino a oggi, il metodo affermato e comunemente usato per qualitativa (cioè, biochimici) caratterizzazione di EV è Western blotting, dove le proteine possono essere analizzate con anticorpi specifici12,13. Tuttavia, gli svantaggi di tutti questi metodi si trovano nell'impossibilità di analizzare singoli EVs per specifici marcatori di superficie. Inoltre, i lunghi tempi di elaborazione e le procedure di lavaggio/isolamento lungo utilizzate da molti dei protocolli attuali comportano passaggi laboriosi, che li rende non adatti per campione alto throughput e caratterizzazione della singola EVs. Il nostro protocollo fornisce un flusso di lavoro completo per rapido isolamento e caratterizzazione del singoli SVE con specifici marcatori di superficie quali CD63, CD9, il vimentin e CD107a e può essere espansa per un ampio spettro di altri marcatori di superficie per determinare l'origine di rilasciato EVs. A causa di un avanzamento tecnico permanente del dispositivo NTA, abbiamo confermato i nostri risultati in collaborazione con il produttore con l'analizzatore più recente. Qualunque sia il futuro progresso della ricerca sulla biologia di EV, soprattutto per quanto riguarda gli esosomi, il protocollo che qui viene presentato fornirà un metodo rapido e affidabile per la caratterizzazione del singoli SVE con marcatori specifici. Perché l'aggregazione del SVE durante l'isolamento e la procedura di colorazione finora è inevitabile, la ricerca futura dovrebbe concentrarsi sullo sviluppo di metodi per impedire l'aggregazione EV e permettere una determinazione precisa dimensione della fluorescente-labeled EVs.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano particella Metrix GmbH per coprire parzialmente le spese di pubblicazione di questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| Serum-separation tube | BD | 366882 | BD Vacutainer |
| Ampuwa water | Fresenius Kabi | 10060 | |
| Dulbecco's phosphate-buffered saline | Sigma | 56064C | |
| Falcon tube, 15 mL | Greiner Bio One | 188271 | |
| Falcon tube, 50 mL | Greiner Bio One | 227270 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 30120086 | Speciality tubes for ultra centrifugation |
| Tube with Snap-On Cap 1.5 mL | Beckman Coulter | 357448 | |
| Polybeads Microspheres 0.2 µm | Polysciences, Inc. | 7304 | Alignment Solution |
| Fluoresbrite YG Carboxylate Microspheres beads 0.2 µm | Polysciences, Inc. | 09834-10 | Alignment Solution |
| Syringe, 2 mL | Braun | 4606027V | |
| Syringe, 10 mL | Braun | 4606728V | |
| Exoquick | SBI | EXOQ20A-1 | EV precipitation solution |
| Laemmli Sample Buffer (2x) | BioRad | 1610737 | |
| DC Protein Assay Kit II | BioRad | 5000112 | Lowry prtein assay |
| PKH67 Green Fluorescent Cell Linker Kit | Sigma | PKH67GL-1KT | For general membrane labelling |
| Alexa Fluor 488 anti-human CD107a Antibody | BioLegend | 328609 | Lysosomal-associated membrane protein-1 (LAMP-1) |
| Human CD9-Alexa Fluor 488 | R&D Systems | FAB1880G | |
| Anti-CD9 Antibody | SBI | EXOAB-CD9A-1 | |
| CD63-Alexa Fluor 488 | ThermoFisher | MA5-18149 | |
| FITC anti-human CD63 Antibody | BioLegend | 353005 | |
| CD63. Antibody, polyclonal | SantaCruz | Sc-15363 | |
| Alexa Fluor 488 anti-vimentin Antibody | BioLegend | 677809 | |
| Anti-Vimentin Antibody | SBI | EXOAB-VMTN-1 | |
| Goat anti mouse IgG + IgM | Jackson Immuno | 315-035-048 | |
| Goat anti rabbit IgG | Dianova | 111-035-003 | |
| SuperSignal West Femto Maximum Sensitivity Substrate | ThermoFisher | 34094 | |
| ZetaView | Particle Metrix | PMX 100, Type | |
| Centrifuge | Eppendorf | 5804R | |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | |
| Chemiluminescence Imager | GE Healthcare | Amersham Imager 600 |
Riferimenti
- Ibrahim, A., Marban, E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology. Annual Review of Physiology. 78, 67-83 (2016).
- Su, S. A., et al. Emerging role of exosome-mediated intercellular communication in vascular remodeling. Oncotarget. 8 (15), 25700-25712 (2017).
- Lasser, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9, 9 (2011).
- Li, M., et al. Analysis of the RNA content of the exosomes derived from blood serum and urine and its potential as biomarkers. Philosophical Transactions of The Royal Society B Biological Sciences. 369 (1652), (2014).
- Lin, J., et al. Exosomes: novel biomarkers for clinical diagnosis. The Scientific World Journal. 2015, 657086 (2015).
- Properzi, F., Logozzi, M., Fais, S. Exosomes: the future of biomarkers in medicine. Biomarkers in Medicine. 7 (5), 769-778 (2013).
- Thery, C., Zitvogel, L., Amigorena, S. Exosomes: composition, biogenesis and function. Nature Reviews Immunology. 2 (8), 569-579 (2002).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203 (2015).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , (2006).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. (97), (2015).
- Wu, Y., Deng, W., Klinke, D. J. Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. Analyst. 140 (19), 6631-6642 (2015).
- Bianco, N. R., Kim, S. H., Morelli, A. E., Robbins, P. D. Modulation of the immune response using dendritic cell-derived exosomes. Methods in Molecular Biology. 380, 443-455 (2007).
- Conde-Vancells, J., et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes. Journal of Proteome Research. 7 (12), 5157-5166 (2008).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments. (95), 50974 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon