Method Article
Caractérisation de basés sur la Fluorescence rapide unique vésicules extracellulaire dans le sang humain avec analyse de suivi des nanoparticules
Dans cet article
Résumé
Dans ce protocole, nous décrivons le flux de travail complet pour isolation rapide des vésicules extracellulaires du sang humain et de la caractérisation des marqueurs spécifiques par analyse de suivi des nanoparticules axée sur la fluorescence. Les résultats présentés montrent une reproductibilité élevée et peuvent être ajustées pour les surnageants de culture cellulaire.
Résumé
Les vésicules extracellulaires (EVs), y compris les exosomes, sont spécialisées vésicules taille nanométrique membraneuses dans les fluides corporels sont constitutivement libérés de nombreux types de cellules qui jouent un rôle essentiel dans la régulation des communication de cellule-cellule et un large éventail de processus biologiques. Différentes méthodes de caractérisation des EVs ont été décrits. Cependant, la plupart de ces méthodes ont l’inconvénient que la préparation et la caractérisation des échantillons sont très coûteuses en temps, ou il est extrêmement difficile d’analyser des marqueurs spécifiques d’intérêt en raison de leur petite taille et en raison du manque de discrets populations. Alors que les méthodes d’analyse des EVs ont été considérablement améliorées ces dix dernières années, il n’y a encore aucune méthode normalisée pour la caractérisation de l’unique EVs. Ici, nous démontrons une méthode semi-automatique pour la caractérisation des EVs unique par analyse de suivi des nanoparticules axée sur la fluorescence. Le protocole présenté aborde le problème commun de nombreux chercheurs dans ce domaine et fournit le flux de travail complet pour isolation rapide des EVs et caractérisation avec PKH67, un linker de la membrane de la cellule générales, ainsi qu’avec des marqueurs de surface tels CD63, CD9, vimentine et protéine de la membrane lysosomale associés à 1 (lampe-1). Les résultats présentés montrent un haut niveau de reproductibilité, tel que confirmé par d’autres méthodes, telles que Western Blot. Dans les expériences menées, nous avons utilisé exclusivement EVs isolées d’échantillons de sérum humain, mais cette méthode est également adaptée pour le plasma ou d’autres liquides organiques et peut être ajustée pour la caractérisation des EVs de surnageants de culture de cellules. Quel que soit l’évolution future de la recherche sur la biologie de l’EV, le protocole qui est présenté ici fournit une méthode rapide et fiable pour la caractérisation rapide des EVs unique avec des marqueurs spécifiques.
Introduction
Les vésicules extracellulaires (EVs), y compris les exosomes, sont spécialisées vésicules de taille nanométrique membraneux (20-150 nm) contenant certaines combinaisons de lipides, adhérence et molécules de signalisation intercellulaires, ainsi que d’autres composants fonctionnels cytosoliques comme microARN (miARN) et ARNm et jouer un rôle essentiel dans la régulation de cellule-cellule communication1,2. SVE est libérés dans leur environnement de nombreux différents types de cellules, par exemple, les cellules endothéliales, les cellules immunitaires et les cellules tumorales et peut être détectées dans les liquides organiques comme le sperme de sérum, urine, le lait maternel, salive ou le liquide céphalorachidien3, 4. nombre croissant d’études en évidence la contribution diversifiée des véhicules électriques comme biomarqueurs potentiels pour un diagnostic précoce de plusieurs maladies et/ou de prédiction de la progression de la maladie5,6. Exosomes sont souvent décrits par la présence de molécules qu’elles sont spécifiquement associées, quel que soit le type de cellule, qu'ils dérivent de7. Par exemple, les exosomes contiennent différents tetraspanins (CD9, CD63, CD81), grandes classe complexe d’histocompatibilité j’ai (MHC I) molécules, diverses protéines transmembranaires, protéines cytosoliques typique (tubuline et l’actine), des molécules impliquées dans les corps multivésiculaires ( Biogenèse MVB) (TSG101 et alix), chauffer des protéines de choc (HSP 70 et HSP 90), et les protéines qui participent au signalent transduction (protéines kinases)8.
Différentes méthodes ont été décrites pour la caractérisation des EVs9. Les méthodes plus courantes et les plus répandues pour l’analyse de l’EV sont écoulement cytometry10, microscopie à balayage électronique (SEM) et transmission electron microscopy (TEM)11. La méthode première et couramment utilisée pour la caractérisation biochimique de la teneur en EV est Western blotting12,13. Tandis que les SEM et TEM permettent la détection des véhicules électriques dans tout l’éventail de toute taille, l’identification très limitée des protéines de surface spécifiques est un désavantage particulier de ces méthodes. En revanche, cytométrie en flux est un outil puissant pour l’identification de marqueurs de surface spécifiques EV, mais le seuil de cette méthode limite l’analyse au SVE, d’une taille supérieure à 500 nm. Par conséquent, analyse des véhicules électriques isolés avec la détection de marqueurs de surface spécifiques n’est actuellement pas accessible par le biais de ces trois méthodes bien établies. Nous avons décrit précédemment une autre méthode très sensible pour la visualisation et l’analyse du SVE, suivi des nanoparticules analyse (NTA)14. En bref, cette méthode combine deux principes physiques différents. Tout d’abord, particules éparpiller lumière lorsqu’ils sont irradiés par un faisceau laser, et le second principe, appelé mouvement brownien, implique que la diffusion de différentes particules dans une suspension liquide est inversement proportionnelle à leur taille. L’instrument d’analyse semi-automatique nanoparticule bureau pour les échantillons liquides se compose de la particule suivi analyseur avec une analyse informatisée, où sont enregistrées les images numériques de la lumière diffusée de particules unique. Les particules et le mouvement des particules sont détectés par un microscope laser de diffusion avec une caméra vidéo. Le faisceau laser est orienté verticalement, tandis que l’axe optique est horizontal et ciblée dans le canal de cellule rempli avec l’échantillon. Les données fournies par les parcelles de lumière des taches éparses et leur vitesse de déplacement permettent la détermination de la distribution de comte et de la taille des particules totales. Après irradiation par le laser, les particules diffusent la lumière, qui est enregistré par une caméra vidéo numérique via le microscope14. L’avancement de notre première méthode est l’insertion d’un filtre de coupure longue vague-pass (LWP) à 500 nm entre le laser (longueur d’onde de 488 nm) et le canal de la cellule, qui permet l’analyse directe des particules marqués par fluorescence (Figure 1). Notre protocole traite la demande commune de nombreux chercheurs dans ce domaine pour une caractérisation rapide des EVs unique, par exemple, selon leur origine parentale. Dans ce protocole, nous décrivons le flux de travail complet pour isolation rapide des véhicules électriques du sang humain et de la caractérisation rapide des marqueurs spécifiques par analyse de nanoparticules de suivi axée sur la fluorescence. Serveur virtuel Exchange peut être détectée par coloration avec PKH67, un linker de la membrane de la cellule générales, ainsi qu’avec des marqueurs spécifiques d’exosomal, par exemple, CD63, CD9 et vimentine. Notre protocole est également adapté aux EDTA et plasma citraté, ainsi qu’autres fluides corporels et les surnageants de culture de cellules.
Protocole
Le Conseil d’éthique institutionnel de l’Université de Düsseldorf a approuvé les expériences présentées dans ce travail (numéro de référence : 3381).
1. EV isolement de sang total humain
- Isoler les EVs avec solution de précipitation exosome.
- Recueillir 2 mL de sang total humain en séparant les sérum tubes (SST) par ponction veineuse et incuber le tube pendant 15 min à température ambiante (RT) jusqu'à ce que la coagulation est terminée.
- Centrifuger le SST à 1 700 x g pendant 10 min à RT pour séparer les cellules de sérum et de transférer 1 mL de sérum dans un tube de réaction de 1,5 mL. Centrifuger le plasma riche en plaquettes (PRP) à 3 000 x g pendant 15 min à 4 ° C pour enlever les plaquettes et transférer 100 μl du plasma pauvre en plaquettes (PPP) dans un nouveau tube de réaction de 1,5 mL.
- Ajouter 25 µL de solution de précipitation exosome (4 parties PPP, solution de 1 partie exosome précipitations) et vortex soigneusement. Incuber l’échantillon pendant 30 minutes sur la glace. Gardez le tube à la verticale et ne pas tourner ou mélanger le tube au cours de la période d’incubation.
- Centrifuger l’échantillon à 1 500 x g pendant 30 min à 4 ° C à l’EVs de granule. Après centrifugation, le serveur virtuel Exchange apparaître comme une boulette de beige ou blanche au fond du bateau. Aspirer le surnageant et centrifuger l’échantillon à 1 500 x g pendant 5 min à 4 ° C.
- Éliminer toute trace de liquide et resuspendre le culot dans 100 µL d’une solution saline tamponnée au phosphate (PBS) en pipettant également fréquemment haut et en bas. Stocker la suspension EV à-80 ° C lorsque l’analyse n’est pas exécutée immédiatement.
Remarque : Lorsque l’isoler l’EVs de plasma, fibrinogène et fibrine peuvent gêner la récupération efficace et remise en suspension est plus lourd et prend plus de temps.
- Isoler les EVs avec ultracentrifugation.
- Prendre le rotor refroidi (TLA-55 fixe angle) du réfrigérateur et refroidissement de l’ultracentrifugeuse avant utilisation.
- Transférer 1,25 mL de PPP (préparé à l’étape 1.1) dans un tube d’ultracentrifugation adapté de 1,5 mL avec bouchon et centrifuger l’échantillon à 110 000 x g pendant 90 min à 4 ° C. Assurez-vous que la charge du rotor est équilibrée avant de commencer.
- Éliminer le surnageant et lieu tube à l’envers sur une serviette en papier pour 2 min. resuspendre le culot dans 500 μl de PBS et centrifuger l’échantillon à 110 000 x g pendant 90 min à 4 ° C.
- Aspirer le surnageant et resuspendre le culot dans 50 μl de PBS.
Remarque : Utilisez uniquement des rotors et des accessoires conçus pour l’ultracentrifugeuse qui est en cours d’utilisation. Pretest les tubes dans le rotor à l’aide de l’eau parce que la résistance des tubes peut varier entre les lots.
2. coloration des échantillons
- Tacher les échantillons avec PKH67.
- Préparer la solution colorante en ajoutant 50 μL de diluant C (inclus dans le kit) 1 μL de la solution éthanolique de colorant de PKH67 dans un tube de réaction de 1,5 mL et mélanger soigneusement.
- Transférer 10 μL de la solution colorante à 20 μL de la suspension de EV (préparée à l’étape 1.1) dans le tube de réaction, bien mélanger et incuber pendant 5 min à la RT dans l’obscurité.
- Diluer 50 μL de la suspension de EV tachée avec 2,5 mL d’eau distillée dans un tube de réaction de 15 mL, bien mélanger et utiliser cette suspension définitive pour la mesure des particules.
Remarque : Il est crucial d’utiliser l’eau comme diluant pour la suspension de l’EV, car la mesure risque de nuire aux autres diluants (p. ex., PBS). Lorsque stockées au format EV-suspension, laisser décongeler sur glace et bien mélanger avant la coloration.
- Tacher les échantillons avec des anticorps spécifiques.
- Diluer 10-20 μL de la suspension de EV (préparée à l’étape 1.1) avec 50 μL d’eau distillée dans un tube de réaction de 1,5 mL et mélanger soigneusement.
- Ajouter 2,5 à 5 μl de l’anticorps spécifique (tableau 1) dans le tube de réaction, bien mélanger et incuber 30 min à ta dans l’obscurité.
- Transférer 50 μL de la suspension de EV tachée de 2,5 à 10 mL d’eau distillée (tableau 1) dans un tube de réaction de 15 mL, bien mélanger et utiliser cette suspension définitive pour la mesure des particules.
Remarque : Dans certaines circonstances, la concentration de l’anticorps utilisé doit être ajusté (tableau 1).
3. traitement des échantillons
Remarque : Les principes fondamentaux de cette méthode ont été largement décrits précédemment et en dessous le protocole met l’accent sur les mesures spécifiques nécessaires pour l’analyse de fluorescence-étiquetée EVs14.
- Effectuez la procédure de démarrage.
- Poussez le filtre de fluorescence dans le chemin optique du microscope et caméra. Lancez le programme et suivez les instructions à l’écran pour la mise en œuvre automatisée.
- Sélectionnez le nombre de cellules correct (Z158_C1149_Fluor) dans l’onglet « Cellule Check » (définition de la cellule) pour la mesure de la fluorescence. Sélectionnez la position de référence pour l’optique de s’assurer que le microscope et le laser sont en un point commun (laser et microscope déplacer automatiquement vers cette position).
- Rincer le canal de la cellule avec une seringue remplie de 10 ml d’eau distillée. Assurez-vous que la cellule de mesure est exempte de bulles d’air et ne pas injecter de bulles d’air dans le système.
- Préparer une suspension d’étalonnage contenant uniforme 200 nm taille marquée par fluorescence particules de polystyrène ayant des groupes carboxylates sur leur surface. Diluer 10 μL des particules avec 990 μL d’eau distillée. Diluer 10 μl de cette solution de particules dans un tube de 15 mL avec 10 mL d’eau distillée pour obtenir la concentration requise.
- Injecter 2,5 mL de la solution diluée de particules dans le chenal de la cellule et cliquez sur « Optimiser la mise au point » pour régler la caméra.
- Mesurer l’échantillon.
- Rincer le canal cellule plusieurs fois avec une seringue remplie de 10 ml d’eau distillée avant chaque mesure de l’échantillon. Injecter la suspension EV tachée (préparée à l’étape 2) dans le canal de la cellule.
- Ajuster les paramètres de caméra principale suivants dans l’onglet « Vérifier la cellule » dans le logiciel comme nécessaires (tableau 2). Utilisez la position de référence ou position 0.41193 pour ajuster les paramètres.
- Pour la sensibilité, trouver la gamme de sensibilité optimale en cliquant sur le bouton « Nombre de particules vs sensibilité » pour afficher une courbe de particules mesurées par écran pour des sensibilités différentes.
Remarque : - Pour obturation, ajuster la période pendant laquelle l’appareil photo permet à la lumière de passer pour un intervalle déterminé.
- Après l’acquisition de paramètres, choisissez une luminosité minimale de 20, une taille minimale de 20 nm et une taille maximale de 500 nm pour la mesure.
- Pour la sensibilité, trouver la gamme de sensibilité optimale en cliquant sur le bouton « Nombre de particules vs sensibilité » pour afficher une courbe de particules mesurées par écran pour des sensibilités différentes.
- Notez le nombre de particules détectées comptées dans le champ de vision de l’écran. La barre de diffusion doit être dans le vert à orange range (particules de 50 à 300). Si la barre de diffusion est rouge, le scatter va fusionner des particules individuelles et elles sont comptées comme une seule particule, conduisant ainsi à des résultats erronés. Dans ce cas, plus de diluer l’échantillon afin d’éviter le chevauchement des particules ou de diminuer la sensibilité.
- Cliquez sur « Check particule dérive à 0 V » dans l’onglet « Cellule Check » avant de commencer la mesure. Si la dérive est supérieure à 5 μm/s, attendez que l’échantillon cesse de couler pour continuer la mesure.
Remarque : Si la dérive est trop élevée au début de la mesure, les mesures répétées peuvent différer et sophisticate les résultats. En raison des principes sous-jacents du NTA, une dérive pertinente peut-être avoir un impact dans la granulométrie déterminée, telle que calculée par le logiciel. - Cliquez sur « Lancer l’Acquisition vidéo » dans l’onglet « Mesure » sélectionnez le nombre d’expériences (3-5) et le délai entre eux (0 min).
- Définir le nombre de postes (subvolume-individuel) (11) et le nombre de cycles (mesure) (10) à chaque position de la mesure, où les particules doivent être analysées
- Sélectionnez un dossier, créer un nouveau nom de fichier et cliquez sur « OK » pour démarrer la mesure.
4. interprétation des résultats
- Découvre les résultats et les paramètres dans l’onglet « Analyse » après la mesure. Vérifiez les paramètres suivants après l’analyse avant de nettoyer le canal de la cellule : nombre moyen de particules par la poste, le nombre total de particules tracées et la concentration de particules, la largeur de la distribution des particules (valeurs x10, x50 et x90), valeur de moyenne et écart-type. Recommencez la mesure de l’échantillon si nécessaire.
Remarque : Les résultats sont également enregistrés dans un fichier .pdf ou .txt. - Cliquez sur l’onglet « Analyse » pour afficher le graphique calculé après la mesure, qui indique la répartition des particules détectées selon la taille. Cliquez sur « Affichage » dans l’onglet « Analyse » et utilisez les icônes pour ajuster et modifier les paramètres du graphique des règles particulières.
5. validation via EV détection par Western Blot
- Dissoudre le culot de EV (préparé à l’étape 1) dans le tampon de lyse et extraction RIPA, pipetter soigneusement et incuber sur glace pendant 30 min. centrifuger l’échantillon à 8 000 x g pendant 10 min à 4 ° C pour clarifier le lysat et transférer le surnageant dans un nouveau tube.
- Mesurer la fraction protéique totale par un kit de dosage de protéines Lowry. Diluer 1 μL de la suspension de EV isolée avec 49 μL de tampon de RIPA et utiliser 5 μL réanalysés pour analyse. Diluer la suspension EV avec 2 tampon de charge de x Laemmli à une concentration finale de 2 µg/μL et chauffer pendant 10 min à 95 ° C.
- Charge 20 μg de protéines par puits. Séparer et transférer les protéines par électrophorèse sur gel de polyacrylamide et réservoir buvard conformément aux protocoles standards.
- Bloquer la membrane (0,2 μm polyvinylidène difluoride) avec bovin lait en poudre (5 %) pendant 1 h à RT et incuber la membrane avec des anticorps primaires spécifiques (CD9, CD63 et vimentine) durant la nuit à 4 ° C.
Remarque : Les anticorps primaires sont utilisés à une dilution de 1 : 1 000. - Nettoyer la membrane avec un mélange TBST 3 x 5 min et incuber la membrane avec la peroxydase de raifort (HRP)-anticorps secondaire conjugué (01:20, 000 dans un mélange TBST) pendant 60 min à température ambiante.
- Nettoyer la membrane avec un mélange TBST 3 x 5 min et détecter les protéines par chimiluminescence avec une solution de substrat de haute sensibilité sur un système d’imagerie.
Remarque : Parce que CD63 antigène est largement et diversement glycosylée, le poids moléculaire peuvent varier, et bandes peuvent apparaître entre 40 et 65 kDa.
Résultats
EVs ont été isolées du sang total et caractérisées par des nanoparticules suivi d’analyse avec des réactifs fluorescents. La sensibilité optimale pour la mesure des particules colorées ou non a été identifiée à étendue à 70 % au cours de nos expériences. Les perles fluorescentes utilisées pour le réglage et l’étalonnage de la mesure ont montré un réglage optimal à une sensibilité de 85 % (Figure 2 a). Une sensibilité de 70 % à 90 %, le nombre de particules détectées a augmenté rapidement, tout en augmentant encore la sensibilité peut conduire à une détérioration de la distribution granulométrique où le nombre de particules est re-chute. Les paramètres de l’appareil photo affichent une image nette (Figure 2 b) et répètent des mesures ont montré le faible écart (Figure 2). Pour autant, le protocole pour le traitement des échantillons du SVE a été ajusté afin que toutes les mesures qui pourraient être menées avec les mêmes paramètres (tableau 2). La largeur de la distribution est définie par trois valeurs sur l’axe des abscisses, la x10, x50 et x90. Le x50, ou dimensions médianes des particules est le diamètre au cours de laquelle la moitié de la population se trouve au-dessous de cette valeur. De même, les x10 et x90 indiquent le diamètre au cours de laquelle 10 % et 90 % des particules détectées sont inférieures à la taille signalée. Coloration avec un kit de linker PKH67 cellule, y compris un linker cellule fluorescente qui incorpore un colorant fluorescent vert avec des queues longues aliphatiques dans régions de lipides de la membrane cellulaire, a démontré une forte corrélation entre la sensibilité et le nombre de des particules mesurées (Figure 3 a). PKH67 est souvent utilisé pour la surveillance de la prolifération, mais s’est aussi avérée utile pour le suivi exosome ou liposome absorption aussi bien en ce qui concerne l’in vivo la cellule traite. En raison de l’étiquetage de non spécifiques, des PKH67, une grande variété de véhicules électriques peut être étiquetée et détectée. La distribution des particules était dans une fourchette comprise entre 266 nm (x10) et 1946 nm (x90) avec un pic maximal à 857 nm (x50) et avec un faible écart entre les mesures (28,1 nm). LAMPE-1, également connu sous le nom glycoprotéine membranaire associée à lysosome 1 et CD107a résident principalement à travers les membranes lysosomales. Après coloration à l’Alexa Fluor 488 étiqueté d’anticorps spécifiques contre lampe-1, la distribution des particules varie de 220 nm (x10) à 1145 nm (x90) avec un pic maximal à 541 nm (x50) et un écart type de 11,7 nm (Figure 3 b). Pour la caractérisation du SVE, nous avons utilisé Alexa Fluor 488 anticorps contre marqueurs communs d’exosomal marqués et confirme nos conclusions Western Blot. Après coloration avec CD9-anticorps marqué Alexa 488 de Fluor, la distribution des particules varie de 251 nm (x10) à 1139 nm (x90) avec un pic maximal à 548 nm et un second pic mineur à environ 25 nm (Figure 4 a). Coloration avec Alexa Fluor 488 étiqueté CD63 (Figure 4 b) et la vimentine (Figure 4) a donné des résultats similaires. Western blotting analyse étayée notre résultat positif pour les anticorps utilisés ici. Des mesures répétées ont montré des résultats reproductibles pour tous les anticorps utilisés dans le présent rapport. Comme témoins, nous avons teinté eau exempte de vésicules avec des anticorps respectifs (Figure 5 a), où des anticorps PKH67 et LAMP1 ne détectés pratiquement aucun EV jusqu'à une sensibilité proche de 100 %. À l’aide de l’exemple de vimentine, haute sensibilité a augmenté le nombre de nouveaux objets, même lorsque l’échantillon est essentiellement libre de particules. Si la mesure est démarré lorsque la dérive est encore trop élevée (> 5 µm/s), les répétitions individuelles s’écartent nettement entre eux (Figure 5 b). Représentée avec trois types d’anticorps, il est crucial que la dérive est aussi minime que possible avant de commencer la mesure. Selon notre expérience, à l’aide de l’isothiocyanate de fluorescéine (FITC) comme fluorochrome se traduit par des mesures qui ne sont pas précis et reproductibles comme FITC est sujette aux photo rapide de blanchiment (Figure 5). Par conséquent, nous recommandons d’utiliser exclusivement Alexa Fluor 488 anticorps pour la caractérisation de l’EV marqués. Dans le présent protocole, les EVs ont été isolées par une solution de précipitation exosome à base de polymères contenant du polyéthylène glycol. Pour faire en sorte que nos résultats ne sont pas falsifiées par la méthode d’isolement appliquée, nous avons caractérisé EVs après isolement par ultracentrifugation. Représentée avec PKH67 et deux types d’anticorps (CD63 et lampe-1), les résultats de notre isolement appliquée avec solution de précipitation exosome (Figure 6 a) sont comparables aux EVs isolées par ultracentrifugation (Figure 6 b ). Malheureusement, en raison du faible rendement des véhicules électriques après ultracentrifugation, l’ensemble initial de sérum pour l’isolement doit être nettement supérieur comparé à l’isolement avec solution de précipitation exosome.
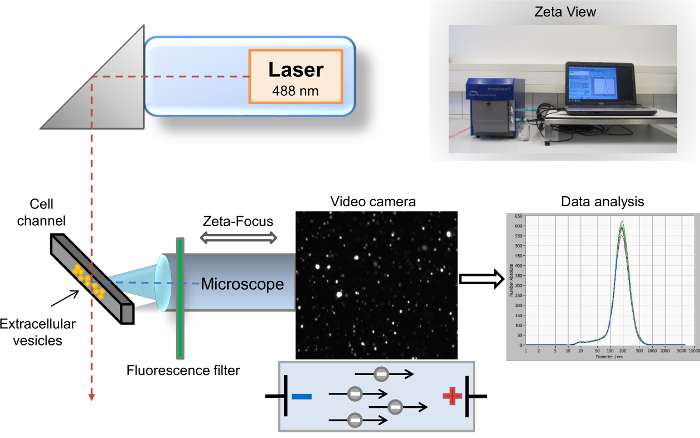
Figure 1 : configuration schématique de la nanoparticule suivi analyse. Le faisceau laser et axe de microscope/vidéo sont orientées perpendiculairement les uns aux autres, se croisent la cellule transversale du canal. Un filtre de fluorescence est placé entre le canal de la cellule et le microscope. Lumière diffusée par les particules s’affiche dans la fenêtre « live-view » du logiciel. Après l’acquisition, les résultats sont affichés comme un repère de courbe de distribution de taille. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
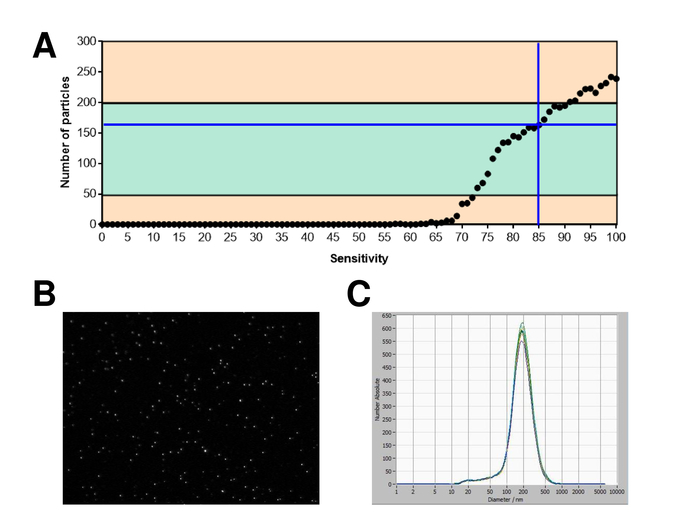
Figure 2 : étalonnage avec fluorescence étiqueté perles. (A) le nombre de particules vs sensibilité courbe affiche les particules dans un poste à un moment donné dans le temps lors d’une analyse de sensibilité automatique. (B) visualisation des particules sur l’écran de visualisation en direct. (C) particule size distribution après des mesures répétées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
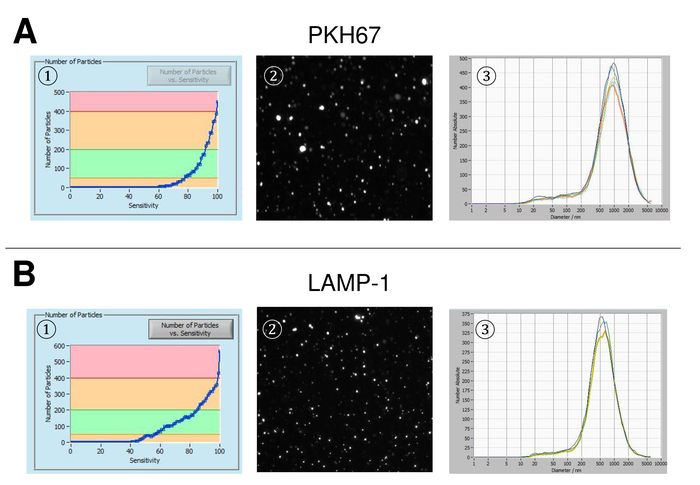
Figure 3 : représentant des résultats après coloration avec PKH67 et lampe-1. Nombre de particules vs courbe de sensibilité (1), visualisation de particules sur la distribution des tailles mode live view écran (2) et les particules (3) après coloration à le PKH67 (A) et lampe-1 (B). Une distribution similaire de la taille des particules est observée, alors que des changements dans la sensibilité affectant un changement similaire mais encore pas tout à fait identique de particules détectées à plomb. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
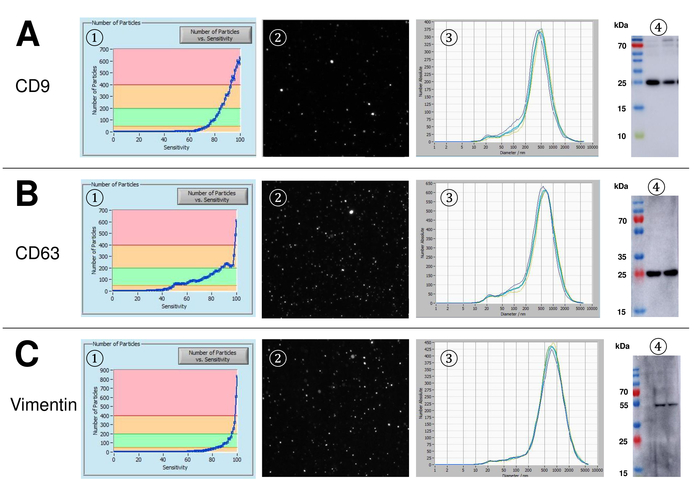
Figure 4 : représentant des résultats après coloration à l’Alexa Fluor 488 étiquetés CD9, CD63 et vimentine. Nombre de particules vs courbe de sensibilité (1), visualisation de particules sur l’écran de visualisation en direct (2), distribution granulométrique (3) et transferts Western représentatifs de deux différentes suspensions de EV (4) pour CD9 (24-27 kDa, A), CD63 (26 kDa, ( B) et la vimentine (54 kDa, C). Apparition tardive des particules des signaux le long de la sensibilité croissante (axe x) est en corrélation avec la plus faible intensité de signal dans le Western blot analyse, confirmant le montant inférieur du marqueur de surface de particules respectives (par exemple, vimentine vs CD63). Notez les courbes presque identiques des mesures représentatives de tous les marqueurs analysés indiquant la reproductibilité élevée (3). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
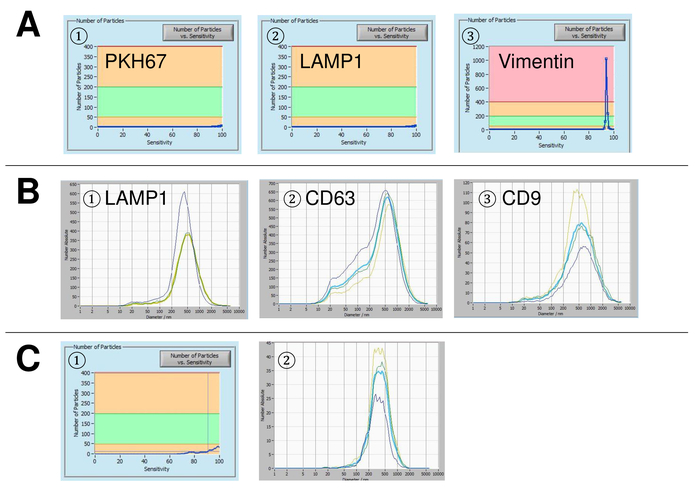
Figure 5 : représentant des résultats pour les contrôles utilisés et sources d’erreurs possibles. (A) vésicule exempt eau colorées avec PKH67 (1), lampe-1 (2) et la vimentine (3) sous forme de contrôles. (B) distributions granulométriques représentant après coloration avec lampe-1 (1), CD63 (2) et CD9 (3), et des mesures effectuées lors de dérive de la suspension est encore trop élevé. (C) nombre de particules vs sensibilité courbe (1) et de la distribution granulométrique (2) après le marquage avec l’anticorps marqué FITC CD63. On observe un effet de blanchiment certain après chaque mesure, ce qui entraîne progressivement plus faible nombre de particules. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
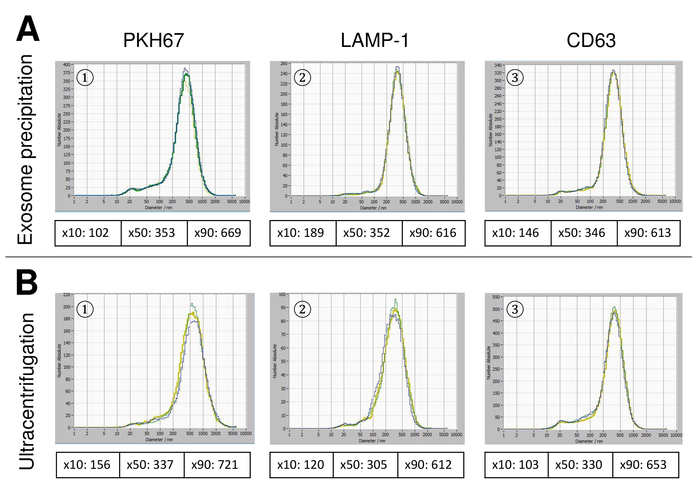
Figure 6 : comparaison des méthodes d’isolation différents pour ve. Distribution granulométrique du SVE isolé avec exosome précipitations solution (A) et (B) d’ultracentrifugation après coloration à le PKH67 (1), lampe-1 (2) et CD63 (3). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| LAMPE-1 | CD9 | CD63 | Vimentine | |
| Anticorps (µL) | 5 | 2,5 à 5 | 2,5 à 5 | 5 |
| Suspension de EV (µL) | 10 | 20 | 10 | 10 |
| H2O (µL) pour la coloration | 50 | 50 | 50 | 50 |
| Volume final (mL) | 5-10 | 2,5 à 5 | 5 | 10 |
Tableau 1 : Liste des anticorps utilisés et gamme de dilution des échantillons.
| Paramètres d’acquisition | |
| Sensibilité (%) | 85 |
| Obturateur | 70 |
| Luminosité min. | 20 |
| Max. Taille (nm) | 500 |
| Taille min. (nm) | 20 |
| Polarité | Négatif |
| Tension | Hors |
| Dérive de la particule à 0 V (µm/s) | 5 < |
| Postes | 11 |
| Cycles | 10 |
| Plusieurs acquisitions | 3-5 |
| Temporisation (min) | 0 |
Tableau 2 : Des paramètres d’acquisition pour les nanoparticules suivi analyse.
Discussion
Nous démontrons un protocole détaillé pour l’isolation des véhicules électriques du sang total et de la caractérisation rapide des marqueurs de surface spécifiques avec des nanoparticules basés sur la fluorescence analyse de suivi. Dans les expériences menées, nous avons utilisé exclusivement EVs isolées d’échantillons de sérum, mais cette méthode est également adaptée pour l’acide tétraacétique (EDTA) et plasma citraté et peut également être étendue à d’autres liquides corporels tels que le lait maternel, l’urine, la salive, le liquide céphalorachidien et le sperme. En outre, le présent protocole peut être ajusté pour la caractérisation des EVs de surnageants de culture de cellules. Dans ce protocole, la suspension de l’EV a été générée à partir de 100 μL de sérum, utilisant un réactif de précipitation exosome, qui contient un polymère qui précipite doucement les exosomes et EVs selon une taille corpusculaire allant de 30 nm à 200 nm, auquel cas 10-20 μL des véhicules électriques ont été nommés pour la caractérisation de chaque marqueur de surface. Malheureusement, l’étape d’isolement est inévitable, car la quantité élevée de protéines dans le sérum (p. ex., albumine et globuline) interfère avec l’anticorps procédure de coloration et aboutit à haut niveau de fond et résultats sophistiqués. En outre, selon la disponibilité biologique de l’exosomes dans les échantillons, le montant de la suspension de EV indépendant ainsi que la dilution avant traitement doit être ajusté pour d’autres matériaux de source. Pour comparer des échantillons multiples, il faut une approche normalisée pour la dilution de l’échantillons, mais aussi les paramètres d’acquisition cohérent (sensibilité, obturateur, etc.). Un autre point important est que les mesures ne sont pas démarrés, jusqu'à ce que la dérive est faible (entre nos mains, < 5 μm/s). Si la dérive était trop élevée, des mesures répétées de l’échantillon donné grande écart entre eux, mais avec une faible dérive, les données résultantes étaient très compatibles et confirment un niveau élevé de reproductibilité. Il est important que les anticorps sélectionnés ont un fluorochrome approprié. Anticorps doivent être conjugués avec Alexa Fluor 488, FITC ayant un taux élevé de blanchiment photo. Éventuellement fluophores plus stable conduira certainement à la stabilité accrue de dosage à l’avenir. Normalement, de nombreux chercheurs utilisent des PBS comme diluant pour EVs. Pour ce protocole, il est crucial d’utiliser l’eau distillée comme diluant pour les suspensions de EV. Quand EVs sont étiquetés avec les colorants fluorescents et l’osmolalité élevée, concentration de l’ion d’autres diluants, tels que PBS, peuvent interférer avec la mesure et plomb à modifié les résultats.
Alors que les méthodes d’analyse des EVs ont été considérablement améliorées ces dix dernières années, il n’y a encore aucune méthode normalisée pour l’isolement et la caractérisation de l’EVs. L’inconvénient majeur de cytométrie en flux, où EVs sont souvent liés à perles pour fournir une surface plus grande, est que de nombreux EVs dock à la surface pour donner un signal fort et détectable10. SEM et TEM ont l’inconvénient que la préparation des échantillons est chronophage et EVs se distingués seulement par leur taille et la morphologie11. Jusqu'à ce jour, la méthode fort et couramment utilisée pour qualitative (p. ex., biochimiques) caractérisation EV est Western blotting, où les protéines peuvent être analysées avec des anticorps spécifiques12,13. Toutefois, les inconvénients de toutes ces méthodes se trouvent dans l’incapacité d’analyser des EVs unique pour les marqueurs de surface spécifiques. En outre, les longs délais de traitement et les procédures de lavage/isolement prolongé utilisés par de nombreux protocoles actuels impliquent des étapes fastidieuses, ce qui les rend impropre pour un débit élevé échantillon et caractérisation de l’unique EVs. Notre protocole prévoit un workflow complet rapide isolement et caractérisation des EVs unique avec des marqueurs de surface spécifiques comme CD63, CD9, vimentine et CD107a et peut être étendu pour un large éventail d’autres marqueurs de surface pour déterminer l’origine de publié EVs. En raison d’un progrès technique permanent du dispositif NTA, nous avons confirmé nos résultats en coopération avec le fabricant de l’analyseur plus récent. Quel que soit l’évolution future de la recherche sur la biologie de EV, concernant en particulier les exosomes, le protocole qui est présenté ici fournira une méthode rapide et fiable pour la caractérisation des EVs unique avec des marqueurs spécifiques. Agrégation des véhicules électriques au cours de l’isolement et la procédure de marquage étant jusqu'à présent inévitable, recherche future devrait se concentrer sur le développement de méthodes pour empêcher l’agrégation EV et permettre une détermination de la taille exacte de fluorescent-étiquetées EVs.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient les particules Metrix GmbH pour couvrir partiellement les coûts de publication de cet ouvrage.
matériels
| Name | Company | Catalog Number | Comments |
| Serum-separation tube | BD | 366882 | BD Vacutainer |
| Ampuwa water | Fresenius Kabi | 10060 | |
| Dulbecco's phosphate-buffered saline | Sigma | 56064C | |
| Falcon tube, 15 mL | Greiner Bio One | 188271 | |
| Falcon tube, 50 mL | Greiner Bio One | 227270 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 30120086 | Speciality tubes for ultra centrifugation |
| Tube with Snap-On Cap 1.5 mL | Beckman Coulter | 357448 | |
| Polybeads Microspheres 0.2 µm | Polysciences, Inc. | 7304 | Alignment Solution |
| Fluoresbrite YG Carboxylate Microspheres beads 0.2 µm | Polysciences, Inc. | 09834-10 | Alignment Solution |
| Syringe, 2 mL | Braun | 4606027V | |
| Syringe, 10 mL | Braun | 4606728V | |
| Exoquick | SBI | EXOQ20A-1 | EV precipitation solution |
| Laemmli Sample Buffer (2x) | BioRad | 1610737 | |
| DC Protein Assay Kit II | BioRad | 5000112 | Lowry prtein assay |
| PKH67 Green Fluorescent Cell Linker Kit | Sigma | PKH67GL-1KT | For general membrane labelling |
| Alexa Fluor 488 anti-human CD107a Antibody | BioLegend | 328609 | Lysosomal-associated membrane protein-1 (LAMP-1) |
| Human CD9-Alexa Fluor 488 | R&D Systems | FAB1880G | |
| Anti-CD9 Antibody | SBI | EXOAB-CD9A-1 | |
| CD63-Alexa Fluor 488 | ThermoFisher | MA5-18149 | |
| FITC anti-human CD63 Antibody | BioLegend | 353005 | |
| CD63. Antibody, polyclonal | SantaCruz | Sc-15363 | |
| Alexa Fluor 488 anti-vimentin Antibody | BioLegend | 677809 | |
| Anti-Vimentin Antibody | SBI | EXOAB-VMTN-1 | |
| Goat anti mouse IgG + IgM | Jackson Immuno | 315-035-048 | |
| Goat anti rabbit IgG | Dianova | 111-035-003 | |
| SuperSignal West Femto Maximum Sensitivity Substrate | ThermoFisher | 34094 | |
| ZetaView | Particle Metrix | PMX 100, Type | |
| Centrifuge | Eppendorf | 5804R | |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | |
| Chemiluminescence Imager | GE Healthcare | Amersham Imager 600 |
Références
- Ibrahim, A., Marban, E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology. Annual Review of Physiology. 78, 67-83 (2016).
- Su, S. A., et al. Emerging role of exosome-mediated intercellular communication in vascular remodeling. Oncotarget. 8 (15), 25700-25712 (2017).
- Lasser, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9, 9(2011).
- Li, M., et al. Analysis of the RNA content of the exosomes derived from blood serum and urine and its potential as biomarkers. Philosophical Transactions of The Royal Society B Biological Sciences. 369 (1652), (2014).
- Lin, J., et al. Exosomes: novel biomarkers for clinical diagnosis. The Scientific World Journal. 2015, 657086(2015).
- Properzi, F., Logozzi, M., Fais, S. Exosomes: the future of biomarkers in medicine. Biomarkers in Medicine. 7 (5), 769-778 (2013).
- Thery, C., Zitvogel, L., Amigorena, S. Exosomes: composition, biogenesis and function. Nature Reviews Immunology. 2 (8), 569-579 (2002).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , Chapter 3 Unit 3 22 (2006).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. (97), (2015).
- Wu, Y., Deng, W., Klinke, D. J. 2nd Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. Analyst. 140 (19), 6631-6642 (2015).
- Bianco, N. R., Kim, S. H., Morelli, A. E., Robbins, P. D. Modulation of the immune response using dendritic cell-derived exosomes. Methods in Molecular Biology. 380, 443-455 (2007).
- Conde-Vancells, J., et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes. Journal of Proteome Research. 7 (12), 5157-5166 (2008).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments. (95), 50974(2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon