Method Article
나노-추적 분석 인 혈에 있는 단일 Extracellular Vesicles의 빠른 형광 기반 특성
요약
이 프로토콜에서 우리는 형광 기반 나노-추적 분석 하 여 인간의 전체 혈액에서 세포 외 vesicles의 신속한 격리 및 특정 마커의 특성화에 대 한 완벽 한 워크플로우를 설명합니다. 제시 결과 재현성의 높은 레벨을 표시 하 고 셀 문화 supernatants 조정 될 수 있습니다.
초록
Extracellular 소포 (EVs), exosomes, 등은 전문된 막 나노 크기의 소포 constitutively 많은 세포 유형에서 발표 되 고 셀 통신 및 다양 한 종류의 조절에 중추적인 역할을 하는 체액에서 발견 생물 학적 프로세스입니다. EVs의 특성에 대 한 다양 한 방법은 설명 했습니다. 그러나, 이러한 방법의 대부분 준비 및 샘플의 특성은 매우 시간이 걸리는, 또는 그것은 그들의 작은 크기로 인해 및 개별의 부족으로 인해 특정 마커 분석 하기 매우 어려운 단점이 있다 인구입니다. 여전히 단일 EV미 의 특성에 대 한 표준화 된 방법 동안 EVs의 분석에 대 한 방법을 지난 10 년간 상당히 향상 되었습니다, 여기, 형광 기반 나노-추적 분석에 의해 단일 EVs의 특성에 대 한 반 자동화 된 방법을 설명합니다. 프로토콜 표시 되는이 분야에서 많은 연구자의 일반적인 문제를 해결 하 고 EVs와 특성화 같은 특정 표면 마커 뿐만 아니라 PKH67, 일반 세포 막 링커의 신속한 격리에 대 한 완벽 한 워크플로우를 제공 합니다. CD63, CD9, vimentin, 및 관련 된 lysosomal 막 단백질 1 (램프-1). 제시 결과 부 럽 등 다른 방법으로 확인 재현성, 높은 수준을 보여줍니다. 실시 실험에서 우리가 독점적으로 EVs에서 인간의 혈 청 샘플, 절연을 사용 하지만이 방법은 플라즈마 또는 다른 체액에 적합 하 고 셀 문화 supernatants에서 EVs의 특성화에 대 한 조정 될 수 있다. EV 생물학에 대 한 연구의 향후 진행에 관계 없이 여기에 표시 되는 프로토콜 특정 마커 단일 EVs의 신속한 특성화에 대 한 신속 하 고 안정적인 방법을 제공 한다.
서문
Extracellular 소포 (EVs), exosomes를 포함 하 여 전문화 된 막 나노 크기의 소포 (20-150 nm) 지질, 접착 세포 신호 분자 뿐만 아니라 같은 다른 기능 cytosolic 성분의 특정 조합을 포함 하는 (미르) 예측에 관한 mRNA, 그리고 놀이-셀 통신1,2조절에 중추적인 역할. EVs에서 많은 다른 세포 유형, 예를 들어, 내 피 세포, 면역 세포, 종양 세포, 그들의 환경에서 발표 되 고 혈 청 정액, 소변, 모유, 타 액, 또는 척수3, 같은 체액에서 검출 될 수 있다 4. 연구의 증가 수로 여러 가지 질병의 조기 진단 또는 질병 진행5,6의 예측에 대 한 잠재적인 생체 EVs의 다양 한 기여를 강조. Exosomes는 종종 그들은 구체적으로 연관 된, 그들은7에서 파생 셀 유형에 관계 없이 분자의 존재에 의해 설명 됩니다. 예를 들어 exosomes 다른 tetraspanins (CD81 CD9, CD63,)를 포함, 중요 한 조직 적합성 복잡 한 클래스 나 (MHC 나) 분자, 다양 한 막 횡단 단백질, 일반적인 cytosolic 단백질 (tubulin 그리고 말라), 분자 multivesicular 몸 (에 관련 된 MVB) 속 (TSG101 및 alix), 열 충격 단백질 (HSP 70 및 HSP 90), 그리고에 참여 하는 단백질 신호 변환 (단백질 kinases)8.
여러 가지 방법 EVs9특성에 대 한 설명 했습니다. 가장 일반적이 고 널리 퍼진 방법 EV 분석에 사용 되는 흐름 cytometry10, 스캐닝 전자 현미경 (SEM), 및 전송 전자 현미경 (TEM)11. EV 콘텐츠 생 화 확 적인 특성에 대 한 best-established 방법과 일반적으로 사용 되는 서양 blotting12,13. SEM과 TEM 전체 크기 스펙트럼에 걸쳐 EVs의 검출에 대 한 허용, 특정 표면 단백질의 매우 제한 된 식별 이러한 메서드의 특정 단점입니다. 대조적으로, cytometry 특정 EV 표면 마커, 식별을 위한 강력한 도구 이지만이 방법의 임계값 제한 500 보다 큰 크기 evs 분석 nm. 따라서, 특정 표면 마커 검출 고립 된 EVs의 분석은 현재 이러한 세 가지 잘 설립 방법을 통해 액세스할 수 없습니다. 우리는 이전 시각화 및 EVs, 나노-추적 분석 (NTA)14의 분석에 대 한 또 다른 매우 중요 한 방법 설명. 간단히,이 방법은 두 개의 다른 물리적 원리 결합합니다. 첫째, 입자 그들은 레이저 빔으로 반구는 브라운 모션로 알려진 두 번째 원리는 액체에 다른 입자의 보급은 그들의 크기에 반비례 하는 때 빛을 피해 라. 단일 입자에서 뿌려 진된 빛의 디지털 이미지 기록 됩니다 소프트웨어 기반 분석 분석기 추적 입자 액체 샘플의 반자동된 데스크톱 나노 분석 계기에 의하여 이루어져 있다. 입자와 입자의 운동 비디오 카메라와 함께 레이저 산란 현미경에 의해 검색 됩니다. 레이저 빔은 세로로, 광학 축이 수평 및 샘플 가득 셀 채널에 집중 하는 동안. 흩어져 빛 반점의 음모와 모션의 그들의 속도 의해 제공 하는 데이터 사용 총 입자 수와 크기 분포의 결정. 레이저에 의해 방사선 조사 후 입자 분산형은 빛 현미경14는 디지털 비디오 카메라 를 통해 에 의해 기록 된. 우리의 전 방법에 발전은 레이저 사이 500 nm 긴 웨이브 통과 (LWP) 컷오프 필터의 삽입 (파장 488 nm)와 형광 표시 된 입자 (그림 1)의 직접 분석을 가능 하 게 셀 채널. 우리의 프로토콜 예를 들어, 그들의 부모의 기원에 따르면, 단일 EVs의 빠른 특성에 대 한이 분야에서 많은 연구자의 일반적인 수요를 해결합니다. 이 프로토콜에서 우리는 형광 기반 나노 입자 추적 분석 하 여 인간의 전체 혈액에서 EVs의 신속한 격리 및 특정 마커의 빠른 특성을 위한 완벽 한 워크플로우를 설명합니다. EVs는 특정 exosomal, 예를 들어, CD63, CD9, 표식과 vimentin 뿐만 아니라 PKH67, 일반 세포 막 링커 얼룩에 의해 감지할 수 있습니다. 우리의 프로토콜은 또한 EDTA citrated 플라즈마로 다른 체액 및 세포 문화 supernatants에 적합 합니다.
프로토콜
뒤셀도르프 대학 기관 윤리 위원회는이 작품에서 제시 하는 실험을 승인 했습니다 (참조 번호: 3381).
1. EV 격리 인간의 전체 혈액에서
- Exosome 강수량 솔루션 EVs를 격리 합니다.
- 혈 청 분리 관 (SST) 통해 venipuncture에 인간의 전체 혈액의 2 개 mL를 수집 하 고 응고가 완료 될 때까지 실 온 (RT)에서 15 분 동안 튜브를 품 어.
- 1700 x g 혈 청에서 세포를 분리 하 고 1.5 mL 반응 관에 혈 청 1 mL를 전송 하는 RT에 10 분에서 SST 원심 혈소판을 제거 하 고 새로운 1.5 mL 반응 관에 혈소판 가난한 플라스마 (PPP)의 100 μ 전송 하 4 ° C에서 15 분 동안 3000 x g 에서 혈소판이 풍부한 혈장 (PRP)을 원심.
- 철저 하 게 exosome 강수량 솔루션 (4 개 부품 PPP, 1 부분 exosome 강수량 솔루션) 및 소용돌이의 25 µ L를 추가 합니다. 얼음에 30 분에 대 한 샘플을 품 어. 튜브를 똑바로 유지 하 고 회전 하거나 마십시오 인큐베이션 기간 동안 튜브를 혼합.
- EVs를 펠 렛을 4 ° C에서 30 분 동안 1500 x g 에서 샘플 원심 원심, 후 EVs 그릇의 하단에 베이지색 이나 흰색 펠 릿으로 나타납니다. 상쾌한 발음 및 4 ° c.에서 5 분 동안 1500 x g 에서 샘플을 원심
- 액체의 모든 흔적을 제거 하 고 다시 자주 아래로 pipetting으로 인산 염 버퍼 식 염 수 (PBS)의 100 µ L에 펠 릿을 일시 중단. 분석은 즉시 수행 되지 때-80 ° C에서 EV 정지를 저장 합니다.
참고: 때 플라즈마에서 EVs를 격리, fibrinogen 및 섬유 소 수 방해 효율적인 복구 물의 resuspension 무거운 하 고 더 많은 시간이 걸립니다.
- Ultracentrifugation와 EVs를 격리 합니다.
- 받아 냉장고를 사용 하기 전에 ultracentrifuge 다운 멋진 사전 냉각된 회전자 (TLA 55 고정-각도).
- 1.25 mL (단계 1.1에서에서 준비) PPP의 모자와 적당 한 1.5 mL ultracentrifugation 튜브 전송과 110000 x g 4 ° c.에 90 분에서 샘플을 원심 시작 하기 전에 터 부하 균형은 다는 것을 확인 하십시오.
- 상쾌한 가만히 따르다와 장소 튜브-거꾸로 2 분에 대 한 종이 타월에 다시 PBS의 500 μ에 펠 릿을 일시 중단 하 고 원심 110000 x g 4 ° c.에 90 분에서 샘플
- 발음은 상쾌한 고 다시 PBS의 50 μ에 펠 릿을 중단.
참고: 사용로 터와 사용 중인 ultracentrifuge를 위한 액세서리. 튜브의 강도 많은 사이 다 수 있기 때문에 물을 사용 하 여 회전자에 튜브를 미리 테스트.
2. 샘플의 얼룩
- PKH67와 얼룩.
- 철저 하 게 1.5 mL 반응 관에 믹스 PKH67 ethanolic 염료 해결책의 1 μ 희석제 C (키트에 포함)의 50 μ에 추가 하 여 얼룩 솔루션을 준비 합니다.
- 반응 관에 EV 정지 (단계 1.1에서에서 준비) 20 μ 얼룩 솔루션의 10 μ 전송, 철저 하 게 혼합 하 고 어둠 속에서 RT에 5 분 동안 품 어.
- 15 mL 반응 관에 2.5 mL 증 류 물으로 얼룩진된 EV 현 탁 액의 희석 50 μ, 철저 하 게 혼합 하 고이 마지막 정지를 사용 하 여 입자 측정을 위한.
참고:이 희석제로 물을 사용 하 여 EV 정지에 대 한 중요 한 다른 diluents (예를 들어, PBS) 측정을 손상 시킬 수 있기 때문에. EV-서 스 펜 션, 저장 사용 하 여 얼음 샘플을 녹여 고 얼룩이 지기 전에 철저 하 게 혼합.
- 특정 항 체와 얼룩.
- 희석 증류수 1.5 mL 반응 관에 혼합의 50 μ로 (단계 1.1에서에서 준비) EV 정지의 10-20 μ 철저 하 게.
- 반응 관에 특정 항 체 (표 1)의 2.5-5 μ를 추가 하 고 혼합 철저 하 게, 어둠 속에서 RT에서 30 분 동안 품 어.
- 2.5-10 ml 증류수 (표 1) 15 mL 반응 관에 얼룩진된 EV 서 스 펜 션의 50 μ를 전송 하 고, 철저 하 게 혼합 입자 측정이 최종 서 스 펜 션 사용 합니다.
참고: 일부 상황에서 사용 된 항 체의 농도 이어야 합니다 (표 1)을 조정.
3. 샘플의 처리
참고:이 방법의 기본 광범위 하 게 설명 했다 이전 및 프로토콜 초점 아래 형광 표시 된 EVs14의 분석에 필요한 특정 단계에.
- 시작 절차를 수행 합니다.
- 현미경과 카메라의 광 경로에 형광 필터를 밀어. 프로그램을 시작 하 고 자동화 된 구현에 대 한 화면 지침을 따르십시오.
- 형광 측정 "셀 확인" 탭 (셀 정의)에서 정확한 휴대폰 번호 (Z158_C1149_Fluor)를 선택 합니다. 광학 현미경과 레이저는 일반적인 초점 (레이저 현미경이 위치로 자동으로 이동)에 다는 것을 확인에 대 한 참조 위치를 선택 합니다.
- 주사기의 증류수 10 mL로 가득 셀 채널을 플러시. 측정 셀 공기 방울의 무료 인지 확인 하 고 시스템에 공기 방울을 주입 하지 마십시오.
- 유니폼 200 nm 크기의 형광 표시 폴리스 티 렌 입자 카복실산 그룹 그들의 표면에 있는 포함 하는 교정 정지를 준비 합니다. 990 μ와 희석 10 μ 입자의 증류수. 다음에 필요한 농도를 증류수 10 mL와 10 μ 15 mL 튜브에이 입자 솔루션의 희석.
- 셀 채널에서 희석된 입자 솔루션의 2.5 mL를 주사 하 고 "초점 최적화"를 클릭 카메라를 조정.
- 샘플을 측정 합니다.
- 각 샘플 측정 전에 증류수 10 mL로 채워진 주사기 셀 채널 여러 번을 플러시. 셀으로 얼룩진된 EV 현 탁 액 (2 단계에서 준비)를 주사.
- 필요 (표 2)로 소프트웨어의 "셀" 확인 탭에서 다음과 같은 주요 카메라 매개 변수를 조정 합니다. 기준 위치를 사용 하거나 매개 변수를 조정 하는 0.41193 위치.
- 감도, "수 입자 대 감도" 버튼을 클릭 하 여 최적의 감도 범위 찾을 다른 감도 레벨 화면 당 측정 된 입자의 곡선을 표시 하려면.
참고: - 셔터, 카메라 결정된 간격을 통과 하는 빛을 허용 하는 기간을 조정 합니다.
- 20, 20의 최소 크기의 최소 밝기 선택 후 인수 매개 변수에 대 한 nm, 그리고 500의 최대 크기 측정에 대 한 nm.
- 감도, "수 입자 대 감도" 버튼을 클릭 하 여 최적의 감도 범위 찾을 다른 감도 레벨 화면 당 측정 된 입자의 곡선을 표시 하려면.
- 참고 검색 된 입자의 수는 디스플레이에서 시야에 계산. 산란 바 녹색 주황색 범위 (50-300 입자)을 해야 합니다. 산란 바 빨간색 이면 살포는 개별 입자 융합 것입니다 그리고 그들은 1 개의 단 하나 입자, false 결과 하로 계산 됩니다. 이러한 경우, 추가 입자의 중복을 피하기 위해 샘플을 희석 하거나 낮은 감도.
- 측정을 시작 하기 전에 "확인 입자 드리프트 0 V에서" "셀 검사" 탭에서 클릭 하십시오. 드리프트 5 μ m/s 보다 높은 경우는 샘플 측정을 계속 흐르는 중지 될 때까지 기다립니다.
참고: 드리프트 측정의 시작 부분에서 너무 높은 경우에, 반복된 측정 수 있습니다 다 고 결과 세상일. 주권의 기본 원리 때문 관련 드리프트는 소프트웨어에 의해 계산 된 결정된 입자 크기에 영향을 있을 수 있습니다. - "측정" 탭에서 "실행 비디오 수집"에 클릭 선택 실험 (3-5)의 수와 그들 (0 분) 사이의 시간 지연 합니다.
- (개별 subvolume-) 위치 (11) 수와 입자를 분석 해야 합니다 어디 각 측정 위치에서 (측정) 주기 (10) 수 정의
- 폴더를 선택 하 고 새 파일 이름을 만들 "확인"을 클릭 측정 시작.
4입니다. 결과의 해석
- 측정 후 "분석" 탭에서 매개 변수 및 결과 볼. 셀 채널을 청소 하기 전에 분석 후 다음 매개 변수를 확인 하십시오: 위치, 추적된 입자와 입자 농도, 입자 (x10, x50, 및 x90 값)의 분포 폭의 총 수 입자의 평균 수의 값 평균 그리고 표준 편차입니다. 필요한 경우 샘플의 측정을 반복 합니다.
참고: 결과.pdf 또는.txt 파일로 저장 됩니다. - "분석" 탭 그래프 크기에 의해 검색 된 입자의 분포를 보여주는 측정 후 계산을 클릭 합니다. "분석" 탭에서 "디스플레이"를 클릭 하 고 아이콘을 사용 하 여 조정 하 고 특정 요구 사항에 대 한 그래프 설정을 변경.
5. 유효성 검사 통해 EV 탐지 부 럽에 의해
- EV 펠 릿 (1 단계에서 준비) RIPA 세포와 추출 버퍼에 해산 하 고, 철저 하 게 플라스틱 lysate를 명확히 하는 상쾌한 새로운 튜브에 전송 30 분 4 ° C에서 10 분 원심 분리기 8000 x g 에서 샘플에 대 한 얼음에 품 어.
- Lowry 단백질 분석 실험 키트를 총계 단백질을 측정 한다. RIPA 버퍼의 49 μ와 격리 된 EV 서 스 펜 션의 1 μ를 희석 하 고 분석을 위한 triplicates의 5 μ를 사용 합니다. 2 µ g/μ와 95 ° c.에서 10 분 동안 열의 최종 농도에 2 x Laemmli 로딩 버퍼와 EV 정지 희석
- 잘 당 단백질의 20 μ g를 로드 합니다. 고 polyacrylamide 젤 전기 이동 법 및 탱크 표준 프로토콜에 따라 blotting에 의해 단백질을 전송 합니다.
- RT에 1 시간에 대 한 소 우유 분말 (5%)와 막 (0.2 μ m polyvinylidene difluoride)를 차단 하 고 특정 기본 항 체 (CD9, CD63, 및 vimentin) 4 ° c.에 하룻밤을 막 품 어
참고: 기본 항 체 1:1,000 희석에 사용 됩니다. - TBST 가진 막 씻고 3 x 5 분 양 고추냉이 과산화 효소 (HRP)와 막 품 어 고-실시간에서 60 분에 대 한 활용 된 이차 항 체 (1:20, TBST에 000)
- TBST 가진 막 씻고 3 x 5 분 이미징 시스템에 높은 감도 기판 솔루션 화학에 의해 단백질을 검출 하 고.
참고: 때문에 CD63 항은 광범위 하 게 변함없이 당화, 분자량에 다를 수 있습니다, 그리고 밴드 40-65 kDa 사이 나타날 수 있습니다.
결과
EVs 전체 혈액에서 고립 되었고, 나노 분석 fluorescing 시 약을 추적 하 여 특징. 흠 없는 입자의 측정에 대 한 최적의 감도 70% 범위에 우리의 실험 하는 동안 확인 되었다. 조정 및 측정의 교정에 사용 되는 형광 구슬 85% (그림 2A)의 감도 최적의 설정을 보여주었다. 70%의 민감도 90% 사이 감지 된 입자의 수 증가, 입자의 수는 다시 떨어지고 입자 크기 분포의 악화도 이어질 수 있는 더 감도 증가 하는 동안. 카메라의 설정 날카로운 그림 (그림 2B)를 표시 하 고 반복 측정 낮은 표준 편차 (그림 2C)를 보였다. Insofar, EVs의 샘플을 처리 하기 위한 프로토콜 모든 측정 동일한 설정 (표 2)으로 실시 될 수 있도록 조정 되었다. 분포 폭 x90, x50,는 x10, x 축에 세 개의 값으로 정의 됩니다. X50, 또는 평균 입자 크기는 인구의 절반이 값 보다 거짓말 하는 지름입니다. 마찬가지로,는 x10과 x90 직경을 10% 및 감지 된 입자의 90%는 보고 된 크기를 나타냅니다. 감도의 사이 강한 상관 관계를 보여주었다 PKH67 셀 링커 키트, 세포 막의 지질 지역으로 긴 지방 족 꼬리와 녹색 형광 염료를 형광 셀 링커를 포함 하 여 얼룩이 입자 측정 (그림 3A). PKH67는 주로 확산 모니터링 사용 하지만 또한 exosome 또는 liposome 통풍 관 뿐만 아니라 vivo에서 세포는 인신 매매에 대해서 모니터링 하는 데 유용 입증 되었습니다. 때문에 PKH67의 일반적인 라벨, EVs의 광범위 한 분류 고 감지 될 수 있습니다. 266 nm (x10) 및 1946 nm (x90) 857에서 최대 피크 사이의 범위에 있는 입자의 분포는 nm (x50)와 측정 사이 낮은 표준 편차 (28.1 nm). 램프-1, 일컬어 리소좀 관련 막 당단백질 1, 및 CD107a 거주 lysosomal 막에 걸쳐 주로. 541에서 최대 피크와 (x90) 220 nm (x10) 1145 nm에서 입자의 분포 범위는 알 렉 사 Fluor 488와 얼룩 표시 램프-1에 대 한 특정 항 체, 후 (x50) 및 11.7의 표준 편차 nm (그림 3B). EVs의 특성, 우리 알 렉 사 Fluor 488 라는 일반적인 exosomal 표시에 대 한 항 체를 사용 하 고 서양 blotting에 의해 우리의 연구 결과 확인. 알 렉 사 Fluor 488 표시 CD9-항 체와 얼룩, 후 251 nm (x10) 1139 nm (x90) 548에서 최대 피크에서 입자의 분포 범위 및 대략 25에서 두 번째 작은 피크 nm (그림 4A). CD63 라고 표시 된 알 렉 사 Fluor 488와 얼룩 (그림 4B)와 vimentin (그림 4C)와 비슷한 결과 굴복. 분석을 더럽혀 서 여기에 사용 되는 항 체에 대 한 우리의 긍정적인 결과 입증. 반복된 측정이이 보고서에 사용 된 모든 항 체에 대 한 재현성 결과 보여주었다. 컨트롤, 우리는 PKH67와 LAMP1 항 체는 거의 100%에 가까운 감도까지 아무 EV 감지 각각 항 체 (그림 5A), 소포 무료 물 스테인드. Vimentin의 예를 사용 하 여 샘플 본질적으로 자유 입자의 경우에 높은 감도, 신흥의 수를 증가. 드리프트는 아직 너무 높은 때 측정 시작 됩니다 (> 5 µ m/s), 개별 반복 분명히 (그림 5B) 그들 자신의 사이에서 이탈. 세 가지 서로 다른 항 체와 표현 되, 그것은 중요 한 측정을 시작 하기 전에 드리프트는 가능한 최소한 의입니다. 우리의 경험에 따르면 fluorescein isothiocyanate (FITC)를 사용 하 여 형광 색소로 측정 되지 않은 정확 하 고 재현성 FITC 빠른 사진 표백 (그림 5C) 하는 경향이 있기 때문에 발생 합니다. 따라서, 사용 하 여 독점적으로 알 렉 사 Fluor 488 EV 특성에 대 한 항 체를 표시 하는 것이 좋습니다. 이 프로토콜에서 EVs 폴리머 기반 exosome 강수량 솔루션 폴 리 에틸렌 글리콜을 포함 하 여 고립 되었다. 우리의 결과 적용된 절연 방법으로 위조 하지는 보장 하기 위해, 우리는 ultracentrifugation와 격리 후 EVs를 특징. PKH67와 두 개의 서로 다른 항 체 (CD63 및 램프-1) 대표, exosome 강수량 솔루션 (그림 6A) 격리 우리의 적용된의 결과 EVs 격리 를 통해 ultracentrifugation (그림 6B와 비교 ). 불행히도, ultracentrifugation 후 EVs의 가난한 수율, 때문에 절연에 대 한 혈 청의 초기 집합 해야 합니다 분명히 높은 비교 될 exosome 강수량 솔루션 격리.
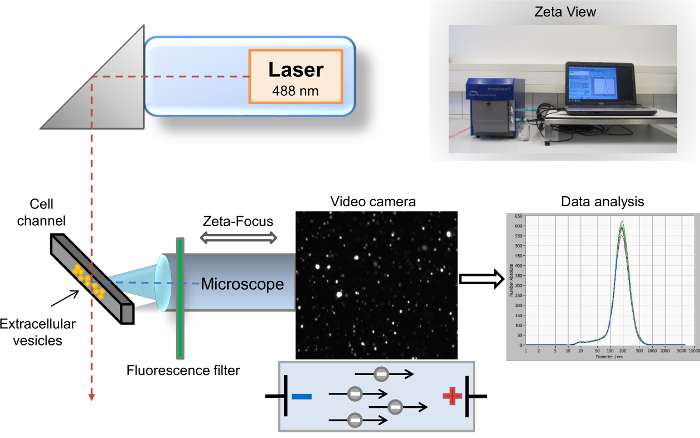
그림 1: 분석을 추적 하는 나노의 도식 설치. 현미경/비디오 축과 레이저 광선은 셀에서 교차 서로를 직교 방향의 단면을 채널. 형광 필터는 셀 채널과 현미경 사이 배치 됩니다. 빛 입자에 의해 흩어져 소프트웨어의 "라이브 뷰" 창에 표시 됩니다. 수집, 결과 크기 분포 곡선 좌표 시스템으로 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
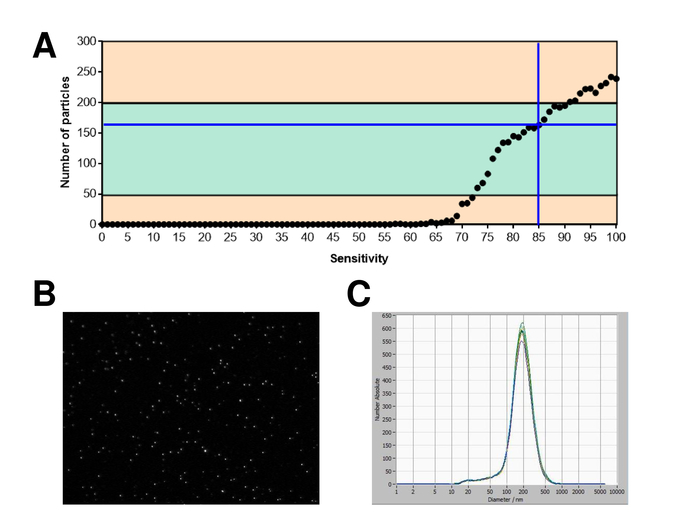
그림 2: 교정 형광 구슬 표시. (A) 입자 대 감도 곡선 수 자동 감도 검색 동안 시간에 한 시점에서 한 위치에서 입자를 표시 합니다. 라이브 뷰 화면에 입자의 (B) 시각화. (C) 입자 크기 반복된 측정 후 배포 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
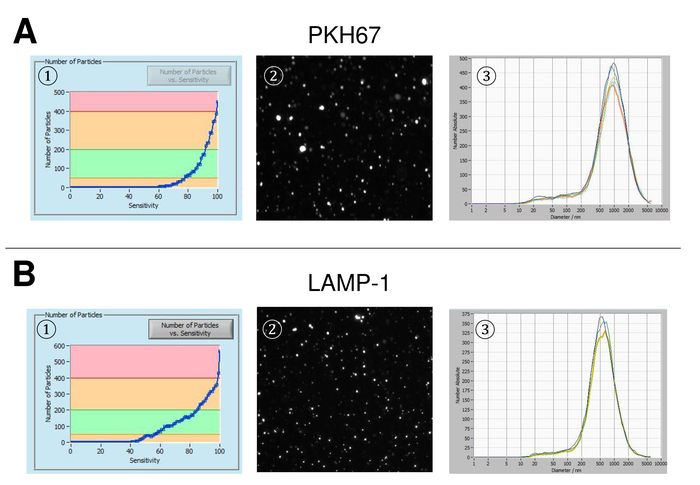
그림 3: 대표 결과 PKH67 및 램프-1 얼룩 후. 입자 대 감도 곡선 (1), (3) PKH67와 얼룩 후 라이브 뷰 화면 (2), 및 입자 크기 분포에 입자의 시각화의 수 (A) 및 램프-1 (B). 입자의 비슷한 크기 분포 검색 된 입자의 유사 하지만 아직 완전히 동일 하지 않은 변화에 리드를 설정 하는 감도에 변화 하는 동안 관찰 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
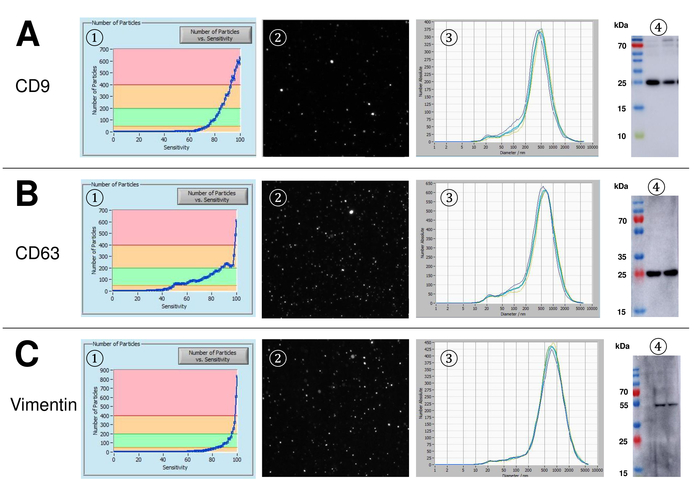
그림 4: 대표 결과 CD9, CD63, 및 vimentin 표시 알 렉 사 Fluor 488와 얼룩 후. 수 입자 대 감도 곡선 (1), (4) 대 한 CD9 라이브 뷰 화면 (2), 입자 크기 분포 (3), 및 두 개의 서로 다른 EV 정지의 대표적인 서양 오 점 입자의 시각화 (24-27 kDa, A), CD63 (26 kDa, B), 그리고 vimentin (54 kDa, C). 입자의 늦게 발생 신호 증가 감도 (x 축)을 따라 서쪽에서 낮은 신호 강도 가진 관계가 오 점 분석, 각 입자 표면 표식 (예를 들어, vimentin 대 의 낮은 금액을 확인 CD63)입니다. (3) 높은 재현성을 나타내는 모든 분석된 표식에 대 한 대표적인 측정의 거의 동일한 곡선 note 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
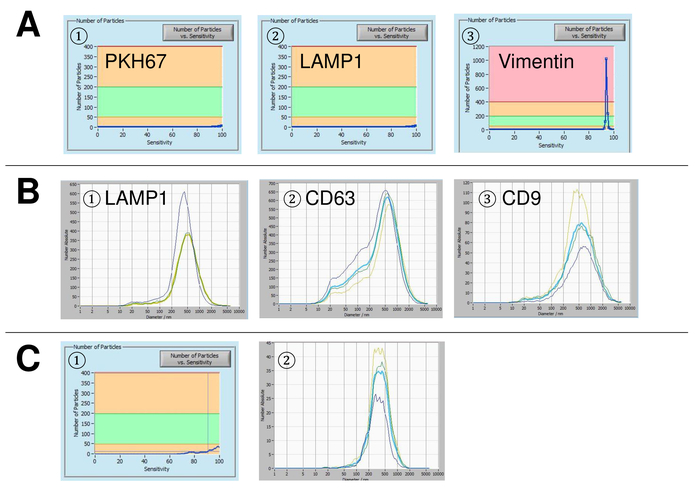
그림 5: 대표 사용된 컨트롤 및 가능한 오류 소스에 대 한 결과. (A) 기 무료 물 물 PKH67 (1), 램프-1 (2), 그리고 (3) 컨트롤로 vimentin. 램프-1 (1), CD63와 얼룩 후 (B) 대표 입자 크기 분포 (2), 그리고 CD9 (3) 측정 수행 때 서 스 펜 션 드리프트 아직 너무 높습니다. (C) 입자 대 감도 곡선 (1) 및 (2) FITC 표시 CD63 항 체와 얼룩 후 입자 크기 분포의 수입니다. 명확한 표백 효과 점차적으로 낮은 입자 수의 결과로 각 측정 후 관찰 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
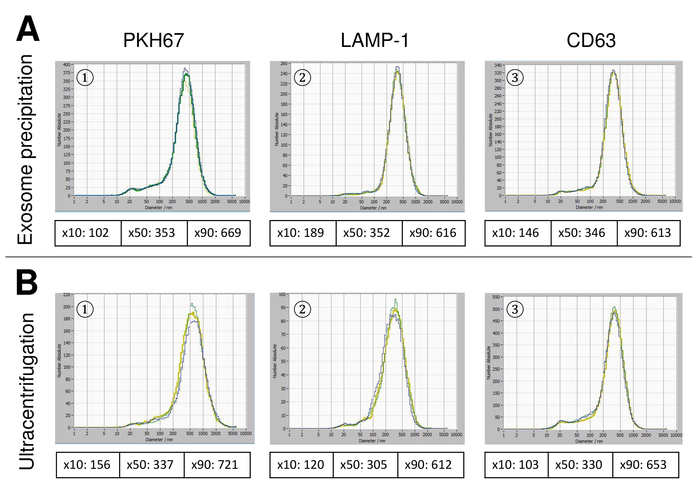
그림 6: EVs에 대 한 다양 한 격리 방법의 비교. EVs exosome 강수량 솔루션 (A)와 (B) ultracentrifugation PKH67와 얼룩 후 절연의 입자 크기 분포 (1), 램프-1 (2), 및 CD63 (3). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 램프-1 | CD9 | CD63 | Vimentin | |
| 항 체 (µ L) | 5 | 2.5-5 | 2.5-5 | 5 |
| EV 정지 (µ L) | 10 | 20 | 10 | 10 |
| H2O (µ L) 얼룩 | 50 | 50 | 50 | 50 |
| 마지막 볼륨 (mL) | 5-10 | 2.5-5 | 5 | 10 |
표 1: 목록 사용된 항 체 및 샘플의 희석 범위입니다.
| 인수 매개 변수 | |
| 감도 (%) | 85 |
| 셔터 | 70 |
| 최소 밝기 | 20 |
| 최대입니다. 크기 (nm) | 500 |
| 분 크기 (nm) | 20 |
| 극성 | 네거티브 |
| 전압 | 끄기 |
| 입자 드리프트 0 V (µ m/s) | < 5 |
| 위치 | 11 |
| 사이클 | 10 |
| 여러 획득 | 3-5 |
| 시간 지연 (최소) | 0 |
표 2: 나노 분석 추적에 대 한 매개 변수 수집.
토론
EVs의 격리에 대 한 자세한 프로토콜 분석 추적 형광 기반 나노 입자와 전체 혈액 및 특정 표면 마커의 빠른 특성에서 설명 합니다. 실시 실험에서 우리가 독점적으로 EVs에서 혈 청 샘플, 절연을 사용 하지만이 방법은 ethylenediaminetetraacetic 산 (EDTA) 및 citrated 플라즈마에 적합 하 고 또한 소변, 모유, 타 액, 다른 체액에 확장 될 수 있습니다. 중추 신 경계, 그리고 정액입니다. 또한,이 프로토콜은 셀 문화 supernatants에서 EVs의 특성화에 대 한 조정할 수 있습니다. 이 프로토콜에서 EV의 서 스 펜 션은 부드럽게 30에서 배열 하는 미 립 자 크기에 따라 exosomes 및 EVs를 침전 하는 독자적인 폴리머를 포함 한 exosome 강 수 시 약을 사용 하 여 혈 청의 100 μ에서 생성 된 200 nm nm, 그것에 의하여 10-20 μ EVs의 각 표면 표식의 특성에 대 한 임명 되었다. 불행히도, 격리 단계 불가피 하다, 혈 청 샘플 (예를 들어, 알 부 민 그리고 글로불린)에 단백질의 높은 금액 절차를 얼룩이 지는 항 체 방해 배경 및 정교한 결과의 높은 수준에 결과 때문에. 또한, 샘플에서 exosomes의 생물학 가용성에 따라, 처리 하기 전에 희석 고용된 EV 서 스 펜 션의 양은 해야 합니다 조정할 수 다른 소스 재료에 대 한. 여러 샘플을 비교, 일관성 있는 수집 매개 변수 (감도, 셔터, 등) 뿐만 아니라 샘플의 희석에 대 한 표준화 된 접근은 필요 합니다. 또 다른 중요 한 점은 측정 드리프트 (우리의 손에, < 5 μ m/s) 낮은 될 때까지 시작 되지 있습니다. 드리프트 너무 높은 경우, 반복된 측정 샘플의 굴복, 그들 자신의 사이에서 높은 표준 편차 그러나 낮은 드리프트, 결과 데이터 매우 일관 했다 재현성의 높은 수준을 확인. 선택 된 항 체는 적절 한 형광 색소는 중요 하다. FITC 사진 표백의 높은 비율을가지고 있기 때문에 알 렉 사 Fluor 488와 항 체를 활용 해야 합니다. 가능성이 더 안정적인 fluophores 이어질 것입니다 확실히 증가 분석 결과 안정성 미래에. 일반적으로, 많은 연구원은 사용 하 여 PBS를 희석제로 EV미 에 대 한 이 프로토콜에 대 한 희석 액으로 증류수를 사용 하 여 EV 정지에 대 한 결정적 이다. 측정을 방해할 수 있습니다 때 EVs와 fluorescing 염료, 높은 osmolality PBS, 같은 다른 diluents의 이온 농도 표시는 그리고 이어질 변경 결과.
여전히 격리 및 EV미 의 특성화에 대 한 표준화 된 방법 동안 EVs의 분석에 대 한 방법을 지난 10 년간 상당히 향상 되었습니다, 어디 EVs는 종종 바인딩할 구슬에 더 큰 표면을 제공, cytometry의 주요 단점은 많은 EVs10강하고 감지 신호 제공 하기 위해 표면에 고정. SEM과 TEM 샘플의 준비 시간이 많이 걸리는 이며 EVs만11그들의 크기 및 형태 의해 구별 될 수 있다는 단점이 있다. 최대 날짜, 질적 (즉, 생화학)에 대 한 best-established 및 일반적으로 사용 방법 EV 특성화는 서양 더럽혀, 이벤트는 특정 항 체12,13의 단백질 분석. 그러나, 이러한 모든 방법의 단점은 특정 표면 표식에 대 한 단일 EVs를 분석 하는 무 능력에 거짓말. 또한, 긴 처리 시간 및 현재 프로토콜의 많은 것에 의해 사용 되는 긴 세척/격리 절차 높은 샘플 처리량과 하나의 EV미 의 특성에 적합 하지 않은 그들을 만드는 노동 집약적인 단계를 포함 우리의 프로토콜 CD63, CD9, vimentin, CD107a, 등 특정 표면 마커 빠른 격리와 단일 EVs의 특성에 대 한 완벽 한 워크플로우를 제공 하 고 광범위 한 다른 표면 마커의 원산지 결정에 대 한 확장 될 수 있다 출시 된 EV미 NTA 장치의 영구적인 기술 발전, 때문에 우리는 우리의 연구 결과를와 최신 분석기 제조 업체와 협력에서을 확인 했다. EV 생물학, 특히 exosomes에 관하여에 대 한 연구의 진행 하는 미래 상황에 관계 없이 여기에 표시 되는 프로토콜 특정 마커 단일 EVs의 특성에 대 한 신속 하 고 안정적인 방법을 제공 합니다. 격리 및 얼룩 절차 동안 EVs의 집계 지금까지 피할 수는, 때문에 미래 연구 EV 집계를 방지 하 고 형광 표시 된 EV미 의 정확한 크기 결정을 사용 하는 방법을 개발에 초점을 맞추어야
공개
저자는 공개 없다.
감사의 말
저자는 부분적으로이 작품의 출판 비용을 커버에 대 한 입자 메트릭스 GmbH를 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Serum-separation tube | BD | 366882 | BD Vacutainer |
| Ampuwa water | Fresenius Kabi | 10060 | |
| Dulbecco's phosphate-buffered saline | Sigma | 56064C | |
| Falcon tube, 15 mL | Greiner Bio One | 188271 | |
| Falcon tube, 50 mL | Greiner Bio One | 227270 | |
| Microcentrifuge tube, 1.5 mL | Eppendorf | 30120086 | Speciality tubes for ultra centrifugation |
| Tube with Snap-On Cap 1.5 mL | Beckman Coulter | 357448 | |
| Polybeads Microspheres 0.2 µm | Polysciences, Inc. | 7304 | Alignment Solution |
| Fluoresbrite YG Carboxylate Microspheres beads 0.2 µm | Polysciences, Inc. | 09834-10 | Alignment Solution |
| Syringe, 2 mL | Braun | 4606027V | |
| Syringe, 10 mL | Braun | 4606728V | |
| Exoquick | SBI | EXOQ20A-1 | EV precipitation solution |
| Laemmli Sample Buffer (2x) | BioRad | 1610737 | |
| DC Protein Assay Kit II | BioRad | 5000112 | Lowry prtein assay |
| PKH67 Green Fluorescent Cell Linker Kit | Sigma | PKH67GL-1KT | For general membrane labelling |
| Alexa Fluor 488 anti-human CD107a Antibody | BioLegend | 328609 | Lysosomal-associated membrane protein-1 (LAMP-1) |
| Human CD9-Alexa Fluor 488 | R&D Systems | FAB1880G | |
| Anti-CD9 Antibody | SBI | EXOAB-CD9A-1 | |
| CD63-Alexa Fluor 488 | ThermoFisher | MA5-18149 | |
| FITC anti-human CD63 Antibody | BioLegend | 353005 | |
| CD63. Antibody, polyclonal | SantaCruz | Sc-15363 | |
| Alexa Fluor 488 anti-vimentin Antibody | BioLegend | 677809 | |
| Anti-Vimentin Antibody | SBI | EXOAB-VMTN-1 | |
| Goat anti mouse IgG + IgM | Jackson Immuno | 315-035-048 | |
| Goat anti rabbit IgG | Dianova | 111-035-003 | |
| SuperSignal West Femto Maximum Sensitivity Substrate | ThermoFisher | 34094 | |
| ZetaView | Particle Metrix | PMX 100, Type | |
| Centrifuge | Eppendorf | 5804R | |
| Ultracentrifuge | Beckman Coulter | Optima MAX-XP | |
| Chemiluminescence Imager | GE Healthcare | Amersham Imager 600 |
참고문헌
- Ibrahim, A., Marban, E. Exosomes: Fundamental Biology and Roles in Cardiovascular Physiology. Annual Review of Physiology. 78, 67-83 (2016).
- Su, S. A., et al. Emerging role of exosome-mediated intercellular communication in vascular remodeling. Oncotarget. 8 (15), 25700-25712 (2017).
- Lasser, C., et al. Human saliva, plasma and breast milk exosomes contain RNA: uptake by macrophages. Journal of Translational Medicine. 9, 9 (2011).
- Li, M., et al. Analysis of the RNA content of the exosomes derived from blood serum and urine and its potential as biomarkers. Philosophical Transactions of The Royal Society B Biological Sciences. 369 (1652), (2014).
- Lin, J., et al. Exosomes: novel biomarkers for clinical diagnosis. The Scientific World Journal. 2015, 657086 (2015).
- Properzi, F., Logozzi, M., Fais, S. Exosomes: the future of biomarkers in medicine. Biomarkers in Medicine. 7 (5), 769-778 (2013).
- Thery, C., Zitvogel, L., Amigorena, S. Exosomes: composition, biogenesis and function. Nature Reviews Immunology. 2 (8), 569-579 (2002).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203 (2015).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Current Protocols in Cell Biology. , (2006).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. Journal of Visualized Experiments. (97), (2015).
- Wu, Y., Deng, W., Klinke, D. J. Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. Analyst. 140 (19), 6631-6642 (2015).
- Bianco, N. R., Kim, S. H., Morelli, A. E., Robbins, P. D. Modulation of the immune response using dendritic cell-derived exosomes. Methods in Molecular Biology. 380, 443-455 (2007).
- Conde-Vancells, J., et al. Characterization and comprehensive proteome profiling of exosomes secreted by hepatocytes. Journal of Proteome Research. 7 (12), 5157-5166 (2008).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments. (95), 50974 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유