Method Article
In vivo Messung der Kniestreckmuskelfunktion bei Mäusen
In diesem Artikel
Zusammenfassung
Die Quantifizierung der maximalen Kniestreckkraft ist unerlässlich, um funktionelle Anpassungen an Alterung, Krankheit, Verletzung und Rehabilitation zu verstehen. Wir stellen eine neuartige Methode vor, um das isometrische Spitzentitanmoment der Kniestreckung wiederholt in vivo zu messen.
Zusammenfassung
Skelettmuskelplastizität als Reaktion auf unzählige Zustände und Reize vermittelt gleichzeitige funktionelle Anpassung, sowohl negativ als auch positiv. In der Klinik und im Forschungslabor wird die maximale Muskelkraft beim Menschen weitgehend longitudinal gemessen, wobei die Kniestreckmuskulatur das am häufigsten berichtete funktionelle Ergebnis ist. Pathologie des Kniestreckmuskelkomplexes ist gut dokumentiert bei Alterung, orthopädischen Verletzungen, Krankheit und Nichtgebrauch; Die Kniestreckkraft hängt eng mit der Funktionsfähigkeit und dem Verletzungsrisiko zusammen, was die Bedeutung einer zuverlässigen Messung der Kniestreckkraft unterstreicht. Die wiederholbare In-vivo-Bewertung der Kniestreckkraft in präklinischen Nagetierstudien bietet wertvolle funktionelle Endpunkte für Studien zur Erforschung von Arthrose oder Knieverletzungen. Wir berichten über ein In-vivo- und nicht-invasives Protokoll zur wiederholten Messung des isometrischen tetanischen Spitzendrehmoments der Kniestreckmuskeln bei Mäusen im Laufe der Zeit. Wir demonstrieren Konsistenz mit dieser neuartigen Methode zur Messung der Kniestreckkraft mit wiederholter Beurteilung bei mehreren Mäusen, die ähnliche Ergebnisse erzielen.
Einleitung
Skelettmuskel ist ein hochgradig anpassungsfähiges Gewebe mit kompensatorischen Veränderungen von Masse und Struktur als Reaktion auf eine Vielzahl von Reizen wie Bewegung, Ernährung, Verletzungen, Krankheit, Alterung und Nichtgebrauch. Viele Studien, die die Anpassung der Skelettmuskulatur beim Menschen untersuchen, verwenden Methoden, um sowohl die Skelettmuskelgröße als auch den Einfluss auf die Funktion zu messen, da Goldstandard-Kraftbewertungen bei menschlichen Probanden leicht wiederholbar sind.
Insbesondere Kniestreck- und Beugefestigkeit werden in der klinischen Forschung am meisten bewertet. Veränderungen der Kniestreckkraft wurden in Humanstudien über Alterung, Bewegung, orthopädische Verletzungen, Kniearthrose, chronische Erkrankungen und Nichtgebrauch1,2,3,4,5,6,7weit verbreitet . Die Methoden zur wiederholten und nicht-invasiven Analyse der Kniestreckmuskelstärke (Quadrizeps) in mechanistischen Nagetierstudien waren jedoch relativ begrenzt. Eine Methode zur Bestimmung der In-vivo-Quadrizepsmuskelkontraktilität bei Ratten wurde zuvor entwickelt8; Es ist jedoch ein umfangreicher Bau von nicht kommerziell verfügbaren Geräten erforderlich. Angesichts der Breite der Nagetiermodelle, die zur Untersuchung der muskuloskelettalen Ergebnisse nach Knieverletzungen/Osteoarthritis entwickelt wurden9,10,11,12,13 besteht ein Bedarf an nicht-invasiver Beurteilung der Quadrizepsstärke.
Darüber hinaus verwenden Nagetierstudien, die molekulare Mechanismen untersuchen, die die Anpassung der Skelettmuskulatur untermauern, aufgrund der Einfachheit der genetischen Veränderung häufig Mausmodelle, ebenso wie viele pharmakologische Interventionsstudien aufgrund der geringeren finanziellen Kosten, die mit einer geringeren gewichtsbasierten Dosierung eines Arzneimittels bei Mäusen im Vergleich zu Ratten verbunden sind. Wir berichten über eine nicht-invasive Methode zur wiederholten Messung der In-vivo-Kniestreckfunktion in derselben Maus im Laufe der Zeit mit kommerziell erhältlichen Geräten mit geringfügigen Modifikationen, was die Reproduzierbarkeit zwischen verschiedenen Labors erleichtert und einen direkteren Vergleich mit den Ergebnissen der menschlichen Stärke ermöglicht.
Protokoll
Alle experimentellen Verfahren wurden vom Institutional Animal Care and Use Committee der University of Kentucky genehmigt.
1. Einrichtung der Ausrüstung
- Vergewissern Sie sich, dass die Maschinen gemäß den Herstellerangaben angeschlossen sind.
- Falls noch nicht vorhanden, befestigen Sie den Motor 300D-305C-FP mit Kniestreckvorrichtung an der Tierplattform 809C.
- Schalten Sie die Wasserpumpe auf 37 °C ein, um mit der Erwärmung der Plattform zu beginnen.
- Wenn der Computer noch nicht eingeschaltet ist, schalten Sie den Computer ein, gefolgt vom High-Power Bi-Phasen-Stimulator und dem 2-Kanal-Dual-Mode-Hebelsystem.
- Gießen Sie Isofluran in den Vaporizer bis zur maximalen Fülllinie.
2. Software-Einrichtung
- Öffnen Sie die Software (Details finden Sie in der Materialtabelle).
- Um die Sofortstimulationsfunktion in Verbindung mit Live Data Monitor zur Optimierung der Sondenplatzierung zu verwenden (Schritt 4), wählen Sie Experiment vorbereiten, gefolgt von Instant Stim konfigurieren ( Abbildung1). Legen Sie die Pulsfrequenz (Hz) auf 125, die Pulsbreite (ms) auf 0,2, die Anzahl der Impulse auf 1, die Zugfrequenz (Hz) auf 0,5 und die Laufzeit (s) auf 120 fest.
- Wählen Sie Datei und öffnen Sie Live Data Monitor.
- Um Zuckungs- (Schritt 5) und Drehmomentfrequenz- (Schritt 6) Experimente durchzuführen, wählen Sie eine zuvor programmierte Studie aus, die geeignete Zuckungs- und Kniestreckungs-Drehmomentfrequenzexperimente enthält (siehe unten in Schritt 5 und Schritt 6).
- Wählen Sie die entsprechende Versuchsmaus oder Neues Tier hinzufügen und geben Sie entsprechende Mausinformationen ein, die mit Drehmomentdaten gespeichert werden sollen.
- Wählen Sie Nächstes Experiment oder Vorheriges Experiment, um vom Zuckungsprotokoll zur Drehmoment-Frequenz-Sequenz zu wechseln.
3. Maus einrichten
- Legen Sie eine einzelne Maus in die Anästhesiekammer.
- Lassen Sie das Sauerstofftankventil los und stellen Sie den Sauerstoffdurchfluss auf 1 l / min mit 2,5% Isofluran ein.
- Stellen Sie sicher, dass die Maus in der Kammer bleibt und den Deckel sicher geschlossen hat, bis sie vollständig bewusstlos ist. Bestätigen Sie den vollständigen Bewusstseinsverlust durch fehlenden Fußreflex mit Zehenklemme.
- Platzieren Sie die betäubte Maus in Rückenlage mit dem Kopf im Nasenkon auf der beheizten Plattform mit Sauerstoffflussrate bei 1 L / min mit 2,5% Isofluran.
- Rasieren Sie Haare von der rechten Hintergliedmaße mit elektrischen Clippern. Entfernen Sie die Haare aus dem rasierten Bereich mit einem Alkoholtuch und einem kleinen Vakuum. Reinigen Sie die entfernten Haare von der Hintergliedmaße und der Plattform.
- Klemmen Sie die obere Hintergliedmaße, hinter dem Knie, sicher ein (Abbildung 2).
HINWEIS: Stellen Sie sicher, dass der Bewegungsumfang des Knies nicht beeinträchtigt wird. - Legen Sie die untere Hintergliedmaße in das Kniestreckgerät, wobei die vordere Tibia das verstellbare Kunststoffstück leicht berührt (die Force In-Kanal-Ablesung sollte zwischen 0 und -1,0 mN * m lauten). Abhängig von der Größe der unteren Hintergliedmaße der Maus kann chirurgisches Klebeband um den unteren Teil des verstellbaren Kunststoffstücks gewickelt werden, damit das Bein sicher ruhen kann.
HINWEIS: Detaillierte Bilder und Abmessungen des speziell angefertigten Kunststoffstücks sind in der ergänzenden Abbildung 1 dargestellt. - Stellen Sie die Knöpfe auf der Plattform ein, um sicherzustellen, dass das Knie um 60 ° gebeugt ist.
- Legen Sie leicht ein Stück Klebeband über den Mauskörper auf die Plattform, um eine kompensatorische Bewegung mit maximaler Kniestreckung zu verhindern.
4. Platzierung der Elektrode
- Platzieren Sie die Elektroden subkutan 2-4 mm proximal zum Knie direkt über den Quadrizeps-/Kniestreckmuskeln (Abbildung 2). Elektroden sollten etwa 1-2 mm voneinander entfernt sein.
- Um die optimale Platzierung von Elektroden zu bestimmen, verwenden Sie die Instant Stimulation-Funktion mit Live Data Monitor. Stellen Sie die Stromzahl / den Strom auf 50 mA für wiederholte Zuckungen ein, um die Kniedehnung zu bestätigen (die Kniestreckmuskeln erzeugen eine negative Zuckungskurve). Stellen Sie die Sonden während der Sofortstimulation ein, um ein maximales Kniestreckzuckungsmoment zu erreichen, das im Live Data Monitor-Fenster gemessen wird.
HINWEIS: Abbildung 3 zeigt einen repräsentativen Instant Stimulation-Ausgang, der die Kniestreckung bestätigt. Ergänzendes Video 1 und Ergänzendes Video 2 zeigen Kniestreckzuckungen in Echtzeit und in Zeitlupe, ohne dass der Motorarm an Ort und Stelle ist, was eine visuelle Bestätigung der Kniestreckung ermöglicht. - Bei wiederholten Zuckungen mit Instant Stimulationtasten Sie die Kniebeugermuskeln mit dem Zeigefinger ab, um zu bestätigen, dass keine Aktivierung der Antagonistenmuskeln erfolgt. Um Kniestrecker maximal zu stimulieren, kann eine Sondenneupositionierung erforderlich sein, abhängig von der Körperzusammensetzung der Maus und leichten anatomischen Unterschieden in der genauen Lage des motorischen Punktes des Femurnervs und der Kniestreckmuskulatur.
HINWEIS: Ein muskelmotorischer Punkt ist die Stelle, an der der motorische Ast eines Nervs in den Muskelbauch eintritt und ist der Punkt mit dem geringsten Widerstand gegen elektrische Leitfähigkeit und anschließend der höchsten Reaktionsfähigkeit auf elektrische Stimulation14,15. In klinischen Anwendungen mit elektrischer Stimulation wird dieser Punkt durch Scannen mit einer Stiftelektrode identifiziert, um die Stelle über dem Muskel zu finden, an der ein Muskelzucken mit dem niedrigsten injizierten Strom14,15auftritt. Die Identifizierung des motorischen Muskelpunkts ist unerlässlich, um eine optimale neuromuskuläre elektrische Stimulation zu ermöglichen15. In klinischen Studien am Menschen wurden muskelmotorische Punkte für Quadrizepsmuskeln in der distalen Hälfte des Muskelsidentifiziert 14. Um eine optimale Kniestreckenstimulation bei Mäusen zu erreichen, wurde diese Technik unter Verwendung der Elektrodenplatzierung mit Instant Stimulation rekapituliert, um die Muskelmotorpunktpositionen, die typischerweise in der distalen Hälfte der Kniestreckmuskeln zu finden sind, am ehesten anzunähern. Es gibt eine gewisse Variabilität bei der Platzierung der Elektroden (von relativ oberflächlich bis tief), die zu einem maximalen Drehmoment führt, und die Instant Stimulation-Funktion erleichtert eine optimale Platzierung der Elektroden.
5. Bestimmung des optimalen Stroms
- Sobald die optimale Platzierung der Sonde bestimmt ist, führen Sie eine Reihe von progressiven Zuckungen durch, um die optimale Stromkraft / den optimalen Strom zu bestimmen, der für das Drehmoment-Frequenz-Experiment verwendet werden soll, mit dem Ziel, den niedrigsten Strom zu bestimmen, um die maximale Zuckungsdrehmomentleistung zu erreichen. Beginnen Sie mit dem aktuellen Satz bei 50 mA und wählen Sie Experiment ausführen, um ein einzelnes Zucken zu erzeugen. Wählen Sie Ergebnisse analysieren aus, um die Drehmomentabgabe anzuzeigen. Zeichnen Sie das unter Max Force angezeigte Zuckungsmoment mit subtrahierter Basislinie auf.
HINWEIS: Wählen Sie die Option zum Umkehren des Kraftkanals, um Messungen von negativem Drehmoment in positive umzuwandeln. - Erhöhen Sie den Strom auf 60-70 mA und wiederholen Sie das Zuckungsexperiment. Zeichnen Sie das unter Max Force angezeigte Zuckungsmoment mit subtrahierter Basislinie auf.
- Fahren Sie mit einer Reihe von Zuckungsexperimenten auf diese Weise fort (mit jeder Progression um ca. 10-20 mA erhöhen), bis das Zuckungsmoment nicht mehr zunimmt (entweder plateaut oder abnimmt). Ein Beispiel für Twitch-Serien ist in Tabelle 1 dargestellt.
- Zeichnen Sie den niedrigsten Strom auf, bei dem das höchste Zuckungsmoment erreicht wurde. Dieser Strom wird während des bevorstehenden Kraft-Frequenz-Experiments verwendet und konstant bleiben. Abbildung 4 zeigt ein repräsentatives Spitzenzucken.
6. Drehmoment-Frequenz-Experiment zur Bestimmung des isometrischen tetanischen Spitzendrehmoments
- Wählen Sie in der Software (siehe Materialtabelle)das vorprogrammierte Drehmoment-Frequenz-Experiment zur Kniestreckung aus, um folgende Einstellungen zu gewährleisten. Reizdauer: 0,35 s, Frequenzfolge: 10 Hz, 40 Hz, 120 Hz, 150 Hz, 180 Hz, 200 Hz, Ruhezeit zwischen Impulsen/Kontraktionen: 120 s
HINWEIS: Die Abtastrate beträgt 10.000 Hz (Standardeinstellung). - Führen Sie ein Experimentdurch, analysieren Sie die Ergebnisseund zeichnen Sie das unter Max Force angezeigte Drehmoment mit subtrahierter Basislinie (stellen Sie sicher, dass der Kraftkanal invertiert ist, da die Kniestreckenkontraktion ein negatives Drehmoment erzeugt) bei jeder Frequenz auf. Beachten Sie den höchsten Maximalkraftwert als isometrisches tetanisches Spitzendrehmoment. Ein Beispiel für Drehmoment-Frequenz-Daten ist in Tabelle 2 dargestellt und Abbildung 5 zeigt eine repräsentative Tetanuskurve für die isometrische tetanische Spitzendrehmomentleistung, die bei 120 Hz erreicht wird.
7. Beendigung des Experiments
- Führen Sie nach Abschluss des Drehmoment-Frequenz-Experiments ein Follow-up-Zucken durch und vergleichen Sie es mit dem anfänglichen Spitzenzucken bei gleichem Strom, um Schäden / Ermüdung zu beurteilen.
HINWEIS: In einigen Modellen von Verletzungen und Krankheiten wird eine erhöhte Ermüdbarkeit der Skelettmuskulatur erwartet und stellt kein Problem mit dem Versuchsaufbau oder der Maus dar. - Wenn alle Drehmomentmessungen abgeschlossen sind, entfernen Sie vorsichtig die Elektrodensonden und entknaufen Sie das Knie.
- Schalten Sie Isofluran aus und entfernen Sie die Maus aus dem Nasenkegel.
- Legen Sie die Maus wieder in einen geeigneten Käfig, der auf einem Wärmekissen platziert ist. Überwachen Sie, wie sich die Maus erholt und das Bewusstsein wiedererlangt.
HINWEIS: Die Maus sollte bei Bewusstsein sein und sich innerhalb von 2-3 Minuten bewegen.
8. Datenanalyse
- Extrahieren Sie daten nach dem Experiment aus der Analysesoftware (siehe Materialtabelle).
- Offene Analysesoftware.
- Wählen Sie Daten aus der Software abrufen aus.
- Wählen Sie Datum, an dem das Experiment durchgeführt wurde, und den entsprechenden Mauscode aus.
- Wählen Sie die gewünschte Frequenz (alle Zuckungsexperimente und jede Frequenz des Drehmoment-Frequenz-Experiments wird aufgelistet).
- Wählen Sie Muskelanalyse.
- Vergewissern Sie sich, dass Baseline-Korrektur verwenden aktiviert ist.
HINWEIS: Das Basisdrehmoment wird von der Software als Durchschnitt der ersten 100 abgetasteten Punkte berechnet und vom absoluten maximalen Drehmomentwert abgezogen. - Notieren Sie den unter Maximumaufgeführten Drehmomentwert.
HINWEIS: Die hier dargestellten Daten sind ungefiltert; Auf Wunsch kann jedoch ein Filter in der Software ausgewählt werden.
- Alternativ können Sie, wie oben in Schritt 6.2 beschrieben, das unter Max Force angezeigte Drehmoment in Echtzeit bei jedem Drehmoment-Frequenz-Punkt/jeder Kontraktion manuell über das Fenster Ergebnisse analysieren aufzeichnen.
- Vergewissern Sie sich, dass die Basislinie subtrahiert und der Kraftkanal invertiert ist.
- Geben Sie Daten in eine Tabelle für Berechnungen zur Normalisierung des Körpergewichts (Drehmoment / Körpergewicht in Gramm) und zur grafischen darstellung und statistischen Analyse von Interesse ein. Statistische Software wurde verwendet, um Drehmoment-Frequenz-Kurven grafisch darzustellen und die Fläche unter der Kurve zu berechnen.
HINWEIS: Drehmomentdaten werden in mN.m (milliNewton.meters) gemessen.
- Um Tetanuskurven zu generieren, exportieren Sie vollständige Daten aus jeder Frequenz aus der Analysesoftware.
- Wiederholen Sie die Schritte 8.1.1-8.1.4 oben.
- Wählen Sie Daten exportierenaus.
- Wählen Sie Rohe gefilterte Daten aus und speichern Sie sie am Speicherort Ihrer Wahl. MATLAB kann verwendet werden, um Tetanuskurven aus der exportierten Textdatei zu generieren und/oder zur weiteren Analyse.
HINWEIS: MATLAB-Code zum Generieren der Tetanuskurve aus einer Textdatei ist auf Anfrage erhältlich.
9. Dual-Mode-Hebelsystemkalibrierung
- Kalibrieren Sie das System vor der ersten Verwendung, um genaue und zuverlässige Daten zu gewährleisten, und wiederholen Sie die Kalibrierung regelmäßig mit der Datenerfassungssoftware und bekannten Gewichten.
- Offene Datenerfassungssoftware.
- Klicken Sie auf die Registerkarte Setup und wählen Sie Kanal-Setup.
- Wählen Sie 305C-FP unter Meine Instrumente aus.
- Klicken Sie auf Ausgewählt kalibrieren, um das Fenster Kalibrierungseditor zu öffnen.
- Um die Länge zu kalibrieren, geben Sie eine Reihe von Prüfspannungen ein, einschließlich negativer und positiver Spannungen (z. B. -3, -2, -1, 0, 1, 2, 3 V).
- Klicken Sie für die erste Zeile auf Festlegen.
- Klicken Sie auf Lesen.
- Messen Sie die genaue Länge des Hebelarms in Millimetern und geben Sie sie in die entsprechende Box ein.
- Wiederholen Sie den Vorgang für die nächste Spannung.
- Klicken Sie bei der Aufzeichnung aller Spannungen auf Cal Factors berechnen (aufgezeichnet in mm/Volt).
- Um die Kraft zu kalibrieren, verwenden Sie eine Reihe bekannter Gewichte, die in einer linearen Progression zunehmen.
- Stellen Sie den Motor so ein, dass er auf der Kante der Bank oder des Tisches mit dem Hebelarm parallel zur Tischplatte ruht und über der Kante hängt, damit das Gewicht hängen kann.
- Hängen Sie das erste Gewicht mit einem Gummiband vom Hebelarm auf. Geben Sie unter Angewendete Kraftdas bekannte Gewicht in Gramm ein, das die Masse des Gummibands berücksichtigt.
- Wählen Sie Lesenaus.
- Wiederholen Sie dies für mindestens 3 bekannte Gewichte.
- Wählen Sie Cal Factor berechnenaus.
- Um die Berechnung zu überprüfen, zeichnen Sie Die Kalibrierungsdaten und die Kurvenpassung auf, indem Sie Plot Cal auswählen.
- Um die Kraftabtrieb zu kalibrieren, geben Sie Kalibrierspannungen (bis zu 10 Volt) ein.
- Klicken Sie direkt neben der Kalibrierspannung auf Festlegen.
- Wiederholen Sie den Vorgang für jede Spannungsleitung.
- Drücken Sie den Hebelarm vorsichtig mit einem Finger aus, bis sich das Force Out nicht mehr ändert und sich der Motorarm zu bewegen beginnt.
- Behalten Sie diese Position bei. Wählen Sie Lesenaus.
- Wiederholen Sie den Vorgang für jede Spannungsleitung.
- Wählen Sie Cal Factor berechnenaus.
Ergebnisse
Die Drehmoment-Frequenz-Kurve nutzt niedrigere Frequenzen, um mehrere isolierte isometrische Zuckungen mit relativ niedrigem Drehmoment zu erzeugen, und schreitet durch immer höhere Frequenzen voran, was zu einer Fusion von Zuckungen für eine isometrische Tetanuskontraktion führt, bei der das maximale tetanische Drehmoment erreicht wird. Das vorgestellte Protokoll für die Kniestreckung des maximalen tetanischen Drehmoments, das die Kraft-Frequenz-Kurve bei 10 Hz einleitet, was 3 isolierte Zuckungen hervorruft. Die partielle Fusion von Zuckungen tritt bei 40 Hz auf, und das maximale tetanische Drehmoment wird zwischen 120-180 Hz erreicht(Abbildung 5).
Abbildung 6 zeigt repräsentative Drehmoment-Frequenz-Kurven der Kniestreckung von weiblichen C57BL/6-Mäusen. Drei separate Mäuse wurden zu Studienbeginn getestet, und das Experiment wurde 2 Wochen später in jeder Maus zum Vergleich wiederholt, um die Reproduzierbarkeit zu beurteilen. Drehmoment-Frequenz-Kurven werden mit Rohdrehmomentwerten (Abbildung 6A) sowie Rohdrehmomentwerten normalisiert auf Mauskörpergewicht (Abbildung 6B ) dargestellt. Wiederholte Beobachtungen zeigen vergleichbare Ergebnisse bei allen 3 Mäusen mit einer 2-wöchigen Ruhezeit zwischen den Experimenten. Normalisierte Drehmomentdaten des Körpergewichts sollten zusätzlich zum Rohdrehmoment berücksichtigt werden, da geringfügige Gewichtsschwankungen die Funktionsleistung beeinträchtigen können und nicht nur mit dem Rohdrehmoment berücksichtigt werden. Darüber hinaus erleichtern normalisierte Drehmomentdaten des Körpergewichts den Vergleich von Mäusen unterschiedlicher Größe. Das Drehmoment kann auch auf Muskelnässegewicht oder Myofiberquerschnittsfläche normalisiert werden, wie wir bereits gezeigt haben16.
Abbildung 7A zeigt den Bereich unter der Kurve unter Verwendung von normierten isometrischen Drehmomentdaten des Körpergewichts aus kompletten Drehmoment-Frequenz-Experimenten (10 Hz, 40 Hz, 120 Hz, 150 Hz, 180 Hz, 200 Hz) für 4 separate C57BL/6-Mäuse, wobei ähnliche Gesamtdrehmomentabgabe und Variationskoeffizienten zwischen 5,6% und 8,8% bei wiederholten Experimenten innerhalb derselben Mäuse hervorgehoben werden. Die Daten werden am einfachsten als maximales tetanisches Drehmoment(Abbildung 7B)gemeldet, das der maximale Drehmomentwert aus den wiederholten isometrischen Tetanuskontraktionen von 120-200 Hz ist. Die maximale tetanische Drehmomentabgabe ist bei 6-8 Monate alten weiblichen C57BL/6-Mäusen vergleichbar (Abbildung 7B) mit Variationskoeffizienten zwischen 4,8% und 8,7% mit Längsmessung innerhalb derselben Mäuse. Das maximale tetanische Drehmoment ist am ehesten mit der Goldstandard-Festigkeitsbewertung in Humanstudien vergleichbar: maximale isometrische Que.
Darüber hinaus ist das Knee Extensor Peak Tetanic Torque Protocol ein nützliches Werkzeug, um Festigkeitsunterschiede in mehreren Mausmodellen zu erkennen. Abbildung 8 zeigt den starken Kontrast zwischen der Kniestreckkraft bei einer unverletzten, gesunden 6 Monate alten C57BL/6-Maus (schwarze Linie) und einem transgenen Mausmodell der supraphysiologischen Hypertrophie, bei dem Myostatin/GDF8 ausgeknockt wird (blaue Linie). Wir zeigen auch eine Spitzen-Tetanuskurve einer C57BL/6-Maus 7 Tage nach der chirurgischen Transsektion des vorderen Kreuzbandes (ACL-T) (rote Linie), die einen Rückgang des spitzen Drehmoments nach einer Verletzung um fast 50% zeigt, der weit außerhalb der Variationskoeffizienten liegt, die bei wiederholten Tests von unverletzten Mäusen beobachtet wurden. Gleichzeitig mit den menschlichen Daten17,18ist die Stärke mit ACL-T deutlich verringert. Alle Mäuse sind weiblich und in ähnlichem Alter (6-8 Monate).
| Twitch-Experiment | Strom/Strom (mA) | Drehmoment (mN•m) |
| 1 | 50 | 1.279 |
| 2 | 70 | 1.341 |
| 3 | 90 | 1.36 |
| 4 | 110 | 1.362 |
| 5 | *130 | 1.449 |
| 6 | 150 | 1.436 |
| 7 | 140 | 1.333 |
Tabelle 1: Beispiel für Twitch-Serien. * bezeichnet optimale Stromstrom.
| Frequenz (Hz) | Drehmoment (mN•m) |
| 10 | 1.385 |
| 40 | 1.869 |
| 120 | *18.765 |
| 150 | 18.375 |
| 180 | 17.97 |
| 200 | 17.548 |
Tabelle 2: Beispiel für Drehmoment-Frequenz-Kurvendaten. * bezeichnet das maximale tetanische Drehmoment.
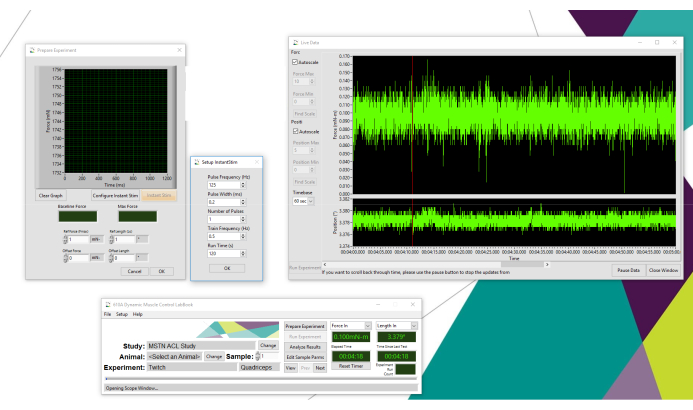
Abbildung 1:Einrichtung der Datenerfassungssoftware. Illustration der Einrichtung von Datenerfassungssoftware mit Live Data Monitor. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Mausaufbau und Elektrodenplatzierung. (A-B) Rückenlage der Maus, die über einen Nasenkegel auf der beheizten Plattform betäubt wird. Die obere Hintergliedmaße ist sicher geklemmt, hinter dem Knie, um eine uneingeschränkte Bewegung am Kniegelenk zu ermöglichen. Der Motorarm ist so eingestellt, dass das Knie um ca. 60° gebeugt ist. Der motorische Punkt des Femurnervs wird durch Nadelelektroden stimuliert, um die Kontraktion von Kniestreckmuskeln zu aktivieren. Die Mauseinrichtung wird aus einer Seitenansicht (A) und einer Overhead-Ansicht ( B )angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
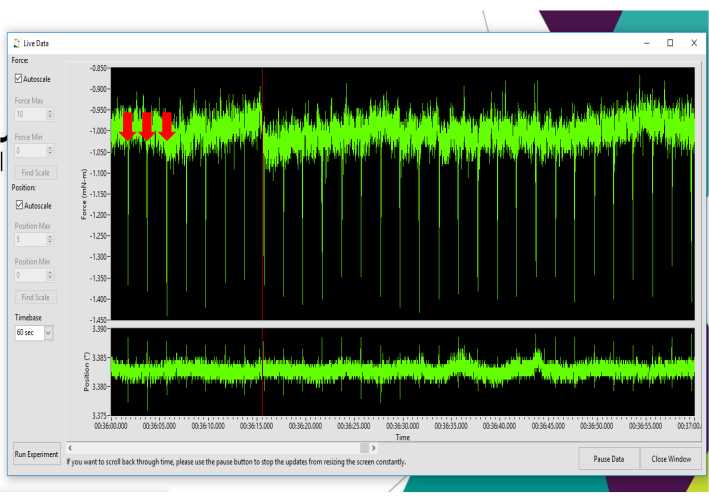
Abbildung 3: Bestimmung der optimalen Elektrodenplatzierung zur Isometrie-Kniestreckung. Darstellung wiederholter negativer Zuckungen, die mit 50 mA über die Instant Stimulation-Funktion stimuliert und im Live Data Monitor angezeigt werden. Rote Pfeile zeigen die ersten drei Kniestreckzuckungen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
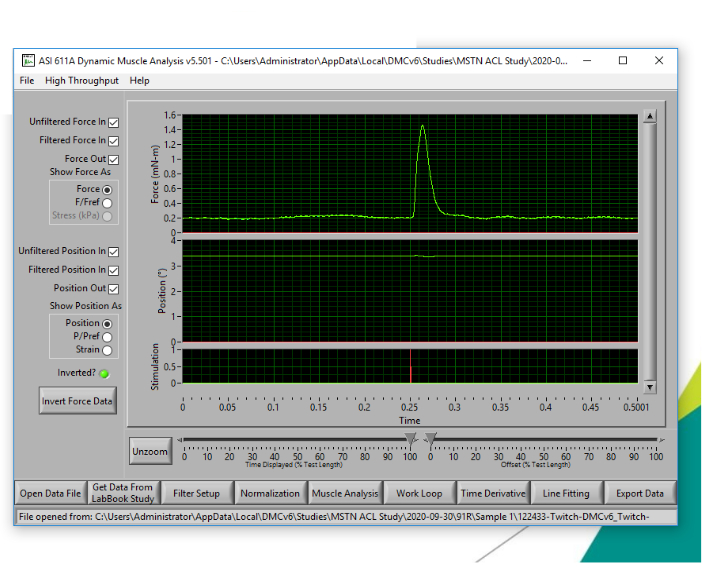
Abbildung 4: Repräsentatives Zucken zur Bestimmung der optimalen Stromzahl. Die niedrigste Stromstärke, um das höchste zuckende isometrische Drehmoment hervorzulocken, muss für das Kraft-Frequenz-Experiment durch wiederholte Zuckungsexperimente mit progressiv erhöhter Stromstärke bestimmt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
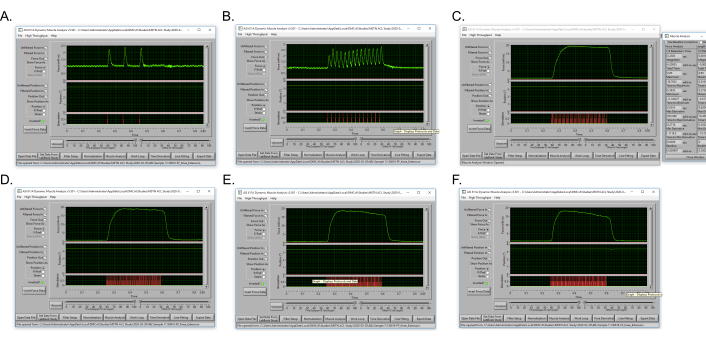
Abbildung 5: Repräsentative tetanische Drehmomentkurven während eines Drehmoment-Frequenz-Experiments für dieselbe Maus. (A) Submaximales isometrisches tetanisches Drehmoment bei 10 Hz. (B) Submaximales isometrisches tetanisches Drehmoment bei 40 Hz. (C) Maximale isometrische tetanische Drehmomentabgabe bei 120 Hz. (D) Isometrisches tetanisches Drehmoment bei 150 Hz. (E) Isometrisches tetanisches Drehmoment bei 180 Hz. (F) Isometrisches tetanisches Drehmoment bei 200 Hz. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
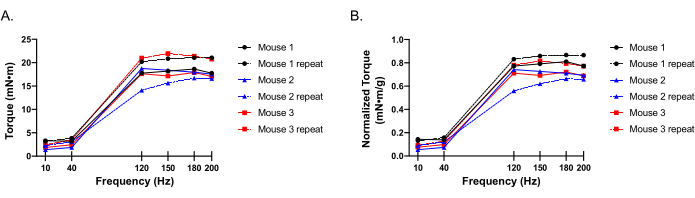
Abbildung 6: Repräsentative Drehmoment-Frequenz-Kurvendaten( A-B). Drehmoment-Frequenz-Kurve an 2 verschiedenen Zeitpunkten (Woche 1 und 3) in 3 separaten Mäusen, dargestellt als rohes Spitzendrehmoment (A) und rohes Spitzendrehmoment normalisiert auf Körpergewicht (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
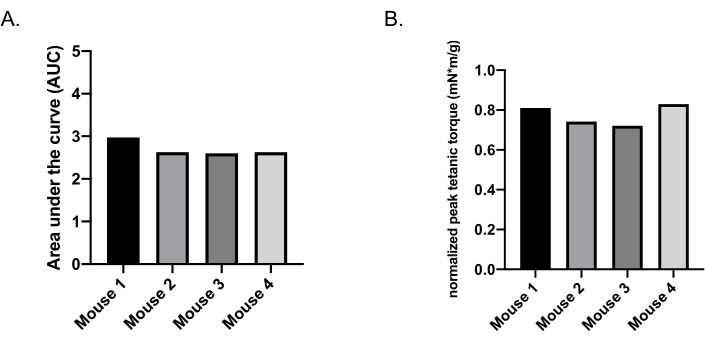
Abbildung 7: Repräsentative Fläche unter der Kurve (AUC) und Maximale tetanische Drehmomentdaten. (A) AUC für 4 separate Mäuse, dargestellt als Rohdrehmoment normalisiert auf das Körpergewicht. (B) Maximales tetanisches Drehmoment für die gleichen 4 Mäuse, dargestellt als rohes tetanisches Spitzendrehmoment, normalisiert auf das Körpergewicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
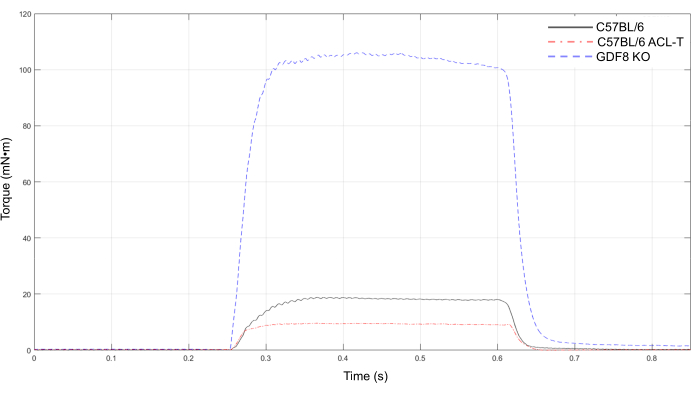
Abbildung 8:Maximales tetanisches Drehmoment von Kniestreckmuskeln in mehreren Mausmodellen. Repräsentative Spitzendrehmoment-Tetanuskurven für ein offen hypertrophietransgenes Mausmodell (GDF8 KO), eine unverletzte gesunde C57BL/6-Maus (Maus 2) und eine C57BL/6-Maus 7 Tage nach der vorderen Kreuzbandtransektion (ACL-T). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Abmessungen des kundenspezifisch gefertigten Kunststoffs. Rot eingelassen zeigt die Dimension der Tiefe an. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Video 1: Echtzeit-Kniestreckzucken ohne Motorarm. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 2: Kniestreckung in Zeitlupe ohne Motorarm. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Die Messung und Analyse der Muskelfunktion in Nagetiermodellen ist unerlässlich, um translationale und aussagekräftige Rückschlüsse auf histologische und molekulare Skelettmuskelanpassungen zu ziehen, die bei Bewegung, Verletzungen, Krankheiten und therapeutischer Behandlung beobachtet werden. Wir demonstrieren eine Methode zur zuverlässigen und wiederholten Beurteilung der maximalen Kniestreckfestigkeit bei Mäusen mit handelsüblichen Geräten, wobei das verstellbare Kunststoffstück zur Befestigung der unteren Hintergliedmaße an der vorderen Tibia das einzige kundenspezifische Teil ist, das repliziert werden kann.
Gängige Funktionelle Bewertungswerkzeuge wurden häufig verwendet, um die körperliche Leistung innerhalb derselben Maus wiederholt zu bewerten, z. B. Laufbandlauf bis hin zu willensermüdender Ermüdung, Rotarod-Leistungstest, invertierter Klammertest und Grifffestigkeitstest. Obwohl diese Bewertungen informativ sind, beinhalten sie kardiopulmonale und Verhaltenskomponenten, die die Abfrage der neuromuskulären Funktion im Zusammenhang mit diesen körperlichen Leistungsmessungen verschleiern können. Darüber hinaus sind Elemente der Ausdauer, Koordination und des Gleichgewichts in vielen dieser funktionellen Bewertungen auf unterschiedlichen Ebenen vorhanden, was eine klare Interpretation in Bezug auf die Muskelkraft einschränkt. Die Kraftproduktionsfähigkeit von Nagetiermuskel(n) kann in vitro, in situ oder in vivo gemessen werden. Jeder Ansatz hat relative Vorteile und Grenzen. Insbesondere bei der In-vitro-Beurteilung wird der Muskel vollständig isoliert und aus dem Körper des Tieres entfernt, so dass es keinen Einfluss von Perfusion oder Innervation gibt19. Dies führt zu einer gut kontrollierten Umgebung, um die kontraktile Fähigkeit zu bestimmen, begrenzt jedoch die Größe des untersuchten Muskels durch Abhängigkeit von passiver Diffusion von Sauerstoff und Nährstoffen während des Tests. In-situ-Tests erhalten die Innervation und Blutversorgung des Muskels, beschränken sich jedoch auf eine singuläre terminale Beurteilung, wie bei In-vitro-Tests20. Schließlich ist der In-vivo-Test am wenigsten invasiv, wobei der Muskel in seiner nativen Umgebung verbleibt, wobei perkutane Elektroden in der Nähe des motorischen Nervs eingeführt werden, um den Muskel elektrisch zu stimulieren. Eine Stärke des In-vivo-Ansatzes ist das Potenzial für Längsschnitttests über die Zeit21,22,23.
Die In-vivo-Bewertung der maximalen Muskelkontraktilität misst optimal die maximale Stärke, da die normale Anatomie und Physiologie der Maus intakt bleibt und die Methode vor und nach einem Eingriff oder während der gesamten Lebensdauer an derselben Maus wiederholt werden kann. Insbesondere ist die In-vivo-Messung der Kniestreckkraft bei Mäusen die Beurteilung der Murinstärke mit der größten translationalen Relevanz für Humanstudien, da das maximale Kniestreckmoment häufig gemessen und als Goldstandard-Festigkeitstest beim Menschen mit Korrelation zu verschiedenen funktionellen und gesundheitlichen Ergebnissen angesehen wird24,25,26,27 . Darüber hinaus wird die Kniestreckpathologie mit dem Altern sowie einer Vielzahl von Verletzungen undKrankheiten beobachtet 1,2,4,5,6, aber die Bewertung der Auswirkungen dieser Zustände auf die Kniestreckkraft in Längsform bei Mäusen war nicht ohne weiteres erreichbar.
Obwohl diese Methode nützlich ist, um das Spitzendrehmoment des Kniestrecks in Längshöhe zu bestimmen, sollten bestimmte Einschränkungen des Protokolls berücksichtigt werden. Niedrigere Frequenzen zwischen 40 Hz und 120 Hz wurden im Drehmoment-Frequenz-Protokoll weggelassen, was die Fähigkeit einschränken kann, Links- oder Rechtsverschiebungen in der Drehmoment-Frequenz-Kurve mit Verletzungen oder Krankheiten zu erkennen. Mit diesem Drehmoment-Frequenz-Protokoll konnten wir jedoch Veränderungen des maximalen tetanischen Drehmoments in einem ACL-Verletzungsmodell und zwischen C56BL/6-Wildtyp-Mäusen und einem transgenen Mausmodell der supraphysiologischen Muskelmasse erkennen (Abbildung 8). Wir weisen darauf hin, dass es von Vorteil sein kann, die Elektroden mit helfenden Händen oder ähnlichen Geräten zu sichern, da Muskelkontraktionen Elektroden leicht bewegen können. Wir haben keine offensichtliche Verschiebung von Elektroden mit fortschreitenden Kontraktionen bemerkt; Es kann jedoch nicht ausgeschlossen werden, dass sich die Elektroden leicht bewegen, was sich auf die Muskelstimulation auswirken kann. Darüber hinaus wurde die intramuskuläre Elektromyographie (EMG) nicht in Verbindung mit dem Stimulusprotokoll durchgeführt; Die Einbeziehung von EMG-Maßnahmen kann jedoch möglich sein, wenn dies gewünscht und für das experimentelle Modell von Interesse angemessen ist.
Die Bewertung der Kniestreckkraft in murinen Modellen orthopädischer Verletzungen und Erkrankungen wird die präklinische Forschung mit aussagekräftiger translationaler Relevanz für klinische Kraftmessungen erleichtern. Unser Protokoll ermöglicht eine präzise und wiederholte Beurteilung der maximalen Kniestreckkraft bei Mäusen mit kommerziell erhältlichen Geräten, die für jedes Labor zugänglich sind.
Offenlegungen
Matthew Borkowski ist bei Aurora Scientific Inc. angestellt, einem Unternehmen, das möglicherweise von den Forschungsergebnissen profitieren kann, und ist auch eine Führungskraft des Unternehmens.
Danksagungen
Wir danken Rosario Maroto für die technische Unterstützung. Die in dieser Veröffentlichung berichtete Forschung wurde vom National Institute of Arthritis and Musculoskeletal and Skin Diseases der National Institutes of Health unter der Award-Nummer R01 AR072061 (CSF) unterstützt. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offiziellen Ansichten der National Institutes of Health dar.
Materialien
| Name | Company | Catalog Number | Comments |
| 1300A: 3-in-1 Whole Animal System- Mouse | Aurora Scientific Incorporated | 300D-305C-FP: dual-mode motor with custom knee extension apparatus, 605A: Dynamic Muscle Data Acquisition and Analysis System, 701C: Electrical Stimulator, 809C: in-situ Mouse Apparatus | |
| 6100 Dynamic Muscle Control LabBook software | Aurora Scientific Incorporated | DMC v6.000 | |
| 611A Dynamic Muscle Analysis | Aurora Scientific Incorporated | DMA v5.501 | |
| BravMini hair clippers | Wahl Clipper Corporation | ASIN: B00IN24ILE | |
| Eye Lube | Optixcare | Item Number: 142422 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip Inhalation Anesthesia Systems | Item Number: 901806 | |
| Prism 8 | GraphPad Software, LLC | Version 8.3.0 (328) |
Referenzen
- Brightwell, C. R., et al. Moderate-intensity aerobic exercise improves skeletal muscle quality in older adults. Translational Sports Medicine. 2 (3), 109-119 (2019).
- Moro, T., et al. Muscle protein anabolic resistance to essential amino acids does not occur in healthy older adults before or after resistance exercise training. Journal of Nutrition. 148 (6), 900-909 (2018).
- Angelozzi, M., et al. Rate of force development as an adjunctive outcome measure for return-to-sport decisions after anterior cruciate ligament reconstruction. Journal of Orthopedic Sports Physical Therapy. 42 (9), 772-780 (2012).
- Kalyani, R. R., et al. Quadriceps strength, quadriceps power, and gait speed in older U.S. adults with diabetes mellitus: results from the National Health and Nutrition Examination Survey, 1999-2002. Journal of American Geriatric Society. 61 (5), 769-775 (2013).
- Culvenor, A. G., Ruhdorfer, A., Juhl, C., Eckstein, F., Øiestad, B. E. Knee extensor strength and risk of structural, symptomatic, and functional decline in knee osteoarthritis: A systematic review and meta-analysis. Arthritis Care Res (Hoboken). 69 (5), 649-658 (2017).
- Abramowitz, M. K., et al. Skeletal muscle fibrosis is associated with decreased muscle inflammation and weakness in patients with chronic kidney disease. American Journal of Physiology and Renal Physiology. 315 (6), 1658-1669 (2018).
- Arentson-Lantz, E. J., English, K. L., Paddon-Jones, D., Fry, C. S. Fourteen days of bed rest induces a decline in satellite cell content and robust atrophy of skeletal muscle fibers in middle-aged adults. Journal of Applied Physiology. 120 (1985), 965-975 (2016).
- Pratt, S. J. P., Lovering, R. M. A stepwise procedure to test contractility and susceptibility to injury for the rodent quadriceps muscle. Journal of Biological Methods. 1 (2), (2014).
- Kamekura, S., et al. Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis Cartilage. 13 (7), 632-641 (2005).
- Kwok, J., et al. Histopathological analyses of murine menisci: implications for joint aging and osteoarthritis. Osteoarthritis Cartilage. 24 (4), 709-718 (2016).
- Glasson, S. S., Blanchet, T. J., Morris, E. A. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse. Osteoarthritis Cartilage. 15 (9), 1061-1069 (2007).
- Christiansen, B. A., et al. Musculoskeletal changes following non-invasive knee injury using a novel mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 20 (7), 773-782 (2012).
- Wurtzel, C. N., et al. Pharmacological inhibition of myostatin protects against skeletal muscle atrophy and weakness after anterior cruciate ligament tear. Journal of Orthopedic Research. 35 (11), 2499-2505 (2017).
- Botter, A., et al. Atlas of the muscle motor points for the lower limb: implications for electrical stimulation procedures and electrode positioning. European Journal of Applied Physiology. 111 (10), 2461-2471 (2011).
- Gobbo, M., Maffiuletti, N. A., Orizio, C., Minetto, M. A. Muscle moter point identification is essential for optimizing neuromuscular electrical stimulation use. Journal of Neuroengineering and Rehabililitation. 11, 17(2014).
- Neelakantan, H., et al. Small molecule nicotinamide N-methyltransferase inhibitor activates senescent muscle stem cells and improves regenerative capacity of aged skeletal muscle. Biochemical Pharmacology. 163, 481-492 (2019).
- Kline, P. W., Morgan, K. D., Johnson, D. L., Ireland, M. L., Noehren, B. Impaired quadriceps rate of torque development and knee mechanics after anterior cruciate ligament reconstruction with patellar tendon autograft. American Journal of Sports Medicine. 43 (10), 2553-2558 (2015).
- Hiemstra, L. A., Webber, S., MacDonald, P. B., Kriellaars, D. J. Knee strength deficits after hamstring tendon and patellar tendon anterior cruciate ligament reconstruction. Medicine and Science in Sports and Exercise. 32 (8), 1472-1479 (2000).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. Journal of Visualized Experiments. (69), e4198(2012).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. Journal of Visualized Experiments. (56), e3167(2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskeletal Disorder. 12, 246(2011).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. Journal of Visualized Experiments. (116), e54487(2016).
- Gerlinger-Romero, F., et al. Non-invasive assessment of dorsiflexor muscle function in mice. Journal of Visualized Experiments. (143), e58696(2019).
- Davis, C. C., Ellis, T. J., Amesur, A. K., Hewett, T. E., Di Stasi, S. Improvements in knee extension strength are associated with improvements in self-reported hip function following arthroscopy for femoroacetabular impingement syndrome. International Journal of Sports Physical Therapy. 11 (7), 1065-1075 (2016).
- Omori, G., et al. Quadriceps muscle strength and its relationship to radiographic knee osteoarthritis in Japanese elderly. Journal of Orthopedic Science. 18 (4), 536-542 (2013).
- Wilk, K. E., Romaniello, W. T., Soscia, S. M., Arrigo, C. A., Andrews, J. R. The relationship between subjective knee scores, isokinetic testing, and functional testing in the ACL-reconstructed knee. Journal of Orthopedic Sports and Physical Therapy. 20 (2), 60-73 (1994).
- Bobowik, P., Wiszomirska, I. Diagnostic dependence of muscle strength measurements and the risk of falls in the elderly. Internation Journal of Rehabilitation Research. 43 (4), 330-336 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten