Method Article
Mesure in vivo de la fonction musculaire extensrice du genou chez la souris
Dans cet article
Résumé
La quantification de la force maximale de l’extenseur du genou est impérative pour comprendre les adaptations fonctionnelles au vieillissement, à la maladie, aux blessures et à la réadaptation. Nous présentons une nouvelle méthode pour mesurer à plusieurs reprises le couple tétanique de crête isométrique d’extension du genou in vivo.
Résumé
La plasticité des muscles squelettiques en réponse à d’innombrables conditions et stimuli interjudrait l’adaptation fonctionnelle simultanée, à la fois négative et positive. En clinique et en laboratoire de recherche, la force musculaire maximale est largement mesurée longitudinalement chez l’homme, la musculature extensrice du genou faisant l’objet le plus rapporté. La pathologie du complexe musculaire extenseur du genou est bien documentée dans le vieillissement, les blessures orthopédiques, les maladies et la désuétude; La force de l’extenseur du genou est étroitement liée à la capacité fonctionnelle et au risque de blessure, ce qui souligne l’importance d’une mesure fiable de la force de l’extenseur du genou. L’évaluation in vivo reproductible de la force de l’extenseur du genou dans les études précliniques sur les rongeurs offre des critères fonctionnels précieux pour les études explorant l’arthrose ou les blessures au genou. Nous rapportons un protocole in vivo et non invasif pour mesurer à plusieurs reprises le couple tétanique maximal isométrique des extenseurs du genou chez la souris au fil du temps. Nous démontrons la cohérence en utilisant cette nouvelle méthode pour mesurer la force de l’extenseur du genou avec une évaluation répétée chez plusieurs souris produisant des résultats similaires.
Introduction
Le muscle squelettique est un tissu hautement adaptable avec des altérations compensatoires de la masse et de la structure en réponse à une myriade de stimuli, tels que l’exercice, la nutrition, les blessures, les maladies, le vieillissement et la désuétude. De nombreuses études portant sur l’adaptation des muscles squelettiques chez l’homme utilisent des méthodes pour mesurer à la fois la taille des muscles squelettiques et l’impact sur la fonction, car les évaluations de force de référence sont facilement reproductibles chez les sujets humains.
Plus précisément, l’extenseur du genou et la résistance du fléchisseur sont les plus évalués dans la recherche clinique. Des altérations de la force de l’extenseur du genou ont été largement rapportées dans des études humaines sur le vieillissement, l’exercice, les blessures orthopédiques, l’arthrose du genou, les maladies chroniques et la désuétude1,2,3,4,5,6,7. Cependant, les méthodes d’analyse répétée et non invasive de la force du muscle extenseur du genou (quadriceps) dans les études mécanistes sur les rongeurs ont été relativement limitées. Une méthode pour déterminer in vivo la contractilité musculaire du quadriceps chez le rat a été précédemment développée8; toutefois, la construction intensive d’équipement non disponible dans le commerce est nécessaire. Compte tenu de l’étendue des modèles de rongeurs développés pour étudier les résultats musculo-squelettiques à la suite d’une blessure au genou oud’arthrose 9,10,11,12,13, il existe un besoin d’évaluation non invasive de la force des quadriceps.
En outre, les études sur les rongeurs portant sur les mécanismes moléculaires sous-jacents à l’adaptation des muscles squelettiques utilisent souvent des modèles murins en raison de la simplicité de la modification génétique, comme le font de nombreuses études d’intervention pharmacologique en raison de la diminution des dépenses financières associée à une administration plus faible d’un médicament basée sur le poids chez la souris par rapport au rat. Nous rapportons une méthode non invasive pour mesurer à plusieurs reprises la fonction extensrice du genou in vivo chez la même souris au fil du temps en utilisant de l’équipement disponible dans le commerce avec des modifications mineures, facilitant la reproductibilité entre différents laboratoires et fournissant une comparaison plus directe avec les résultats de la force humaine.
Protocole
Toutes les procédures expérimentales ont été approuvées par le comité institutionnel de soins et d’utilisation des animaux de l’Université du Kentucky.
1. Configuration de l’équipement
- Vérifiez que les machines sont connectées conformément aux spécifications du fabricant.
- Si ce n’est pas déjà fait, fixez le moteur 300D-305C-FP avec un appareil d’extension du genou à la plate-forme animale 809C.
- Allumez la pompe à eau à 37 °C pour commencer à chauffer la plate-forme.
- Si l’ordinateur n’est pas déjà allumé, allumez-le, suivi du stimulateur biphasé haute puissance et du système de levier bimode à 2 canaux.
- Versez l’isoflurane dans le vaporisateur jusqu’à la ligne de remplissage maximale.
2. Configuration du logiciel
- Ouvrez le logiciel (détails fournis dans le tableau des matériaux).
- Pour utiliser la fonction de stimulation instantanée en conjonction avec Live Data Monitor pour optimiser le placement de la sonde (étape 4), sélectionnez Préparer l’expérience, puis Configurer le Stim instantané (Figure 1). Définissez la fréquence d’impulsion (Hz) sur 125, la largeur d’impulsion (ms) sur 0,2, le nombre d’impulsions sur 1, la fréquence de train (Hz) sur 0,5 et le temps d’exécution sur 120.
- Sélectionnez Fichier et ouvrez Live Data Monitor.
- Pour effectuer des expériences de contraction (étape 5) et de fréquence de couple (étape 6), sélectionnez une étude précédemment programmée qui comprend des expériences appropriées de contraction et de fréquence de couple d’extension du genou (détaillées ci-dessous aux étapes 5 et 6).
- Sélectionnez la souris expérimentale appropriée ou Ajouter un nouvel animal et entrez les informations correspondantes de la souris à stocker avec les données de couple.
- Sélectionnez Expérience suivante ou Expérience précédente pour passer du protocole de contraction à la séquence couple-fréquence.
3. Configuration de la souris
- Placez la souris individuelle dans la chambre d’anesthésie.
- Relâchez la vanne du réservoir d’oxygène et réglez le débit d’oxygène à 1 L / min avec 2,5% d’isoflurane.
- Assurez-vous que la souris reste dans la chambre avec le couvercle bien fermé jusqu’à ce qu’elle soit complètement inconsciente. Confirmez la perte de conscience complète par l’absence de réflexe plantaire avec pincement des orteils.
- Placez la souris anesthésiée en position couchée avec la tête dans le nosecone sur la plate-forme chauffée avec un débit d’oxygène de 1 L / min avec 2,5% d’isoflurane.
- Rasez les cheveux du membre postérieur droit à l’aide de tondeuses électriques. Enlevez les poils de la zone rasée avec une lingette à l’alcool et un petit aspirateur. Nettoyez les poils enlevés du membre postérieur et de la plate-forme.
- Serrez solidement le membre postérieur supérieur, postérieur au genou (Figure 2).
REMARQUE: Assurez-vous que l’amplitude de mouvement du genou n’est pas entravée. - Placez le membre postérieur inférieur dans l’appareil d’extension du genou avec le tibia antérieur touchant légèrement la pièce en plastique réglable (la lecture du canal Force In doit être comprise entre 0 et -1,0 mN * m). Selon la taille du membre postérieur inférieur de la souris, du ruban chirurgical peut être enroulé autour de la partie inférieure de la pièce en plastique réglable pour permettre à la jambe de se reposer en toute sécurité.
REMARQUE: Les images détaillées et les dimensions de la pièce en plastique fabriquée sur mesure sont illustrées dans la figure supplémentaire 1. - Ajustez les boutons sur la plate-forme pour vous assurer que le genou est plié à 60 °.
- Placez légèrement un morceau de ruban adhésif sur le torse de la souris sur la plate-forme pour éviter tout mouvement compensatoire avec une extension maximale du genou.
4. Placement des électrodes
- Placer les électrodes par voie sous-cutanée de 2 à 4 mm proximaux au genou directement au-dessus des quadriceps/muscles extenseurs du genou (Figure 2). Les électrodes doivent être espacées d’environ 1 à 2 mm.
- Pour déterminer le placement optimal des électrodes, utilisez la fonction de stimulation instantanée avec Live Data Monitor. Réglez l’ampérage/ courant à 50 mA pour les contractions répétées afin de confirmer l’extension du genou (les extenseurs du genou produiront une courbe de contraction négative). Ajustez les sondes pendant la stimulation instantanée pour obtenir un couple de contraction maximal de l’extension du genou tel que mesuré dans la fenêtre Live Data Monitor.
REMARQUE: La figure 3 montre une sortie de stimulation instantanée représentative, confirmant l’extension du genou. La vidéo supplémentaire 1 et la vidéo supplémentaire 2 montrent des contractions d’extenseur de genou en temps réel et au ralenti sans le bras moteur en place, ce qui permet une confirmation visuelle de l’extension du genou. - Lors de contractions répétées avec stimulation instantanée,palper les muscles fléchisseurs du genou avec l’index pour confirmer l’absence d’activation des muscles antagonistes. Pour stimuler au maximum les extenseurs du genou, un repositionnement de la sonde peut être nécessaire en fonction de la composition corporelle de la souris et de légères différences anatomiques dans l’emplacement exact du point moteur du nerf fémoral et des muscles extenseurs du genou.
REMARQUE: Un point moteur musculaire est l’endroit où la branche motrice d’un nerf pénètre dans le ventre musculaire et est le point avec la plus faible résistance à la conductivité électrique et par la suite la plus grande réactivité à la stimulation électrique14,15. Dans les applications cliniques utilisant la stimulation électrique, ce point est identifié en scannant avec une électrode de stylo pour trouver l’emplacement au-dessus du muscle où une contraction musculaire se produit avec le courant injecté le plus bas14,15. L’identification du point moteur musculaire est essentielle pour faciliter une stimulation électrique neuromusculaire optimale15. Dans les essais cliniques humains, des points moteurs musculaires pour les muscles quadriceps ont été identifiés dans la moitié distale du muscle14. Pour obtenir une stimulation optimale de l’extenseur du genou chez la souris, cette technique a été récapitulée à l’aide du placement d’électrodes avec stimulation instantanée pour se rapprocher le plus des emplacements des points moteurs musculaires généralement trouvés dans la moitié distale des extenseurs du genou. Il existe une certaine variabilité dans le placement de l’électrode (de relativement superficielle à profonde) qui se traduit par un couple maximal, et la fonction de stimulation instantanée facilite le placement optimal de l’électrode.
5. Détermination du courant optimal
- Une fois que le placement optimal de la sonde est déterminé, effectuez une série de secousses progressives pour déterminer l’ampérage / courant optimal à utiliser pour l’expérience couple-fréquence, dans le but de déterminer le courant le plus bas pour atteindre la sortie de couple de contraction maximale. Commencez avec un courant réglé à 50 mA et sélectionnez Exécuter l’expérience pour produire une seule contraction. Sélectionnez Analyser les résultats pour afficher le couple de sortie. Enregistrez le couple de contraction affiché sous Force maximale avec la ligne de base soustraite.
REMARQUE: Sélectionnez l’option permettant d’inverser le canal Force pour convertir les mesures du couple négatif en positif. - Augmentez le courant à 60-70 mA et répétez l’expérience de contraction. Enregistrez le couple de contraction affiché sous Force maximale avec la ligne de base soustraite.
- Continuez avec une série d’expériences de contraction de cette manière (augmentant d’environ 10-20 mA à chaque progression) jusqu’à ce que le couple de contraction n’augmente plus (plateaux ou commence à diminuer). Un exemple de série twitch est présenté dans le tableau 1.
- Enregistrez le courant le plus bas auquel le couple de contraction le plus élevé a été atteint. Ce courant sera utilisé et restera constant lors de la prochaine expérience force-fréquence. La figure 4 montre un pic de contraction représentatif.
6. Expérience couple-fréquence pour déterminer le couple tétanique isométrique maximal
- Dans le logiciel (voir Tableau des matériaux),sélectionnez l’expérience de couple-fréquence préprogrammée pour l’extension du genou en assurant le réglage suivant. Durée du stimulus: 0,35 s, Séquence de fréquence: 10 Hz, 40 Hz, 120 Hz, 150 Hz, 180 Hz, 200 Hz, Période de repos entre les impulsions/contractions: 120 s
REMARQUE: La fréquence d’échantillonnage est de 10 000 Hz (paramètre par défaut). - Exécutez l’expérience, analysez les résultatset enregistrez manuellement le couple affiché sous Force maximale avec la ligne de base soustraite (assurez-vous que le canal de force est inversé, car la contraction de l’extenseur du genou produira un couple négatif) à chaque fréquence. Notez la valeur de force maximale la plus élevée comme couple tétanique isométrique maximal. Des exemples de données couple-fréquence sont présentés dans le tableau 2 et la figure 5 montre une courbe représentative du tétanos pour le couple tétanique isométrique maximal atteint à 120 Hz.
7. Fin de l’expérience
- À la fin de l’expérience couple-fréquence, effectuez une contraction de suivi et comparez avec la contraction de crête initiale au même courant pour évaluer les dommages / fatigue.
REMARQUE: Dans certains modèles de blessures et de maladies, une augmentation de la fatigabilité du muscle squelettique est attendue et ne constitue pas un problème avec la configuration expérimentale ou la souris. - Lorsque toutes les mesures de couple sont terminées, retirez doucement les sondes d’électrode et désarrouillez le genou.
- Éteignez l’isoflurane et retirez la souris du cône du nez.
- Replacez la souris dans une cage appropriée placée sur un coussin chauffant. Surveillez pendant que la souris récupère et reprend conscience.
REMARQUE: La souris doit être consciente et se déplacer dans les 2-3 minutes.
8. Analyse des données
- Extraire les données après l’expérience à partir d’un logiciel d’analyse (voir Tableau des matériaux).
- Logiciel d’analyse ouvert.
- Sélectionnez Obtenir des données à partir du logiciel.
- Sélectionnez Date à laquelle l’expérience a été effectuée et code de souris approprié.
- Sélectionnez la fréquence d’intérêt (toutes les expériences de contraction et chaque fréquence de l’expérience couple-fréquence seront répertoriées).
- Sélectionnez Analyse musculaire.
- Vérifiez que l’option Utiliser la correction de base est cochée.
REMARQUE: Le couple de base est calculé par le logiciel comme la moyenne des 100 premiers points échantillonnés et soustraits de la valeur de couple maximale absolue. - Enregistrez la valeur de couple indiquée sous Maximum.
REMARQUE : Les données présentées ici ne sont pas filtrées; cependant, un filtre peut être sélectionné dans le logiciel, si vous le souhaitez.
- Alternativement, comme décrit ci-dessus à l’étape 6.2, enregistrez manuellement la sortie de couple affichée sous Force maximale en temps réel à chaque point/contraction couple-fréquence via la fenêtre Analyser les résultats.
- Vérifiez que la ligne de base est soustraite et que le canal de force est inversé.
- Entrez les données dans une feuille de calcul pour les calculs de normalisation du poids corporel (couple/poids corporel en grammes) et les analyses graphiques et statistiques d’intérêt. Un logiciel statistique a été utilisé pour représenter graphiquement les courbes couple-fréquence et calculer l’aire sous la courbe.
REMARQUE: Les données de couple sont mesurées en mN.m (milliNewton.meters).
- Pour générer des courbes de tétanos, exportez des données complètes de chaque fréquence à partir du logiciel d’analyse.
- Répétez les étapes 8.1.1 à 8.1.4 ci-dessus.
- Sélectionnez Exporter les données.
- Sélectionnez Données filtrées brutes et enregistrez-les à l’emplacement de votre choix. MATLAB peut être utilisé pour générer des courbes de tétanos à partir du fichier texte exporté et/ou pour une analyse plus approfondie.
REMARQUE: Le code MATLAB pour générer la courbe du tétanos à partir d’un fichier texte est disponible sur demande.
9. Calibrage du système de levier bimode
- Étalonnez le système avant l’utilisation initiale pour garantir des données précises et fiables, et répétez l’étalonnage périodiquement à l’aide du logiciel de collecte de données et des poids connus.
- Logiciel de collecte de données ouvertes.
- Cliquez sur l’onglet Configuration et sélectionnez Configuration du canal.
- Sélectionnez 305C-FP répertorié sous Mes instruments.
- Cliquez sur Calibrer la sélection pour ouvrir la fenêtre De l’éditeur d’étalonnage.
- Pour calibrer la longueur, entrez une série de tensions d’essai comprenant des tensions négatives et positives (par exemple, -3, -2, -1, 0, 1, 2, 3 V).
- Cliquez sur Définir pour la première ligne.
- Cliquez sur Lire.
- Mesurez la longueur exacte du bras de levier en millimètres et entrez dans la boîte correspondante.
- Répétez l’opération pour la tension suivante.
- Lors de l’enregistrement de toutes les tensions, cliquez sur Calculer les facteurs cal (enregistrés en mm/volt).
- Pour calibrer la force, utilisez un ensemble de poids connus augmentant dans une progression linéaire.
- Réglez le moteur de manière à ce qu’il repose sur le bord du banc ou de la table avec le bras de levier parallèle à la paillasse et suspendu sur le bord pour permettre au poids de pendre.
- Suspendez le premier poids au bras de levier à l’aide d’un élastique. Sous Force appliquée, entrez le poids connu en grammes représentant la masse de l’élastique.
- Sélectionnez Lire.
- Répétez l’opération pour au moins 3 poids connus.
- Sélectionnez Calculer le facteur cal.
- Pour vérifier le calcul, les données d’étalonnage du tracé et l’ajustement de la courbe en sélectionnant Plot Cal.
- Pour calibrer la force de sortie, entrez des tensions d’étalonnage (jusqu’à 10 volts)
- Cliquez sur Définir directement à côté de la tension d’étalonnage.
- Répétez l’opération pour chaque ligne de tension.
- Appliquez doucement une pression sur le bras de levier à l’aide d’un doigt jusqu’à ce que le Force Out cesse de changer et que le bras du moteur commence à bouger.
- Maintenez cette position. Sélectionnez Lire.
- Répétez l’opération pour chaque ligne de tension.
- Sélectionnez Calculer le facteur cal.
Résultats
La courbe couple-fréquence utilise des fréquences plus basses pour produire de multiples contractions isométriques isolées de couple relativement faible et progresse à travers des fréquences de plus en plus élevées, ce qui entraîne la fusion des contractions pour une contraction isométrique du tétanos à laquelle le couple tétanique maximal est obtenu. Le protocole présenté pour le couple ainsi que le couple mentétanique de crête d’extension du genou, la courbe force-fréquence s’initie à 10 Hz, ce qui provoque 3 secousses isolées. La fusion partielle des secousses se produit à 40 Hz et le couple 0étanique maximal est atteint entre 120 et 180 Hz(Figure 5).
La figure 6 illustre les courbes couple-fréquence représentatives de l’extension du genou de souris femelles C57BL/6. Trois souris distinctes ont été testées au départ, et l’expérience a été répétée chez chaque souris 2 semaines plus tard pour comparaison afin d’évaluer la reproductibilité. Les courbes couple-fréquence sont représentées avec les valeurs de couple brutes (Figure 6A), ainsi que les valeurs de couple brut normalisées en fonction du poids corporel de la souris (Figure 6B). Des observations répétées démontrent des résultats comparables chez les 3 souris avec une période de repos de 2 semaines entre les expériences. Les données de couple normalisées sur le poids corporel doivent être prises en compte en plus du couple brut, car une légère fluctuation du poids peut avoir une incidence sur la puissance fonctionnelle et n’est pas prise en compte avec le couple brut seul. De plus, les données de couple normalisées du poids corporel facilitent la comparaison de souris de tailles variables. Le couple peut également être normalisé en poids musculaire humide ou en section transversale myofiber, comme nous l’avons déjà montré16.
La figure 7A montre l’aire sous la courbe en utilisant des données de couple isométrique normalisées par le poids corporel provenant d’expériences complètes de couple-fréquence (10 Hz, 40 Hz, 120 Hz, 150 Hz, 180 Hz, 200 Hz) pour 4 souris C57BL/6 distinctes, mettant en évidence une puissance de couple totale similaire et des coefficients de variation entre 5,6% et 8,8% avec des expériences répétées au sein des mêmes souris. Les données sont le plus simplement rapportées comme le couple tétanique maximal(Figure 7B),qui est la valeur de couple maximal des contractions isométriques répétées du tétanos de 120 à 200 Hz. Le couple tétanique maximal est comparable chez les souris femelles C57BL/6 âgées de 6 à 8 mois(figure 7B)avec des coefficients de variation compris entre 4,8 % et 8,7 % avec une évaluation longitudinale chez les mêmes souris. Le couple tétanique maximal est le plus comparable à l’évaluation de la résistance de référence dans les études humaines: la toque isométrique maximale.
De plus, le protocole de couple tétannique de crête d’extenseur de genou est un outil utile pour détecter les différences de force dans plusieurs modèles de souris. La figure 8 montre le contraste frappant entre la force de l’extenseur du genou chez une souris femelle C57BL/6 de 6 mois non blessée et en bonne santé (ligne noire) et un modèle murin transgénique d’hypertrophie supraphysiologique dans laquelle la myostatine/GDF8 est éliminée (ligne bleue). Nous montrons également une courbe de pic de tétanos d’une souris C57BL/6 7 jours après la transsection chirurgicale du ligament croisé antérieur (ACL-T) (ligne rouge), démontrant une baisse de près de 50% du couple de pointe après une blessure, ce qui est bien en dehors des coefficients de variation observés avec des tests répétés sur des souris non blessées. Parallèlement aux donnéeshumaines17,18, la force est nettement diminuée avec le LCA-T. Toutes les souris sont femelles et d’âge similaire (6-8 mois).
| Expérience Twitch | Ampérage/Courant (mA) | Couple (mN•m) |
| 1 | 50 | 1.279 |
| 2 | 70 | 1.341 |
| 3 | 90 | 1.36 |
| 4 | 110 | 1.362 |
| 5 | *130 | 1.449 |
| 6 | 150 | 1.436 |
| 7 | 140 | 1.333 |
Tableau 1 : Exemple de série twitch. * indique un ampérage/courant optimal.
| Fréquence (Hz) | Couple (mN•m) |
| 10 | 1.385 |
| 40 | 1.869 |
| 120 | *18.765 |
| 150 | 18.375 |
| 180 | 17.97 |
| 200 | 17.548 |
Tableau 2 : Exemple de données de courbe couple-fréquence. * indique le couple tétanique maximal.
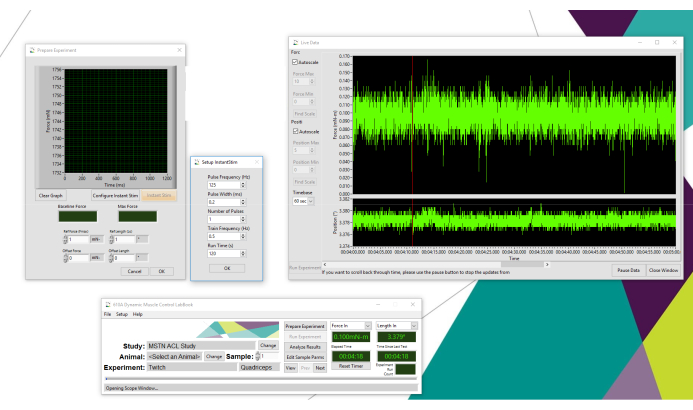
Figure 1: Configurationdu logiciel de collecte de données. Illustration de la configuration du logiciel de collecte de données avec Live Data Monitor. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2: Configuration de la souris et placement de l’électrode. (A-B) Position couchée de la souris recevant l’anesthésie via un cône de nez sur la plate-forme chauffée. Le membre postérieur supérieur est solidement serré, postérieur au genou pour permettre un mouvement sans restriction au niveau de l’articulation du genou. Le bras moteur est ajusté de manière à ce que le genou soit plié à environ 60 °. Le point moteur du nerf fémoral est stimulé par des électrodes à aiguille pour activer la contraction des extenseurs du genou. La configuration de la souris est affichée à partir d’une vue latérale (A) et d’une vue aérienne (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
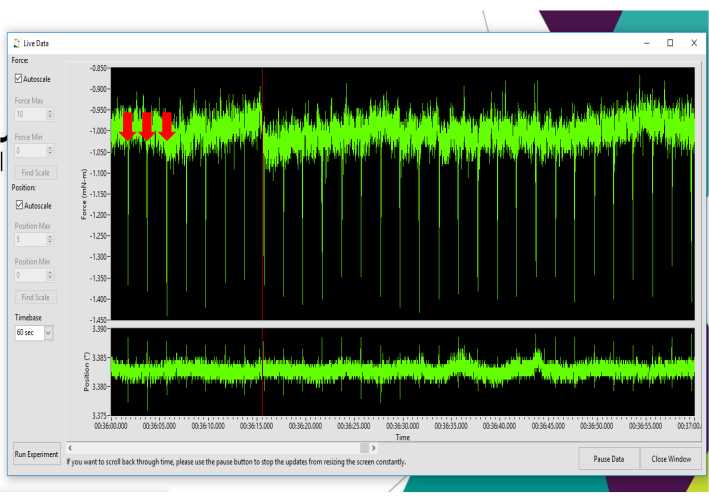
Figure 3: Détermination du placement optimal de l’électrode pour obtenir une extension isométrique du genou. Représentation de contractions négatives répétées stimulées avec 50 mA à l’aide de la fonction de stimulation instantanée et visualiées dans le moniteur de données en direct. Des flèches rouges indiquent les trois premières contractions d’extension du genou. Veuillez cliquer ici pour voir une version agrandie de cette figure.
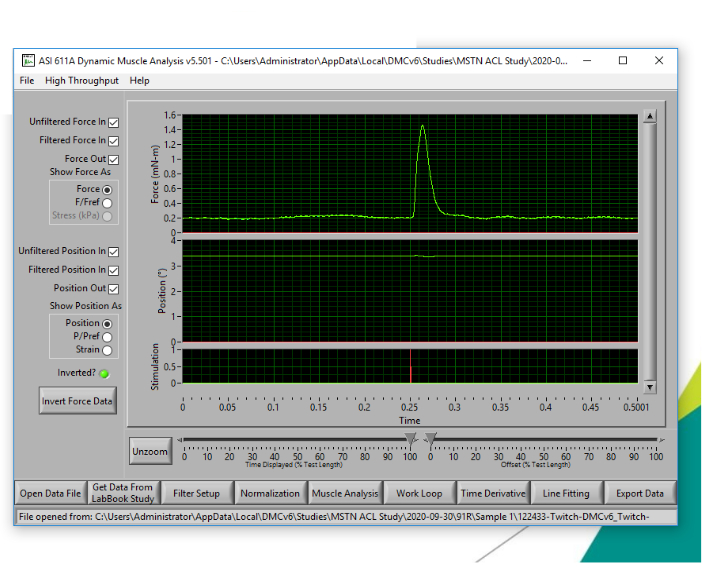
Figure 4: Contraction représentative pour déterminer l’ampérage optimal. L’ampérage le plus bas pour obtenir le couple isométrique de contraction le plus élevé doit être déterminé pour l’expérience force-fréquence par des expériences de contraction répétées avec un ampérage progressivement accru. Veuillez cliquer ici pour voir une version agrandie de cette figure.
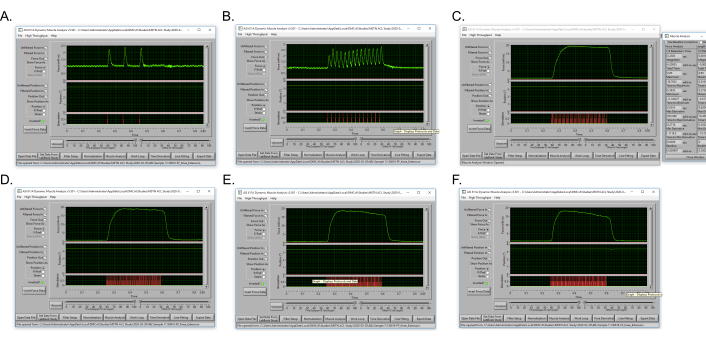
Figure 5: Courbes de couple tétaniques représentatives tout au long d’une expérience couple-fréquence pour la même souris. (A) Couple tétanique isométrique sous-maximal produit à 10 Hz. (B) Couple tétanique isométrique sous-maximal à 40 Hz. (C) Couple tétanique isométrique de crête à 120 Hz. (D) Couple tétanique isométrique à 150 Hz. (E) Couple tétanique isométrique à 180 Hz. (F) Couple tétanique isométrique à 200 Hz. Veuillez cliquer ici pour voir une version agrandie de cette figure.
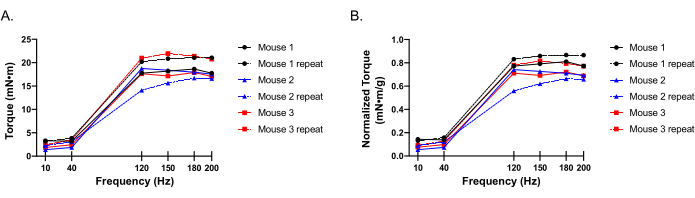
Figure 6: Données représentatives de la courbe couple-fréquence. (A-B). Courbe couple-fréquence à 2 points temporels différents (semaines 1 et 3) chez 3 souris distinctes, présentées sous forme de couple de crête brut(A)et de couple de crête brut normalisé au poids corporel(B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
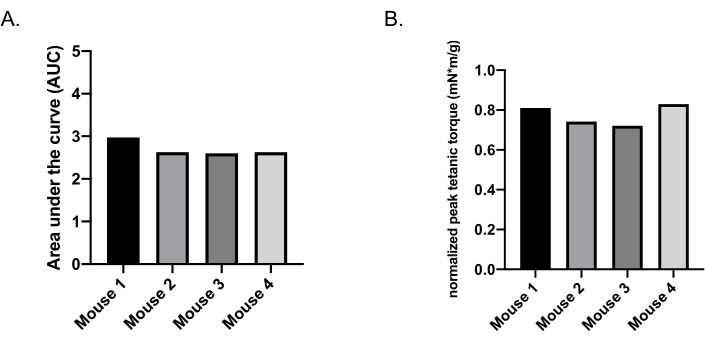
Figure 7: Aire représentative sous la courbe (ASC) et données de couple tétanique de crête. (A) ASC pour 4 souris distinctes, présentées comme un couple brut normalisé au poids corporel. (B) Couple tétannique maximal pour les mêmes 4 souris, présenté comme un couple tétanique de crête brut normalisé au poids corporel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
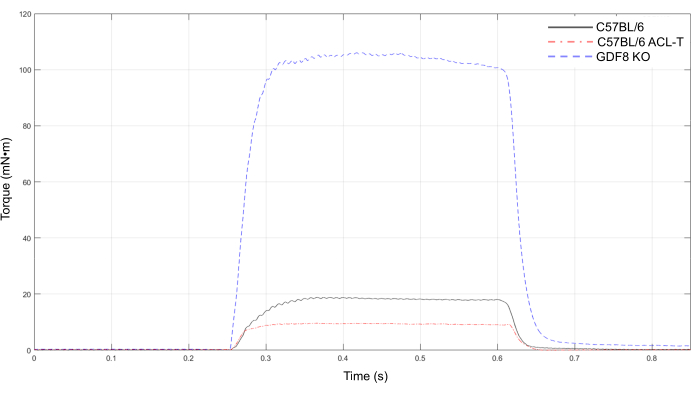
Figure 8: Couple tétanique maximal des extenseurs de genou dans plusieurs modèles de souris. Courbes de couple de pointe représentatives du tétanos pour un modèle murin transgénique d’hypertrophie manifeste (GDF8 KO), une souris C57BL/6 saine non blessée (souris 2) et une souris C57BL/6 7 jours après la transsection du ligament croisé antérieur (ACL-T). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire 1: Dimensions du plastique fabriqué sur mesure. L’encart en rouge indique la dimension de la profondeur. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 1: Contraction en temps réel de l’extenseur du genou sans bras moteur. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire 2: Contraction lente de l’extenseur du genou sans bras moteur. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
La mesure et l’analyse de la fonction musculaire dans les modèles de rongeurs sont impératives pour faire des inférences translationnelles et significatives concernant les adaptations histologiques et moléculaires des muscles squelettiques observées avec l’exercice, les blessures, les maladies et les traitements thérapeutiques. Nous démontrons une méthode pour évaluer la résistance maximale de l’extenseur du genou de manière fiable et répétée chez la souris à l’aide d’équipements disponibles dans le commerce, la pièce en plastique réglable pour maintenir le membre postérieur inférieur au niveau du tibia antérieur étant la seule pièce fabriquée sur mesure qui peut être reproduite.
Les outils d’évaluation fonctionnelle courants ont été largement utilisés pour évaluer à plusieurs reprises les performances physiques d’une même souris, tels que la course sur tapis roulant jusqu’à la fatigue volontaire, le test de performance de la rotarod, le test d’accrochage inversé et le test de force de préhension. Cependant, bien qu’informatives, ces évaluations impliquent des composantes cardiopulmonaires et comportementales, qui peuvent obscurcir l’interrogation de la fonction neuromusculaire associée à ces mesures de performance physique. En outre, des éléments d’endurance, de coordination et d’équilibre sont présents dans bon nombre de ces évaluations fonctionnelles à des niveaux variables, ce qui limite l’interprétation claire par rapport à la force musculaire. La capacité de production de force du ou des muscles des rongeurs peut être mesurée in vitro, in situ ou in vivo. Chaque approche présente des avantages et des limites relatifs. Plus précisément, avec l’évaluation in vitro, le muscle est complètement isolé et retiré du corps de l’animal afin qu’il n’y ait aucune influence de la perfusion ou de l’innervation19. Cela donne un environnement bien contrôlé pour déterminer la capacité contractile, mais limite la taille du muscle étudié en dépendant de la diffusion passive de l’oxygène et des nutriments pendant les tests. Les tests in situ maintiennent l’innervation et l’apport sanguin du muscle, mais se limitent à une évaluation terminale singulière, comme pour les tests in vitro20. Enfin, les tests in vivo sont les moins invasifs, le muscle restant dans son environnement natif avec des électrodes percutanées insérées près du nerf moteur pour stimuler électriquement le muscle. Une force de l’approche in vivo est le potentiel d’essais longitudinaux à travers les temps21,22,23.
L’évaluation in vivo de la contractilité musculaire maximale mesure de manière optimale la force maximale car l’anatomie et la physiologie normales de la souris restent intactes et la méthode peut être répétée sur la même souris avant et après une intervention ou tout au long de la vie. Plus précisément, la mesure in vivo de la force de l’extenseur du genou chez la souris est l’évaluation de la force murine ayant la plus grande pertinence translationnelle pour les études humaines, car le couple maximal d’extension du genou est couramment mesuré et considéré comme le test de force de référence chez l’homme avec une corrélation avec divers résultats fonctionnels et de santé24, 25,26,27 . De plus, une pathologie de l’extenseur du genou est observée avec le vieillissement ainsi qu’une myriade de blessures et de maladies1,2,4,5,6, mais l’évaluation de l’impact de ces conditions sur la force longitudinale de l’extenseur du genou chez la souris n’a pas été facilement réalisable.
Bien que cette méthode soit utile pour déterminer le couple maximal de l’extenseur du genou de manière longitudinale, certaines limites du protocole doivent être prises en compte. Les fréquences plus basses entre 40 Hz et 120 Hz ont été omises du protocole couple-fréquence, ce qui peut limiter la capacité de détecter les décalages vers la gauche ou la droite dans la courbe couple-fréquence avec une blessure ou une maladie. Cependant, en utilisant ce protocole couple-fréquence, nous avons pu détecter des altérations du couple tétanique maximal dans un modèle de lésion du LCA et entre des souris de type sauvage C56BL/6 et un modèle murin transgénique de masse musculaire supraphysiologique(Figure 8). Nous notons qu’il peut être bénéfique de fixer les électrodes avec des mains d’aide ou un appareil similaire, car les contractions musculaires peuvent déplacer légèrement les électrodes. Nous n’avons pas noté de déplacement évident d’électrodes avec des contractions progressives; cependant, la possibilité d’un léger mouvement des électrodes ne peut être exclue, ce qui peut avoir un impact sur la stimulation musculaire. De plus, l’électromyographie intramusculaire (EMG) n’a pas été réalisée en conjonction avec le protocole de stimulation; toutefois, l’inclusion de mesures EMG peut être faisable, si désiré et appropriée pour le modèle expérimental d’intérêt.
L’évaluation de la force de l’extenseur du genou dans les modèles murins de blessures et de maladies orthopédiques facilitera la recherche préclinique avec une pertinence translationnelle significative pour les mesures de force clinique. Notre protocole permet une évaluation précise et répétée de la force maximale de l’extenseur du genou chez la souris avec un équipement disponible dans le commerce accessible à tout laboratoire.
Déclarations de divulgation
Matthew Borkowski est employé par Aurora Scientific Inc., une entreprise qui pourrait potentiellement bénéficier des résultats de la recherche et est également un dirigeant de l’entreprise.
Remerciements
Nous tenons à remercier Rosario Maroto pour son assistance technique. La recherche rapportée dans cette publication a été soutenue par l’Institut national de l’arthrite et des maladies musculo-squelettiques et cutanées des National Institutes of Health sous le numéro d’attribution R01 AR072061 (CSF). Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les points de vue officiels des National Institutes of Health.
matériels
| Name | Company | Catalog Number | Comments |
| 1300A: 3-in-1 Whole Animal System- Mouse | Aurora Scientific Incorporated | 300D-305C-FP: dual-mode motor with custom knee extension apparatus, 605A: Dynamic Muscle Data Acquisition and Analysis System, 701C: Electrical Stimulator, 809C: in-situ Mouse Apparatus | |
| 6100 Dynamic Muscle Control LabBook software | Aurora Scientific Incorporated | DMC v6.000 | |
| 611A Dynamic Muscle Analysis | Aurora Scientific Incorporated | DMA v5.501 | |
| BravMini hair clippers | Wahl Clipper Corporation | ASIN: B00IN24ILE | |
| Eye Lube | Optixcare | Item Number: 142422 | |
| Isoflurane | Covetrus | NDC: 11695-6777-2 | |
| V-1 Tabletop Laboratory Animal Anesthesia System | VetEquip Inhalation Anesthesia Systems | Item Number: 901806 | |
| Prism 8 | GraphPad Software, LLC | Version 8.3.0 (328) |
Références
- Brightwell, C. R., et al. Moderate-intensity aerobic exercise improves skeletal muscle quality in older adults. Translational Sports Medicine. 2 (3), 109-119 (2019).
- Moro, T., et al. Muscle protein anabolic resistance to essential amino acids does not occur in healthy older adults before or after resistance exercise training. Journal of Nutrition. 148 (6), 900-909 (2018).
- Angelozzi, M., et al. Rate of force development as an adjunctive outcome measure for return-to-sport decisions after anterior cruciate ligament reconstruction. Journal of Orthopedic Sports Physical Therapy. 42 (9), 772-780 (2012).
- Kalyani, R. R., et al. Quadriceps strength, quadriceps power, and gait speed in older U.S. adults with diabetes mellitus: results from the National Health and Nutrition Examination Survey, 1999-2002. Journal of American Geriatric Society. 61 (5), 769-775 (2013).
- Culvenor, A. G., Ruhdorfer, A., Juhl, C., Eckstein, F., Øiestad, B. E. Knee extensor strength and risk of structural, symptomatic, and functional decline in knee osteoarthritis: A systematic review and meta-analysis. Arthritis Care Res (Hoboken). 69 (5), 649-658 (2017).
- Abramowitz, M. K., et al. Skeletal muscle fibrosis is associated with decreased muscle inflammation and weakness in patients with chronic kidney disease. American Journal of Physiology and Renal Physiology. 315 (6), 1658-1669 (2018).
- Arentson-Lantz, E. J., English, K. L., Paddon-Jones, D., Fry, C. S. Fourteen days of bed rest induces a decline in satellite cell content and robust atrophy of skeletal muscle fibers in middle-aged adults. Journal of Applied Physiology. 120 (1985), 965-975 (2016).
- Pratt, S. J. P., Lovering, R. M. A stepwise procedure to test contractility and susceptibility to injury for the rodent quadriceps muscle. Journal of Biological Methods. 1 (2), (2014).
- Kamekura, S., et al. Osteoarthritis development in novel experimental mouse models induced by knee joint instability. Osteoarthritis Cartilage. 13 (7), 632-641 (2005).
- Kwok, J., et al. Histopathological analyses of murine menisci: implications for joint aging and osteoarthritis. Osteoarthritis Cartilage. 24 (4), 709-718 (2016).
- Glasson, S. S., Blanchet, T. J., Morris, E. A. The surgical destabilization of the medial meniscus (DMM) model of osteoarthritis in the 129/SvEv mouse. Osteoarthritis Cartilage. 15 (9), 1061-1069 (2007).
- Christiansen, B. A., et al. Musculoskeletal changes following non-invasive knee injury using a novel mouse model of post-traumatic osteoarthritis. Osteoarthritis Cartilage. 20 (7), 773-782 (2012).
- Wurtzel, C. N., et al. Pharmacological inhibition of myostatin protects against skeletal muscle atrophy and weakness after anterior cruciate ligament tear. Journal of Orthopedic Research. 35 (11), 2499-2505 (2017).
- Botter, A., et al. Atlas of the muscle motor points for the lower limb: implications for electrical stimulation procedures and electrode positioning. European Journal of Applied Physiology. 111 (10), 2461-2471 (2011).
- Gobbo, M., Maffiuletti, N. A., Orizio, C., Minetto, M. A. Muscle moter point identification is essential for optimizing neuromuscular electrical stimulation use. Journal of Neuroengineering and Rehabililitation. 11, 17 (2014).
- Neelakantan, H., et al. Small molecule nicotinamide N-methyltransferase inhibitor activates senescent muscle stem cells and improves regenerative capacity of aged skeletal muscle. Biochemical Pharmacology. 163, 481-492 (2019).
- Kline, P. W., Morgan, K. D., Johnson, D. L., Ireland, M. L., Noehren, B. Impaired quadriceps rate of torque development and knee mechanics after anterior cruciate ligament reconstruction with patellar tendon autograft. American Journal of Sports Medicine. 43 (10), 2553-2558 (2015).
- Hiemstra, L. A., Webber, S., MacDonald, P. B., Kriellaars, D. J. Knee strength deficits after hamstring tendon and patellar tendon anterior cruciate ligament reconstruction. Medicine and Science in Sports and Exercise. 32 (8), 1472-1479 (2000).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. Journal of Visualized Experiments. (69), e4198 (2012).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. Journal of Visualized Experiments. (56), e3167 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskeletal Disorder. 12, 246 (2011).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. Journal of Visualized Experiments. (116), e54487 (2016).
- Gerlinger-Romero, F., et al. Non-invasive assessment of dorsiflexor muscle function in mice. Journal of Visualized Experiments. (143), e58696 (2019).
- Davis, C. C., Ellis, T. J., Amesur, A. K., Hewett, T. E., Di Stasi, S. Improvements in knee extension strength are associated with improvements in self-reported hip function following arthroscopy for femoroacetabular impingement syndrome. International Journal of Sports Physical Therapy. 11 (7), 1065-1075 (2016).
- Omori, G., et al. Quadriceps muscle strength and its relationship to radiographic knee osteoarthritis in Japanese elderly. Journal of Orthopedic Science. 18 (4), 536-542 (2013).
- Wilk, K. E., Romaniello, W. T., Soscia, S. M., Arrigo, C. A., Andrews, J. R. The relationship between subjective knee scores, isokinetic testing, and functional testing in the ACL-reconstructed knee. Journal of Orthopedic Sports and Physical Therapy. 20 (2), 60-73 (1994).
- Bobowik, P., Wiszomirska, I. Diagnostic dependence of muscle strength measurements and the risk of falls in the elderly. Internation Journal of Rehabilitation Research. 43 (4), 330-336 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon