Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Dreidimensionale Kultivierung von vaskularisiertem thermogenem Fettgewebe aus mikrovaskulären Fragmenten
In diesem Artikel
Zusammenfassung
Hier stellen wir ein detailliertes Protokoll vor, das die Verwendung von mikrovaskulären Fragmenten, die aus Nagetier- oder menschlichem Fettgewebe isoliert wurden, als einfachen Ansatz zur Herstellung von funktionellem, vaskularisiertem beigefarbenem Fettgewebe beschreibt.
Zusammenfassung
Die Entwicklung von thermogenem Fettgewebe (z. B. beigem oder braunem Fettgewebe) wurde als potenzielle Therapie für Stoffwechselerkrankungen oder für das Design von personalisiertem Mikrogewebe für Gesundheitsuntersuchungen und Arzneimitteltests untersucht. Aktuelle Strategien sind oft sehr komplex und können die multizellulären und funktionellen Eigenschaften von thermogenem Fettgewebe nicht vollständig vollständig abbilden. Mikrovaskuläre Fragmente, kleine intakte Mikrogefäße, die aus Arteriolen, Venolen und Kapillaren bestehen, die aus Fettgewebe isoliert sind, dienen als eine einzige autologen Quelle von Zellen, die die Vaskularisierung und die Bildung von Fettgewebe ermöglichen. Dieser Artikel beschreibt Methoden zur Optimierung der Kulturbedingungen, um die Erzeugung von dreidimensionalem, vaskularisiertem und funktionellem thermogenem Fettgewebe aus mikrovaskulären Fragmenten zu ermöglichen, einschließlich Protokollen zur Isolierung mikrovaskulärer Fragmente aus Fettgewebe und Kulturbedingungen. Darüber hinaus werden Best Practices sowie Techniken zur Charakterisierung der künstlich hergestellten Gewebe diskutiert, und es werden Probenergebnisse sowohl von Nagetieren als auch von menschlichen mikrovaskulären Fragmenten bereitgestellt. Dieser Ansatz hat das Potenzial, für das Verständnis und die Entwicklung von Therapien für Fettleibigkeit und Stoffwechselerkrankungen genutzt zu werden.
Einleitung
Das Ziel dieses Protokolls ist es, einen Ansatz zur Entwicklung von vaskularisiertem beigem Fettgewebe aus einem einzigen, potenziell autologen Mikrovaskulärfragment (MVF) zu beschreiben. Es wurde gezeigt, dass braunes und beigefarbenes Fettgewebe vorteilhafte Eigenschaften im Zusammenhang mit der Stoffwechselregulierung aufweist. Das geringe Volumen dieser Fettgewebsdepots bei Erwachsenen begrenzt jedoch die potenziellen Auswirkungen auf den systemischen Stoffwechsel, insbesondere bei Erkrankungen wie Adipositas oder Typ-2-Diabetes 1,2,3,4,5,6,7. Es besteht ein erhebliches Interesse an braunem/beigem Fett als therapeutisches Ziel, um die schädlichen metabolischen Auswirkungen von Adipositas und ihren Komorbiditäten zu verhindern 8,9,10,11,12.
MVFs sind Gefäßstrukturen, die direkt aus Fettgewebe isoliert, kultiviert und über längere Zeiträume in einer dreidimensionalen Konfiguration gehalten werden können13,14,15. Frühere Arbeiten unserer Gruppe und anderer haben begonnen, die multizelluläre und multipotente Kapazität von MVFs zu nutzen, insbesondere in Bezug auf die Bildung von Fettgewebe16,17,18. Im Rahmen dieser Arbeit haben wir kürzlich gezeigt, dass MVFs, die aus Nagetiermodellen für gesunden und Typ-2-Diabetes19 und von menschlichen Probanden (Erwachsene über 50 Jahre)20 stammen, Zellen enthalten, die zur Bildung von thermogenem oder beigefarbenem Fettgewebe induziert werden können.
Hierin liegt ein innovativer Ansatz vor, bei dem ein MVF aus einer einzigen Quelle verwendet wird, das nicht nur in der Lage ist, beiges Fettgewebe zu erzeugen, sondern auch die damit verbundene und kritische vaskuläre Komponente21. Der Einsatz dieser Technik könnte von großem Wert für Studien sein, die nach einem einfachen Tissue-Engineering-Ansatz für die thermogene Bildung von Fettgewebe suchen. Im Gegensatz zu anderen Methoden, die darauf abzielen, beiges Fettgewebe 22,23,24,25,26,27,28 zu entwickeln, erfordert der in dieser Studie beschriebene Prozess nicht die Verwendung mehrerer Zelltypen oder komplexer Induktionsschemata. Vaskularisierte beige und weiße Fettmodelle können mit MVFs erstellt werden, die aus Nagetieren und menschlichen Quellen stammen, was ein großes Translationspotenzial aufweist. Das Endprodukt dieses Protokolls ist ein künstlich hergestelltes beigefarbenes thermogenes Fettgewebe mit einer Struktur und Stoffwechselfunktion, die mit braunem Fettgewebe vergleichbar ist. Insgesamt stellt dieses Protokoll die Idee dar, dass eine leicht zugängliche und möglicherweise autologe Quelle MVF eine lohnende therapeutische Intervention und ein Werkzeug zur Untersuchung von Stoffwechselstörungen sein könnte.
Protokoll
Diese Studie wurde in Übereinstimmung mit dem Tierschutzgesetz und den Durchführungsbestimmungen zum Tierschutz nach den Grundsätzen des Leitfadens für die Pflege und Verwendung von Versuchstieren durchgeführt. Alle Tierverfahren wurden vom Institutional Animal Care and Use Committee der University of Texas in San Antonio genehmigt.
HINWEIS: Für die unten beschriebenen Schritte werden männliche Lewis-Ratten verwendet. Sowohl für eine Sammlung von mikrovaskulären Fragmenten (MVF) aus Weibchen als auch aus Mäusen müssen geringfügige Protokollanpassungen vorgenommen werden29. Bei Protokollen, die humane MVFs (h-MVFs) verwenden, sind die einzigen Schritte erforderlich, die Resuspension von h-MVFs gemäß dem Protokoll des Herstellers, die Aufbereitung von Wachstumsmedien (1.3), die Bildung von Fibrinhydrogelen (5) und die Kultivierung (6). Einen Überblick über das Protokoll finden Sie in Abbildung 1.
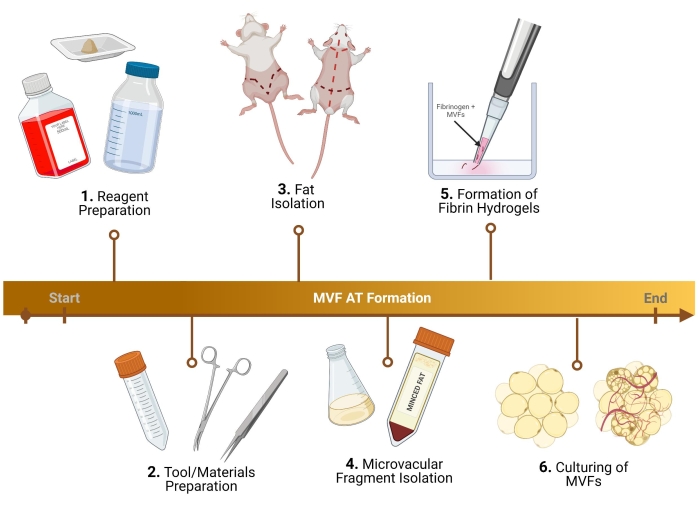
Abbildung 1: Versuchsskizze. Aufschlüsselung von sechs Schlüsselschritten vor der Analyse für die Bildung von thermogenem Fettgewebe mit MVF. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
1. Vorbereitung der Reagenzien
HINWEIS: Die folgenden Reagenzien entsprechen einer Ratte, die in einer Biohaube gewogen und hergestellt wurde.
- Bereiten Sie Rinderserumalbumin (BSA) in PBS vor.
- Bereiten Sie 10 mg/ml (1,0 %) BSA in PBS vor, um es für die Waschschritte (1 mg/ml, 0,1 %) und den Aufschluss (4 mg/ml, 0,4 %) zu verdünnen.
- Bereiten Sie verschiedene BSA-Konzentrationen vor, wie in Schritt 1.1.1 beschrieben, indem Sie die Schritte 1.1.3 bis 1.1.5 befolgen.
- 10 mg/ml BSA in PBS (1% BSA in PBS)
- Geben Sie 500 mg BSA und 500 ml PBS in ein konisches 50-ml-Röhrchen und wirbeln Sie die Lösung vortex, um die BSA aufzulösen.
- Wenn sich übermäßige Blasen bilden, zentrifugieren Sie die Lösung 2 Minuten lang bei 350 x g . Sterilisieren Sie die Lösung mit einem 0,22 μm Nylon-Netzfilter.
- 1 mg/ml BSA in PBS (0,1 % BSA in PBS)
- Verdünnen Sie 15 ml 10 mg/ml BSA in PBS 1:10 mit PBS, indem Sie 15 ml 10 mg/ml BSA in PBS zu 135 ml PBS in einer sterilen 500-ml-Flasche hinzufügen und die Flasche vorsichtig schütteln, um eine homogene Mischung zu gewährleisten.
- 4 mg/ml BSA in PBS (0,4 % BSA in PBS)
- Verdünnen Sie 35 ml 10 mg/ml BSA in PBS 1:2,5 mit PBS, indem Sie 35 ml 10 mg/ml BSA in PBS + 57,5 ml PBS in eine sterile 100-ml-Flasche geben und die Flasche vorsichtig schütteln, um eine homogene Mischung zu gewährleisten.
- Bereiten Sie Kollagenase in BSA für die Verdauung von gehackten Fettpölsterchen vor.
- Bereiten Sie 6 mg/ml Kollagenase vor.
- In einem konischen 50-ml-Röhrchen wiegen Sie 72 mg Kollagenase ab (Etikett "für Epi").
- In drei konischen 50-ml-Röhrchen wiegen Sie jeweils 144 mg Kollagenase (Etikett "für Ing 1", "für Ing 2" und "für SubQ") ab.
- Lagern Sie die abgewogene Kollagenase bis zur Verwendung bei 4 °C.
Anmerkungen: Fügen Sie BSA/PBS erst kurz vor der Verdauung hinzu. - Geben Sie 12 ml 4 mg/ml BSA in PBS in das Röhrchen mit 72 mg Kollagenase.
- Geben Sie 24 ml 4 mg/ml BSA in PBS in die Röhrchen mit 144 mg Kollagenase.
- Schütteln Sie die Röhrchen, um eine homogene Lösung zu gewährleisten, und filtern Sie die Lösung mit einem 0,22 μm Nylon-Netzfilter.
- Bereiten Sie 6 mg/ml Kollagenase vor.
- Bereiten Sie Nährmedien vor, die mit Aminocapronsäure (ACA) angereichert sind, um das isolierte MVF zu ernähren/zu differenzieren.
- Nährmedien (GM): Ergänzen Sie DMEM mit 20 % FBS, 1 % Penicillin-Streptomycin (Pen-Streptokokken), 0,2 % Mykoplasmen-Prophylaxe und 1 mg/ml ACA.
- Bereiten Sie weiße adipogene Medien (WAM) vor.
- WAM-Induktion: Ergänzen Sie DMEM/F12 mit 20 % FBS, 1 % Pen-Streptokokken, 0,2 % Mykoplasmen-Prophylaxe, 10 μg/ml Insulin, 10 μm Forskolin, 1 μm Dexamethason und 1 mg/ml ACA.
HINWEIS: Bei h-MVFs zusätzlich 125 μM Indometacin hinzufügen. - WAM-Erhaltung: Ergänzen Sie DMEM/F12 mit 20 % FBS, 1 % Pen-Streptokokken, 0,2 % Mykoplasmen-Prophylaxe, 5 μg/ml Insulin und 1 mg/ml ACA.
Anmerkungen: Ändern Sie bei h-MVFs die Insulinkonzentration auf 10 μg/ml.
- WAM-Induktion: Ergänzen Sie DMEM/F12 mit 20 % FBS, 1 % Pen-Streptokokken, 0,2 % Mykoplasmen-Prophylaxe, 10 μg/ml Insulin, 10 μm Forskolin, 1 μm Dexamethason und 1 mg/ml ACA.
- Beigefarbene adipogene Medien (BAM) herstellen.
- BAM-Induktion: DMEM/F12 mit 20 % FBS, 1 % Pen-Streptokokken, 0,2 % Mykoplasmen-Prophylaxe, 10 μg/ml Insulin, 10 μm Forskolin, 1 μm Dexamethason, 1 μm Rosiglitazon, 20 nM 3,3′,5-Trijod-L-Thyronin (T3) und 1 mg/ml ACA ergänzen.
Anmerkungen: Ändern Sie bei h-MVFs die Konzentration von T3 auf 120 nM. - BAM-Erhaltung: Ergänzen Sie DMEM/F12 mit 20 % FBS, 1 % Pen-Streptokokken, 0,2 % Mykoplasmen-Prophylaxe, 5 μg/ml Insulin, 10 μm Forskolin, 1 μm Rosiglitazon, 20 nM T3 und 1 mg/ml ACA.
HINWEIS: Ändern Sie bei h-MVFs die Insulinkonzentration auf 10 μg/ml und die T3-Konzentration auf 120 nM.
- BAM-Induktion: DMEM/F12 mit 20 % FBS, 1 % Pen-Streptokokken, 0,2 % Mykoplasmen-Prophylaxe, 10 μg/ml Insulin, 10 μm Forskolin, 1 μm Dexamethason, 1 μm Rosiglitazon, 20 nM 3,3′,5-Trijod-L-Thyronin (T3) und 1 mg/ml ACA ergänzen.
- Bereiten Sie Thrombin vor (muss nur hergestellt werden, wenn die aliquotierte Stammlösung nicht verfügbar ist), um das Gerinnungsmittel herzustellen, das in Fibringelen verwendet werden soll.
- 10 U/mL Thrombin inddH2O:
- Resuspendieren Sie Thrombinpulver mit 1-5 mlddH2Oin der Durchstechflasche des Herstellers und überführen Sie die Resuspension in ein 250-ml-Becherglas.
- Bringen Sie die Lösung auf 100 ml und pipettieren Sie die Lösung mehrmals auf und ab, um eine homogene Mischung zu gewährleisten. Aliquotieren Sie die Lösung in konische 15-ml-Röhrchen (~10 ml/Röhrchen) und lagern Sie die Aliquots in einem -20 °C-Gefrierschrank.
Anmerkungen: Tauen Sie das Thrombin bei Raumtemperatur (RT) auf.
- 10 U/mL Thrombin inddH2O:
2. Werkzeug-/Materialvorbereitung
HINWEIS: Alle Instrumente sollten vor der Verwendung autoklaviert/sterilisiert werden.
- Epididymale/inguinale/subkutane Fettisolierung (Operation in einem definierten Operationsbereich)
- Stellen Sie sicher, dass Einwegunterlagen, zwei Scheren, ein Hämostat (optional), zwei Pinzetten und vier konische 50-ml-Röhrchen mit 10-15 ml 1 mg/ml BSA (0,1 %) in PBS zur Verfügung stehen.
- Isolierung mikrovaskulärer Fragmente
- Stellen Sie für das Zerkleinern (das in einer Biohaube durchgeführt werden soll) sicher, dass drei unbeschichtete sterile 100-mm-Petrischale, eine Pinzette und eine gebogene Schere zur Verfügung stehen.
- Für den Aufschluss und die Isolierung (in einer Biohood) ist die Verfügbarkeit einer Schere, einer Pinzette, acht unbeschichteter steriler 100-mm-Petrischale, drei unbeschichteter steriler 35-mm-Petrischale, Kollagenase gewogen und bei 4 °C, vier 250-ml-Kolben, einem Kunststoffhalter mit einem Loch in der Mitte, vier 500-μM-Sieben (in 3 in abgerundeten Quadraten geschnitten) sicherzustellen. vier 37-μM-Siebe (in 3 in abgerundete Quadrate geschnitten) und 11 konische 50-ml-Röhrchen.
- Fibrin-Resuspension
- Stellen Sie bei Fibrin-Hydrogelen (die in einer Biohood durchgeführt werden müssen) sicher, dass Fibrinogen, Thrombin und Wachstumsmedien (die während der Reagenzienherstellung hergestellt werden) verfügbar sind.
3. Fettisolierungsprotokoll
- Vorbereitende Schritte
- Füllen Sie einen Becher mit Ethanol, um die chirurgischen Instrumente zu waschen und zu desinfizieren, bevor Sie sie verwenden. Bereiten Sie als Nächstes den Tisch für den Umgang mit der Ratte vor und halten Sie ein Vakuum bereit, um das während des Rasierschritts erzeugte Fell anzusaugen.
- Bereiten Sie einen Eimer mit Eis vor, in den die zuvor vorbereiteten konischen 50-ml-Röhrchen mit jeweils 10 ml 1 mg/ml BSA gestellt werden. Beschriften Sie die Röhrchen entsprechend.
HINWEIS: Es kann notwendig sein, zwei separate konische Röhrchen für das Leistenfett zu haben, da zwei Seiten extrahiert werden müssen und die Menge an Fett, die aus dieser Region gesammelt wird, im Vergleich zu Nebenhoden und hinteren Subkutan tendenziell am größten ist. - Beginnen Sie mit einer euthanasierten Ratte im definierten Operationsbereich mit den erforderlichen chirurgischen Instrumenten. Im Allgemeinen wird CO2 verwendet, um die Ratten gemäß den IACUC-Protokollen einzuschläfern.
- Rasieren Sie die Ratte mit einer Haarschneidemaschine um den interessierenden Bereich herum. Rasieren Sie sich insbesondere zwischen den Leisten und der Hälfte des Bauches, um Nebenhoden und Leistenfett zu isolieren (verwenden Sie den kleineren Rasierer für das Fell in dieser Region). Rasieren Sie den gesamten Rücken, damit sich das hintere Unterhautfett zwischen den Skapulen befindet (es ist am besten, einen größeren Rasierer zu verwenden, da das Fell auf der Rückseite der Ratte dicker ist).
- Bereiten Sie die Ratte aseptisch vor, indem Sie sie mit 70%igem Ethanol besprühen. Im Allgemeinen wird empfohlen, den Bereich, der geschnitten werden soll, zweimal zu reinigen.
- Isolierung verschiedener Fettdepots
- Inguinal (subkutan)
- Heben Sie in Rückenlage die Haut unterhalb des Penis mit einer Schere an. Beginne den Schnitt mit einer Schere, beginne in der Mitte und schneide seitlich, bilde eine "V"-Form und schlaufe zur Rückseite der Ratte, um auf das gesamte Fettdepot zuzugreifen. Denken Sie daran, oberflächlich zu schneiden, damit das Fett darunter intakt ist. Achten Sie während des Schneideschritts auf die Trennung der Haut vom Fett, indem Sie das miteinander verbundene Fasziengewebe durchtrennen (Abbildung 2A).
- Sobald die Faszie richtig geschnitten ist, stellen Sie sicher, dass die beiden Seiten des Leistenfetts sichtbar sind (das Leistenfett erstreckt sich von der Leistengegend nach hinten). Als nächstes entfernen Sie das Fett von beiden Seiten in zwei separate konische Röhrchen, die 10 ml 1 mg/ml BSA enthalten (Abbildung 2B).
- Nebenhoden (viszeral)
- Entnahme des Nebenhodenfetts, indem Sie durch die Bauchhaut und vorsichtig durch die dünne Schicht schneiden, die die Hoden umgibt (Abbildung 2C).
- Ziehen Sie das Fettgewebe vorsichtig mit einer Pinzette heraus und schneiden Sie es mit einer Schere heraus. Vermeiden Sie es, größere sichtbare Blutgefäße zu präparieren (sollten Hoden und Nebenhoden entnommen werden, entfernen Sie diese während des Reinigungsschritts in der Biohood).
- Geben Sie das entfernte Fett vorsichtig in ein konisches 50-ml-Röhrchen mit 10 ml 1 mg/ml BSA in PBS.
HINWEIS: Die Entfernung des Nebenhodenfetts sollte nach der Entfernung des Leistenfetts erfolgen. Das Nebenhodenfett ist im Allgemeinen kleiner und befindet sich unterhalb des Leistenfetts, unterhalb der Bauchhaut, die den Hoden und den Nebenhoden umgibt.
- Posterior subkutan
- Drehen Sie die Ratte in Bauchlage (Rückenseite nach oben) und schneiden Sie mit einer großen Schere die Haut des Rückens (die Haut in diesem Bereich ist dick) bis zur Kopfhaut auf, wobei Sie darauf achten, nicht zu tief direkt unter der Haut zu schneiden (Abbildung 2D).
- Schneiden Sie die Faszien durch, die die Haut mit dem Gewebe verbinden. Das Fett befindet sich im Bereich des Schulterblattes. Notieren Sie sich, um das subkutane Fett vom braunen Fett zu unterscheiden/zu trennen. Das braune Fett befindet sich näher an der Wirbelsäule (Abbildung 2E).
- Isolieren Sie das Fett und geben Sie es mit 10 ml 1 mg/ml BSA in PBS in die entsprechenden konischen 50-ml-Röhrchen.
- Inguinal (subkutan)
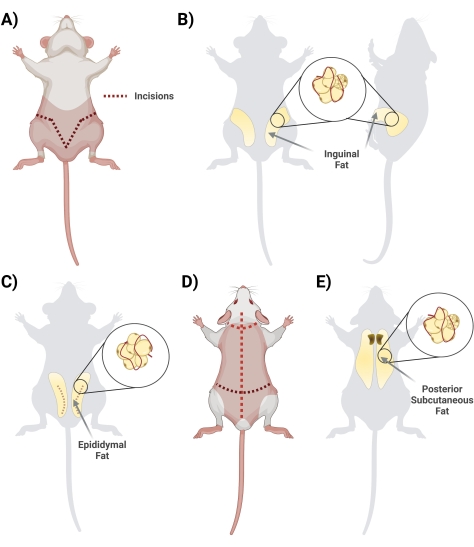
Abbildung 2: Isolierung verschiedener Fettgewebsdepots . (A) Initiale Inzisionen, die für die Exzision des inguinalen Fettgewebes erforderlich sind. (B) Standort des Leistenfettdepots. (C) Lage des Nebenhodenfettdepots unter Angabe des für den Zugang erforderlichen Schnittes der Außenhaut. (D) Zusätzliche Schnitte sind erforderlich, sobald die Mäuse in Bauchlage gelegt werden, um Zugang zu zusätzlichem Fett zu erhalten. (E) Lage des hinteren subkutanen Fettdepots. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Protokoll zur Isolierung mikrovaskulärer Fragmente
- Legen Sie 50 ml konische Röhrchen mit herausgeschnittenem Fett von der Ratte in die Biohood.
- Geben Sie das Fett mit einer Pinzette in eine Standard-100-mm-Petrischale (mit ~0,5 ml 1 mg/ml BSA in PBS, um das Gewebe mit Feuchtigkeit zu versorgen).
- Reinigen und entfernen Sie alle sichtbaren Blutgefäße und Muskeln/Fremdgewebe von Fett.
- Hacken Sie das Fett mit einer Schere für ~10 Minuten (so weit zerkleinern, dass es mit einer 10-ml-Pipette übertragen werden kann).
- Überprüfen Sie auf Klumpen, indem Sie ~0,5 ml 1 mg/ml BSA in PBS hinzufügen. Hacken Sie bei Bedarf weiter.
- Übertragen Sie das gehackte Fett in einen sterilen 250-ml-Kolben mit einer 10-ml-Pipette.
Anmerkungen: Notieren Sie das Volumen mit einer Pipette. - Fügen Sie so viel BSA (1 mg/ml) hinzu, dass das Endvolumen 20 ml beträgt.
- Fügen Sie der Kollagenase 4 mg/ml BSA in PBS hinzu (Kollagenase-Endkonzentration: 6 mg/ml) (d. h. 12 ml für die 72 mg Kollagenase oder 24 ml für die 144 mg Kollagenase).
Anmerkungen: Fügen Sie erst hinzu, wenn das Zerkleinern abgeschlossen ist, da es zeitkritisch ist. - Schütteln Sie das konische Röhrchen vorsichtig, um eine homogene Lösung zu gewährleisten, und sterilisieren Sie die Lösung mit einem 0,22 μm Nylon-Netzfilter.
- Für das Nebenhodenfett ~8-10 Minuten verdauen; für das Leisten- und hintere Unterhautfett ~15-20 min in einem 37 °C warmen Wasserbad verdauen, dabei den Kolben durchgehend kreisend schütteln (stoppen Sie in dem Moment, in dem das Fett dort ankommt, wo nur noch wenige Klumpen übrig sind).
- Übertragen Sie das verdaute Fett in ein konisches 50-ml-Röhrchen (es sollten ~ 30 ml/Röhrchen vorhanden sein) und kennzeichnen Sie das Röhrchen als "verdautes Fett".
- Drehen Sie das Röhrchen 4 Minuten lang bei 400 x g ; Nach dem Schleudern muss das Pellet rot sein (Abbildung 3A).
- Legen Sie während des Schleuderns das sterile 37-μM-Sieb und das 500-μM-Sieb in eine sterile Petrischale mit 5 ml 1 mg/ml BSA in PBS, um es vor Gebrauch einzuweichen.
- Nach dem Schleudern wird der Überstand in ein konisches 50-ml-Röhrchen umgefüllt, das als "Abfall" gekennzeichnet ist. Führen Sie das Dekantieren vorsichtig durch, um das oberflächliche Fett zu entfernen und das Pellet aus MVFs nicht zu stören.
- Geben Sie 10 ml 1 mg/ml BSA in PBS in das Röhrchen mit dem Pellet ("verdautes Fett"). Das Pellet 2x verreiben (auf und ab pipettieren).
- Vermeiden Sie es, zu grob mit dem Pellet umzugehen, um die Fragmente nicht zu beschädigen.
- Platzieren Sie das 500-μM-Sieb in einer neuen Petrischale über dem Kunststoff-Siebhalter (Abbildung 3B).
- Pipettieren Sie 10 ml aus dem Röhrchen des "verdauten Pellets" über ein 500-μM-Sieb mit konzentrischen Kreisen (Abbildung 3C).
- Waschen Sie den Filter mit zusätzlichen 5 ml 1 mg/ml BSA in PBS. Die gewünschten Zellen werden in die Petrischale gefiltert; Entsorgen Sie daher das 500-μM-Sieb, aber bewahren Sie die gefilterte Flüssigkeit in der Petrischale auf.
- Platzieren Sie das 37 μM-Sieb in einer neuen Petrischale über dem Kunststoff-Siebhalter.
- Tauschen Sie die Pipette aus, um Klumpen zu entfernen, bevor Sie das 37-μM-Sieb verwenden.
- Pipettieren Sie die aus der ersten Filtration gewonnene Flüssigkeit über das 37-μM-Sieb mit konzentrischen Kreisen.
- Waschen Sie den Filter mit zusätzlichen 5 ml 1 mg/ml BSA in PBS. Die gewünschten Zellen verbleiben im Filter, daher wird die gefilterte Flüssigkeit verworfen, aber das 37 μM-Sieb gespeichert.
- Schieben Sie das 37-μM-Sieb in eine neue Petrischale, die 5 ml 1 mg/ml BSA in PBS enthält.
- Schütteln Sie die Schüssel, indem Sie sie gegen einen konischen Halter klopfen, um die Fragmente zu entfernen. Nicht zu kräftig schütteln, da die Flüssigkeit/Zellen aus der Petrischale auslaufen können.
- Spülen Sie den Filter mit zusätzlichen 5 ml 1 mg/ml BSA in PBS. Die gewünschten Zellen verbleiben in flüssiger Lösung in der Petrischale. Bewahren Sie das 37-μM-Sieb und das gelöste Fragment mit Flüssigkeit in der Petrischale für die folgenden Schritte auf.
- Übertragen Sie das BSA+-Fragment mit Flüssigkeit in ein steriles konisches 50-ml-Röhrchen.
- Wiederholen Sie das Spülen des 37 μM-Siebs noch mehrmals (jedes Mal mit ~5 mL von 1 mg/mL BSA in PBS) und geben Sie es in das konische Röhrchen. Wiederholen Sie den Vorgang, bis das gesammelte Gesamtvolumen ~15-20 ml beträgt. Schließlich werden die gewünschten Zellen aus der flüssigen Lösung in der Petrischale gesammelt und in ein konisches Röhrchen gelegt. Entsorgen Sie zu diesem Zeitpunkt das 37-μM-Sieb nach der letzten Spülung, aber bewahren Sie die gelösten Fragmente mit Flüssigkeit im konischen 50-ml-Röhrchen auf.
- Schneiden Sie das Ende einer 200-μl-Pipettenspitze mit einer Schere ab. Schütteln Sie das 50-ml-Röhrchen vorsichtig, entnehmen Sie zwei Proben von 20 μl und legen Sie sie in eine saubere 35-mm-Petrischale.
- Zählen Sie die Anzahl der Fragmente in jeder Probe in der Petrischale, um die Gesamtzahl der isolierten MVFs zu erhalten.
Gesamtzahl der Fragmente =
- Drehen Sie das verbleibende gelöste Fragment mit Flüssigkeit in einem konischen 50-ml-Röhrchen bei 400 x g für 4 Minuten, um die MVF zu sammeln.
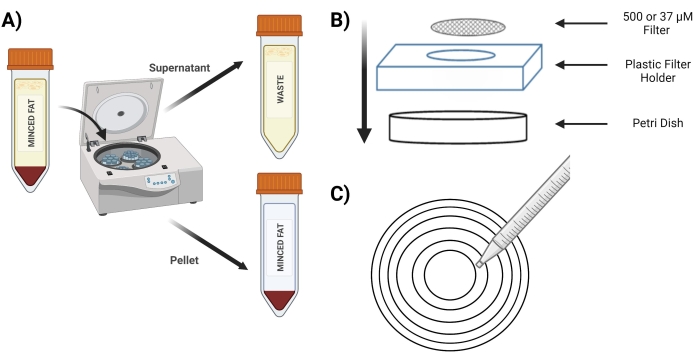
Abbildung 3: Isolierung von MVFs. (A) Postverdauung des Fettgewebes, Darstellung der Trennung von MVFs, die Pellets und Überstand enthalten, nach einem Spin-Down. (B) Anordnung der Versorgungen für die Filtration und den Einschluss von MVFs. (C) Darstellung der konzentrischen Kreismethode für Filtrations-/Waschschritte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Bildung von Fibrin-Hydrogelen
- Beispielrechnungen:
HINWEIS: Nachfolgend finden Sie die Berechnungen für MVFs, die mit ~15.000-20.000 MVF/ml ausgesät wurden, und das Fibrinogen:Thrombin-Gel-Verhältnis von 2:5, wobei Fibrinogen in einer Konzentration von 20 mg/ml verwendet wird.- Für die Herstellung von fünf 250-μl-Gelen wird ein Gesamtvolumen von 1.250 μl benötigt. Berücksichtigen Sie immer Pipettierfehler, daher reichen Sie für 1,5 ml Gele.
- Berechnen Sie die benötigte Fibrinogenmenge wie folgt:
 , X1 = 428,57 μl Fibrinogen
, X1 = 428,57 μl Fibrinogen - Berechnen Sie das benötigte Thrombinvolumen wie folgt:
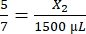 , X2 = 1.071,43 μl Thrombin
, X2 = 1.071,43 μl Thrombin - Für das erforderliche Volumen von 428,57 μl stellen Sie 500 μl Fibrinogen wie folgt her:
20 mg/ml * 0,5 ml = 10 mg Fibrinogen. Resuspendieren Sie dies in 500 μL DMEM - Um jedes Gel zu erhalten, berechnen Sie das Volumen von Fibrinogen und Thrombin wie folgt:
- Fibrinogen:
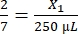 , X1 = 71,43 μl Fibrinogen (in DMEM) + MVF
, X1 = 71,43 μl Fibrinogen (in DMEM) + MVF - Thrombin:
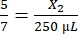 , X2 = 178,57 μl Thrombin
, X2 = 178,57 μl Thrombin
- Fibrinogen:
- Berechnen Sie die benötigte Fibrinogenmenge wie folgt:
- Für die Herstellung von fünf 250-μl-Gelen wird ein Gesamtvolumen von 1.250 μl benötigt. Berücksichtigen Sie immer Pipettierfehler, daher reichen Sie für 1,5 ml Gele.
- MVF-Fibrin-Gel-Guss
- Dekantieren Sie den größten Teil der Flüssigkeit im abgeschleuderten Fragment in das konische 50-ml-Röhrchen. Verwenden Sie eine Pipette, um das kleine Flüssigkeitsvolumen zu entfernen, das sich am Rand des konischen Röhrchens verfängt.
- Geben Sie Thrombin in Vertiefungen, in denen Gele hergestellt werden (Abbildung 4A).
- Schneiden Sie das Ende einer 200-μl-Pipettenspitze ab und resuspendieren Sie die MVFs vorsichtig mit Fibrinogen, um eine endgültige Dichte von ~15.000-20.000 MVF/ml zu erhalten, sobald sie im Gel vorhanden sind.
- Klemmen Sie das Ende einer 200-μl-Pipettenspitze ab und pipettieren Sie MVF+Fibrinogen vorsichtig in die Thrombinlösung. Pipettieren Sie schnell auf und ab, um eine homogene Mischung zu gewährleisten. Wiederholen Sie den Vorgang, bis alle Gele hergestellt sind (Abbildung 4B).
- Legen Sie die Wellplatte(n) für ~15 min in einen Inkubator (37 °C, 5 %CO 2), um eine Gelvernetzung zu ermöglichen (Abbildung 4C).
- Geben Sie 100-150 μl Nährmedium in jede Vertiefung.
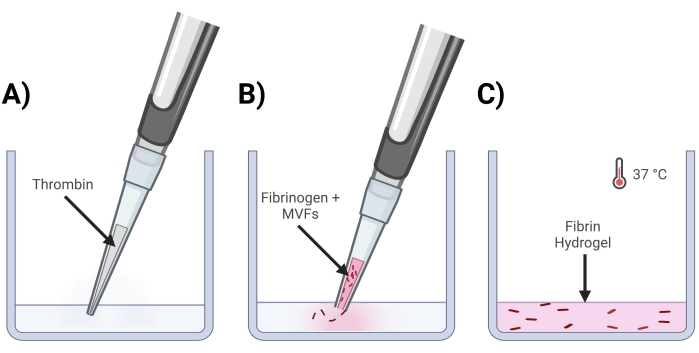
Abbildung 4: Bildung von MVF-Fibringelen . (A) Ein 5/7-teiliges Thrombingemisch wird in die entsprechende Vertiefung pipettiert. (B) Als nächstes wird mit einer abgeschnittenen Pipettenspitze (um MVFs nicht zu stören) ein 2/7-Komponenten-Fibrinogen+MVF-Gemisch in die Vertiefung pipettiert und vorsichtig gemischt. (C) Zum Schluss werden alle fertigen Gele bei 37 °C in einen Inkubator gegeben, damit sich das Hydrogel vollständig verfestigen kann, bevor das Medium darauf platziert wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
6. Kultivierungsbedingungen von MVFs
- Für die Kultivierung von nicht vaskularisiertem weißem und beigefarbenem Fettgewebe (+ GM-Kontrolle) verwenden Sie die in Abbildung 5 gezeigten Zeitachsen19.
- Für die Kultivierung von vaskularisiertem weißem und beigefarbenem Fettgewebe (+ GM-Kontrolle) verwenden Sie die in Abbildung 6 gezeigten Zeitachsen19.
- Hydrogele sollten für die Dauer der Kultur für die Studie in einem Inkubator (37 °C, 5 % CO2) aufbewahrt werden, wobei das Medium jeden zweiten Tag gewechselt werden sollte. Zur Fixierung und Handhabung von Proben für die Analyse siehe bereits veröffentlichte Arbeiten16,19,20.

Abbildung 5: Timing für die Bildung von nicht-vaskularisiertem Fettgewebe. Diese Abbildung wurde von Acosta et al.19 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
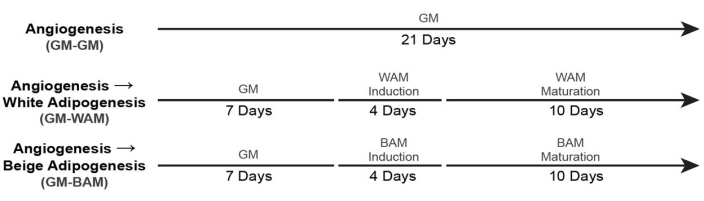
Abbildung 6: Timing für die Bildung von vaskularisiertem Fettgewebe. Diese Abbildung wurde von Acosta et al.19 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Es gibt einige wichtige phänotypische morphologische Merkmale des beige/braunen Fettgewebes: Es ist multilokulär / enthält kleine Lipidtröpfchen, besitzt eine große Anzahl von Mitochondrien (der Grund für sein charakteristisches "bräunliches" Aussehen in vivo), hat dementsprechend eine hohe Sauerstoffverbrauchsrate/mitochondriale Bioenergetik, ist stark vaskularisiert, hat eine erhöhte Lipolyse/insulinstimulierte Glukoseaufnahme und, am berüchtigtsten, exprimiert hohe Konzentrationen von Uncoupling Pro...
Diskussion
Das Gebiet des braun/beigen Fettgewebe-Engineerings ist weitgehend unausgereift 22,23,24,25,26,27,28, wobei der Großteil der Fettmodelle für weißes Fettgewebe entwickelt wird 8,22,31. Künstlich ...
Offenlegungen
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Dr. Acosta wird durch die Zuschüsse CA148724 und TL1TR002647 der National Institutes of Health unterstützt. Dr. Gonzalez Porras wird vom National Institute of Diabetes and Digestive and Kidney Diseases der National Institutes of Health unter der Fördernummer F32-0DK122754 unterstützt. Diese Arbeit wurde zum Teil von den National Institutes of Health (5SC1DK122578) und dem Department of Biomedical Engineering der University of Texas at San Antonio unterstützt. Der Inhalt liegt in der alleinigen Verantwortung der Autoren und spiegelt nicht unbedingt die offizielle Meinung der National Institutes of Health wider. Figuren wurden teilweise mit Biorender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
Referenzen
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten