Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Трехмерная культура васкуляризированной термогенной жировой ткани из микрососудистых фрагментов
В этой статье
Резюме
Здесь мы представляем подробный протокол, описывающий использование микрососудистых фрагментов, выделенных из жировой ткани грызунов или человека, в качестве простого подхода к созданию функциональной, васкуляризированной бежевой жировой ткани.
Аннотация
Инженерная термогенная жировая ткань (например, бежевые или коричневые жировые ткани) была исследована в качестве потенциальной терапии метаболических заболеваний или для разработки персонализированных микротканей для скрининга здоровья и тестирования лекарств. Современные стратегии часто довольно сложны и не могут точно полностью отразить многоклеточные и функциональные свойства термогенной жировой ткани. Микрососудистые фрагменты, небольшие интактные микрососуды, состоящие из артериол, венул и капилляров, выделенных из жировой ткани, служат единым аутологичным источником клеток, которые обеспечивают васкуляризацию и образование жировой ткани. В данной статье описываются методы оптимизации условий культивирования для получения трехмерных, васкуляризированных и функциональных термогенных жировых тканей из микрососудистых фрагментов, включая протоколы выделения микрососудистых фрагментов из жировой ткани и условий культивирования. Кроме того, обсуждаются лучшие практики, а также методы характеристики сконструированных тканей, а также приводятся результаты образцов микрососудистых фрагментов как грызунов, так и человека. Этот подход может быть использован для понимания и разработки методов лечения ожирения и метаболических заболеваний.
Введение
Целью этого протокола является описание подхода к развитию васкуляризированной бежевой жировой ткани из одного, потенциально аутологичного источника, микрососудистого фрагмента (MVF). Было продемонстрировано, что коричневые и бежевые жировые ткани проявляют полезные свойства, связанные с метаболической регуляцией; Однако небольшой объем этих депо жировой ткани у взрослых ограничивает потенциальное влияние на системный метаболизм, особенно при таких болезненных состояниях, как ожирение или диабет 2 типа 1,2,3,4,5,6,7. Существует значительный интерес к коричнево-бежевому жиру как терапевтической мишени для предотвращения вредных метаболических эффектов, связанных с ожирением и сопутствующими заболеваниями 8,9,10,11,12.
MVF представляют собой сосудистые структуры, которые могут быть непосредственно изолированы от жировой ткани, культивированы и поддерживаться в трехмерной конфигурации в течение длительных периодов времени13,14,15. Предыдущая работа нашей группы и других ученых начала использовать многоклеточную и мультипотентную способность MVF, особенно в том, что касается образования жировой ткани16,17,18. В качестве наращивания этой работы мы недавно продемонстрировали, что MVF, полученные из моделей грызунов здорового диабета и диабета 2 типа19 и от людей (взрослых старше 50 лет)20, содержат клетки, способные индуцироваться для образования термогенной или бежевой жировой ткани.
Здесь представлен инновационный подход, в котором используется MVF из одного источника, способный не только создавать бежевую жировую ткань, но и связанный с ней и критический сосудистый компонент21. Использование этого метода может иметь большое значение для исследований, ищущих простой тканеинженерный подход к образованию термогенной жировой ткани. В отличие от других методов, направленных на создание бежевой жировой ткани 22,23,24,25,26,27,28, процесс, описанный в этом исследовании, не требует использования нескольких типов клеток или сложных схем индукции. Васкуляризированные модели бежевого и белого жира могут быть созданы с помощью MVF, происходящих от грызунов и людей, демонстрируя большой потенциал перевода. Конечным продуктом этого протокола является сконструированная бежевая термогенная жировая ткань со структурой и метаболической функцией, сравнимыми с бурой жировой тканью. В целом, этот протокол представляет идею о том, что легкодоступный и, возможно, аутологичный источник MVF может быть полезным терапевтическим вмешательством и инструментом для изучения метаболических нарушений.
протокол
Это исследование было проведено в соответствии с Законом о благополучии животных и Положениями о благополучии животных в соответствии с принципами Руководства по уходу за лабораторными животными и их использованию. Все процедуры для животных были одобрены Институциональным комитетом по уходу за животными и их использованию при Техасском университете в Сан-Антонио.
ПРИМЕЧАНИЕ: Для шагов, описанных ниже, используются самцы крыс Льюиса. Небольшие корректировки протокола должны быть сделаны для коллекции микрососудистых фрагментов (MVF) женского пола, а также мыши29. Для протоколов, использующих человеческие MVF (h-MVF), единственными необходимыми шагами являются ресуспендирование h-MVF в соответствии с протоколом производителя, подготовка питательной среды (1.3), образование фибриновых гидрогелей (5) и культивирование (6). Обзор протокола приведен на рисунке 1.
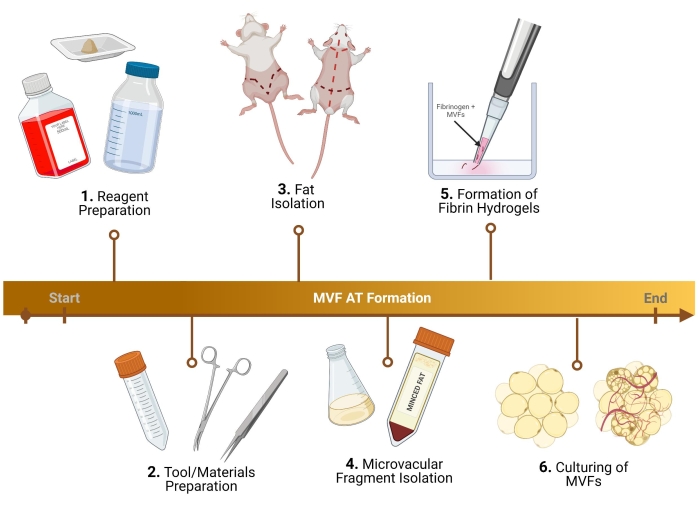
Рисунок 1: Схема эксперимента. Разбивка на шесть ключевых этапов перед анализом для формирования термогенной жировой ткани с использованием MVF. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Приготовление реагентов
ПРИМЕЧАНИЕ: Приведенные ниже реагенты соответствуют одной крысе, взвешенной и изготовленной внутри биокапюшона.
- Приготовьте бычий сывороточный альбумин (BSA) в PBS.
- Приготовьте 10 мг / мл (1,0%) BSA в PBS для разбавления для этапов промывки (1 мг / мл, 0,1%) и разложения (4 мг / мл, 0,4%).
- Приготовьте различные концентрации BSA, как указано в шаге 1.1.1, следуя этапам 1.1.3-1.1.5.
- 10 мг/мл BSA в PBS (1% BSA в PBS)
- Добавьте 500 мг BSA и 500 мл PBS в коническую пробирку объемом 50 мл и встряхните раствор для растворения BSA.
- Если образуются чрезмерные пузырьки, центрифугируйте раствор при 350 х г в течение 2 мин. Фильтр стерилизует раствор с помощью нейлонового сетчатого фильтра 0,22 мкм.
- 1 мг/мл BSA в PBS (0,1% BSA в PBS)
- Разбавьте 15 мл 10 мг / мл BSA в PBS 1: 10 с PBS, добавив 15 мл 10 мг / мл BSA в PBS к 135 мл PBS в стерильной бутылке объемом 500 мл и осторожно встряхните бутылку, чтобы обеспечить однородную смесь.
- 4 мг/мл BSA в PBS (0,4% BSA в PBS)
- Разбавьте 35 мл 10 мг / мл BSA в PBS 1: 2,5 с PBS, добавив 35 мл 10 мг / мл BSA в PBS + 57,5 мл PBS в стерильной бутылке объемом 100 мл и осторожно встряхните бутылку, чтобы обеспечить однородную смесь.
- Подготовьте коллагеназу в BSA для переваривания измельченных жировых комков.
- Приготовьте коллагеназу 6 мг/мл.
- В конической пробирке объемом 50 мл взвесьте 72 мг коллагеназы (метка «для Epi»).
- В трех конических пробирках по 50 мл взвесьте 144 мг коллагеназы (метка «для Ing 1», «для Ing 2» и «для SubQ») каждая.
- Храните взвешенную коллагеназу при температуре 4 °C до использования.
ПРИМЕЧАНИЕ: Не добавляйте BSA/PBS до самого начала пищеварения. - Добавьте 12 мл 4 мг / мл BSA в PBS в пробирку, содержащую 72 мг коллагеназы.
- Добавьте 24 мл 4 мг / мл BSA в PBS в пробирки, содержащие 144 мг коллагеназы.
- Встряхните пробирки, чтобы получить однородный раствор, и стерилизуйте раствор с помощью нейлонового сетчатого фильтра 0,22 мкм.
- Приготовьте коллагеназу 6 мг/мл.
- Подготовьте питательные среды с добавлением аминокапроновой кислоты (ACA) для подачи/дифференциации выделенного MVF.
- Питательные среды (ГМ): Дополните DMEM 20% FBS, 1% пенициллин-стрептомицин (пер-стрептококк), 0,2% микоплазменного профилактического средства и 1 мг / мл ACA.
- Подготовьте белые адипогенные среды (WAM).
- Индукция WAM: Дополняйте DMEM/F12 20% FBS, 1% стрептококка ручки, 0,2% профилактического средства от микоплазмы, инсулина 10 мкг/мл, форсколина 10 мкм, дексаметазона 1 мкм и 1 мг/мл ACA.
ПРИМЕЧАНИЕ: Для h-MVF, кроме того, добавьте 125 мкМ индометацина. - Поддержка WAM: Дополняйте DMEM/F12 20% FBS, 1% стерептококка, 0,2% микоплазменного профилактического средства, 5 мкг/мл инсулина и 1 мг/мл ACA.
ПРИМЕЧАНИЕ: Для h-MVF измените концентрацию инсулина до 10 мкг / мл.
- Индукция WAM: Дополняйте DMEM/F12 20% FBS, 1% стрептококка ручки, 0,2% профилактического средства от микоплазмы, инсулина 10 мкг/мл, форсколина 10 мкм, дексаметазона 1 мкм и 1 мг/мл ACA.
- Подготовьте бежевую адипогенную среду (БАМ).
- Индукция БАМа: Дополните DMEM/F12 20% FBS, 1% стрептококка ручки, 0,2% профилактического средства для микоплазмы, инсулина 10 мкг/мл, форсколина 10 мкм, 1 мкм дексаметазона, 1 мкм росиглитазона, 20 нМ 3,3′,5-трийодо-L-тиронина (Т3) и 1 мг/мл ACA.
ПРИМЕЧАНИЕ: Для h-MVF измените концентрацию T3 на 120 нМ. - Поддержание БАМа: Дополняйте DMEM/F12 20% FBS, 1% PEN-стрептококка, 0,2% профилактического средства от микоплазмы, 5 мкг/мл инсулина, 10 мкм форсколина, 1 мкм росиглитазона, 20 нМ T3 и 1 мг/мл ACA.
ПРИМЕЧАНИЕ: Для h-MVF измените концентрацию инсулина на 10 мкг / мл и концентрацию T3 на 120 нМ.
- Индукция БАМа: Дополните DMEM/F12 20% FBS, 1% стрептококка ручки, 0,2% профилактического средства для микоплазмы, инсулина 10 мкг/мл, форсколина 10 мкм, 1 мкм дексаметазона, 1 мкм росиглитазона, 20 нМ 3,3′,5-трийодо-L-тиронина (Т3) и 1 мг/мл ACA.
- Подготовьте тромбин (его нужно принимать только в том случае, если исходный аликвотированный раствор недоступен), чтобы сделать свертывающий агент, который будет использоваться в фибриновых гелях.
- 10 ЕД/мл тромбина в ddH2O:
- Ресуспендировать порошок тромбина, используя 1-5 мл ddH2O во флаконе от производителя, и перенести ресуспендирование в стакан объемом 250 мл.
- Доведите раствор до 100 мл и запипейте раствор пипеткой вверх и вниз несколько раз, чтобы обеспечить однородную смесь. Аликвотируйте раствор в конические пробирки объемом 15 мл (~ 10 мл / пробирка) и храните аликвоты в морозильной камере при температуре -20 ° C.
ПРИМЕЧАНИЕ: Перед использованием разморозьте тромбин при комнатной температуре (RT).
- 10 ЕД/мл тромбина в ddH2O:
2. Подготовка инструмента/материалов
ПРИМЕЧАНИЕ: Все контрольно-измерительные приборы должны быть автоклавированы/стерилизованы перед использованием.
- Выделение придатка яичка/пахового/подкожно-жировой клетчатки (операция проводится в определенной хирургической области)
- Обеспечьте наличие одноразовых пеленок, двух ножниц, одного гемостата (опционально), двух щипцов и четырех конических трубок объемом 50 мл с 10-15 мл 1 мг/мл BSA (0,1%) в PBS.
- Выделение микрососудистых фрагментов
- Для фарша (проводимого в биовытяжке) обеспечьте наличие трех стерильных чашек Петри диаметром 100 мм без покрытия, одной пары щипцов и одной пары изогнутых ножниц.
- Для пищеварения и изоляции (должно быть сделано в биовытяжке) обеспечьте наличие одной пары ножниц, одной пары щипцов, восьми стерильных чашек Петри без покрытия 100 мм, трех стерильных чашек Петри без покрытия 35 мм, взвешенных коллагеназы и при 4 °C, четырех колб по 250 мл, одного пластикового держателя с отверстием в центре, четырех экранов по 500 мкМ (разрезанных на 3 закругленных квадрата), четыре экрана по 37 мкМ (разрезанные на 3 закругленных квадрата) и 11 конических трубок по 50 мл.
- Ресуспендирование фибрина
- Для фибриновых гидрогелей (которые должны быть сделаны в биовытяжке) убедитесь, что доступны фибриноген, тромбин и питательные среды (полученные во время приготовления реагента).
3. Протокол выделения жира
- Предварительные шаги
- Наполните стакан этанолом, чтобы вымыть и продезинфицировать хирургические инструменты перед их использованием. Затем подготовьте стол для работы с крысой и подготовьте пылесос для аспирации меха, образующегося на этапе бритья.
- Подготовьте ведро со льдом, куда будут помещены предварительно подготовленные конические пробирки объемом 50 мл, каждая из которых содержит 10 мл 1 мг/мл BSA. Маркируйте тюбики соответствующим образом.
ПРИМЕЧАНИЕ: Может потребоваться две отдельные конические трубки для пахового жира, так как необходимо извлечь две стороны, и количество жира, собранного в этой области, как правило, самое большое по сравнению с придатком яичка и задней подкожной клетчаткой. - Начните с усыпленной крысы в определенной хирургической области с необходимыми хирургическими инструментами. Как правило, CO2 используется для эвтаназии крыс в соответствии с протоколами IACUC.
- Используя машинки для стрижки волос, побрейте крысу вокруг интересующей области. В частности, бритье между пахом и половиной живота для изоляции придатка яичка и пахового жира (используйте бритву меньшего размера для меха в этой области). Побрейте всю спину, чтобы получить задний подкожный жир, расположенный между лопатками (лучше всего использовать бритву большего размера, так как мех на задней стороне крысы толще).
- Асептически подготовьте крысу, опрыскав ее 70% этанолом. Как правило, рекомендуется очищать участок, который будет разрезаться, дважды.
- Изоляция различных жировых депо
- Паховая (подкожная)
- В положении лежа на спине поднимите кожу ниже полового члена ножницами. Начните разрез ножницами, начиная с центра и разрезая сбоку, образуя V-образную форму и петляя к задней части крысы, чтобы получить доступ ко всему жировому депо. Не забывайте резать поверхностно, чтобы жир внизу был целым. На этапе резки обеспечьте отделение кожи от жира, разрезав взаимосвязанную ткань фасции (рис. 2А).
- После того, как фасция будет соответствующим образом разрезана, убедитесь, что две стороны пахового жира видны (паховый жир простирается от паховой области к спине). Затем удалите жир с двух сторон в две отдельные конические пробирки, содержащие 10 мл 1 мг / мл BSA (рис. 2B).
- Придаток яичка (висцеральный)
- Соберите жир из придатка яичка, разрезав кожу живота и осторожно продев тонкий слой, окружающий яички (рис. 2C).
- Щипцами аккуратно вытащите жировую ткань и вырежьте ее с помощью ножниц. Избегайте рассечения каких-либо основных видимых кровеносных сосудов (если яичко и придаток яичка будут собраны, удалите их на этапе очистки биокапюшона).
- Осторожно поместите удаленный жир в коническую пробирку объемом 50 мл с 10 мл 1 мг / мл BSA в PBS.
ПРИМЕЧАНИЕ: Удаление жира в придатке яичка должно быть выполнено после удаления пахового жира. Жир придатка яичка, как правило, меньше по объему и расположен ниже пахового жира, ниже кожи живота, окружающей яичко и придаток яичка.
- Задняя подкожная
- Переверните крысу лежа спинной стороной вверх и, используя большие ножницы, разрежьте кожу спины (кожа в этой области толстая) до самой головы, стараясь не резать слишком глубоко, чуть ниже кожи (рис. 2D).
- Разрежьте фасцию, соединяющую кожу с тканями; Жир располагается в межлопаточной области. Сделайте заметку, чтобы дифференцировать / отделить подкожный жир от бурого жира. Бурый жир находится ближе к позвоночнику (рис. 2E).
- Изолируйте и поместите жир в соответствующую коническую пробирку (пробирки) объемом 50 мл с 10 мл 1 мг/мл BSA в PBS.
- Паховая (подкожная)
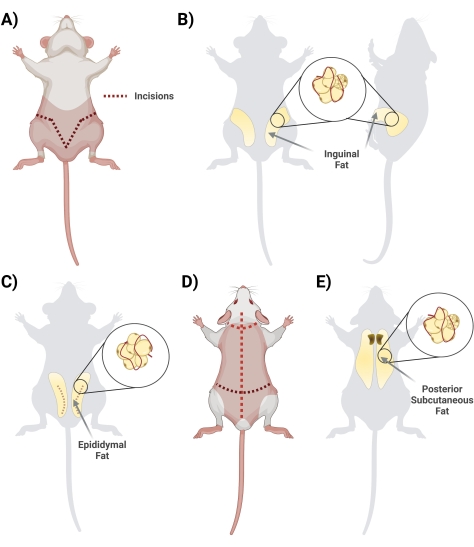
Рисунок 2: Выделение различных депо жировой ткани. (А) Начальные разрезы, необходимые для иссечения паховой жировой ткани. (B) Местонахождение пахового жирового депо. (C) Расположение жирового депо придатка яичка с указанием разреза наружной кожи, необходимого для доступа. (D) Дополнительные разрезы, необходимые после того, как мыши помещены в положение склонных к доступу к дополнительному жиру. (E) Расположение заднего подкожно-жирового депо. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Протокол выделения микрососудистых фрагментов
- Поместите коническую пробирку (пробирки) объемом 50 мл, содержащую удаленный жир от крысы, в биокапюшон.
- Используя щипцы, поместите жир в стандартную чашку Петри диаметром 100 мм (с ~ 0,5 мл 1 мг / мл BSA в PBS, чтобы сохранить ткань увлажненной).
- Очистите и удалите все видимые кровеносные сосуды и мышечные / посторонние ткани из жира.
- Измельчите жир ножницами в течение ~ 10 минут (пропустите через мясорубку достаточно, чтобы его можно было перенести пипеткой объемом 10 мл).
- Проверьте наличие комков, добавив ~ 0,5 мл 1 мг / мл BSA в PBS; При необходимости продолжайте фарш.
- Переложите измельченный жир в стерильную колбу объемом 250 мл с помощью пипетки объемом 10 мл.
ПРИМЕЧАНИЕ: Обратите внимание на громкость с помощью пипетки. - Добавьте достаточное количество BSA (1 мг / мл), чтобы конечный объем составил 20 мл.
- Добавьте 4 мг/мл BSA в PBS к коллагеназе (конечная концентрация коллагеназы: 6 мг/мл) (т. е. 12 мл для 72 мг коллагеназы или 24 мл для 144 мг коллагеназы).
ПРИМЕЧАНИЕ: Не добавляйте, пока фарш не будет завершен, так как он чувствителен ко времени. - Осторожно встряхните коническую трубку, чтобы обеспечить однородный раствор, и фильтруйте раствор с помощью нейлонового сетчатого фильтра 0,22 мкм.
- Жир придатка яичка переваривать ~8-10 мин; для пахового и заднего подкожного жира варить в течение ~15-20 мин на водяной бане при температуре 37 °C, встряхивая колбу круговыми движениями (остановитесь в тот момент, когда жир доберется до места, где осталось всего несколько комков).
- Переложите переваренный жир в коническую пробирку объемом 50 мл (должно быть ~ 30 мл / пробирка) и пометьте пробирку как «переваренный жир».
- Отжим тюбика при 400 х г в течение 4 мин; после отжима гранула должна быть красного цвета (рис. 3А).
- Во время отжима поместите стерильный экран 37 мкМ и 500 мкМ в стерильную чашку Петри с 5 мл 1 мг / мл BSA в PBS для предварительного замачивания перед использованием.
- После отжима сцедите надосадочную жидкость в коническую трубку объемом 50 мл с пометкой «отходы». Аккуратно выполните декантацию, чтобы удалить поверхностный жир и не нарушить гранулы, изготовленные из MVF.
- Добавьте 10 мл 1 мг/мл BSA в PBS в пробирку, содержащую гранулы («переваренный жир»). Тритурат (пипетка вверх и вниз) гранулы 2x.
- Избегайте слишком грубой обработки гранул, чтобы не повредить фрагменты.
- Поместите экран 500 мкМ в новую чашку Петри над пластиковым держателем экрана (рис. 3B).
- Пипетка 10 мл из пробирки «расщепленные гранулы» через сито 500 мкМ с использованием концентрических кругов (рис. 3C).
- Промойте фильтр дополнительными 5 мл 1 мг/мл BSA в PBS. Нужные клетки будут просачиваться в чашку Петри; поэтому откажитесь от экрана 500 мкМ, но сохраните отфильтрованную жидкость внутри чашки Петри.
- Поместите экран 37 мкМ в новую чашку Петри над пластиковым держателем экрана.
- Замените пипетку, чтобы удалить комки, прежде чем использовать сито 37 мкМ.
- Пипетируйте жидкость, полученную в результате первой фильтрации, через сито 37 мкМ с помощью концентрических окружностей.
- Промойте фильтр дополнительными 5 мл 1 мг/мл BSA в PBS. Нужные ячейки останутся в фильтре, поэтому отфильтруйте отфильтрованную жидкость, но сохраните экран 37 мкМ.
- Вставьте экран 37 мкМ в новую чашку Петри, содержащую 5 мл 1 мг/мл BSA в PBS.
- Встряхните блюдо, постучав им по коническому держателю, чтобы выбить осколки. Не встряхивайте слишком сильно, так как жидкость / клетки могут вылиться из чашки Петри.
- Промойте фильтр дополнительными 5 мл 1 мг/мл BSA в PBS. Нужные клетки останутся в жидком растворе в чашке Петри. Сохраните экран 37 мкМ и смещенный фрагмент, содержащий жидкость внутри чашки Петри, для следующих шагов.
- Переведите фрагмент BSA+, содержащий жидкость, в стерильную коническую пробирку объемом 50 мл.
- Повторите промывку экрана 37 мкМ еще несколько раз (каждый раз с ~ 5 мл 1 мг / мл BSA в PBS) и добавьте в коническую трубку. Повторяйте до тех пор, пока общий объем не составит ~ 15-20 мл. В конечном итоге нужные клетки будут собраны из жидкого раствора в чашке Петри и помещены в коническую трубку; на этом этапе выбросьте сито 37 мкМ после окончательного промывания, но сохраните смещенные фрагменты, содержащие жидкость внутри конической пробирки объемом 50 мл.
- Отрежьте конец наконечника пипетки объемом 200 мкл с помощью ножниц. Осторожно встряхните пробирку объемом 50 мл, извлеките два образца по 20 мкл и поместите их в чистую чашку Петри диаметром 35 мм.
- Подсчитайте количество фрагментов в каждом образце в чашке Петри, чтобы получить общее количество выделенных MVF.
Всего фрагментов =
- Оставшийся смещенный фрагмент, содержащий жидкость, отжимают в конической пробирке объемом 50 мл при 400 x g в течение 4 мин для сбора MVF.
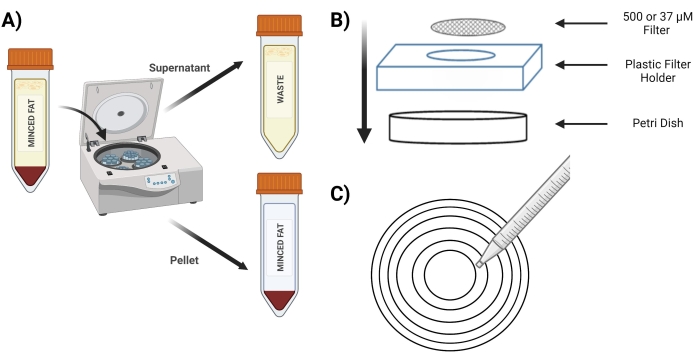
Рисунок 3: Выделение MVF. (A) После переваривания жировой ткани, изображение разделения MVF, содержащих гранулы и надосадочную жидкость, после отжима. В) Схема снабжения для фильтрации и улавливания МВФ. С) Иллюстрация метода концентрического круга для этапов фильтрации/промывки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Образование фибриновых гидрогелей
- Примеры расчетов:
ПРИМЕЧАНИЕ: Ниже приведены расчеты для MVF, высеваемых при ~ 15 000-20 000 MVF / мл, и соотношении фибриногена: тромбинового геля при 2: 5, при этом фибриноген используется в концентрации 20 мг / мл.- Для изготовления пяти гелей по 250 мкл требуется общий объем 1,250 мкл. Всегда учитывайте ошибки пипетирования, поэтому сделайте достаточно 1,5 мл гелей.
- Рассчитайте необходимый объем фибриногена следующим образом:
 , X1 = 428,57 мкл фибриногена
, X1 = 428,57 мкл фибриногена - Рассчитайте необходимый объем тромбина следующим образом:
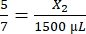 , X2 = 1 071,43 мкл тромбина
, X2 = 1 071,43 мкл тромбина - Для необходимого объема 428,57 мкл сделайте 500 мкл фибриногена следующим образом:
20 мг/мл * 0,5 мл = 10 мг фибриногена. Ресуспендировать это в 500 мкл DMEM - Для получения каждого геля рассчитайте объем фибриногена и тромбина следующим образом:
- Фибриноген:
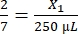 , X1 = 71,43 мкл фибриногена (в ДМЭМ) + MVF
, X1 = 71,43 мкл фибриногена (в ДМЭМ) + MVF - Тромбин:
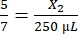 , X2 = 178,57 мкл тромбина
, X2 = 178,57 мкл тромбина
- Фибриноген:
- Рассчитайте необходимый объем фибриногена следующим образом:
- Для изготовления пяти гелей по 250 мкл требуется общий объем 1,250 мкл. Всегда учитывайте ошибки пипетирования, поэтому сделайте достаточно 1,5 мл гелей.
- Литье фибринового геля MVF
- Сцеживают большую часть жидкости в раскрученном фрагменте в коническую пробирку объемом 50 мл. Используйте пипетку, чтобы удалить небольшой объем жидкости, который зацепился за край конической трубки.
- Добавьте тромбин в лунки, где будут образовываться гели (рис. 4А).
- Обрежьте конец наконечника пипетки объемом 200 мкл и осторожно ресуспендируйте MVF с помощью фибриногена, чтобы получить окончательную плотность ~ 15 000-20 000 MVF / мл один раз в геле.
- Аккуратно закрепите конец наконечника пипетки объемом 200 мкл и пипетки MVF+фибриноген в раствор тромбина. Быстро пипетируйте вверх и вниз, чтобы получить однородную смесь. Повторяйте до тех пор, пока не будут сделаны все гели (рис. 4B).
- Поместите лунку (пластины) в инкубатор (37 °C, 5% CO2) на ~ 15 минут, чтобы обеспечить сшивание геля (рис. 4C).
- Добавьте 100-150 мкл питательной среды в каждую лунку.
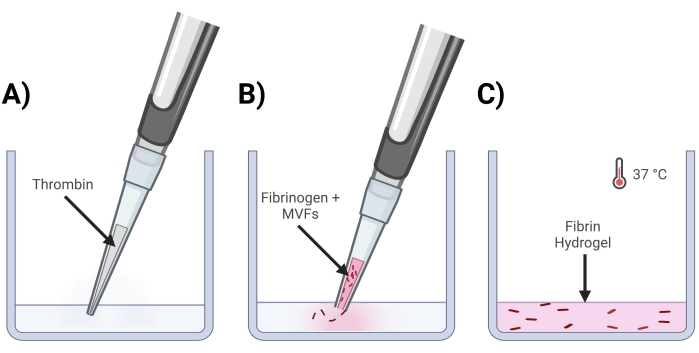
Рисунок 4: Формирование фибриновых гелей MVF . (A) Смесь тромбина, состоящая из 5/7 частей, вводится пипеткой в соответствующую лунку. (B) Затем с помощью обрезанного наконечника пипетки (чтобы не нарушать MVF) смесь фибриногена + MVF, состоящая из 2/7 частей, пипетка вводится в лунку и осторожно перемешивается. (C) Наконец, все готовые гели помещают в инкубатор при 37 °C, что позволяет гидрогелю полностью затвердеть до того, как среда будет помещена сверху. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
6. Условия культивирования МВФ
- Для культивирования неваскуляризированной белой и бежевой жировой ткани (+ GM Control) используйте временные шкалы19 , показанные на рисунке 5.
- Для культивирования васкуляризированной белой и бежевой жировой ткани (+ GM Control) используйте временные шкалы19 , показанные на рисунке 6.
- Гидрогели следует выдерживать в инкубаторе (37 °C, 5% CO2) в течение всего времени посева для исследования, при этом среду меняют через день. Сведения о фиксации и обработке образцов для анализа см. в ранее опубликованных работах16,19,20.

Рисунок 5: Сроки образования неваскуляризированной жировой ткани. Эта цифра была изменена по сравнению с Acosta et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
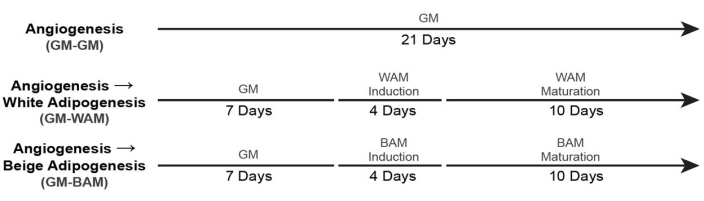
Рисунок 6: Сроки образования васкуляризированной жировой ткани. Эта цифра была изменена по сравнению с Acosta et al.19. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Существует несколько ключевых фенотипических морфологических характеристик бежевой/бурой жировой ткани: она многолопастная/содержит мелкие липидные капли, обладает большим количеством митохондрий (причина ее характерного «коричневатого» вида in vivo), соответственно имеет высок?...
Обсуждение
Область коричнево-бежевой жировой тканевой инженерии в значительной степени незрелая 22,23,24,25,26,27,28, при этом основная часть жировых моделей разрабатывается для белой жировой ткани 8,22,31
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Доктор Акоста поддерживается грантами Национального института здравоохранения CA148724 и TL1TR002647. Доктор Гонсалес Поррас поддерживается Национальным институтом диабета, болезней органов пищеварения и почек Национального института здравоохранения под номером F32-0DK122754. Эта работа была частично поддержана Национальными институтами здравоохранения (5SC1DK122578) и Техасским университетом в Сан-Антонио. Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения. Фигуры были частично созданы с помощью Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
Ссылки
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены