Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Culture tridimensionnelle de tissu adipeux thermogénique vascularisé à partir de fragments microvasculaires
Dans cet article
Résumé
Ici, nous présentons un protocole détaillé décrivant l’utilisation de fragments microvasculaires isolés à partir de rongeurs ou de tissus adipeux humains comme une approche simple pour concevoir un tissu adipeux beige vascularisé fonctionnel.
Résumé
L’ingénierie du tissu adipeux thermogénique (p. ex. tissus adipeux beiges ou bruns) a été étudiée comme traitement potentiel pour les maladies métaboliques ou pour la conception de microtissus personnalisés pour le dépistage médical et les tests de drogues. Les stratégies actuelles sont souvent assez complexes et ne parviennent pas à décrire avec précision les propriétés multicellulaires et fonctionnelles du tissu adipeux thermogénique. Les fragments microvasculaires, petits microvaisseaux intacts composés d’artériole, de veinules et de capillaires isolés du tissu adipeux, constituent une source autologue unique de cellules qui permettent la vascularisation et la formation de tissu adipeux. Cet article décrit les méthodes d’optimisation des conditions de culture pour permettre la génération de tissus adipeux thermogéniques tridimensionnels, vascularisés et fonctionnels à partir de fragments microvasculaires, y compris les protocoles d’isolement des fragments microvasculaires du tissu adipeux et des conditions de culture. De plus, les meilleures pratiques sont discutées, de même que les techniques de caractérisation des tissus modifiés, et les résultats d’échantillons provenant de fragments microvasculaires de rongeurs et humains sont fournis. Cette approche a le potentiel d’être utilisée pour la compréhension et le développement de traitements pour l’obésité et les maladies métaboliques.
Introduction
L’objectif de ce protocole est de décrire une approche pour développer du tissu adipeux beige vascularisé à partir d’une source unique, potentiellement autologue, le fragment microvasculaire (MVF). Il a été démontré que les tissus adipeux bruns et beiges présentent des propriétés bénéfiques liées à la régulation métabolique; Cependant, le faible volume de ces dépôts de tissu adipeux chez les adultes limite l’impact potentiel sur le métabolisme systémique, en particulier dans les maladies telles que l’obésité ou le diabète de type 2 1,2,3,4,5,6,7. La graisse brune/beige suscite un intérêt considérable en tant que cible thérapeutique pour prévenir les effets métaboliques nocifs liés à l’obésité et à ses comorbidités 8,9,10,11,12.
Les MVF sont des structures de vaisseaux qui peuvent être directement isolées du tissu adipeux, cultivées et maintenues dans une configuration tridimensionnelle pendant de longues périodesde temps 13,14,15. Des travaux antérieurs de notre groupe, et d’autres, ont commencé à exploiter la capacité multicellulaire et multipotente des MVF, en particulier en ce qui concerne la formation de tissu adipeux16,17,18. Dans le prolongement de ces travaux, nous avons récemment démontré que les MVF dérivés de modèles de rongeurs de diabète sain et de type 219 et de sujets humains (adultes de plus de 50 ans)20 contenaient des cellules capables d’être induites à former du tissu adipeux thermogénique ou beige.
Il s’agit d’une approche innovante à partir de laquelle une source unique de MVF est utilisée, non seulement capable de créer du tissu adipeux beige, mais aussi son composant vasculaire associéet critique 21. L’utilisation de cette technique pourrait être d’une grande valeur pour les études à la recherche d’une approche simple d’ingénierie tissulaire pour la formation de tissu adipeux thermogénique. Contrairement à d’autres méthodes aspirant à concevoir du tissu adipeux beige 22,23,24,25,26,27,28, le processus décrit dans cette étude ne nécessite pas l’utilisation de plusieurs types de cellules ou de régimes d’induction complexes. Des modèles de graisse beige et blanche vascularisés peuvent être créés avec des MVF provenant de rongeurs et de sources humaines, démontrant un grand potentiel de traduction. Le produit final de ce protocole est un tissu adipeux thermogénique beige modifié avec une structure et une fonction métabolique comparables au tissu adipeux brun. Dans l’ensemble, ce protocole présente l’idée qu’une source facilement accessible et éventuellement autologue MVF peut être une intervention thérapeutique utile et un outil pour étudier les troubles métaboliques.
Protocole
Cette étude a été menée conformément à la Loi sur le bien-être des animaux et au Règlement d’application sur le bien-être des animaux conformément aux principes du Guide sur le soin et l’utilisation des animaux de laboratoire. Toutes les procédures relatives aux animaux ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux de l’Université du Texas à San Antonio.
NOTE: Pour les étapes décrites ci-dessous, des rats Lewis mâles sont utilisés. De légers ajustements de protocole doivent être effectués pour une femelle, ainsi que pour la collecte de fragments microvasculaires de souris (MVF)29. Pour les protocoles utilisant des MVF humains (h-MVF), les seules étapes requises sont la remise en suspension des h-MVF suivant le protocole du fabricant, la préparation des milieux de croissance (1.3), la formation d’hydrogels de fibrine (5) et la culture (6). Pour un aperçu du protocole, veuillez consulter la figure 1.
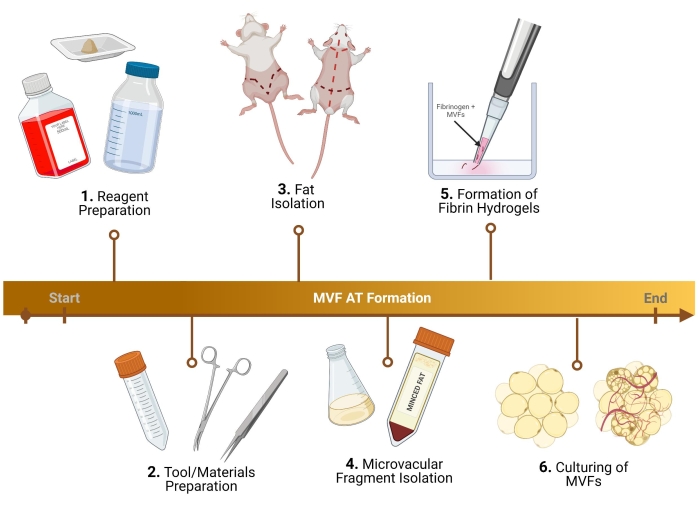
Figure 1 : Plan expérimental. Décomposition de six étapes clés, avant l’analyse, pour la formation de tissu adipeux thermogénique à l’aide de MVF. Veuillez cliquer ici pour voir une version agrandie de cette figure.
1. Préparation du réactif
NOTE: Les réactifs ci-dessous correspondent à un rat, pesé et fabriqué à l’intérieur d’un biohood.
- Préparer l’albumine sérique bovine (BSA) dans PBS.
- Préparer 10 mg/mL (1,0 %) de BSA dans du PBS à diluer pour les étapes de lavage (1 mg/mL, 0,1 %) et la digestion (4 mg/mL, 0,4 %).
- Préparer différentes concentrations de BSA, comme mentionné à l’étape 1.1.1, après les étapes 1.1.3-1.1.5.
- 10 mg/mL de BSA dans le PBS (1 % de BSA dans le PBS)
- Ajouter 500 mg de BSA et 500 mL de PBS dans un tube conique de 50 mL et vortex la solution pour dissoudre le BSA.
- Si des bulles excessives se forment, centrifuger la solution à 350 x g pendant 2 min. Filtrer stériliser la solution avec un filtre en filet en nylon de 0,22 μm.
- 1 mg/mL de BSA dans le PBS (0,1 % de BSA dans le PBS)
- Diluer 15 mL de BSA à 10 mg/mL dans du PBS 1:10 avec du PBS en ajoutant 15 mL de BSA à 10 mg/mL de PBS à 135 mL de PBS dans un flacon stérile de 500 mL et agiter doucement le flacon pour obtenir un mélange homogène.
- 4 mg/mL de BSA dans le PBS (0,4 % de BSA dans le PBS)
- Diluer 35 mL de BSA à 10 mg/mL dans du PBS 1:2,5 avec du PBS en ajoutant 35 mL de BSA à 10 mg/mL dans du PBS + 57,5 mL de PBS dans un flacon stérile de 100 mL et agiter doucement le flacon pour obtenir un mélange homogène.
- Préparer la collagénase dans BSA pour la digestion des coussinets adipeux hachés.
- Préparer 6 mg/mL de collagénase.
- Dans un tube conique de 50 mL, peser 72 mg de collagénase (étiquette « pour Epi »).
- Dans trois tubes coniques de 50 mL, peser 144 mg de collagénase (étiquette « for Ing 1 », « for Ing 2 » et « for SubQ ») chacun.
- Conserver la collagénase pesée à 4 °C jusqu’à utilisation.
REMARQUE: N’ajoutez pas BSA / PBS jusqu’à juste avant la digestion. - Ajouter 12 mL de 4 mg/mL de BSA dans du PBS au tube contenant 72 mg de collagénase.
- Ajouter 24 mL de 4 mg/mL de BSA dans du PBS aux tubes contenant 144 mg de collagénase.
- Agiter les tubes pour assurer une solution homogène et filtrer stériliser la solution avec un filtre en filet en nylon de 0,22 μm.
- Préparer 6 mg/mL de collagénase.
- Préparer des milieux de croissance supplémentés en acide aminocaproïque (ACA) pour nourrir/différencier le MVF isolé.
- Milieux de croissance (GM): Complétez DMEM avec 20% FBS, 1% pénicilline-streptomycine (streptocoque de stylo), 0,2% mycoplasme prophylactique et 1 mg / mL ACA.
- Préparer les milieux adipogènes blancs (WAM).
- Induction WAM : Compléter DMEM/F12 avec 20 % de FBS, 1 % de streptocoque de stylo, 0,2 % de mycoplasmes prophylactiques, 10 μg/mL d’insuline, 10 μm de forskoline, 1 μm de dexaméthasone et 1 mg/mL d’ACA.
NOTE: Pour les h-MVF, en outre, ajouter 125 μM d’indométacine. - Entretien WAM : Complétez DMEM/F12 avec 20 % de FBS, 1 % de penptocoque, 0,2 % de mycoplasmes prophylactiques, 5 μg/mL d’insuline et 1 mg/mL d’ACA.
REMARQUE : Pour les h-MVF, modifier la concentration d’insuline à 10 μg/mL.
- Induction WAM : Compléter DMEM/F12 avec 20 % de FBS, 1 % de streptocoque de stylo, 0,2 % de mycoplasmes prophylactiques, 10 μg/mL d’insuline, 10 μm de forskoline, 1 μm de dexaméthasone et 1 mg/mL d’ACA.
- Préparer des milieux adipogènes beiges (MAB).
- Induction BAM: Supplément DMEM / F12 avec 20% FBS, 1% de streptocoque de stylo, 0,2% de mycoplasme prophylactique, 10 μg / mL d’insuline, 10 μm de forskoline, 1 μm de dexaméthasone, 1 μm de rosiglitazone, 20 nM 3,3′,5-Triiodo-L-thyronine (T3) et 1 mg / mL d’ACA.
NOTE: Pour les h-MVF, changer la concentration de T3 à 120 nM. - Entretien BAM: Compléter DMEM / F12 avec 20% FBS, 1% de penptocoque, 0,2% de mycoplasme prophylactique, 5 μg / ml d’insuline, 10 μm de forskoline, 1 μm de rosiglitazone, 20 nM T3 et 1 mg / mL d’ACA.
REMARQUE : Pour les HFM-h, modifier la concentration d’insuline à 10 μg/mL et la concentration de T3 à 120 nM.
- Induction BAM: Supplément DMEM / F12 avec 20% FBS, 1% de streptocoque de stylo, 0,2% de mycoplasme prophylactique, 10 μg / mL d’insuline, 10 μm de forskoline, 1 μm de dexaméthasone, 1 μm de rosiglitazone, 20 nM 3,3′,5-Triiodo-L-thyronine (T3) et 1 mg / mL d’ACA.
- Préparer la thrombine (ne doit être faite que si la solution d’aliquote mère n’est pas disponible) pour fabriquer l’agent de coagulation à utiliser dans les gels de fibrine.
- 10 U/mL de thrombine dans ddH2O:
- Resuspendre la poudre de thrombine en utilisant 1 à 5 mL de ddH2O dans le flacon du fabricant et transférer la remise en suspension dans un bécher de 250 mL.
- Porter la solution à 100 ml et la pipeter de haut en bas plusieurs fois pour assurer un mélange homogène. Aliquote la solution dans des tubes coniques de 15 mL (~10 mL/tube) et conserver les aliquotes dans un congélateur à -20 °C.
REMARQUE: Pour utiliser, décongelez la thrombine à température ambiante (RT).
- 10 U/mL de thrombine dans ddH2O:
2. Préparation des outils et des matériaux
REMARQUE : Tous les instruments doivent être autoclavés/stérilisés avant utilisation.
- Isolement épididymique / inguinal / sous-cutané (chirurgie à effectuer dans une zone chirurgicale définie)
- Assurer la disponibilité de coussinets jetables, de deux ciseaux, d’un hémostatique (facultatif), de deux pinces et de quatre tubes coniques de 50 ml contenant 10 à 15 ml de BSA (0,1 %) dans du PBS.
- Isolement de fragments microvasculaires
- Pour le hachage (à faire dans une biocagoule), assurez-vous de la disponibilité de trois boîtes de Petri stériles de 100 mm non enduites, d’une paire de pinces et d’une paire de ciseaux incurvés.
- Pour la digestion et l’isolement (à faire dans un biohood), s’assurer de la disponibilité d’une paire de ciseaux, d’une paire de pinces, de huit boîtes de Petri stériles non revêtues de 100 mm, de trois boîtes de Petri stériles non revêtues de 35 mm, de collagénase pesées et à 4 °C, quatre fioles de 250 mL, un support en plastique avec un trou au centre, quatre écrans de 500 μM (coupés en carrés arrondis de 3), quatre cribles de 37 μM (découpés en carrés arrondis) et 11 tubes coniques de 50 mL.
- Resuspension de fibrine
- Pour les hydrogels de fibrine (à faire dans un biohood), assurez-vous que le fibrinogène, la thrombine et les milieux de croissance (fabriqués pendant la préparation du réactif) sont disponibles.
3. Protocole d’isolement des graisses
- Étapes préliminaires
- Remplissez un bécher avec de l’éthanol pour laver et désinfecter les instruments chirurgicaux avant de les utiliser. Ensuite, préparez la table pour manipuler le rat et ayez un aspirateur prêt à aspirer la fourrure générée lors de l’étape de rasage.
- Préparez un seau avec de la glace à l’endroit où seront placés les tubes coniques de 50 mL préparés précédemment, contenant chacun 10 mL de 1 mg/mL de BSA. Étiquetez les tubes en conséquence.
REMARQUE: Il peut être nécessaire d’avoir deux tubes coniques distincts pour la graisse inguinale, car deux côtés doivent être extraits et la quantité de graisse recueillie dans cette région a tendance à être la plus grande par rapport à l’épididymaire et au sous-cutané postérieur. - Commencez avec un rat euthanasié dans la zone chirurgicale définie avec les outils chirurgicaux requis. Généralement, le CO2 est utilisé pour euthanasier les rats selon les protocoles de l’IACUC.
- À l’aide de tondeuses à cheveux, rasez le rat autour de la zone d’intérêt. Plus précisément, rasez-vous entre les aines et la moitié de l’abdomen pour l’isolement de la graisse épididymaire et inguinale. Rasez tout le dos pour obtenir la graisse sous-cutanée postérieure située entre les omoplates (il est préférable d’utiliser un rasoir plus grand car la fourrure est plus épaisse sur le dos du rat).
- Préparez le rat de manière aseptique en le pulvérisant avec de l’éthanol à 70%. Généralement, il est recommandé de nettoyer la zone qui va être coupée deux fois.
- Isolement de différents dépôts de graisse
- Inguinal (sous-cutané)
- En décubitus dorsal, soulevez la peau sous le pénis avec une paire de ciseaux. Commencez l’incision avec des ciseaux, en commençant par le centre et en coupant latéralement, en formant une forme de « V » et en bouclant sur le dos du rat pour accéder à tout le dépôt de graisse. N’oubliez pas de couper superficiellement afin que la graisse ci-dessous soit intacte. Lors de l’étape de coupe, assurez-vous de séparer la peau de la graisse en coupant le tissu fascia interconnecté (Figure 2A).
- Une fois que le fascia est coupé de manière appropriée, assurez-vous que les deux côtés de la graisse inguinale sont visibles (la graisse inguinale s’étend de la région de l’aine vers l’arrière). Ensuite, retirez la graisse des deux côtés dans deux tubes coniques distincts contenant 10 mL de BSA à 1 mg/mL (figure 2B).
- Épididymaire (viscéral)
- Récolter la graisse épididymaire en coupant à travers la peau abdominale et soigneusement à travers la fine couche entourant les testicules (Figure 2C).
- Avec une pince, retirez doucement le tissu adipeux et découpez-le à l’aide de ciseaux. Évitez de disséquer les principaux vaisseaux sanguins visibles (si le testicule et l’épididyme sont récoltés, retirez-les pendant l’étape de nettoyage dans le biohood).
- Placez soigneusement la graisse enlevée dans un tube conique de 50 mL contenant 10 mL de BSA à 1 mg/mL dans du PBS.
REMARQUE: L’élimination de la graisse épididymaire doit être effectuée après l’élimination de la graisse inguinale. La graisse épididymaire est généralement plus petite en volume et située sous la graisse inguinale, sous la peau abdominale entourant le testicule et l’épididyme.
- Sous-cutanée postérieure
- Tournez le rat couché (côté dorsal vers le haut) et, à l’aide de gros ciseaux, coupez la peau du dos (la peau de cette région est épaisse) jusqu’au cuir chevelu, en prenant soin de ne pas couper trop profondément, juste en dessous de la peau (Figure 2D).
- Couper le fascia reliant la peau au tissu; La graisse est située dans la région interscapulaire. Prenez note de différencier / séparer la graisse sous-cutanée de la graisse brune. La graisse brune est plus proche de la colonne vertébrale (figure 2E).
- Isoler et placer la graisse dans le(s) tube(s) conique(s) correspondant(s) de 50 mL avec 10 mL de BSA à 1 mg/mL dans du PBS.
- Inguinal (sous-cutané)
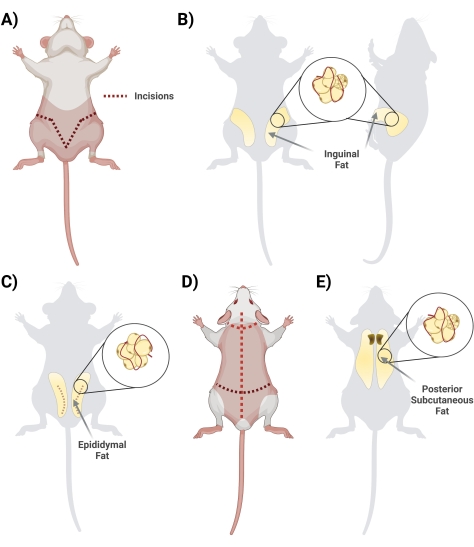
Figure 2 : Isolement de différents dépôts de tissu adipeux. (A) Incisions initiales nécessaires à l’excision du tissu adipeux inguinal. (B) Emplacement du dépôt de graisse inguinale. (C) Emplacement du dépôt de graisse épididymaire, en notant l’incision de la peau externe nécessaire pour l’accès. (D) Des incisions supplémentaires sont nécessaires une fois que les souris sont placées susceptibles d’accéder à de la graisse supplémentaire. E) Emplacement du dépôt de graisse sous-cutanée postérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Protocole d’isolement des fragments microvasculaires
- Placer 50 ml de tube conique contenant de la graisse excisée du rat dans le biohood.
- À l’aide d’une pince, placer la graisse dans une boîte de Petri standard de 100 mm (avec ~0,5 mL de BSA à 1 mg/mL dans du PBS pour garder le tissu hydraté).
- Nettoyez et retirez tous les vaisseaux sanguins visibles et les tissus musculaires ou étrangers de la graisse.
- Hacher la graisse avec des ciseaux pendant ~10 min (hacher suffisamment pour qu’elle puisse être transférée avec une pipette de 10 mL).
- Vérifiez la présence de grumeaux en ajoutant ~0,5 mL de BSA à 1 mg/mL dans le PBS; Continuez à hacher si nécessaire.
- Transférer la graisse hachée dans une fiole stérile de 250 ml à l’aide d’une pipette de 10 ml.
Remarque : Notez le volume à l’aide d’une pipette. - Ajouter suffisamment de BSA (1 mg/mL) pour que le volume final soit de 20 mL.
- Ajouter 4 mg/mL de BSA dans le PBS à la collagénase (concentration finale de collagénase : 6 mg/mL) (c.-à-d. 12 mL pour les 72 mg de collagénase ou 24 mL pour les 144 mg de collagénase).
REMARQUE: N’ajoutez pas tant que le hachage n’est pas terminé car il est sensible au temps. - Secouez doucement le tube conique pour assurer une solution homogène et filtrez stérilisez la solution avec un filtre en filet en nylon de 0,22 μm.
- Pour la graisse épididymaire, digérer pendant ~8-10 min; pour la graisse sous-cutanée inguinale et postérieure, digérer pendant ~15-20 min dans un bain-marie à 37 °C, en secouant le ballon dans un mouvement circulaire (arrêtez-vous au moment où la graisse arrive là où il ne reste que quelques touffes).
- Transférer la graisse digérée dans un tube conique de 50 ml (il devrait y avoir ~30 ml / tube) et étiqueter le tube comme « graisse digérée ».
- Faire tourner le tube à 400 x g pendant 4 min; après filature, la pastille doit être rouge (figure 3A).
- Pendant l’essorage, placer le crible stérile de 37 μM et les cribles de 500 μM dans une boîte de Petri stérile contenant 5 mL de BSA à 1 mg/mL dans du PBS pour les prétremper avant utilisation.
- Après l’essorage, décanter le surnageant dans un tube conique de 50 ml étiqueté comme « déchet ». Effectuer la décantation doucement pour enlever la graisse superficielle et ne pas déranger la pastille faite de MVF.
- Ajouter 10 mL de BSA à 1 mg/mL dans du PBS au tube contenant la pastille (« gras digéré »). Triturer (pipeter de haut en bas) la pastille 2x.
- Évitez d’être trop rugueux sur le granulé afin de ne pas perturber les fragments.
- Placez l’écran de 500 μM dans une nouvelle boîte de Pétri au-dessus du support d’écran en plastique (Figure 3B).
- Pipette à 10 mL du tube « granulés digérés » sur un tamis de 500 μM à l’aide de cercles concentriques (figure 3C).
- Lavez le filtre avec 5 mL supplémentaires de BSA à 1 mg/mL de PBS. Les cellules désirées filtreront dans la boîte de Pétri; par conséquent, jetez l’écran de 500 μM, mais conservez le liquide filtré à l’intérieur de la boîte de Pétri.
- Placez l’écran de 37 μM dans une nouvelle boîte de Petri au-dessus du support d’écran en plastique.
- Changez la pipette pour éliminer les touffes avant d’utiliser l’écran de 37 μM.
- Pipeter le liquide obtenu à partir de la première filtration sur le crible de 37 μM à l’aide de cercles concentriques.
- Lavez le filtre avec 5 mL supplémentaires de BSA à 1 mg/mL de PBS. Les cellules souhaitées resteront dans le filtre, donc jetteront le liquide filtré, mais économiseront l’écran de 37 μM.
- Glissez l’écran de 37 μM dans une nouvelle boîte de Petri contenant 5 mL de 1 mg/mL de BSA dans du PBS.
- Secouez le plat en le tapotant contre un support conique pour déloger les fragments. Ne pas agiter trop vigoureusement, car le liquide / les cellules peuvent se répandre hors de la boîte de Pétri.
- Rincer le filtre avec 5 mL supplémentaires de BSA à 1 mg/mL dans du PBS. Les cellules souhaitées resteront en solution liquide dans la boîte de Pétri. Conservez l’écran de 37 μM et le fragment délogé contenant du liquide à l’intérieur de la boîte de Petri pour les étapes suivantes.
- Transférer le fragment BSA + contenant du liquide dans un tube conique stérile de 50 mL.
- Répéter le rinçage du crible 37 μM plusieurs fois (chaque fois avec ~5 mL de BSA à 1 mg/mL dans du PBS) et ajouter au tube conique. Répéter jusqu’à ce que le volume total recueilli soit ~15-20 mL. En fin de compte, les cellules souhaitées seront collectées à partir de la solution liquide dans la boîte de Petri et placées dans un tube conique; à ce stade, jetez le crible de 37 μM après le rinçage final, mais conservez les fragments délogés contenant du liquide à l’intérieur du tube conique de 50 mL.
- Coupez l’extrémité d’un embout de pipette de 200 μL à l’aide de ciseaux. Secouez doucement le tube de 50 mL, retirez deux échantillons de 20 μL et mettez-les dans une boîte de Petri propre de 35 mm.
- Compter le nombre de fragments dans chaque échantillon de la boîte de Petri pour obtenir le nombre total de MVF isolés.
Nombre total de fragments =
- Faire tourner le fragment délogé restant contenant du liquide dans un tube conique de 50 mL à 400 x g pendant 4 minutes pour recueillir le MVF.
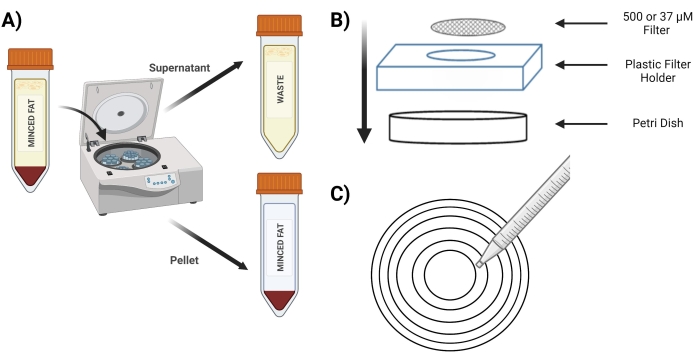
Figure 3 : Isolement des MVF. (A) Après digestion du tissu adipeux, représentation de la séparation des MVF contenant des pastilles et du surnageant à la suite d’une essorage. (B) Schéma des fournitures pour la filtration et le piégeage des MVF. (C) Illustration de la méthode du cercle concentrique pour les étapes de filtration/lavage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Formation d’hydrogels de fibrine
- Exemples de calculs :
REMARQUE : Vous trouverez ci-dessous les calculs pour les FVE ensemencées à ~15 000-20 000 MVF/mL et le rapport fibrinogène/gel de thrombine à 2:5, avec un fibrinogène utilisé à une concentration de 20 mg/mL.- Pour fabriquer cinq gels de 250 μL, un volume total de 1 250 μL est nécessaire. Tenez toujours compte des erreurs de pipetage, par conséquent, faites assez pour 1,5 mL de gels.
- Calculer le volume de fibrinogène requis comme suit:
 , X1 = 428,57 μL de fibrinogène
, X1 = 428,57 μL de fibrinogène - Calculez le volume de thrombine requis comme suit :
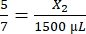 , X2 = 1 071,43 μL de thrombine
, X2 = 1 071,43 μL de thrombine - Pour le volume requis de 428,57 μL, faire 500 μL de fibrinogène comme suit :
20 mg/mL * 0,5 mL = 10 mg de fibrinogène. Remettez en suspension dans 500 μL de DMEM - Pour obtenir chaque gel, calculez le volume de fibrinogène et de thrombine comme suit:
- Fibrinogène:
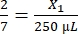 , X1 = 71,43 μL de fibrinogène (dans DMEM) + MVF
, X1 = 71,43 μL de fibrinogène (dans DMEM) + MVF - Thrombine:
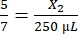 , X2 = 178,57 μL de thrombine
, X2 = 178,57 μL de thrombine
- Fibrinogène:
- Calculer le volume de fibrinogène requis comme suit:
- Pour fabriquer cinq gels de 250 μL, un volume total de 1 250 μL est nécessaire. Tenez toujours compte des erreurs de pipetage, par conséquent, faites assez pour 1,5 mL de gels.
- Fonte de gel de fibrine MVF
- Décanter la majeure partie du liquide dans le fragment filé dans le tube conique de 50 mL. Utilisez une pipette pour enlever le petit volume de liquide qui s’accroche sur le bord du tube conique.
- Ajouter la thrombine dans les puits où les gels seront fabriqués (figure 4A).
- Coupez l’extrémité d’un embout de pipette de 200 μL et remettez doucement en suspension les MVF en utilisant du fibrinogène pour obtenir une densité finale de ~15 000-20 000 MVF / mL une fois dans le gel.
- Fixez doucement l’extrémité d’un embout de pipette de 200 μL et le pipet MVF+Fibrinogène dans la solution de thrombine. Monter et descendre rapidement pour assurer un mélange homogène. Répéter l’opération jusqu’à ce que tous les gels soient fabriqués (figure 4B).
- Placer la ou les plaques de puits dans un incubateur (37 °C, 5 % de CO2) pendant ~15 min pour permettre la réticulation du gel (figure 4C).
- Ajouter 100-150 μL de milieu de culture à chaque puits.
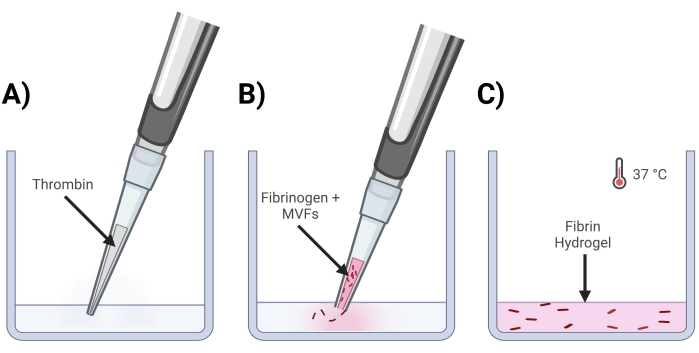
Figure 4 : Formation de gels de fibrine MVF. (A) Un mélange de thrombine de 5/7 parties est pipeté dans le puits correspondant. (B) Ensuite, avec une pointe de pipette coupée (pour ne pas déranger les MVF), un mélange fibrinogène + MVF en 2/7 parties est pipeté dans le puits et mélangé doucement. (C) Enfin, tous les gels terminés sont placés dans un incubateur à 37 °C, ce qui permet à l’hydrogel de se solidifier complètement avant que le milieu ne soit placé sur le dessus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Conditions de culture des MVF
- Pour la culture de tissu adipeux blanc et beige non vascularisé (+ GM Control), utilisez les chronologies19 illustrées à la figure 5.
- Pour la culture de tissu adipeux blanc et beige vascularisé (+ GM Control), utilisez les chronologies19 illustrées à la figure 6.
- Les hydrogels doivent être conservés dans un incubateur (37 °C, 5 % de CO2) pendant toute la durée de la culture pour l’étude, les milieux étant changés tous les deux jours. Pour la fixation et la manipulation des échantillons à analyser, se référer aux travaux publiés précédemment16,19,20.

Figure 5 : Moment de la formation du tissu adipeux non vascularisé. Ce chiffre a été modifié à partir d’Acosta et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.
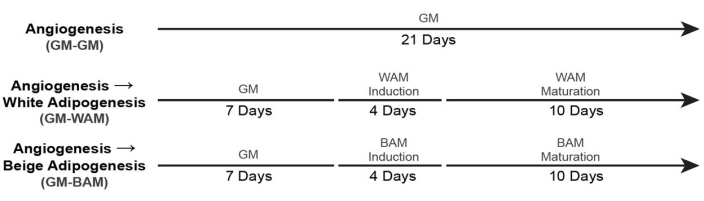
Figure 6 : Moment de la formation du tissu adipeux vascularisé. Ce chiffre a été modifié à partir d’Acosta et al.19. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Il existe quelques caractéristiques morphologiques phénotypiques clés du tissu adipeux beige / brun: il est multioculaire / contient de petites gouttelettes lipidiques, possède un grand nombre de mitochondries (la raison de son apparence caractéristique « brunâtre » in vivo), a donc un taux élevé de consommation d’oxygène / bioénergétique mitochondriale, est fortement vascularisé, a augmenté l’absorption de glucose stimulée par la lipolyse / l’insuline et, plus notoirement, exprime des n...
Discussion
Le domaine de l’ingénierie du tissu adipeux brun/beige est largement immature 22,23,24,25,26,27,28, la majeure partie des modèles adipeux étant développés pour le tissu adipeux blanc 8,22,31....
Déclarations de divulgation
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Le Dr Acosta est soutenu par les subventions CA148724 et TL1TR002647 des National Institutes of Health. Le Dr Gonzalez Porras est soutenu par l’Institut national du diabète et des maladies digestives et rénales des National Institutes of Health, sous le numéro d’attribution F32-0DK122754. Ce travail a été soutenu, en partie, par les National Institutes of Health (5SC1DK122578) et le département de génie biomédical de l’Université du Texas à San Antonio. Le contenu relève de la seule responsabilité des auteurs et ne représente pas nécessairement les opinions officielles des National Institutes of Health. Les figures ont été partiellement créées avec Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| Aminocaproic Acid | Sigma Aldrich | A2504-100G | Added in DMEM at the concentration of 1 mg/mL |
| Blunt-Tipped Scissors | Fisher scientific | 12-000-172 | Sterilize in autoclave |
| Bovin Serum Albumin (BSA) | Millipore | 126575-10GM | Diluted in PBS to 4 mg/mL and 1 mg/mL |
| Collagenase Type 1 | Fisher scientific | NC9633623 | Diluted to 6 mg/mL in BSA 4 mg/mL, Digestion of minced fat |
| Dexamethasone | Thermo Scientific | AC230302500 | Diluted in ethanol at a 2 mg/ml stock concentration |
| Disposable underpads | Fisher scientific | 23-666-062 | For fluid absorption during surgery |
| Dissecting Scissors | Fisher scientific | 08-951-5 | Sterilize in autoclave |
| Dulbecco′s Modified Eagle′s Medium (DMEM) | Fisher scientific | 11885092 | |
| Dulbecco′s Modified Eagle′s Medium/Nutrient Mixture F-12 Ham (DMEM/F12) | Sigma Aldrich | D8062 | |
| Fetal Bovine Serum | Fisher scientific | 16140089 | Added in DMEM to 20% v/v. |
| Fibrinogen | Sigma Aldrich | F8630-25G | Solubilized in DMEM at the concentration of 20 mg/mL, Protein found in blood plasma and main component of hydrogel |
| Flask, 250 mL | Fisher scientific | FB500250 | Allows for digestion of fat using a large surface area |
| Forceps | Fisher scientific | 50-264-21 | Sterilize in autoclave, For handling of tissue and filters |
| Forskolin | Sigma Aldrich | F6886 | Diluted in ethanol at a 10 mM stock concentration |
| Human MVF | Advanced Solutions Life Scienes, LLC | https://www.advancedsolutions.com/microvessels | Human MVFs (hMVFs) isolated from three different patients (52-, 54-, and 56-year old females) were used in the current study. |
| Indomethacine | Sigma Aldrich | I7378 | Diluted in ethanol at a 12.5 mM stock concentration |
| Insulin from porcine pancreas | Sigma Aldrich | I5523 | Diluted in 0.01 N HCl at a 5 mg/ml stock concentration |
| MycoZap | Fisher scientific | NC9023832 | Added in DMEM to 0.2% w/v, Mycoplasma Prophylactic |
| Pennycilin/Streptomycin (10,000 U/mL) | Fisher scientific | 15140122 | Added in DMEM to 1% v/v. |
| Petri dishes, polystyrene (100 mm x 15 mm). | Fisher scientific | 351029 | 3 for removal of blood vessels and mincing, 8 (lid) for presoaking of screens & 8 (dish) for use when filtering with 500 or 37 µM screens |
| Petri dishes, polystyrene (35 mm x 10 mm). | Fisher scientific | 50-202-036 | For counting fragments |
| Phosphate Buffer Saline (PBS) | Fisher scientific | 14-190-250 | Diluted to 1x with sterile deionized water. |
| Rat Clippers (Andwin Mini Arco Pet Trimmer) | Fisher scientific | NC0854141 | |
| Rosiglitazone | Fisher scientific | R0106200MG | Diluted in DMSO at a 10 mM stock concentration |
| Scissors | Fine Science Tools | 14059-11 | 1 for initial incision, 1 for epididymal incision, 1 for tip clipping |
| Screen 37 µM | Carolina Biological Supply Company | 652222R | Cut into 3" rounded squares and sterilized in ethylene oxide, Fragment entrapment and removal of very small fragments/single cells and debris |
| Screen 500 µM | Carolina Biological Supply Company | 652222F | Cut into 3" rounded squares and sterilized in ethylene oxide, Removes larger fragments/debris |
| Serrated Hemostat | Fisher scientific | 12-000-171 | Sterilize in autoclave, For clamping of skin before incision |
| Steriflip Filter 0.22 μm | Millipore | SE1M179M6 | |
| Thrombin | Fisher scientific | 6051601KU | Diluted in deionzed water to 10 U/mL, Used as a clotting agent turning fibrinogen to fibrin |
| Thyroid hormone (T3) | Sigma Aldrich | T2877 | Diluted in 1N NaOH at a 0.02 mM stock concentration |
| Zucker diabetic fatty (ZDF) rats - obese (FA/FA) or lean (FA/+) male | Charles River | https://www.criver.com/products-services/find-model/zdf-rat-lean-fa?region=3611 https://www.criver.com/products-services/find-model/zdf-rat-obese?region=3611 | Obtained from Charles River (Wilmington, MA). Rats were acquired at 4 weeks of age and fed Purina 5008 until euthanasia (15-19 weeks of age). Glucose levels (blood from the lateral saphenous vein) were greater than 300 mg/dL in all FA/FA rats used in the study. All animals were housed in a temperature-controlled environment with a 12-h light-dark cycle and fed ad libitum. |
Références
- Cohen, P., Spiegelman, B. M. Brown and beige fat: molecular parts of a thermogenic machine. Diabetes. 64 (7), 2346-2351 (2015).
- Liu, X., et al. Brown adipose tissue transplantation reverses obesity in Ob/Ob mice. Endocrinology. 156 (7), 2461-2469 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Barquissau, V., et al. White-to-brite conversion in human adipocytes promotes metabolic reprogramming towards fatty acid anabolic and catabolic pathways. Molecular Metabolism. 5 (5), 352-365 (2016).
- Kim, S. H., Plutzky, J. Brown fat and browning for the treatment of obesity and related metabolic disorders. Diabetes & Metabolism Journal. 40 (1), 12-21 (2016).
- Lizcano, F., Vargas, D. Biology of beige adipocyte and possible therapy for type 2 diabetes and obesity. International Journal of Endocrinology. 2016, 9542061 (2016).
- Mulya, A., Kirwan, J. P. Brown and beige adipose tissue: therapy for obesity and its comorbidities. Endocrinology and Metabolism Clinics of North America. 45 (3), 605-621 (2016).
- Murphy, C. S., Liaw, L., Reagan, M. R. In vitro tissue-engineered adipose constructs for modeling disease. BMC Biomedical Engineering. 1, 27 (2019).
- Srivastava, S., Veech, R. L. Brown and brite: The fat soldiers in the anti-obesity fight. Frontiers in Physiology. 10, 38 (2019).
- Samuelson, I., Vidal-Puig, A. Studying brown adipose tissue in a human in vitro context. Frontiers in Endocrinology. 11, 629 (2020).
- Wang, C. -. H., et al. CRISPR-engineered human brown-like adipocytes prevent diet-induced obesity and ameliorate metabolic syndrome in mice. Science Translational Medicine. 12 (558), (2020).
- Kaisanlahti, A., Glumoff, T. Browning of white fat: agents and implications for beige adipose tissue to type 2 diabetes. Journal of Physiology and Biochemistry. 75 (1), 1-10 (2019).
- Sato, N., et al. Development of capillary networks from rat microvascular fragments in vitro: the role of myofibroblastic cells. Microvascular Research. 33 (2), 194-210 (1987).
- Laschke, M. W., Später, T., Menger, M. D. Microvascular fragments: More than just natural vascularization units. Trends in Biotechnology. 39 (1), 24-33 (2021).
- Hoying, J. B., Boswell, C. A., Williams, S. K. Angiogenic potential of microvessel fragments established in three-dimensional collagen gels. In Vitro Cellular & Developmental Biology-Animal. 32 (7), 409-419 (1996).
- Acosta, F. M., Stojkova, K., Brey, E. M., Rathbone, C. R. A straightforward approach to engineer vascularized adipose tissue using microvascular fragments. Tissue Engineering. Part A. 26 (15-16), 905-914 (2020).
- Acosta, F. M., et al. Adipogenic differentiation alters properties of vascularized tissue-engineered skeletal muscle. Tissue Engineering. Part A. 28 (1-2), 54-68 (2021).
- Strobel, H. A., Gerton, T., Hoying, J. B. Vascularized adipocyte organoid model using isolated human microvessel fragments. Biofabrication. 13 (3), 035022 (2021).
- Acosta, F. M., et al. Engineering functional vascularized beige adipose tissue from microvascular fragments of models of healthy and type II diabetes conditions. Journal of Tissue Engineering. 13, 20417314221109337 (2022).
- Gonzalez Porras, M. A., Stojkova, K., Acosta, F. M., Rathbone, C. R., Brey, E. M. Engineering human beige adipose tissue. Frontiers in Bioengineering and Biotechnology. 10, 906395 (2022).
- Herold, J., Kalucka, J. Angiogenesis in adipose tissue: The interplay between adipose and endothelial cells. Frontiers in Physiology. 11, 1861 (2021).
- McCarthy, M., et al. Fat-On-A-Chip models for research and discovery in obesity and its metabolic comorbidities. Tissue Engineering Part B: Reviews. 26 (6), 586-595 (2020).
- Klingelhutz, A. J., et al. Scaffold-free generation of uniform adipose spheroids for metabolism research and drug discovery. Scientific Reports. 8 (1), 523 (2018).
- Yang, J. P., et al. Metabolically active three-dimensional brown adipose tissue engineered from white adipose-derived stem cells. Tissue Engineering. Part A. 23 (7-8), 253-262 (2017).
- Vaicik, M. K., et al. Hydrogel-based engineering of beige adipose tissue. Journal of Materials Chemistry B. 3 (40), 7903-7911 (2015).
- Tharp, K. M., Stahl, A. Bioengineering beige adipose tissue therapeutics. Frontiers in Endocrinology. 6, 164 (2015).
- Tharp, K. M., et al. Matrix-assisted transplantation of functional beige adipose tissue. Diabetes. 64 (11), 3713-3724 (2015).
- Harms, M. J., et al. Mature human white adipocytes cultured under membranes maintain identity, function, and can transdifferentiate into brown-like adipocytes. Cell Reports. 27 (1), 213-225 (2019).
- Frueh, F. S., Später, T., Scheuer, C., Menger, M. D., Laschke, M. W. Isolation of murine adipose tissue-derived microvascular fragments as vascularization units for tissue engineering. Journal of Visualized Experiments. (122), e55721 (2017).
- Cannon, B., Nedergaard, J. Brown adipose tissue: Function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Unser, A. M., Tian, Y., Xie, Y. Opportunities and challenges in three-dimensional brown adipogenesis of stem cells. Biotechnology Advances. 33, 962-979 (2015).
- Dani, V., Yao, X., Dani, C. Transplantation of fat tissues and iPSC-derived energy expenditure adipocytes to counteract obesity-driven metabolic disorders: Current strategies and future perspectives. Reviews in Endocrine & Metabolic Disorders. 23 (1), 103-110 (2022).
- Xu, X., et al. Adipose tissue-derived microvascular fragments as vascularization units for dental pulp regeneration. Journal of Endodontics. 47 (7), 1092-1100 (2021).
- McDaniel, J. S., Pilia, M., Ward, C. L., Pollot, B. E., Rathbone, C. R. Characterization and multilineage potential of cells derived from isolated microvascular fragments. Journal of Surgical Research. 192 (1), 214-222 (2014).
- Gealekman, O., et al. Depot-specific differences and insufficient subcutaneous adipose tissue angiogenesis in human obesity. Circulation. 123 (2), 186-194 (2011).
- Altalhi, W., Hatkar, R., Hoying, J. B., Aghazadeh, Y., Nunes, S. S. Type I diabetes delays perfusion and engraftment of 3D constructs by impinging on angiogenesis; which can be rescued by hepatocyte growth factor supplementation. Cellular and Molecular Bioengineering. 12 (5), 443-454 (2019).
- Altalhi, W., Sun, X., Sivak, J. M., Husain, M., Nunes, S. S. Diabetes impairs arterio-venous specification in engineered vascular tissues in a perivascular cell recruitment-dependent manner. Biomaterials. 119, 23-32 (2017).
- Laschke, M. W., et al. Adipose tissue-derived microvascular fragments from aged donors exhibit an impaired vascularisation capacity. European Cells & Materials. 28, 287-298 (2014).
- Später, T., et al. Vascularization of microvascular fragment isolates from visceral and subcutaneous adipose tissue of mice. Tissue Engineering and Regenerative Medicine. 19 (1), 161-175 (2021).
- Später, T., et al. Adipose tissue-derived microvascular fragments from male and female fat donors exhibit a comparable vascularization capacity. Frontiers in Bioengineering and Biotechnology. 9, 777687 (2021).
- Laschke, M. W., Menger, M. D. The simpler, the better: tissue vascularization using the body's own resources. Trends in Biotechnology. 40 (3), 281-290 (2022).
- Yang, F., Cohen, R. N., Brey, E. M. Optimization of co-culture conditions for a human vascularized adipose tissue model. Bioengineering. 7 (3), 114 (2020).
- Pilkington, A. -. C., Paz, H. A., Wankhade, U. D. Beige adipose tissue identification and marker specificity-Overview. Frontiers in Endocrinology. 12, 599134 (2021).
- Chiou, G., et al. Scaffold architecture and matrix strain modulate mesenchymal cell and microvascular growth and development in a time dependent manner. Cellular and Molecular Bioengineering. 13 (5), 507-526 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon