Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Realistische Membranmodellierung anhand komplexer Lipidmischungen in Simulationsstudien
In diesem Artikel
Zusammenfassung
Die Lipidvielfalt der Membran in Struktur und Zusammensetzung ist ein wichtiger Faktor für zelluläre Prozesse und kann ein Marker für Krankheiten sein. Molekulardynamik-Simulationen ermöglichen es uns, Membranen und ihre Wechselwirkungen mit Biomolekülen mit atomistischer Auflösung zu untersuchen. Hier stellen wir ein Protokoll zur Verfügung, um komplexe Membransysteme zu bauen, zu betreiben und zu analysieren.
Zusammenfassung
Lipide sind strukturelle Bausteine von Zellmembranen; Die Lipidspezies variieren zwischen den Zellorganellen und zwischen den Organismen. Diese Vielfalt führt zu unterschiedlichen mechanischen und strukturellen Eigenschaften in der Membran, die sich direkt auf die Moleküle und Prozesse auswirken, die an dieser Grenzfläche ablaufen. Die Zusammensetzung der Lipide ist dynamisch und kann dazu dienen, Signalprozesse in der Zelle zu modulieren. Computergestützte Ansätze werden zunehmend eingesetzt, um Wechselwirkungen zwischen Biomolekülen vorherzusagen und molekulare Einblicke in experimentelle Observablen zu liefern. Molekulardynamik (MD) ist eine auf statistischer Mechanik basierende Technik, die die Bewegung von Atomen basierend auf den Kräften, die auf sie einwirken, vorhersagt. MD-Simulationen können verwendet werden, um die Wechselwirkung von Biomolekülen zu charakterisieren. Hier stellen wir die Technik kurz vor, skizzieren praktische Schritte für Anfänger, die an der Simulation von Lipiddoppelschichten interessiert sind, demonstrieren das Protokoll mit einsteigerfreundlicher Software und diskutieren Alternativen, Herausforderungen und wichtige Überlegungen zum Prozess. Insbesondere betonen wir die Relevanz der Verwendung komplexer Lipidmischungen zur Modellierung einer Zellmembran von Interesse, um die geeigneten hydrophoben und mechanischen Umgebungen in der Simulation zu erfassen. Wir diskutieren auch einige Beispiele, bei denen die Zusammensetzung und die Eigenschaften der Membran die Wechselwirkungen von Doppelschichten mit anderen Biomolekülen modulieren.
Einleitung
Lipide sind Hauptbestandteile von Membranen, die den Zellen Grenzen bilden und eine intrazelluläre Kompartimentierung ermöglichen 1,2,3. Lipide sind amphiphil, mit einer polaren Kopfgruppe und zwei hydrophoben Fettsäureschwänzen; Diese fügen sich selbst zu einer Doppelschicht zusammen, um den Kontakt der hydrophoben Ketten mit Wasser zu minimieren 3,4. Verschiedene Kombinationen von hydrophilen Kopfgruppen und hydrophoben Schwänzen führen zu unterschiedlichen Klassen von Lipiden in biologischen Membranen, wie z. B. Glycerophospholipide, Sphingolipide und Sterole (Abbildung 1)1,5,6. Glycerophospholipide sind primäre Bausteine eukaryotischer Zellmembranen, die aus Glycerophosphat, langkettigen Fettsäuren und Kopfgruppen mit niedrigem Molekulargewichtbestehen 7. Die Lipidnomenklatur basiert auf Unterschieden in den Kopfgruppen; Beispiele hierfür sind Phosphatidylcholin (PC), Phosphatidyl-Ethanolamin (PE), Phosphatidyl-Serin (PS), Phosphatidyl-Glycerin (PG), Phosphatidyl-Inositol (PI) oder die unmodifizierte Phosphatidsäure (PA)5,6. Bei hydrophoben Schwänzen variieren die Länge und der Sättigungsgrad sowie die Struktur des Rückgrats. Die möglichen Kombinationen sind zahlreich, was zu Tausenden von Lipidspezies in Säugetierzellen führt6. Veränderungen in der Zusammensetzung der Membranlipide führen zu unterschiedlichen mechanischen und strukturellen Membraneigenschaften, die sich auf die Aktivität sowohl der integralen Membranproteine als auch der peripheren Proteine auswirken 2,6.
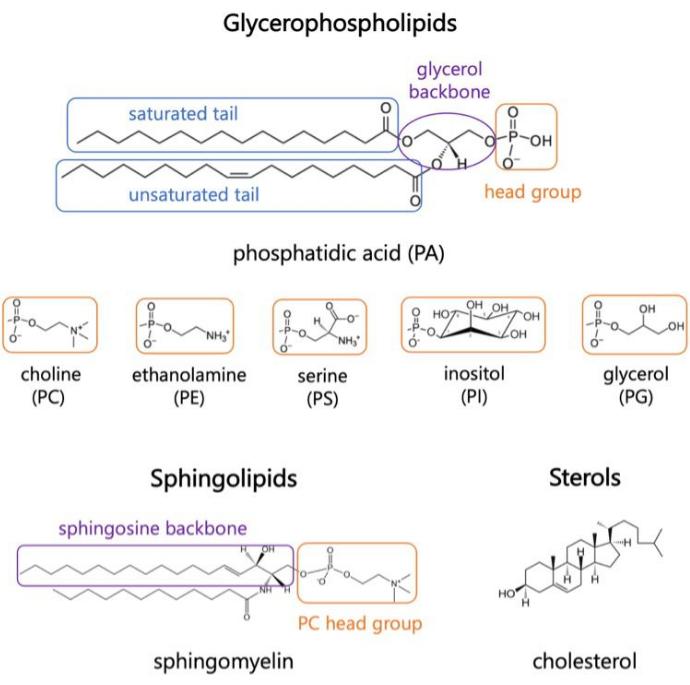
Abbildung 1. Repräsentative Lipidstrukturen. Fettsäureschwänze sind in blauen Kästchen, häufige Lipidkopfgruppen in Orange und Probenrückgrate in Lila dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Lipide sind aktive Akteure in zellulären Prozessen, Proteinaktivierung in Signalkaskaden und gesunder Zellhomöostase 8,9. Eine veränderte Lipiddynamik ist die Folge einer Infektion oder kann Marker für die Pathogenese der Erkrankung sein 10,11,12,13,14,15. Als Barrieren für die Zelle ist die Untersuchung von Membranlipiden und ihrer Rolle bei der Permeation kleiner Moleküle von Bedeutung für Arzneimittelverabreichungssysteme und Membranaufschlussmechanismen 16,17. Chemische Vielfalt und unterschiedliche Verhältnisse von Lipidspezies in Organellen, Geweben und Organismen führen zu einer komplexen Membrandynamik2. Daher ist es wichtig, diese Eigenschaften bei Modellierungsstudien von Lipiddoppelschichten beizubehalten, insbesondere wenn das Ziel einer Studie darin besteht, Wechselwirkungen anderer Biomoleküle mit der Membran zu untersuchen. Welche Lipidspezies in einem Modell zu berücksichtigen sind, hängt vom Organismus und dem Zellkompartiment ab, das von Interesse ist. Zum Beispiel sind PG-Lipide wichtig für den Elektronentransfer in photosynthetischen Baterien18, während phosphorylierte Inositol-Lipide (PIPs) wichtige Akteure bei der Dynamik der Plasmamembran (PM) und den Signalkaskaden in Säugetierzellen sind19,20. Im Inneren der Zelle enthalten das PM, das endoplasmatische Retikulum (ER), der Golgi und die mitochondrialen Membranen einzigartige Lipidhäufigkeiten, die ihre Funktion beeinflussen. Zum Beispiel ist das ER die Drehscheibe für die Lipidbiogenese und transportiert Cholesterin zu PM und Golgi; Es enthält eine hohe Lipidvielfalt mit einer Fülle von PC und PE, aber einen niedrigen Sterolgehalt, der die Membranfluidität fördert21,22,23,24. Im Gegensatz dazu enthält die PM je nach Organismus Hunderte und sogar Tausende von Lipidspezies25, sie enthält hohe Konzentrationen von Sphingolipiden und Cholesterin, die ihr eine charakteristische Steifigkeit im Vergleich zu anderen Membranen in der Zelle verleihen24. Die Asymmetrie des Segels sollte für Membranen wie die PM in Betracht gezogen werden, die ein äußeres Segel hat, das reich an Sphingomyelin, PC und Cholesterin ist, und ein inneres Segel, das reich an PE, PI und PS ist, die für Signalkaskaden wichtig sind24. Schließlich führt die Lipidvielfalt auch zur Bildung von Mikrodomänen, die sich in Packung und innerer Ordnung unterscheiden, die als Lipid-Rafts bekanntsind 24,26; Diese weisen eine laterale Asymmetrie auf, es wird angenommen, dass sie eine wichtige Rolle bei der zellulären Signalübertragungspielen 26, und sind aufgrund ihrer vorübergehenden Natur schwer zu untersuchen.
Experimentelle Techniken wie Fluoroskopie, Spektroskopie und Modellmembransysteme wie riesige unilamellare Vesikel (GUVs) wurden verwendet, um Wechselwirkungen von Biomolekülen mit Membranen zu untersuchen. Die Komplexität und Dynamik der beteiligten Komponenten lässt sich jedoch nur schwer mit experimentellen Methoden erfassen. Zum Beispiel gibt es Einschränkungen bei der Abbildung von Transmembrandomänen von Proteinen, der Komplexität von Membranen, die in solchen Studien verwendet werden, und der Identifizierung von intermediären oder vorübergehenden Zuständen während des interessierenden Prozesses27,28,29. Seit dem Aufkommen der molekularen Simulation von Lipid-Mono- und Doppelschichten in den 1980er Jahren29 können Lipid-Protein-Systeme und ihre Wechselwirkungen auf molekularer Ebene quantifiziert werden. Die Molekulardynamik-Simulation (MD) ist eine gängige Berechnungstechnik, die die Bewegung von Partikeln auf der Grundlage ihrer intermolekularen Kräfte vorhersagt. Ein additives Wechselwirkungspotential beschreibt die gebundenen und nicht gebundenen Wechselwirkungen zwischen Teilchen des Systems30. Der Satz von Parametern, die zur Modellierung dieser Wechselwirkungen verwendet werden, wird als Simulationskraftfeld (FF) bezeichnet. Diese Parameter werden aus ab initio-Berechnungen, semi-empirischen und quantenmechanischen Berechnungen gewonnen und optimiert, um unter anderem Daten aus Röntgen- und Elektronenbeugungsexperimenten, NMR-, Infrarot-, Raman- und Neutronenspektroskopie zu reproduzieren31.
MD-Simulationen können verwendet werden, um Systeme mit verschiedenen Auflösungsstufenzu untersuchen 32,33,34. Systeme, die darauf abzielen, spezifische biomolekulare Wechselwirkungen, Wasserstoffbrückenbindungen und andere hochauflösende Details zu charakterisieren, werden mit All-Atom-Simulationen (AA) untersucht. Im Gegensatz dazu werden bei grobkörnigen (CG) Simulationen Atome in größere funktionelle Gruppen zusammengefasst, um den Rechenaufwand zu senken und die Dynamik auf größerer Skala zu untersuchen33. Dazwischen befinden sich United-Atom (UA)-Simulationen, bei denen Wasserstoffatome mit ihren jeweiligen schweren Atomen kombiniert werden, um die Berechnung zu beschleunigen33,35. MD-Simulationen sind ein leistungsfähiges Werkzeug zur Erforschung der Dynamik von Lipidmembranen und ihrer Wechselwirkungen mit anderen Molekülen und können dazu dienen, Mechanismen auf molekularer Ebene für Prozesse von Interesse an der Membranschnittstelle bereitzustellen. Darüber hinaus können MD-Simulationen dazu dienen, experimentelle Ziele einzugrenzen und makromolekulare Eigenschaften eines bestimmten Systems auf der Grundlage mikroskopischer Wechselwirkungen vorherzusagen.
Kurz gesagt, bei einer Reihe von Anfangskoordinaten, Geschwindigkeiten und einer Reihe von Bedingungen wie konstanter Temperatur und konstantem Druck werden Positionen und Geschwindigkeiten jedes Teilchens durch numerische Integration des Wechselwirkungspotentials und des Newtonschen Bewegungsgesetzes berechnet. Dies wird iterativ wiederholt, wodurch eine Simulationstrajektorie30 erzeugt wird. Diese Berechnungen werden mit einer MD-Engine durchgeführt. Unter mehreren Open-Source-Paketen ist GROMACS36 eine der am häufigsten verwendeten Engines und diejenige, die wir hier beschreiben. Es enthält auch Werkzeuge für die Analyse und Konstruktion der Anfangskoordinaten der zu simulierenden Systeme37. Weitere MD-Motoren sind NAMD38; CHARMM39 und AMBER40, die der Benutzer nach eigenem Ermessen basierend auf der Rechenleistung eines bestimmten Systems auswählen kann. Es ist wichtig, die Trajektorien während der Simulation sowie für die Analyse und Interpretation der Ergebnisse zu visualisieren. Es steht eine Vielzahl von Werkzeugen zur Verfügung; Hier diskutieren wir die visuelle Molekulardynamik (VMD), die eine breite Palette von Funktionen bietet, einschließlich dreidimensionaler (3D) Visualisierung mit umfangreichen Zeichen- und Färbemethoden, volumetrischer Datenvisualisierung, Erstellen, Vorbereiten und Analysieren von Trajektorien von MD-Simulationssystemen und Erstellen von Trajektorienfilmen ohne Begrenzung der Systemgröße, wenn der Speicher verfügbar ist41,42,43.
Die Genauigkeit der vorhergesagten Dynamik zwischen den Systemkomponenten wird direkt durch die FF beeinflusst, die für die Ausbreitung der Trajektorie gewählt wird. Empirische FF-Parametrisierungsbemühungen werden von wenigen Forschungsgruppen verfolgt. Zu den etabliertesten und gebräuchlichsten FF für MD gehören CHARMM39, AMBER 40, Martini44, OPLS 45 und SIRAH 46. Das Vollatom-Additiv CHARMM36 (C36) Kraftfeld47 wird häufig für AA MD von Membransystemen verwendet, da es experimentelle Strukturdaten genau reproduziert. Es wurde ursprünglich von der CHARMM-Community entwickelt und ist mit mehreren MD-Engines wie GROMACS und NAMD kompatibel. Trotz Verbesserungen in den gängigen FFs gibt es kontinuierliche Bemühungen, die Parametersätze zu verbessern, um Vorhersagen zu ermöglichen, die experimentelle Observablen genau reproduzieren, angetrieben von Interessen an bestimmten Studiensystemen48,49.
Eine Herausforderung bei der Simulation von Lipidmembranen ist die Bestimmung der Länge der Simulationstrajektorie. Dies hängt weitgehend von den zu analysierenden Metriken und dem Prozess ab, den man charakterisieren möchte. Typischerweise benötigen komplexe Lipidmischungen mehr Zeit, um ein Gleichgewicht zu erreichen, da mehr Spezies genügend Zeit haben müssen, um auf der Membranebene zu diffundieren und eine stabile laterale Organisation zu erreichen. Eine Simulation befindet sich im Gleichgewicht, wenn die interessierende Eigenschaft ein Plateau erreicht hat und um einen konstanten Wert schwankt. Es ist gängige Praxis, mindestens 100-200 ns äquilibrierte Trajektorie zu erhalten, um eine angemessene statistische Analyse der interessierenden Eigenschaften und Wechselwirkungen durchzuführen. Es ist üblich, reine Membransimulationen zwischen 200 und 500 ns durchzuführen, abhängig von der Komplexität der Lipidmischung und der Forschungsfrage. Protein-Lipid-Wechselwirkungen erfordern typischerweise längere Simulationszeiten zwischen 500 und 2000 ns. Einige Ansätze zur Beschleunigung der Probenahme und der beobachtbaren Dynamik mit Membransystemen sind: (i) das hochmobile membranmimetische (HMMM) Modell, bei dem Endkohlenstoffe von Lipiden in der Membran durch organische Lösungsmittel ersetzt werden, um die Probenahme zu beschleunigen50; und (ii) Wasserstoffmassenumverteilung (HMR), die einen Bruchteil der Massen schwerer Atome innerhalb eines Systems mit denen von Wasserstoffatomen kombiniert, um die Verwendung eines größeren Simulationszeitschritts51 zu ermöglichen.
Das folgende Protokoll erläutert einen anfängerfreundlichen Ansatz zum Erstellen, Ausführen und Analysieren realistischer Membranmodelle mit AA MD. Aufgrund der Beschaffenheit von MD-Simulationen müssen mehrere Trajektorien ausgeführt werden, um die Reproduzierbarkeit und eine ordnungsgemäße statistische Analyse der Ergebnisse zu gewährleisten. Es ist gängige Praxis, mindestens drei Replikate pro relevantem System auszuführen. Sobald die Lipidspezies für den interessierenden Organismus und Prozess ausgewählt wurden, werden grundlegende Schritte zum Aufbau, Ausführen und Analysieren einer Simulationstrajektorie eines reinen Membransystems skizziert und in Abbildung 2 zusammengefasst.
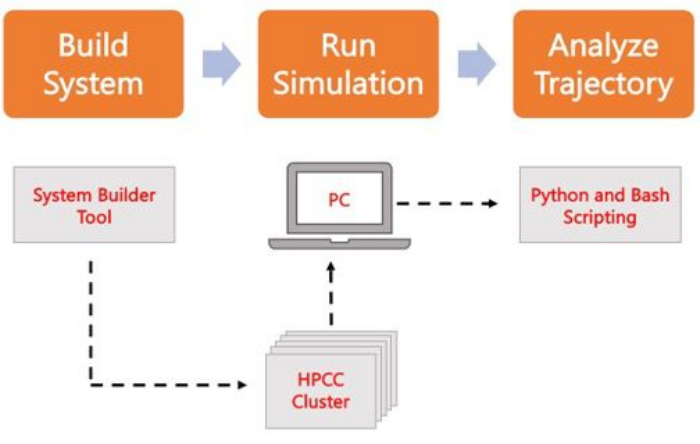
Abbildung 2. Schaltplan zum Ausführen von MD-Simulationen. Orangefarbene Kästchen entsprechen den drei Hauptschritten, die im Protokoll beschrieben sind. Darunter befindet sich der Workflow des Simulationsprozesses. Während des Systemaufbaus wird das System, das die Anfangskoordinaten eines solvatisierten Membransystems enthält, mit einem Systemeingabegenerator wie CHARMM-GUI Membrane Builder erstellt. Nach der Übertragung der Eingabedateien in einen High-Performance-Computing-Cluster wird die Simulationstrajektorie mit einer MD-Engine wie GROMACS weitergegeben. Die Trajektorienanalyse kann zusammen mit der Visualisierung auf dem Computercluster oder einer lokalen Arbeitsstation durchgeführt werden. Die Analyse wird dann entweder mithilfe von Paketen mit integriertem Analysecode wie GROMACS und VMD oder mithilfe von Bash-Skripten oder verschiedenen Python-Bibliotheken durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Erstellen der Systemkoordinaten
- Navigieren Sie mit einem Webbrowser zu CHARMM-GUI.org (C-GUI). Navigieren Sie im oberen Menü zu Input Generator und wählen Sie dann Membrane Builder aus den vertikalen Optionen auf der linken Seite des Bildschirms aus.
- Um einen Bilayer zu erstellen, wählen Sie Bilayer Builder aus.
HINWEIS: Erstbenutzer müssen ihr kostenloses Konto aktivieren, bevor sie ihren ersten Koordinatensatz erstellen. - Wählen Sie Nur Membransystem aus. Speichern Sie die generierte JOB-ID, um das System abzurufen, und fahren Sie bei Bedarf an der Stelle fort, an der Sie während des Vorgangs aufgehört haben.
- Visualisieren Sie die Systeme in jedem Schritt des Bauprozesses, indem Sie im Feld oben auf der Seite auf Struktur anzeigen klicken oder die resultierende PDB-Datei herunterladen. Achten Sie auf fehlende Komponenten, Fehler in der ausgewählten Eingangslipidspezies oder Patchgröße.
- Wählen Sie die Komponenten des Systems aus.
- Wählen Sie die Option "Heterogenes Lipid", auch wenn Sie eine einkomponentige Doppelschicht aufbauen. und wählen Sie dann einen rechteckigen Box-Typ aus.
- Wählen Sie 45 Wassermoleküle pro Lipid für die Hydratationsoption; Dies ist ausreichend, um eine vollständig hydratisierte Doppelschicht zu gewährleisten.
- Stellen Sie die Länge von XY so ein, dass sie auf der Anzahl der Lipidkomponenten basiert. Wählen Sie dann die Anzahl der Lipide aus, die für jede Lipidspezies einbezogen werden sollen, die vor dem Modell bestimmt wurde. Für die im nächsten Abschnitt diskutierte Fallstudie wurde ein Membranmodell mit 600 symmetrisch in zwei Segeln verteilten Lipiden erstellt. Um die ER von eukaryotischen Zellen zu modellieren, wurde eine Mischung aus 336 DOPC-, 132 DPPE-, 60 CHOL- und 72 POPI-Lipiden für das PI-Modell verwendet; und 330 DOPC-, 126 DPPE-, 54 CHOL-, 66 POPI- und 24 DOPS-Lipide für das PI-PS-Modell.
HINWEIS: C-GUI bietet eine Bibliothek von Lipidstrukturen zur Auswahl; Klicken Sie auf die Bilder neben dem Artnamen für seine chemische Struktur. - Geben Sie die gewünschte Anzahl von Molekülen in der oberen und unteren Packungsbeilage in die beiden Felder neben dem Lipidnamen ein. Für die Fallstudie ist eine symmetrische Membranzusammensetzung gewünscht - stellen Sie sicher, dass es keine Fehler in Bezug auf eine unübertroffene Anzahl von Lipiden in der oberen und unteren Faltblätter gibt. Wenn eine Asymmetrie gewünscht ist, stellen Sie sicher, dass die Gesamtzahl der Lipide in jedem Packungsbeilage korrekt ist. Für Details zum Aufbau asymmetrischer Doppelschichten siehe die Arbeit von Park et al.52,53.
- Gehen Sie zum Anfang der Liste der Lipidspezies und klicken Sie auf die Schaltfläche Systeminformationen anzeigen. Bauen Sie Komponenten zusammen und vervollständigen Sie das System.
- Wählen Sie die Option zum Einbeziehen neutralisierender Ionen unter Verwendung des entfernungsbasierten Algorithmus für eine schnellere Konvergenz54 aus.
- Belassen Sie die Standardlösungskonzentration von KCl bei 0,15 mM. Dies ist eine typische Salzkonzentration, um die Simulationsbox für Membrandoppelschichten neutral zu machen.
HINWEIS: Wenn eine andere Konzentration verwendet werden soll, stellen Sie sicher, dass Sie nach der Bearbeitung auf die Schaltfläche Lösungsmittelzusammensetzung berechnen klicken.
- Wählen Sie die Simulationsbedingungen und -einstellungen aus.
- Wählen Sie CHARMM36m als FF-Option aus. Es wird häufig für Lipid- und Proteinsimulationen verwendet, aber der Benutzer kann auch andere Optionen auswählen, die in der Einführung besprochen werden.
- Wählen Sie GROMACS als MD-Engine aus, um Beispieleingabedateien im entsprechenden Format zu erhalten.
HINWEIS: GROMACS wird für neue Benutzer empfohlen, da es mehrere Online-Ressourcen, Tutorials und Foren für den Support bietet. Der Benutzer kann aus mehreren MD-Engines auswählen, um Optionen in Bezug auf Simulationsleistung und Codesyntax zu erkunden. - Wählen Sie das NPT-Ensemble (Constant Particle-Pressure-Temperature), das bei weitem am häufigsten verwendete dynamische Ensemble bei der Simulation von Lipiddoppelschichten.
- Stellen Sie die Temperatur und den Druck in Kelvin und bar auf 303 K bzw. 1 bar ein. Es ist üblich, die Temperatur zwischen 298 K und 310 K einzustellen, um biologische Prozesse zu untersuchen, um eine Doppelschicht im flüssigen Unordnungszustand zu gewährleisten.
HINWEIS: Die Temperatur hängt von den Bedingungen des zu simulierenden Prozesses ab und kann bei Bedarf geändert werden. Abhängig von den Lipidspezies im Modell ist die Temperatur vor dem Ausführen der Simulation so einzustellen, dass sie über der Sprungtemperatur der reinen Lipidkomponenten liegt.
- Laden Sie die resultierenden Dateien herunter und übertragen Sie sie auf den Computercluster.
- Visualisieren Sie das endgültige System mit einer Software Ihrer Wahl, z. B. VMD oder PyMol, und überprüfen Sie die ordnungsgemäße Einrichtung.
HINWEIS: Es ist z. B. gut zu überprüfen, ob genügend Wasser um die Membran herum vorhanden ist, so dass Lipide während der Simulation nicht mit Bildatomen interagieren, und den richtigen Aufbau des Segels (eine Doppelschicht ohne Raum oder Wasser dazwischen).
- Visualisieren Sie das endgültige System mit einer Software Ihrer Wahl, z. B. VMD oder PyMol, und überprüfen Sie die ordnungsgemäße Einrichtung.
2. Ausführen von MD-Simulationen
- Laden Sie die Dateien von C-GUI auf Ihren Computing-Cluster hoch und entpacken Sie sie. Navigieren Sie zum Gromacs-Verzeichnis . Erstellen Sie ein Entspannungsübermittlungsskript.
- Befolgen Sie die Richtlinien des Clusters für das Format eines Übermittlungsskripts.
- Kopieren Sie die Befehle, die bis knapp über dem # Produktionskommentar in der README-Datei aufgeführt sind, in das Übermittlungsskript.
HINWEIS: Diese Standardeinstellung von C-GUI ist eine Schleife, die eine 6-stufige Entspannung des Systems ausführt. Wenn ein anderes und gut etabliertes Protokoll gewünscht wird, bearbeiten Sie es, um die soeben erstellten und von C-GUI heruntergeladenen Koordinaten zu lesen.
- Kopieren Sie die Befehle, die bis knapp über dem # Produktionskommentar in der README-Datei aufgeführt sind, in das Übermittlungsskript.
- Übermitteln Sie das Entspannungsskript und vergewissern Sie sich, dass alle Ausgabedateien für alle Schritte heruntergeladen wurden, bevor Sie mit dem Produktionslauf fortfahren. Suchen Sie nach Abschluss des Vorgangs nach den folgenden Ausgabedateien von GROMACS, die während des 6-Schritte-Laufs generiert wurden: *.log, *.tpr, *.gro, *.edr, *.trr / *.xtc
- Erstellen Sie ein Produktionsausführungsskript.
- Verwenden Sie einen der Beispielbefehle gmx grompp und gmx mdrun aus einem der Entspannungsschritte als Vorlage.
- Bevor Sie das Skript verwenden, stellen Sie sicher, dass Sie eine *.mdp-Datei erstellen, die ähnliche Simulationsoptionen wie die bereitgestellte step7_production.mdp-Datei enthält.
HINWEIS: Die bereitgestellten Standardoptionen sind Standard für Membransimulationen. Die Abweichungen werden in nm angegeben und die Zeit wird in Pikosekunden oder der Anzahl der Schritte (Pikosekunden / Integrationszeitschritt) angegeben. Aktualisieren Sie die nsteps so, dass sie bis zur gewünschten Simulationslänge laufen (dies ist gleich dt * nsteps) und nst[x,v,f]out, um die Häufigkeit der Datenspeicherung in der Anzahl der Integrationsschritte zu aktualisieren. Setzen Sie für die Fallstudie die nsteps auf 250.000.000 für eine Simulationslänge von 500ns (Simulationszeit / Integrationsschritt = 500.000 ps / 0,002ps) und nst[x,v,f]out auf 50.000, um Daten alle 100 ps zu speichern
- Führen Sie vor dem Ausführen der eigentlichen Simulation Benchmark-Studien durch, um die optimale Nutzung der Ressourcen zu ermitteln.
- Führen Sie das System 1-2 ns lang mit einer unterschiedlichen Anzahl von Rechenknoten aus.
HINWEIS: Die ER-Fallstudie wurde auf dem High-Performance-Computing-Cluster55 des UB Center for Computational Research (CCR) für 2 ns eingereicht, wo die Leistung für 1-10 Knoten getestet wurde. - Vergleichen Sie die Leistung in ns/Tag für jede Einstellung, um die optimalen Ressourcen für die Ausführung zu ermitteln. Es ist gängige Praxis, die Anzahl der Knoten auszuwählen, die zu 75 % bis 80 % der maximalen Leistung führen.
- Führen Sie das System 1-2 ns lang mit einer unterschiedlichen Anzahl von Rechenknoten aus.
- Führen Sie den Produktionslauf aus.
- Führen Sie jedes System dreifach aus, um die Reproduzierbarkeit zu gewährleisten, und führen Sie statistische Analysen der Daten durch.
- Erweitern Sie die Trajektorie basierend auf den Benchmarks, wenn die zulässige Warteschlangenzeit für die Übermittlung auf dem Computing-Cluster abgelaufen ist. Verwenden Sie die Befehle gmx convert-tpr, dann gmx mdrun, um mit der Trajektorienerfassung fortzufahren.
HINWEIS: Die Optionen sind in der GROMACS-Dokumentation online (https://manual.gromacs.org/) beschrieben. - Untersuchen Sie bei einem reinen Membransystem, ob das System ein Gleichgewicht erreicht hat, indem Sie die Fläche pro Lipid im Laufe der Zeit berechnen. Ist dies nicht der Fall, verlängern Sie die Simulationstrajektorie.
3. Analyse der Trajektorie
- Visualisieren Sie das System, bevor Sie die Analyse durchführen, um die interessierenden Moleküle und den Teil der Trajektorie zu bestimmen, der für die Charakterisierung vorgesehen ist.
- Komprimieren Sie rohe Trajektoriendateien (*.trr), indem Sie das Dateiformat in *.xtc ändern und/oder Frames überspringen, um die Dateigröße zu reduzieren und eine effizientere Übertragung zur lokalen Station zur Visualisierung und Analyse zu ermöglichen.
HINWEIS: Bei großen Membransystemen kann man sich dafür entscheiden, Wasser aus der Trajektorie zu entfernen, um die Dateigröße weiter zu reduzieren. Dies kann mit Indexdateien auf GROMACS, TCL-Skripten auf VMD oder Python-Bibliotheken wie MDAnalysis und MDTraj erfolgen. - Führen Sie ausgewählte Analysen während des äquilibrierten Teils der Trajektorie durch, wie aus der Flächen-pro-Lipid-Zeitreihe bestimmt.
HINWEIS: Weitere Informationen zu typischen Membrananalysen und deren Durchführung finden Sie in der Diskussion.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Um die Anwendung des Protokolls und die damit verbundenen Ergebnisse zu veranschaulichen, wird eine Vergleichsstudie für Membranmodelle für das endoplasmatische Retikulum (ER) diskutiert. Die beiden Modelle in dieser Studie waren (i) das PI-Modell, das die vier wichtigsten Lipidspezies im ER enthält, und (ii) das PI-PS-Modell, das die anionische Phosphatidylserin-Lipidspezies (PS) hinzufügte. Diese Modelle wurden später in einer Studie eines viralen Proteins und seiner Interaktion mit der Membran verwendet, wobei da...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Experimentelle Techniken können Biomoleküle mit hoher Auflösung unter Verwendung von Kryo-Elektronenmikroskopie (Kryo-EM)58, Fluoreszenztechniken und Rasterkraftmikroskopie (AFM)59 visualisieren. Es ist jedoch eine Herausforderung, das Zusammenspiel und die Dynamik molekularer Wechselwirkungen zu erfassen, die biologischen Signalwegen, der Krankheitspathogenese und der therapeutischen Verabreichung auf atomarer oder Aminosäureebene zugrunde liegen. Hier wurden die Mögl...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen offenzulegen.
Danksagungen
Die Autoren danken Jinhui Li und Ricardo X. Ramirez für ihre Simulationsverläufe und Diskussionen während des Schreibens dieses Manuskripts. O.C. wurde durch das Presidential Fellowship der University at Buffalo und den National Institute of Health's Initiative for Maximizing Student Development Training Grant 1T32GM144920-01 unterstützt, der an Margarita L. Dubocovich (PI) vergeben wurde.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Anaconda3 | Anaconda Inc (Python & related libraries) | N/A | |
| CHARMM-GUI.org | Im lab, Lehigh University | N/A | |
| GROMACS | GROMACS development team | N/A | |
| Linux HPC Cluster | UB CCR | N/A | |
| MATLAB | MathWorks | N/A | |
| VMD | Theoretical and Computational Biophysics Group | N/A |
Referenzen
- Vanni, S., Riccardi, L., Palermo, G., De Vivo, M. Structure and Dynamics of the Acyl Chains in the Membrane Trafficking and Enzymatic Processing of Lipids. Accounts of Chemical Research. 52 (11), 3087-3096 (2019).
- Harayama, T., Riezman, H. Understanding the diversity of membrane lipid composition. Nature Reviews Molecular Cell Biology. 19 (5), 281-296 (2018).
- Tanaka, M. Comprehensive Biophysics. Edward, H. . E. gelman , Elsevier. 261-272 (2012).
- Bruce Alberts, A. J., Julian Lewis,, Martin Raff,, Keith Roberts,, Peter Walter, Molecular Biology of the Cell. , Garland Science. (2002).
- Watson, H. Biological membranes. Essays in Biochemistry. 59, 43-69 (2015).
- Coskun, Ü, Simons, K. Cell Membranes: The Lipid Perspective. Structure. 19 (11), 1543-1548 (2011).
- Biobased Surfactants (Second Edition) eds. Douglas G, H. ayes, Daniel, K. Y., Solaiman,, Richard, D. , AOCS Press. 515-529 (2019).
- González-Rubio, P., Gautier, R., Etchebest, C., Fuchs, P. F. J. Amphipathic-Lipid-Packing-Sensor interactions with lipids assessed by atomistic molecular dynamics. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1808, 2119-2127 (2011).
- Halbleib, K., et al. Activation of the Unfolded Protein Response by Lipid Bilayer Stress. Molecular Cell. 67, 673-684 (2017).
- Andreasen, M., Lorenzen, N., Otzen, D. Interactions between misfolded protein oligomers and membranes: A central topic in neurodegenerative diseases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1848 (9), 1897-1907 (2015).
- Calianese, D. C., Birge, R. B. Biology of phosphatidylserine (PS): basic physiology and implications in immunology, infectious disease, and cancer. Cell Commununication and Signaling. 18 (1), 41(2020).
- Nieto-Garai, J. A., Contreras, F. X., Arboleya, A., Lorizate, M. Role of Protein-Lipid Interactions in Viral Entry. Advanced Biology. 6, 2101264(2022).
- Mazzon, M., Mercer, J. Lipid interactions during virus entry and infection. Cell Microbiology. 16, 1493-1502 (2014).
- Colombelli, C., Aoun, M., Tiranti, V. Defective lipid metabolism in neurodegeneration with brain iron accumulation (NBIA) syndromes: not only a matter of iron. Journal of Inherited Metabolic Disease. 38 (1), 123-136 (2015).
- Saini-Chohan, H. K., Mitchell, R. W., Vaz, F. M., Zelinski, T., Hatch, G. M. Delineating the role of alterations in lipid metabolism to the pathogenesis of inherited skeletal and cardiac muscle disorders: Thematic Review Series: Genetics of Human Lipid Diseases. Journal of Lipid Research. 53 (1), 4-27 (2012).
- Martinotti, C., Ruiz-Perez, L., Deplazes, E., Mancera, R. L. Molecular Dynamics Simulation of Small Molecules Interacting with Biological Membranes. ChemPhysChem. 21 (14), 1486-1514 (2020).
- Li, J., Kalyanram, P., Rozati, S., Monje-Galvan, V., Gupta, A. Interaction of Cyanine-D112 with Binary Lipid Mixtures: Molecular Dynamics Simulation and Differential Scanning Calorimetry Study. ACS Omega. 7 (11), 9765-9774 (2022).
- Nagy, L., et al. Protein/Lipid Interaction in the Bacterial Photosynthetic Reaction Center: Phosphatidylcholine and Phosphatidylglycerol Modify the Free Energy Levels of the Quinones. Biochemistry. 43 (40), 12913-12923 (2004).
- Ramirez, R. X., Campbell, O., Pradhan, A. J., Atilla-Gokcumen, G. E., Monje-Galvan, V. Modeling the molecular fingerprint of protein-lipid interactions of MLKL on complex bilayers. Frontiers in Chemistry. 10, (2023).
- Dondelinger, Y., et al. MLKL Compromises Plasma Membrane Integrity by Binding to Phosphatidylinositol Phosphates. Cell Reports. 7 (4), 971-981 (2014).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5(2011).
- Lee, H. R., Lee, G. Y., You, D. G., Kim, H. K., Young, D. Y. Hepatitis C virus p7 induces membrane permeabilization by interacting with phosphatidylserine. International Journal of Molecular Sciences. 21 (3), 897(2020).
- Casares, D., Escribá, P. V., Rosselló, C. A. Membrane Lipid Composition: Effect on Membrane and Organelle Structure, Function and Compartmentalization and Therapeutic Avenues. International Journal of Molecular Sciences. 20 (9), 2167(2019).
- Marrink, S. J., et al. Computational Modeling of Realistic Cell Membranes. Chemical Reviews. 119 (9), 6184-6226 (2019).
- Janmey, P. A., Kinnunen, P. K. J. Biophysical properties of lipids and dynamic membranes. Trends in Cell Biology. 16 (10), 538-546 (2006).
- Brémaud, E., Favard, C., Muriaux, D. Deciphering the Assembly of Enveloped Viruses Using Model Lipid Membranes. Membranes. 12, 441(2022).
- Campbell, O., Monje-Galvan, V. Protein-driven membrane remodeling: Molecular perspectives from Flaviviridae infections. Biophysical Journal. 122 (11), 1890-1899 (2022).
- Loschwitz, J., Olubiyi, O. O., Hub, J. S., Strodel, B., Poojari, C. S. Computer simulations of protein-membrane systems. Progress in molecular biology and translational science. 170, 273-403 (2020).
- Shell, M. S. Thermodynamics and Statistical Mechanics: An Integrated ApproachCambridge Series in Chemical Engineering. Scott Shell, M. , Cambridge University Press. 21-49 (2015).
- Yang, J., et al. Molecular Dynamic Simulation of Ni-Al Alloy-H2O Reactions Using the ReaxFF Reactive Force Field. ACS Omega. 8 (11), 9807-9814 (2023).
- Ingólfsson, H. I., Arnarez, C., Periole, X., Marrink, S. J. Computational 'microscopy' of cellular membranes. Journal of Cell Science. 129 (2), 257-268 (2016).
- Klauda, J. B. Perspective: Computational modeling of accurate cellular membranes with molecular resolution. The Journal of Chemical Physics. 149 (22), 220901(2018).
- Chavent, M., Duncan, A. L., Sansom, M. S. P. Molecular dynamics simulations of membrane proteins and their interactions: from nanoscale to mesoscale. Current Opinion in Structural Biology. 40, 8-16 (2016).
- Khakbaz, P., Monje-Galvan, V., Zhuang, X., Klauda, J. B. Biogenesis of Fatty Acids, Lipids and Membranes. Otto Geiger, , Springer International Publishing. 1-19 (2017).
- Abraham, M. J., et al. GROMACS: High performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX. 1, 19-25 (2015).
- Lemkul, J. A. From Proteins to Perturbed Hamiltonians: A Suite of Tutorials for the GROMACS-2018 Molecular Simulation Package. Living Journal of Computational Molecular Science. 1 (1), 5068(2018).
- Phillips, J. C., et al. Scalable molecular dynamics on CPU and GPU architectures with NAMD. The Journal of Chemical Physics. 153 (4), 044130(2020).
- Klauda, J. B., et al. Update of the CHARMM All-Atom Additive Force Field for Lipids: Validation on Six Lipid Types. The Journal of Physical Chemistry B. 114 (23), 7830-7843 (2010).
- Wang, J., Wolf, R. M., Caldwell, J. W., Kollman, P. A., Case, D. A. Development and testing of a general amber force field. Journal of Computational Chemistry. 25 (9), 1157-1174 (2004).
- John Stone, A. A., et al. Using VMD. , http://csbmb.beckman.illinois.edu/BIOP586C/vmd-tutorial-2011.pdf (2011).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Hsin, J., Arkhipov, A., Yin, Y., Stone, J. E., Schulten, K. Using VMD: An Introductory Tutorial. Current Protocols in Bioinformatics. 24 (1), 5.7.1-5.7.48 (2008).
- Souza, P. C. T., et al. Martini 3: a general purpose force field for coarse-grained molecular dynamics. Nature Methods. 18 (4), 382-388 (2021).
- Jorgensen, W. L., Maxwell, D. S., Tirado-Rives, J. Development and Testing of the OPLS All-Atom Force Field on Conformational Energetics and Properties of Organic Liquids. Journal of the American Chemical Society. 118 (45), 11225-11236 (1996).
- Machado, M. R., et al. The SIRAH 2.0 Force Field: Altius, Fortius, Citius. Journal of Chemical Theory and Computation. 15 (4), 2719-2733 (2019).
- Huang, J., et al. CHARMM36m: an improved force field for folded and intrinsically disordered proteins. Nature Methods. 14 (1), 71-73 (2017).
- Mu, J., Liu, H., Zhang, J., Luo, R., Chen, H. F. Recent Force Field Strategies for Intrinsically Disordered Proteins. Journal of Chemical Information and Modeling. 61 (3), 1037-1047 (2021).
- Inakollu, V. S. S., Geerke, D. P., Rowley, C. N., Yu, H. Polarisable force fields: what do they add in biomolecular simulations. Current Opinion in Structural Biology. 61, 182-190 (2020).
- Ohkubo, Y. Z., et al. Accelerating Membrane Insertion of Peripheral Proteins with a Novel Membrane Mimetic Model. Biophysical Journal. 102 (9), 2130-2139 (2012).
- Hopkins, C. W., Le Grand, S., Walker, R. C., Roitberg, A. E. Long-Time-Step Molecular Dynamics through Hydrogen Mass Repartitioning. Journal of Chemical Theory and Computation. 11 (4), 1864-1874 (2015).
- Park, S., Beaven, A. H., Klauda, J. B., Im, W. How Tolerant are Membrane Simulations with Mismatch in Area per Lipid between Leaflets. Journal of Chemical Theory and Computation. 11 (7), 3466-3477 (2015).
- Park, S., Im, W., Pastor, R. W. Developing initial conditions for simulations of asymmetric membranes: a practical recommendation. Biophysical Journal. 120 (22), 5041-5059 (2021).
- Wu, E. L., et al. CHARMM-GUI Membrane Builder toward realistic biological membrane simulations. Journal of Computational Chemistry. 35 (27), 1997-2004 (2014).
- Center for Computational Research, U.a.B.. CCR Facility Description. , https://ubir.buffalo.edu/xmlui/handle/10477/79221 (2019).
- Piggot, T. J., Allison, J. R., Sessions, R. B., Essex, J. W. On the Calculation of Acyl Chain Order Parameters from Lipid Simulations. Journal of Chemical Theory and Computation. 13 (11), 5683-5696 (2017).
- Li, J., Monje-Galvan, V. Effect of Glycone Diversity on the Interaction of Triterpenoid Saponins and Lipid Bilayers. ACS Applied Bio Materials. , (2023).
- Renaud, J. P., et al. Cryo-EM in drug discovery: achievements, limitations and prospects. Nature Reviews Drug Discovery. 17 (7), 471-492 (2018).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Martínez, L., Andrade, R., Birgin, E. G., Martínez, J. M. PACKMOL: A package for building initial configurations for molecular dynamics simulations. Journal of Computational Chemistry. 30 (13), 2157-2164 (2009).
- Jewett, A. I., et al. Moltemplate: A Tool for Coarse-Grained Modeling of Complex Biological Matter and Soft Condensed Matter Physics. Journal of Molecular Biology. 433 (11), 166841(2021).
- Jo, S., Kim, T., Iyer, V. G., Im, W. CHARMM-GUI: A web-based graphical user interface for CHARMM. Journal of Computational Chemistry. 29 (11), 1859-1865 (2008).
- Polêto, M. D., Lemkul, J. A. Integration of experimental data and use of automated fitting methods in developing protein force fields. Communications Chemistry. 5 (1), 38(2022).
- Hynninen, A. P., Crowley, M. F. New faster CHARMM molecular dynamics engine. Journal of Computational Chemistry. 35 (5), 406-413 (2014).
- Kim, S. Issues on the Choice of a Proper Time Step in Molecular Dynamics. Physics Procedia. 53, 60-62 (2014).
- Grubmüller, H., Heller, H., Windemuth, A., Schulten, K. Generalized Verlet Algorithm for Efficient Molecular Dynamics Simulations with Long-range Interactions. Molecular Simulation. 6 (1-3), 121-142 (1991).
- Darden, T., York, D., Pedersen, L. Particle mesh Ewald: An N·log(N) method for Ewald sums in large systems. Journal of Chemical Physics. 98 (12), 10089-10092 (1993).
- Hepatitis C. , https://www.who.int/news-room/fact-sheets/detail/hepatitis-c (2021).
- Braun, E., et al. Best Practices for Foundations in Molecular Simulations [Article v1.0]. Living Journal of Computational Molecular Science. 1 (1), 5957(2018).
- Moradi, S., Nowroozi, A., Shahlaei, M. Shedding light on the structural properties of lipid bilayers using molecular dynamics simulation: a review study. RSC Advances. 9 (8), 4644-4658 (2019).
- Monje-Galvan, V., Klauda, J. B. Modeling Yeast Organelle Membranes and How Lipid Diversity Influences Bilayer Properties. Biochemistry. 54 (45), 6852-6861 (2015).
- Michaud-Agrawal, N., Denning, E. J., Woolf, T. B., Beckstein, O. MDAnalysis: A toolkit for the analysis of molecular dynamics simulations. Journal of Computational Chemistry. 32 (10), 2319-2327 (2011).
- Gowers, R., et al. MDAnalysis: A Python Package for the Rapid Analysis of Molecular Dynamics Simulations. SciPy. , (2016).
- McGibbon, R. obert T., et al. MDTraj: A Modern Open Library for the Analysis of Molecular Dynamics Trajectories. Biophysical Journal. 109 (8), 1528-1532 (2015).
- Fortunato, M. E., Colina, C. M. pysimm: A python package for simulation of molecular systems. SoftwareX. 6, 7-12 (2017).
- Scherer, M. K., et al. PyEMMA 2: A Software Package for Estimation, Validation, and Analysis of Markov Models. Journal of Chemical Theory and Computation. 11 (11), 5525-5542 (2015).
- Song, W., et al. PyLipID: A Python Package for Analysis of Protein-Lipid Interactions from Molecular Dynamics Simulations. Journal of Chemical Theory and Computation. 18 (2), 1188-1201 (2022).
- Monje-Galvan, V., Klauda, J. B. Peripheral membrane proteins: Tying the knot between experiment and computation. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858 (7, Part B), 1584-1593 (2016).
- Monje-Galvan, V., Voth, G. A. Binding mechanism of the matrix domain of HIV-1 gag on lipid membranes. eLife. 9, e58621(2020).
- Wang, B., Guo, C. Concentration-Dependent Effects of Cholesterol on the Dimerization of Amyloid-β Peptides in Lipid Bilayers. ACS Chemical Neuroscience. 13 (18), 2709-2718 (2022).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten