Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modélisation membranaire réaliste à l’aide de mélanges lipidiques complexes dans des études de simulation
Dans cet article
Résumé
La diversité des lipides membranaires dans leur structure et leur composition est un contributeur important aux processus cellulaires et peut être un marqueur de maladie. Les simulations de dynamique moléculaire nous permettent d’étudier les membranes et leurs interactions avec les biomolécules à une résolution atomistique. Ici, nous fournissons un protocole pour construire, exécuter et analyser des systèmes membranaires complexes.
Résumé
Les lipides sont des éléments constitutifs structurels des membranes cellulaires ; Les espèces lipidiques varient d’un organite cellulaire à l’autre et d’un organisme à l’autre. Cette variété se traduit par différentes propriétés mécaniques et structurelles dans la membrane qui ont un impact direct sur les molécules et les processus qui se produisent à cette interface. La composition lipidique est dynamique et peut servir à moduler les processus de signalisation cellulaire. Les approches computationnelles sont de plus en plus utilisées pour prédire les interactions entre les biomolécules et fournir des informations moléculaires aux observables expérimentales. La dynamique moléculaire (MD) est une technique basée sur la mécanique statistique qui prédit le mouvement des atomes en fonction des forces qui agissent sur eux. Les simulations de DM peuvent être utilisées pour caractériser l’interaction des biomolécules. Ici, nous présentons brièvement la technique, décrivons les étapes pratiques pour les débutants qui s’intéressent à la simulation de bicouches lipidiques, démontrons le protocole avec un logiciel convivial pour les débutants et discutons des alternatives, des défis et des considérations importantes du processus. En particulier, nous soulignons la pertinence de l’utilisation de mélanges lipidiques complexes pour modéliser une membrane cellulaire d’intérêt afin de capturer les environnements hydrophobes et mécaniques appropriés en simulation. Nous discutons également de quelques exemples où la composition et les propriétés membranaires modulent les interactions des bicouches avec d’autres biomolécules.
Introduction
Les lipides sont des constituants majeurs des membranes, qui fournissent des limites aux cellules et permettent la compartimentation intracellulaire 1,2,3. Les lipides sont amphiphiles, avec un groupe de tête polaire et deux queues d’acides gras hydrophobes ; Ceux-ci s’auto-assemblent en une bicouche pour minimiser le contact des chaînes hydrophobes avec l’eau 3,4. Diverses combinaisons de groupes de têtes hydrophiles et de queues hydrophobes donnent lieu à différentes classes de lipides dans les membranes biologiques, telles que les glycérophospholipides, les sphingolipides et les stérols (Figure 1)1,5,6. Les glycérophospholipides sont les principaux éléments constitutifs des membranes cellulaires eucaryotes composées de glycérophosphate, d’acides gras à longue chaîne et de groupes de tête de faible poids moléculaire7. La nomenclature des lipides est basée sur les différences entre les groupes de têtes ; par exemple, la phosphatidyl-choline (PC), la phosphatidyl-éthanolamine (PE), la phosphatidylsérine (PS), le phosphatidyl-glycérol (PG), le phosphatidyl-inositol (PI) ou l’acide phosphatidique (PA) non modifié5,6. En ce qui concerne les queues hydrophobes, la longueur et le degré de saturation varient, ainsi que la structure de la colonne vertébrale. Les combinaisons possibles sont nombreuses, ce qui donne des milliers d’espèces lipidiques dans les cellules de mammifères6. Les changements dans la composition des lipides membranaires conduisent à différentes propriétés membranaires mécaniques et structurelles qui ont un impact sur l’activité des protéines membranaires intégrales et des protéines périphériques 2,6.
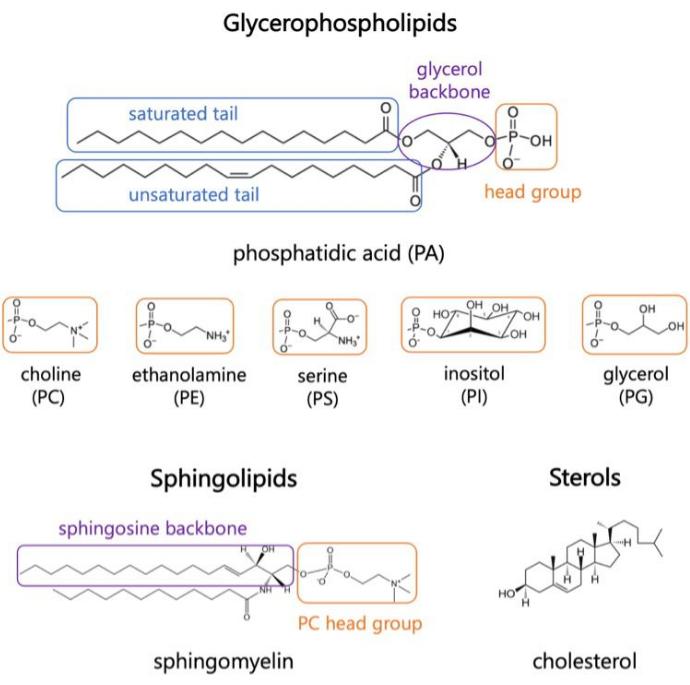
Graphique 1. Structures lipidiques représentatives. Les queues d’acides gras sont représentées dans des cases bleues, les groupes de têtes lipidiques communs en orange et les épines dorsales d’échantillons en violet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les lipides jouent un rôle actif dans les processus cellulaires, l’activation des protéines dans les cascades de signalisation et l’homéostasie des cellules saines 8,9. L’altération de la dynamique des lipides est le résultat d’une infection ou peut être un marqueur de pathogenèse de la maladie 10,11,12,13,14,15. En tant que barrières pour la cellule, l’étude des lipides membranaires et de leur rôle dans la perméation de petites molécules est pertinente pour les systèmes d’administration de médicaments et les mécanismes de perturbation membranaire16,17. La diversité chimique et les différents ratios d’espèces lipidiques entre les organites, les tissus et les organismes donnent lieu à une dynamique membranaire complexe2. Il est donc important de conserver ces caractéristiques dans les études de modélisation des bicouches lipidiques, en particulier lorsque l’objectif d’une étude est d’examiner les interactions d’autres biomolécules avec la membrane. Les espèces lipidiques à prendre en compte dans un modèle dépendent de l’organisme et du compartiment cellulaire d’intérêt. Par exemple, les lipides PG sont importants pour le transfert d’électrons dans les bactéries photosynthétiques18, tandis que les lipides d’inositol phosphorylés (PIP) sont des acteurs majeurs de la dynamique de la membrane plasmique (PM) et des cascades de signalisation dans les cellules de mammifères 19,20. À l’intérieur de la cellule, les membranes de PM, de réticulum endoplasmique (RE), de Golgi et mitochondriales contiennent des abondances lipidiques uniques qui influencent leur fonction. Par exemple, le RE est la plaque tournante de la biogenèse des lipides et transporte le cholestérol vers les PM et Golgi ; il contient une grande diversité lipidique avec une abondance de PC et de PE, mais une faible teneur en stérols, ce qui favorise la fluidité membranaire21,22,23,24. En revanche, le PM incorpore des centaines, voire des milliers d’espèces lipidiques selon lesorganismes25, il contient des niveaux élevés de sphingolipides et de cholestérol qui lui confèrent une rigidité caractéristique par rapport aux autres membranes de la cellule24. L’asymétrie des feuillets doit être envisagée pour les membranes comme le PM, qui a un feuillet externe riche en sphingomyéline, en PC et en cholestérol, et un feuillet interne riche en PE, PI et PS qui sont importants pour les cascades de signalisation24. Enfin, la diversité lipidique induit également la formation de micro-domaines qui diffèrent par leur empilement et leur ordre interne, connus sous le nom de radeaux lipidiques24,26 ; Ceux-ci présentent une asymétrie latérale, sont supposés jouer un rôle important dans la signalisation cellulaire26 et sont difficiles à étudier en raison de leur nature transitoire.
Des techniques expérimentales telles que la fluoroscopie, la spectroscopie et des systèmes membranaires modèles tels que les vésicules unilamellaires géantes (GUV) ont été utilisées pour étudier les interactions des biomolécules avec les membranes. Cependant, la nature complexe et dynamique des composants impliqués est difficile à saisir avec les seules méthodes expérimentales. Par exemple, il existe des limites à l’imagerie des domaines transmembranaires des protéines, à la complexité des membranes utilisées dans de telles études et à l’identification d’états intermédiaires ou transitoires au cours du processus d’intérêt27,28,29. Depuis l’avènement de la simulation moléculaire des monocouches et bicouches lipidiques dans les années 198029, les systèmes lipides-protéines et leurs interactions peuvent désormais être quantifiés au niveau moléculaire. La simulation de dynamique moléculaire (MD) est une technique de calcul courante qui prédit le mouvement des particules en fonction de leurs forces intermoléculaires. Un potentiel d’interaction additif décrit les interactions liées et non liées entre les particules du système30. L’ensemble des paramètres utilisés pour modéliser ces interactions est appelé champ de force de simulation (FF). Ces paramètres sont obtenus à partir de calculs ab initio, de calculs semi-empiriques et de mécanique quantique, et optimisés pour reproduire des données provenant d’expériences de diffraction des rayons X et des électrons, de la RMN, de l’infrarouge, de la spectroscopie Raman et de la spectroscopie neutronique, entre autres méthodes31.
Les simulations MD peuvent être utilisées pour étudier des systèmes à différents niveaux de résolution32,33,34. Les systèmes qui visent à caractériser des interactions biomoléculaires spécifiques, des liaisons hydrogène et d’autres détails à haute résolution sont étudiés avec des simulations de tous les atomes (AA). En revanche, les simulations à gros grain (CG) regroupent les atomes en groupes fonctionnels plus grands afin de réduire les coûts de calcul et d’examiner la dynamique à plus grande échelle33. Entre les deux se trouvent des simulations d’atomes unis (UA), où les atomes d’hydrogène sont combinés avec leurs atomes lourds respectifs pour accélérer le calcul33,35. Les simulations MD sont un outil puissant pour l’exploration de la dynamique des membranes lipidiques et de leurs interactions avec d’autres molécules et peuvent servir à fournir des mécanismes au niveau moléculaire pour les processus d’intérêt à l’interface membranaire. De plus, les simulations de DM peuvent servir à affiner les cibles expérimentales et à prédire les propriétés macromoléculaires d’un système donné sur la base d’interactions microscopiques.
En bref, étant donné un ensemble de coordonnées initiales, de vitesses et un ensemble de conditions telles qu’une température et une pression constantes, les positions et les vitesses de chaque particule sont calculées par intégration numérique du potentiel d’interaction et de la loi du mouvement de Newton. Ceci est répété de manière itérative, générant ainsi une trajectoire de simulation30. Ces calculs sont effectués à l’aide d’un moteur MD ; Parmi plusieurs paquets open-source, GROMACS36 est l’un des moteurs les plus couramment utilisés et celui que nous décrivons ici. Il comprend également des outils d’analyse et de construction des coordonnées initiales des systèmes à simuler37. Parmi les autres moteurs MD, citons le NAMD38 ; CHARMM39 et AMBER40, que l’utilisateur peut sélectionner à sa propre discrétion en fonction des performances de calcul d’un système donné. Il est essentiel de visualiser les trajectoires pendant la simulation ainsi que pour l’analyse et l’interprétation des résultats. Une variété d’outils sont disponibles ; Nous discutons ici de la dynamique moléculaire visuelle (VMD) qui offre un large éventail de fonctionnalités, y compris la visualisation tridimensionnelle (3D) avec des méthodes de dessin et de coloration étendues, la visualisation volumétrique des données, la construction, la préparation et l’analyse des trajectoires des systèmes de simulation MD, et la réalisation de films de trajectoire sans limite de taille du système, si la mémoire est disponible41,42,43.
La précision de la dynamique prédite entre les composants du système est directement influencée par le FF choisi pour la propagation de la trajectoire. Les efforts empiriques de paramétrisation de la FF sont poursuivis par quelques groupes de recherche. Les FF les plus établis et les plus courants pour la DM sont CHARMM39, AMBER 40, Martini44, OPLS 45 et SIRAH 46. Le champ de force47 de l’additif CHARMM36 tous les atomes (C36) est largement utilisé pour la MD AA des systèmes membranaires car il reproduit avec précision les données structurelles expérimentales. Il a été développé à l’origine par la communauté CHARMM, et il est compatible avec plusieurs moteurs MD comme GROMACS et NAMD. Malgré les améliorations apportées aux FF courants, il y a un effort continu pour améliorer les ensembles de paramètres afin de permettre des prédictions qui reproduisent fidèlement les observables expérimentales, motivées par l’intérêt pour des systèmes d’étude particuliers48,49.
L’un des défis de la simulation des membranes lipidiques est de déterminer la longueur de la trajectoire de simulation. Cela dépend en grande partie des métriques à analyser et du processus que l’on cherche à caractériser. En règle générale, les mélanges lipidiques complexes nécessitent plus de temps pour atteindre l’équilibre, car un plus grand nombre d’espèces doivent avoir suffisamment de temps pour diffuser sur le plan membranaire et atteindre une organisation latérale stable. On dit d’une simulation qu’elle est à l’équilibre lorsque la propriété d’intérêt a atteint un plateau et fluctue autour d’une valeur constante. Il est courant d’obtenir au moins 100 à 200 ns de trajectoire équilibrée pour effectuer une analyse statistique appropriée sur les propriétés et les interactions d’intérêt. Il est courant d’effectuer des simulations membranaires uniquement entre 200 et 500 ns, en fonction de la complexité du mélange lipidique et de la question de recherche. Les interactions protéine-lipide nécessitent généralement des temps de simulation plus longs, entre 500 et 2000 ns. Voici quelques approches permettant d’accélérer l’échantillonnage et la dynamique observable avec les systèmes membranaires : (i) le modèle mimétique membranaire hautement mobile (HMMM), qui remplace les carbones finaux des lipides dans la membrane par un solvant organique pour accélérer l’échantillonnage50 ; et (ii) le repartitionnement de la masse de l’hydrogène (HMR), qui combine une fraction des masses d’atomes lourds au sein d’un système avec celles des atomes d’hydrogène pour permettre l’utilisation d’un pas de temps de simulation plus grand51.
Le protocole suivant traite d’une approche conviviale pour les débutants afin de créer, d’exécuter et d’analyser des modèles de membrane réalistes à l’aide d’AA MD. Compte tenu de la nature des simulations de DM, plusieurs trajectoires doivent être exécutées pour tenir compte de la reproductibilité et de l’analyse statistique appropriée des résultats. Il est d’usage d’exécuter au moins trois réplicas par système d’intérêt. Une fois que les espèces lipidiques ont été sélectionnées pour l’organisme et le processus d’intérêt, les étapes de base pour construire, exécuter et analyser une trajectoire de simulation d’un système membranaire seul sont décrites et résumées dans la figure 2.
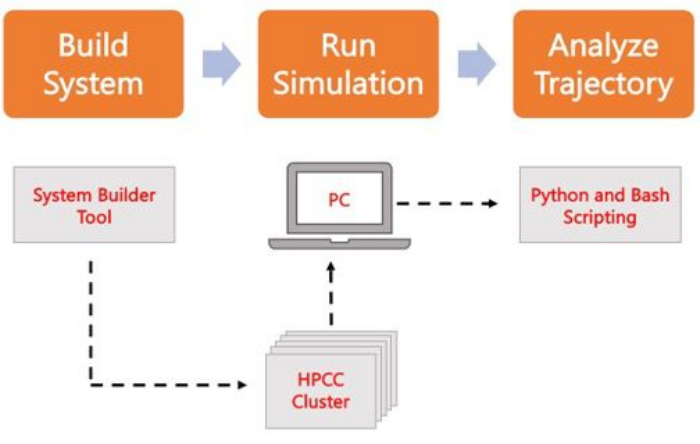
Graphique 2. Schéma permettant d’exécuter des simulations MD. Les cases orange correspondent aux trois étapes principales décrites dans le protocole. En dessous se trouve le flux de travail du processus de simulation. Lors de la configuration du système, le système contenant les coordonnées initiales d’un système à membrane solvatée est construit à l’aide d’un générateur d’entrée système tel que CHARMM-GUI Membrane Builder. Après avoir transféré les fichiers d’entrée vers un cluster de calcul haute performance, la trajectoire de simulation est propagée à l’aide d’un moteur MD, tel que GROMACS. L’analyse de trajectoire peut être effectuée sur le cluster informatique ou sur un poste de travail local avec visualisation. L’analyse est ensuite effectuée, soit à l’aide de packages avec du code d’analyse intégré tels que GROMACS et VMD, soit à l’aide de scripts Bash ou de diverses bibliothèques Python. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Construire les coordonnées du système
- Accédez à CHARMM-GUI.org (C-GUI) à l’aide d’un navigateur Web. Dans le menu supérieur, accédez à Générateur d’entrées, puis sélectionnez Membrane Builder dans les options verticales sur le côté gauche de l’écran.
- Pour créer un bicalque, sélectionnez Générateur de bicalques.
REMARQUE : Les nouveaux utilisateurs doivent activer leur compte gratuit avant de créer leur premier ensemble de coordonnées. - Sélectionnez Système à membrane uniquement. Enregistrez l’ID de JOB généré pour récupérer le système et reprendre là où vous vous êtes arrêté pendant le processus si nécessaire.
- Visualisez les systèmes à chaque étape du processus de construction en cliquant sur Afficher la structure dans la zone située en haut de la page, ou en téléchargeant le fichier PDB résultant. Recherchez les composants manquants, les erreurs dans l’espèce lipidique d’entrée sélectionnée ou la taille du patch.
- Sélectionnez les composants du système.
- Choisissez l’option Lipide hétérogène , même si vous construisez une bicouche à un seul composant ; puis sélectionnez un type de boîte rectangulaire .
- Sélectionnez 45 molécules d’eau par lipide pour l’option d’hydratation ; C’est suffisant pour assurer une bicouche complètement hydratée.
- Définissez la longueur de XY en fonction du nombre de composants lipidiques. Ensuite, sélectionnez le nombre de lipides à inclure pour chaque espèce lipidique déterminé en amont du modèle. Pour l’étude de cas discutée dans la section suivante, un modèle membranaire avec 600 lipides répartis symétriquement dans deux feuillets a été construit. Pour modéliser le RE des cellules eucaryotes, un mélange de 336 lipides DOPC, 132 DPPE, 60 CHOL, 72 POPI a été utilisé pour le modèle PI ; et 330 lipides DOPC, 126 DPPE, 54 CHOL, 66 POPI et 24 DOPS pour le modèle PI-PS.
REMARQUE : C-GUI fournit une bibliothèque de structures lipidiques parmi lesquelles choisir ; Cliquez sur les images à côté du nom de l’espèce pour connaître sa structure chimique. - Tapez le nombre souhaité de molécules dans la foliole supérieure et inférieure dans les deux cases à côté du nom du lipide. Pour l’étude de cas, une composition membranaire symétrique est souhaitée - assurez-vous qu’il n’y a pas d’erreurs sur le nombre inégalé de lipides dans la foliole supérieure et la foliole inférieure. Si une asymétrie est souhaitée, assurez-vous que le nombre total de lipides dans chaque feuillet est correct. Pour plus de détails sur la construction de bicouches asymétriques, reportez-vous aux travaux de Park et al.52,53.
- Allez en haut de la liste des espèces lipidiques et cliquez sur le bouton Afficher les informations système. Assemblez les composants et complétez le système.
- Sélectionnez l’option permettant d’inclure des ions neutralisants à l’aide de l’algorithme basé sur la distance pour une convergence plus rapide54.
- Laisser la concentration par défaut de la solution de KCl à 0,15 mM. Il s’agit d’une concentration de sel typique pour rendre neutre la boîte de simulation pour les bicouches membranaires.
REMARQUE : Si une concentration différente doit être utilisée, assurez-vous de cliquer sur le bouton Calculer la composition du solvant après l’avoir modifié.
- Sélectionnez les conditions et les paramètres de simulation.
- Sélectionnez CHARMM36m comme option FF ; Il est couramment utilisé pour les simulations de lipides et de protéines, mais l’utilisateur peut sélectionner d’autres options discutées dans l’introduction.
- Sélectionnez GROMACS comme moteur MD pour obtenir des exemples de fichiers d’entrée dans le format correspondant.
REMARQUE : GROMACS est recommandé pour les nouveaux utilisateurs car il dispose de plusieurs ressources en ligne, tutoriels et forums d’assistance. L’utilisateur peut choisir parmi plusieurs moteurs MD pour explorer les options en termes de performances de simulation et de syntaxe du code. - Sélectionnez l’ensemble Particule-Pression-Température (NPT), de loin l’ensemble dynamique le plus utilisé dans la simulation des bicouches lipidiques.
- Réglez la température et la pression en Kelvin et en bars sur 303 K et 1 bar, respectivement. Il est typique de régler la température entre 298 K et 310 K pour l’étude des processus biologiques afin d’assurer une bicouche à l’état de désordre liquide.
REMARQUE : La température dépend des conditions du processus à simuler et peut être modifiée si nécessaire. En fonction de l’espèce lipidique dans le modèle, définissez la température au-dessus de la température de transition des composants lipidiques purs avant d’exécuter la simulation.
- Téléchargez les fichiers résultants et transférez-les vers le cluster d’ordinateurs.
- Visualisez le système final sur un logiciel de votre choix, tel que VMD ou PyMol, et vérifiez qu’il est correctement configuré.
REMARQUE : Il est bon de vérifier, par exemple, qu’il y a suffisamment d’eau autour de la membrane pour que les lipides n’interagissent pas avec les atomes de l’image pendant la simulation, et une configuration correcte du feuillet (une bicouche sans espace ni eau entre les deux).
- Visualisez le système final sur un logiciel de votre choix, tel que VMD ou PyMol, et vérifiez qu’il est correctement configuré.
2. Exécution de simulations MD
- Téléchargez et décompressez les fichiers de C-GUI sur votre cluster informatique. Accédez au répertoire Gromacs . Créez un script de soumission de relaxation.
- Suivez les instructions du cluster pour le format d’un script de soumission.
- Copiez les commandes répertoriées jusqu’à ce qu’elles se trouvent juste au-dessus du commentaire # Production dans le fichier README dans le script de soumission.
REMARQUE : Cette valeur par défaut de C-GUI est une boucle qui exécute une relaxation en 6 étapes du système. Si vous souhaitez un protocole différent et bien établi, modifiez-le pour lire les coordonnées qui viennent d’être construites et téléchargées à partir de C-GUI.
- Copiez les commandes répertoriées jusqu’à ce qu’elles se trouvent juste au-dessus du commentaire # Production dans le fichier README dans le script de soumission.
- Envoyez le script de relaxation et vérifiez que tous les fichiers de sortie ont été téléchargés pour toutes les étapes avant de passer à l’exécution de production. Une fois l’opération terminée, recherchez les fichiers de sortie suivants de GROMACS, générés au cours de l’exécution en 6 étapes : *.log, *.tpr, *.gro, *.edr, *.trr / *.xtc
- Créez un script d’exécution de production.
- Utilisez l’un des exemples de commandes gmx grompp et gmx mdrun de l’une des étapes de relaxation comme modèle.
- Avant d’utiliser le script, assurez-vous de créer un fichier *.mdp contenant des options de simulation similaires à celles du fichier step7_production.mdp fourni.
REMARQUE : Les options par défaut fournies sont standard pour les simulations de membranes ; Les durées sont indiquées en nm et le temps est donné en picosecondes ou nombre de pas (picosecondes / pas de temps d’intégration). Mettez à jour les nsteps pour qu’ils s’exécutent jusqu’à la longueur de simulation souhaitée (cela est égal à dt * nsteps) et nst[x,v,f]out pour mettre à jour la fréquence d’enregistrement des données en nombre d’étapes d’intégration. Pour l’étude de cas, définissez nsteps sur 250 000 000 pour une longueur de simulation de 500 ns (temps de simulation / pas d’intégration = 500 000 ps / 0,002 ps), et nst[x,v,f]out sur 50 000 pour enregistrer les données toutes les 100 ps
- Avant d’exécuter la simulation proprement dite, exécutez des études de référence pour déterminer la meilleure utilisation des ressources.
- Exécutez le système pendant 1 à 2 ns en utilisant un nombre différent de nœuds de calcul.
REMARQUE : L’étude de cas ER a été soumise sur le cluster de calcul haute performance55 du centre de recherche computationnelle (CCR) de l’UB pour 2 ns, où les performances ont été testées pour 1 à 10 nœuds. - Comparez les performances en ns/jour pour chaque paramètre afin de déterminer les ressources optimales pour l’exécution. Il est courant de sélectionner le nombre de nœuds qui permettent d’obtenir 75 à 80 % des performances maximales.
- Exécutez le système pendant 1 à 2 ns en utilisant un nombre différent de nœuds de calcul.
- Exécutez le cycle de production.
- Exécutez chaque système en trois exemplaires pour assurer la reproductibilité et effectuez une analyse statistique des données.
- Prolongez la trajectoire en fonction des benchmarks si le temps d’attente autorisé pour la soumission sur le cluster de calcul est écoulé. Utilisez les commandes gmx convert-tpr, puis gmx mdrun pour continuer la collecte de trajectoires.
REMARQUE : Les options sont décrites dans la documentation GROMACS en ligne (https://manual.gromacs.org/). - Dans le cas d’un système membranaire uniquement, vérifiez si le système a atteint l’équilibre en calculant l’aire par lipide au fil du temps. Si ce n’est pas le cas, prolongez la trajectoire de simulation.
3. Analyse de la trajectoire
- Visualisez le système avant d’effectuer l’analyse pour déterminer les molécules d’intérêt et la partie de la trajectoire destinée à la caractérisation.
- Compressez les fichiers de trajectoire bruts (*.trr) en changeant le format de fichier en *.xtc et/ou en sautant des images pour réduire la taille du fichier et faciliter un transfert plus efficace vers la station locale pour la visualisation et l’analyse.
REMARQUE : Pour les grands systèmes à membrane, on peut choisir de retirer l’eau de la trajectoire pour réduire davantage la taille du fichier. Cela peut être fait avec des fichiers d’index sur GROMACS, des scripts TCL sur VMD ou des bibliothèques Python telles que MDAnalysis et MDTraj. - Effectuez les analyses choisies pendant la partie équilibrée de la trajectoire, telle que déterminée à partir de la série chronologique de surface par lipide.
REMARQUE : Reportez-vous à la discussion pour plus de détails sur les analyses membranaires typiques et sur la façon de les exécuter.
Access restricted. Please log in or start a trial to view this content.
Résultats
Pour illustrer l’utilisation du protocole et les résultats qui peuvent être obtenus, une étude comparative pour des modèles membranaires pour le réticulum endoplasmique (RE) est discutée. Les deux modèles de cette étude étaient (i) le modèle PI, qui contient les quatre principales espèces lipidiques trouvées dans le RE, et (ii) le modèle PI-PS, qui a ajouté les espèces lipidiques anioniques phosphatidylsérine (PS). Ces modèles ont ensuite été utilisés dans une étude d’une protéine virale et de l...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les techniques expérimentales permettent de visualiser les biomolécules à haute résolution à l’aide de la cryo-microscopie électronique (cryo-EM)58, des techniques de fluorescence et de la microscopie à force atomique (AFM)59. Cependant, il est difficile de saisir l’interaction et la dynamique des interactions moléculaires qui sous-tendent les voies biologiques, la pathogenèse de la maladie et l’administration thérapeutique au niveau atomique ou des acides a...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts divergents à divulguer.
Remerciements
Les auteurs remercient Jinhui Li et Ricardo X. Ramirez pour leurs trajectoires de simulation et leurs discussions lors de la rédaction de ce manuscrit. O.C. a bénéficié du soutien de la bourse présidentielle de l’Université de Buffalo et de la subvention de formation 1T32GM144920-01 de l’Initiative for Maximizing Student Development de l’Institut national de la santé, attribuée à Margarita L. Dubocovich (PI).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Anaconda3 | Anaconda Inc (Python & related libraries) | N/A | |
| CHARMM-GUI.org | Im lab, Lehigh University | N/A | |
| GROMACS | GROMACS development team | N/A | |
| Linux HPC Cluster | UB CCR | N/A | |
| MATLAB | MathWorks | N/A | |
| VMD | Theoretical and Computational Biophysics Group | N/A |
Références
- Vanni, S., Riccardi, L., Palermo, G., De Vivo, M. Structure and Dynamics of the Acyl Chains in the Membrane Trafficking and Enzymatic Processing of Lipids. Accounts of Chemical Research. 52 (11), 3087-3096 (2019).
- Harayama, T., Riezman, H. Understanding the diversity of membrane lipid composition. Nature Reviews Molecular Cell Biology. 19 (5), 281-296 (2018).
- Tanaka, M. Comprehensive Biophysics. Edward, H. . E. gelman , Elsevier. 261-272 (2012).
- Bruce Alberts, A. J., Julian Lewis,, Martin Raff,, Keith Roberts,, Peter Walter, Molecular Biology of the Cell. , Garland Science. (2002).
- Watson, H. Biological membranes. Essays in Biochemistry. 59, 43-69 (2015).
- Coskun, Ü, Simons, K. Cell Membranes: The Lipid Perspective. Structure. 19 (11), 1543-1548 (2011).
- Biobased Surfactants (Second Edition) eds. Douglas G, H. ayes, Daniel, K. Y., Solaiman,, Richard, D. , AOCS Press. 515-529 (2019).
- González-Rubio, P., Gautier, R., Etchebest, C., Fuchs, P. F. J. Amphipathic-Lipid-Packing-Sensor interactions with lipids assessed by atomistic molecular dynamics. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1808, 2119-2127 (2011).
- Halbleib, K., et al. Activation of the Unfolded Protein Response by Lipid Bilayer Stress. Molecular Cell. 67, 673-684 (2017).
- Andreasen, M., Lorenzen, N., Otzen, D. Interactions between misfolded protein oligomers and membranes: A central topic in neurodegenerative diseases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1848 (9), 1897-1907 (2015).
- Calianese, D. C., Birge, R. B. Biology of phosphatidylserine (PS): basic physiology and implications in immunology, infectious disease, and cancer. Cell Commununication and Signaling. 18 (1), 41(2020).
- Nieto-Garai, J. A., Contreras, F. X., Arboleya, A., Lorizate, M. Role of Protein-Lipid Interactions in Viral Entry. Advanced Biology. 6, 2101264(2022).
- Mazzon, M., Mercer, J. Lipid interactions during virus entry and infection. Cell Microbiology. 16, 1493-1502 (2014).
- Colombelli, C., Aoun, M., Tiranti, V. Defective lipid metabolism in neurodegeneration with brain iron accumulation (NBIA) syndromes: not only a matter of iron. Journal of Inherited Metabolic Disease. 38 (1), 123-136 (2015).
- Saini-Chohan, H. K., Mitchell, R. W., Vaz, F. M., Zelinski, T., Hatch, G. M. Delineating the role of alterations in lipid metabolism to the pathogenesis of inherited skeletal and cardiac muscle disorders: Thematic Review Series: Genetics of Human Lipid Diseases. Journal of Lipid Research. 53 (1), 4-27 (2012).
- Martinotti, C., Ruiz-Perez, L., Deplazes, E., Mancera, R. L. Molecular Dynamics Simulation of Small Molecules Interacting with Biological Membranes. ChemPhysChem. 21 (14), 1486-1514 (2020).
- Li, J., Kalyanram, P., Rozati, S., Monje-Galvan, V., Gupta, A. Interaction of Cyanine-D112 with Binary Lipid Mixtures: Molecular Dynamics Simulation and Differential Scanning Calorimetry Study. ACS Omega. 7 (11), 9765-9774 (2022).
- Nagy, L., et al. Protein/Lipid Interaction in the Bacterial Photosynthetic Reaction Center: Phosphatidylcholine and Phosphatidylglycerol Modify the Free Energy Levels of the Quinones. Biochemistry. 43 (40), 12913-12923 (2004).
- Ramirez, R. X., Campbell, O., Pradhan, A. J., Atilla-Gokcumen, G. E., Monje-Galvan, V. Modeling the molecular fingerprint of protein-lipid interactions of MLKL on complex bilayers. Frontiers in Chemistry. 10, (2023).
- Dondelinger, Y., et al. MLKL Compromises Plasma Membrane Integrity by Binding to Phosphatidylinositol Phosphates. Cell Reports. 7 (4), 971-981 (2014).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature Reviews Molecular Cell Biology. 9 (2), 112-124 (2008).
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5(2011).
- Lee, H. R., Lee, G. Y., You, D. G., Kim, H. K., Young, D. Y. Hepatitis C virus p7 induces membrane permeabilization by interacting with phosphatidylserine. International Journal of Molecular Sciences. 21 (3), 897(2020).
- Casares, D., Escribá, P. V., Rosselló, C. A. Membrane Lipid Composition: Effect on Membrane and Organelle Structure, Function and Compartmentalization and Therapeutic Avenues. International Journal of Molecular Sciences. 20 (9), 2167(2019).
- Marrink, S. J., et al. Computational Modeling of Realistic Cell Membranes. Chemical Reviews. 119 (9), 6184-6226 (2019).
- Janmey, P. A., Kinnunen, P. K. J. Biophysical properties of lipids and dynamic membranes. Trends in Cell Biology. 16 (10), 538-546 (2006).
- Brémaud, E., Favard, C., Muriaux, D. Deciphering the Assembly of Enveloped Viruses Using Model Lipid Membranes. Membranes. 12, 441(2022).
- Campbell, O., Monje-Galvan, V. Protein-driven membrane remodeling: Molecular perspectives from Flaviviridae infections. Biophysical Journal. 122 (11), 1890-1899 (2022).
- Loschwitz, J., Olubiyi, O. O., Hub, J. S., Strodel, B., Poojari, C. S. Computer simulations of protein-membrane systems. Progress in molecular biology and translational science. 170, 273-403 (2020).
- Shell, M. S. Thermodynamics and Statistical Mechanics: An Integrated ApproachCambridge Series in Chemical Engineering. Scott Shell, M. , Cambridge University Press. 21-49 (2015).
- Yang, J., et al. Molecular Dynamic Simulation of Ni-Al Alloy-H2O Reactions Using the ReaxFF Reactive Force Field. ACS Omega. 8 (11), 9807-9814 (2023).
- Ingólfsson, H. I., Arnarez, C., Periole, X., Marrink, S. J. Computational 'microscopy' of cellular membranes. Journal of Cell Science. 129 (2), 257-268 (2016).
- Klauda, J. B. Perspective: Computational modeling of accurate cellular membranes with molecular resolution. The Journal of Chemical Physics. 149 (22), 220901(2018).
- Chavent, M., Duncan, A. L., Sansom, M. S. P. Molecular dynamics simulations of membrane proteins and their interactions: from nanoscale to mesoscale. Current Opinion in Structural Biology. 40, 8-16 (2016).
- Khakbaz, P., Monje-Galvan, V., Zhuang, X., Klauda, J. B. Biogenesis of Fatty Acids, Lipids and Membranes. Otto Geiger, , Springer International Publishing. 1-19 (2017).
- Abraham, M. J., et al. GROMACS: High performance molecular simulations through multi-level parallelism from laptops to supercomputers. SoftwareX. 1, 19-25 (2015).
- Lemkul, J. A. From Proteins to Perturbed Hamiltonians: A Suite of Tutorials for the GROMACS-2018 Molecular Simulation Package. Living Journal of Computational Molecular Science. 1 (1), 5068(2018).
- Phillips, J. C., et al. Scalable molecular dynamics on CPU and GPU architectures with NAMD. The Journal of Chemical Physics. 153 (4), 044130(2020).
- Klauda, J. B., et al. Update of the CHARMM All-Atom Additive Force Field for Lipids: Validation on Six Lipid Types. The Journal of Physical Chemistry B. 114 (23), 7830-7843 (2010).
- Wang, J., Wolf, R. M., Caldwell, J. W., Kollman, P. A., Case, D. A. Development and testing of a general amber force field. Journal of Computational Chemistry. 25 (9), 1157-1174 (2004).
- John Stone, A. A., et al. Using VMD. , http://csbmb.beckman.illinois.edu/BIOP586C/vmd-tutorial-2011.pdf (2011).
- Humphrey, W., Dalke, A., Schulten, K. VMD: Visual molecular dynamics. Journal of Molecular Graphics. 14 (1), 33-38 (1996).
- Hsin, J., Arkhipov, A., Yin, Y., Stone, J. E., Schulten, K. Using VMD: An Introductory Tutorial. Current Protocols in Bioinformatics. 24 (1), 5.7.1-5.7.48 (2008).
- Souza, P. C. T., et al. Martini 3: a general purpose force field for coarse-grained molecular dynamics. Nature Methods. 18 (4), 382-388 (2021).
- Jorgensen, W. L., Maxwell, D. S., Tirado-Rives, J. Development and Testing of the OPLS All-Atom Force Field on Conformational Energetics and Properties of Organic Liquids. Journal of the American Chemical Society. 118 (45), 11225-11236 (1996).
- Machado, M. R., et al. The SIRAH 2.0 Force Field: Altius, Fortius, Citius. Journal of Chemical Theory and Computation. 15 (4), 2719-2733 (2019).
- Huang, J., et al. CHARMM36m: an improved force field for folded and intrinsically disordered proteins. Nature Methods. 14 (1), 71-73 (2017).
- Mu, J., Liu, H., Zhang, J., Luo, R., Chen, H. F. Recent Force Field Strategies for Intrinsically Disordered Proteins. Journal of Chemical Information and Modeling. 61 (3), 1037-1047 (2021).
- Inakollu, V. S. S., Geerke, D. P., Rowley, C. N., Yu, H. Polarisable force fields: what do they add in biomolecular simulations. Current Opinion in Structural Biology. 61, 182-190 (2020).
- Ohkubo, Y. Z., et al. Accelerating Membrane Insertion of Peripheral Proteins with a Novel Membrane Mimetic Model. Biophysical Journal. 102 (9), 2130-2139 (2012).
- Hopkins, C. W., Le Grand, S., Walker, R. C., Roitberg, A. E. Long-Time-Step Molecular Dynamics through Hydrogen Mass Repartitioning. Journal of Chemical Theory and Computation. 11 (4), 1864-1874 (2015).
- Park, S., Beaven, A. H., Klauda, J. B., Im, W. How Tolerant are Membrane Simulations with Mismatch in Area per Lipid between Leaflets. Journal of Chemical Theory and Computation. 11 (7), 3466-3477 (2015).
- Park, S., Im, W., Pastor, R. W. Developing initial conditions for simulations of asymmetric membranes: a practical recommendation. Biophysical Journal. 120 (22), 5041-5059 (2021).
- Wu, E. L., et al. CHARMM-GUI Membrane Builder toward realistic biological membrane simulations. Journal of Computational Chemistry. 35 (27), 1997-2004 (2014).
- Center for Computational Research, U.a.B.. CCR Facility Description. , https://ubir.buffalo.edu/xmlui/handle/10477/79221 (2019).
- Piggot, T. J., Allison, J. R., Sessions, R. B., Essex, J. W. On the Calculation of Acyl Chain Order Parameters from Lipid Simulations. Journal of Chemical Theory and Computation. 13 (11), 5683-5696 (2017).
- Li, J., Monje-Galvan, V. Effect of Glycone Diversity on the Interaction of Triterpenoid Saponins and Lipid Bilayers. ACS Applied Bio Materials. , (2023).
- Renaud, J. P., et al. Cryo-EM in drug discovery: achievements, limitations and prospects. Nature Reviews Drug Discovery. 17 (7), 471-492 (2018).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Martínez, L., Andrade, R., Birgin, E. G., Martínez, J. M. PACKMOL: A package for building initial configurations for molecular dynamics simulations. Journal of Computational Chemistry. 30 (13), 2157-2164 (2009).
- Jewett, A. I., et al. Moltemplate: A Tool for Coarse-Grained Modeling of Complex Biological Matter and Soft Condensed Matter Physics. Journal of Molecular Biology. 433 (11), 166841(2021).
- Jo, S., Kim, T., Iyer, V. G., Im, W. CHARMM-GUI: A web-based graphical user interface for CHARMM. Journal of Computational Chemistry. 29 (11), 1859-1865 (2008).
- Polêto, M. D., Lemkul, J. A. Integration of experimental data and use of automated fitting methods in developing protein force fields. Communications Chemistry. 5 (1), 38(2022).
- Hynninen, A. P., Crowley, M. F. New faster CHARMM molecular dynamics engine. Journal of Computational Chemistry. 35 (5), 406-413 (2014).
- Kim, S. Issues on the Choice of a Proper Time Step in Molecular Dynamics. Physics Procedia. 53, 60-62 (2014).
- Grubmüller, H., Heller, H., Windemuth, A., Schulten, K. Generalized Verlet Algorithm for Efficient Molecular Dynamics Simulations with Long-range Interactions. Molecular Simulation. 6 (1-3), 121-142 (1991).
- Darden, T., York, D., Pedersen, L. Particle mesh Ewald: An N·log(N) method for Ewald sums in large systems. Journal of Chemical Physics. 98 (12), 10089-10092 (1993).
- Hepatitis C. , https://www.who.int/news-room/fact-sheets/detail/hepatitis-c (2021).
- Braun, E., et al. Best Practices for Foundations in Molecular Simulations [Article v1.0]. Living Journal of Computational Molecular Science. 1 (1), 5957(2018).
- Moradi, S., Nowroozi, A., Shahlaei, M. Shedding light on the structural properties of lipid bilayers using molecular dynamics simulation: a review study. RSC Advances. 9 (8), 4644-4658 (2019).
- Monje-Galvan, V., Klauda, J. B. Modeling Yeast Organelle Membranes and How Lipid Diversity Influences Bilayer Properties. Biochemistry. 54 (45), 6852-6861 (2015).
- Michaud-Agrawal, N., Denning, E. J., Woolf, T. B., Beckstein, O. MDAnalysis: A toolkit for the analysis of molecular dynamics simulations. Journal of Computational Chemistry. 32 (10), 2319-2327 (2011).
- Gowers, R., et al. MDAnalysis: A Python Package for the Rapid Analysis of Molecular Dynamics Simulations. SciPy. , (2016).
- McGibbon, R. obert T., et al. MDTraj: A Modern Open Library for the Analysis of Molecular Dynamics Trajectories. Biophysical Journal. 109 (8), 1528-1532 (2015).
- Fortunato, M. E., Colina, C. M. pysimm: A python package for simulation of molecular systems. SoftwareX. 6, 7-12 (2017).
- Scherer, M. K., et al. PyEMMA 2: A Software Package for Estimation, Validation, and Analysis of Markov Models. Journal of Chemical Theory and Computation. 11 (11), 5525-5542 (2015).
- Song, W., et al. PyLipID: A Python Package for Analysis of Protein-Lipid Interactions from Molecular Dynamics Simulations. Journal of Chemical Theory and Computation. 18 (2), 1188-1201 (2022).
- Monje-Galvan, V., Klauda, J. B. Peripheral membrane proteins: Tying the knot between experiment and computation. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858 (7, Part B), 1584-1593 (2016).
- Monje-Galvan, V., Voth, G. A. Binding mechanism of the matrix domain of HIV-1 gag on lipid membranes. eLife. 9, e58621(2020).
- Wang, B., Guo, C. Concentration-Dependent Effects of Cholesterol on the Dimerization of Amyloid-β Peptides in Lipid Bilayers. ACS Chemical Neuroscience. 13 (18), 2709-2718 (2022).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon