Method Article
Kryo-Elektronenmikroskopie-Screening-Automatisierung über mehrere Gitter hinweg mit Smart Leginon
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das Multi-Grid-Screening der Kryo-Elektronenmikroskopie (KryoEM) ist oft ein langwieriger Prozess, der stundenlange Aufmerksamkeit erfordert. Dieses Protokoll zeigt, wie Sie eine Standard-Leginon-Sammlung und Smart Leginon Autoscreen einrichten, um diesen Prozess zu automatisieren. Dieses Protokoll kann auf die meisten KryoEM-Löchrigfoliengitter angewendet werden.
Zusammenfassung
Fortschritte in der Kryo-Elektronenmikroskopie (KryoEM) in den letzten zehn Jahren haben es Strukturbiologen ermöglicht, makromolekulare Proteinkomplexe routinemäßig mit nahezu atomarer Auflösung aufzulösen. Der allgemeine Arbeitsablauf der gesamten KryoEM-Pipeline umfasst die Iteration zwischen Probenvorbereitung, KryoEM-Gittervorbereitung und Proben-/Raster-Screening, bevor zur hochauflösenden Datenerfassung übergegangen wird. Die Iteration zwischen Proben-/Gittervorbereitung und Screening ist in der Regel ein großer Engpass für Forscher, da jedes iterative Experiment unter anderem für Probenkonzentration, Pufferbedingungen, Gittermaterial, Gitterlochgröße, Eisdicke und Proteinpartikelverhalten im Eis optimiert werden muss. Sobald diese Variablen zufriedenstellend bestimmt sind, variieren Gitter, die unter identischen Bedingungen erstellt wurden, stark darin, ob sie für die Datenerhebung bereit sind, so dass zusätzliche Screening-Sitzungen vor der Auswahl optimaler Gitter für die hochauflösende Datenerfassung empfohlen werden. Dieser Proben-/Gittervorbereitungs- und Screening-Prozess nimmt oft mehrere Dutzend Gitter und Tage Bedienerzeit am Mikroskop in Anspruch. Darüber hinaus ist der Screening-Prozess auf die Verfügbarkeit des Bedieners/Mikroskops und die Zugänglichkeit des Mikroskops beschränkt. Hier zeigen wir, wie Sie Leginon und Smart Leginon Autoscreen verwenden, um den Großteil des KryoEM-Gitterscreenings zu automatisieren. Autoscreen kombiniert maschinelles Lernen, Computer-Vision-Algorithmen und Algorithmen zur Handhabung von Mikroskopen, um die Notwendigkeit ständiger manueller Bedienereingaben zu beseitigen. Autoscreen kann Raster mit Multiskalen-Bildgebung mithilfe eines automatisierten Probenwechselkassettensystems autonom laden und abbilden, was zu einem unbeaufsichtigten Rasterraster für eine gesamte Kassette führt. Infolgedessen kann die Bedienerzeit für das Screening von 12 Rastern mit Autoscreen auf ~10 Minuten reduziert werden, verglichen mit ~6 Stunden mit früheren Methoden, die durch ihre Unfähigkeit, eine hohe Variabilität zwischen den Rastern zu berücksichtigen, behindert werden. Dieses Protokoll führt zunächst in die grundlegende Einrichtung und Funktionalität von Leginon ein und demonstriert dann Schritt für Schritt die Autoscreen-Funktionalität von der Erstellung einer Vorlagensitzung bis zum Ende einer automatisierten Screening-Sitzung mit 12 Rastern.
Einleitung
Die Einzelpartikel-Kryo-Elektronenmikroskopie (KryoEM) ermöglicht die Strukturbestimmung von gereinigten makromolekularen Komplexen mit nahezu atomarer Auflösung. Ein Einzelpartikel-KryoEM-Experiment erfordert nur ein oder zwei gut ausgewählte Gitter, die aus einem viel größeren Satz von Gittern mit unterschiedlichen Proben- und Gitterbedingungen ausgewählt werden. Das Mikroskop-Screening zur Untersuchung dieser Gitter beinhaltet die Abbildung jedes Gitters in mehreren Vergrößerungen, um festzustellen, welches Gitter die wichtigsten Anforderungen für eine hochauflösende Datenerfassung erfüllt, einschließlich Eisdicke, ausreichende Flächen für die vollständige Datenerfassung, Proteinreinheit, Proteinkonzentration, Proteinstabilität und minimale Probleme bei der bevorzugten Orientierung1. Die Optimierung für diese Schlüsselanforderungen beinhaltet oft eine Rückkopplung zwischen dem Screening am Mikroskop und den Präparationsbedingungen wie Proteinproduktion, Pufferauswahl, potenziellen Detergenzien und Gittertyp 2,3,4 (Abbildung 1). Das konventionelle Rasterscreening wird manuell oder halbmanuell mit Software wie Leginon5, SerialEM6 und EPU7 durchgeführt. Beim herkömmlichen Screening muss der Mikroskopbediener Stunden am Mikroskop verbringen, um mehrere Raster zu screenen, was einen erheblichen Engpass im hochauflösenden Einzelpartikel-Workflow darstellt, da der Bediener eher mit Routinevorgängen als mit Proben-/Rasteroptimierung beschäftigt wird.
Zuvor wurden Smart Leginon Autoscreen und die zugrunde liegende maschinelle Lernsoftware Ptolemy vorgestellt und ihre zugrunde liegenden Methoden und Algorithmen zusammen mit Beispielen beschrieben 8,9. Mehrere andere Softwarepakete sind entweder in der Lage, ein vollautomatisches Multi-Grid-Screening10 durchzuführen oder darauf hinzuarbeiten, darunter SmartScope11, Smart EPU12 und CryoRL13,14. Um den Screening-Engpass zu beheben, ermöglicht Smart Leginon dem Benutzer, zunächst Screening-Parameter in einer Vorlagenmikroskopsitzung einzurichten und dann die Parameter dieser Vorlagensitzung als Vorlage zu verwenden, um die gesamte Kassette mit Rastern im Mikroskop-Autoloader zu screenen. Alle manuellen Arbeiten während der Kassettensiebung entfallen, wodurch die Optimierungsrückkopplungsschleife deutlich effizienter ablaufen kann.
In diesem Protokoll wird der vollständige Smart Leginon Autoscreen-Workflow beschrieben, so dass das Lesegerät ein vollautomatisches Multi-Grid-KryoEM-Screening unabhängig durchführen kann. Für diejenigen, die neu bei Leginon sind, beschreibt der erste Abschnitt des Protokolls die konventionelle Verwendung von Leginon. Dieses Wissen setzt sich aus mehrjähriger Erfahrung mit mehreren Autoloader-Mikroskopen zusammen, auf der dann im nachfolgenden Smart Leginon-Abschnitt des Protokolls aufgebaut wird. Weitere Tutorial-Videos finden Sie auf https://memc.nysbc.org.
Protokoll
Um diesem Protokoll zu folgen, das in Abbildung 2 dargestellt ist, muss Leginon 3.6+ auf dem Mikroskopcomputer und auf einer zusätzlichen Linux-Workstation installiert sein, und Ptolemy muss auf der Linux-Workstation installiert sein. Dieses Protokoll wurde über mehrere Jahre mit Thermo Fisher Scientific (TFS) Glacios- und Krios-Mikroskopen entwickelt. Dieses Protokoll geht davon aus, dass das Lesegerät bereits Leginon, Appion15, die zugehörige Datenbank, Mikroskopkalibrierungen konfiguriert, direkte Ausrichtungen am Mikroskop durchgeführt und zwei Leginon-Anwendungen eingerichtet hat: Eine für die Standard-Einzelpartikelsammlung und eine für die Einzelpartikelsammlung mit Ptolemäus. Informationen zum Aufbau von Leginon finden Sie hier: https://emg.nysbc.org/redmine/projects/leginon/wiki/Leginon_Manual. Informationen zur Gründung von Ptolemäus in Leginon finden Sie hier: https://emg.nysbc.org/redmine/projects/leginon/wiki/Multi-grid_autoscreening. Leginon von http://leginon.org und Ptolemäus von https://github.com/SMLC-NYSBC/ptolemy herunterladen. Leginon ist unter der Apache-Lizenz, Version 2.0, und Ptolemäus ist unter CC BY-NC 4.0 lizenziert.
1. Leginon Verwendung
- Leginon starten
- Schließen Sie auf dem Windows-Computer des Mikroskops alle Leginon-Clients und öffnen Sie sie erneut. Öffnen Sie in der Linux-Workstation ein Terminalfenster und geben Sie start-leginon.py oder den entsprechenden Alias des Systems zum Starten von Leginon ein.
- Wählen Sie im neuen Leginon-Setup-Fenster Neue Sitzung erstellen und klicken Sie auf Weiter.
- Wählen Sie das Projekt aus der Dropdown-Liste aus und klicken Sie auf Weiter.
- Lassen Sie den Namen unverändert, wählen Sie den richtigen Halter für die Mikroskopeinrichtung aus und klicken Sie auf Weiter.
- Geben Sie für die Beschreibung relevante Informationen wie den Namen des Mikroskops, die Raster-/Probenbeschreibung und die Beschreibung des Experiments ein und klicken Sie dann auf Weiter.
- Stellen Sie für das Image-Verzeichnis sicher, dass das entsprechende Dateisystem ausgewählt ist und dass der vollständige Pfad zum Speichern von Images geeignet ist, und klicken Sie dann auf Weiter.
- Klicken Sie unter Mit Clients verbinden auf Bearbeiten. Wählen Sie im Dropdown-Menü alle Computer aus, die verbunden werden sollen, klicken Sie auf die Schaltfläche + für jeden Computer und klicken Sie dann auf OK und Weiter.
- Geben Sie die richtige C2-Blendengröße ein und klicken Sie auf Weiter. Dieser Wert finden Sie auf der Registerkarte Blenden der TFS TUI-Software.
- Leginon Schnittstelle
- Wählen Sie in der Symbolleiste Anwendung aus, und klicken Sie auf Ausführen.
- Wählen Sie die richtige Anwendung aus dem Dropdown-Menü aus (klicken Sie bei Bedarf auf Alle anzeigen ). Stellen Sie main auf den Leginon-Computer und das Oszilloskop und die Kamera auf den jeweiligen Computer ein und klicken Sie dann auf Ausführen. Die linke Seite des Leginon-Hauptfensters wird mit Knoten gefüllt.
HINWEIS: Im linken Bereich werden alle Leginon-Knoten angezeigt. Die grünen Kamerasymbolknoten sind die Bilder, die gespeichert werden: Raster, Quadrat, Loch und Belichtung. Knoten mit dem Zielzeichen sind Bilder mit geringerer Vergrößerung, um die Bilder mit höherer Vergrößerung anzuvisieren. Die violetten Kameraknoten sind die Knoten, die so programmiert sind, dass sie euzentrische Z-Höhe und euzentrischen Fokus finden. Darüber hinaus gibt es Knoten zum Ausrichten des Null-Verlust-Peaks, zum Überwachen des Pufferzyklus, zum Überwachen der Flüssigstickstofffüllung, zum Sammeln von Verstärkungskorrekturbildern, zum Berechnen der Eisdicke (IceT) und zum Navigieren des Gitters durch verschiedene Vergrößerungen mithilfe von Tisch- und Bildverschiebung. - Preset-Manager
- Klicken Sie auf den Knoten Presets_Manager. Klicken Sie in diesem Knoten auf das untere Symbol zum Importieren von Voreinstellungen oder auf das Symbol darüber, um eine neue Voreinstellung aus dem aktuellen Zustand des Mikroskops zu erstellen.
- Wenn Sie auf das untere Symbol klicken, wird ein Fenster "Voreinstellungen importieren" geöffnet. Wählen Sie das richtige TEM und die richtige Digitalkamera aus, klicken Sie dann auf Suchen und wählen Sie die letzte Sitzung mit den gewünschten Voreinstellungen aus. Markieren Sie alle gewünschten Vorgaben und klicken Sie auf Importieren und dann auf Fertig.
HINWEIS: Der Knoten Vorgaben-Manager sollte jetzt alle importierten und erstellten Voreinstellungen auflisten. Es wird empfohlen, Voreinstellungen für verschiedene Vergrößerungen und Fokussierungen zu haben, einschließlich gr: Rastervergrößerung, sq: Rechteckvergrößerung, hln: Lochvergrößerung, Lüfter: Autofokus, fcn: Zentralfokus, enn: Belichtungsvergrößerung (nachgestelltes 'n' bezieht sich auf Nanosonde). Typische voreingestellte Parameter für jede Vergrößerung sind in Tabelle 1, Tabelle 2 und Tabelle 3 aufgeführt. Beachten Sie, dass dieses Protokoll eine C2-Blendengröße von 70 μm für den Glacios, 50 μm für den Krios mit einem Selectris X und Falcon 4i und 100 μm für den Krios mit einem BioQuantum mit einem K3 verwendet.
- Navigation und euzentrische Höhe
- Um sich mit der Steuerung des Mikroskops über Leginon vertraut zu machen und die Z-Höhe des Rasters einzustellen, gehen Sie zum Navigationsknoten, wählen Sie oben die gr-Voreinstellung aus und klicken Sie auf den roten Pfeil rechts, um die voreingestellten Einstellungen an das Mikroskop zu senden. Das Mikroskop sollte nach 1-2 s aktualisiert werden. Klicken Sie nach der Aktualisierung auf die Kameraschaltfläche rechts, um ein Bild aufzunehmen.
- Wählen Sie mit dem Cursor-Werkzeug ein Rasterquadrat aus, um die Bühne zu verschieben. Klicken Sie auf die Quadratvergrößerung und dann auf den roten Pfeil , um ihn an das Mikroskop zu senden, und klicken Sie auf die Kameraschaltfläche , um ein Bild aufzunehmen.
- Gehen Sie zum Z_Focus Knoten und klicken Sie oben in der Mitte der Schaltflächen auf die Schaltfläche Ziel simulieren . Wechseln Sie während der Aufnahme von Bildern für die Neigungsfokussierung der Bühne in die Korrelationsansicht und beobachten Sie den Peak, um sicherzustellen, dass er sich in der Ecke des Korrelationsbildes befindet. Stellen Sie nach Abschluss der Fokussierung sicher, dass die Bühne auf die Z-Höhe des Rasters eingestellt ist.
- Koma-Korrektur
HINWEIS: In diesem Unterabschnitt wird davon ausgegangen, dass bereits direkte Alignments durchgeführt wurden und dass keine Komakorrekturen durchgeführt wurden.- Navigieren Sie zu einem Bereich des Gitters, der klare Thon-Ringe erzeugt, z. B. Kohlenstoffsubstrat.
HINWEIS: Ein Kreuzgitter kann verwendet werden, wenn das Sammeln auf einem Goldgitter erfolgen soll. - Stellen Sie in den Beam_Tilt_Image Einstellungen sicher, dass die Presets-Reihenfolge nur fcn mit vier Neigungsrichtungen in einem Winkel von 0,005 Bogenmaß enthält.
- Klicken Sie auf Ziel simulieren , um ein Zemlin-Tableau zu erstellen. Klicken Sie auf der linken Seite des Hauptfensters auf Tableau , um das Tableau anzuzeigen.
- Korrigieren Sie das Koma, indem Sie die linke und rechte Fourier-Transformation miteinander und die obere und untere Fourier-Transformation miteinander vergleichen. Wenn die Bildpaare nicht identisch sind, klicken Sie zuerst auf das Cursorsymbol rechts neben den Bildanpassungen, klicken Sie dann leicht außerhalb der Mitte des Tableau-Bildes in Richtung der Differenz und warten Sie, bis ein neuer Satz von Fourier-Transformationen gesammelt wurde. Wiederholen Sie den Vorgang, bis die Fourier-Transformationen identisch sind.
HINWEIS: Jeder Tableau-Klick dauert einige Sekunden, und während dieser Zeit sollten keine weiteren Klicks getätigt werden.
- Navigieren Sie zu einem Bereich des Gitters, der klare Thon-Ringe erzeugt, z. B. Kohlenstoffsubstrat.
- Referenzen gewinnen
HINWEIS: Überspringen Sie diesen Abschnitt, wenn die Kamera über automatische Hardwarereferenzen verfügt.- Senden Sie im Knoten Navigation eine Voreinstellung mit niedriger Vergrößerung, z. B. gr, und navigieren Sie zu einem Bereich, in dem der Strahlengang nicht behindert wird.
- Vergewissern Sie sich, dass sich die Tischposition an einer Stelle befindet, die nicht durch den Strahlengang verdeckt wird, indem Sie ein Bild mit mittlerer Vergrößerung mit der Voreinstellung sq oder hln aufnehmen.
- Senden Sie die Voreinstellung mit hoher Vergrößerung an das Mikroskop.
- Wählen Sie in den Einstellungen des Korrekturknotens die richtigen Geräteinformationen aus und richten Sie die Kamerakonfiguration so ein, dass sie den Erfassungseinstellungen entspricht.
- Nehmen Sie ein dunkles Referenzbild auf, indem Sie die Säulenventile am Mikroskop schließen, wählen Sie dann im Knoten Korrektur die Option Dunkel und Beide Kanäle aus den Dropdown-Menüs oben aus und klicken Sie rechts auf die Schaltfläche Kamera erfassen .
- Wenn Sie fertig sind, wählen Sie Bright aus dem Dropdown-Menü aus und klicken Sie auf Acquire. Leginon öffnet die Säulenventile automatisch.
- Überprüfen Sie, ob die Verstärkung ordnungsgemäß erfasst wurde, indem Sie im Dropdown-Menü die Option Korrigiert auswählen, auf Erfassen klicken und das resultierende Bild beobachten.
- Referenzbild der Eisdicke
- Wenn das Mikroskop über einen Energiefilter verfügt, aktivieren Sie in den IceT-Knoteneinstellungen die Option Eisdickenbild erfassen, geben Sie 395 für den mittleren freien Weg ein und geben Sie die restlichen Werte für die Einrichtung ein.
- Wenn das Mikroskop nicht über einen Energiefilter verfügt, senden Sie im Knoten Navigation die enn-Voreinstellung an das Mikroskop und klicken Sie auf Erfassen. Notieren Sie sich den mittleren Pixelwert auf der linken Seite. Aktivieren Sie in den IceT-Knoteneinstellungen die Option Eisdicke aus aperturebegrenzter Streuung berechnen, geben Sie 1055 für den ALS-Koeffizienten und den gemessenen mittleren Pixelwert ein.
HINWEIS: Die Werte 395 und 1055 wurden für die TFS Krios bzw. Glacios bestimmt, wie zuvorbeschrieben 16, und müssen möglicherweise für verschiedene Mikroskopkonfigurationen neu kalibriert werden.
- Kalibrierung der Bilddosis
- Wählen Sie im Preset_Manager die enn-Voreinstellung aus und klicken Sie auf die Kameraschaltfläche (Dosisbild für die ausgewählte Voreinstellung erfassen). Überprüfen Sie die gemessene Dosis auf der Unterseite. Wenn er nahe am erwarteten Wert liegt (in der Regel zwischen 30 und 70), klicken Sie auf JA.
- Voreingestellte Ausrichtungen
- Überprüfen Sie im Preset_Manager alle Voreinstellungen für die hohe Vergrößerung (enn, fcn und fan), um sicherzustellen, dass die Bildverschiebung und die Strahlverschiebung 0, 0 sind.
- Navigieren Sie auf dem Mikroskopcomputer zu einem Kohlenstoffbereich.
- Erfassen Sie auf dem Leginon-Computer im Knoten Navigation ein Bild mit der Voreinstellung gr .
- Suchen Sie ein Objekt von Interesse und gehen Sie mit dem Cursor-Werkzeug zu diesem Ort.
- Nehmen Sie ein Bild mit der hln-Voreinstellung auf und verschieben Sie einen eindeutigen Teil dieses Objekts mit dem Cursorwerkzeug in die Mitte.
- Erfassen Sie ein Bild mit der Voreinstellung enn und verschieben Sie es mit dem Cursor-Werkzeug an denselben eindeutigen Teil des Objekts von Interesse.
- Wählen Sie Bildverschiebung aus dem Pulldown-Menü und nehmen Sie ein Bild mit der hln-Voreinstellung auf . Verschieben Sie mit dem Cursor-Werkzeug auf denselben eindeutigen Teil des Objekts von Interesse.
- Wählen Sie im Presets_Manager die hln-Voreinstellung aus, klicken Sie auf dieSchaltfläche s ettings und importieren Sie die Bildverschiebung aus der Navigation , indem Sie auf den linken grünen Pfeil neben den Bildverschiebungswerten klicken.
- Wiederholen Sie die Schritte 2.9.7 und 2.9.8 für die Voreinstellungen sq und gr .
- Gitter-Atlas
- Schließen Sie am Mikroskopcomputer die Säulenventile und ziehen Sie die Objektivblende ein. Wechseln Sie zum Knoten Grid_Targeting. Ändern Sie in den Einstellungen die Beschriftung des Rasters. Wählen Sie den gewünschten Radius des Atlas (der maximale Radius beträgt 0,0009 m). Klicken Sie auf OK. Klicken Sie dann oben auf die Schaltfläche Atlasrechner berechnen und klicken Sie auf die grüne Schaltfläche "Spielen" ("Ziele einreichen").
- Im Square_Targeting Knoten werden die Rasterbilder gesammelt und zu einem Atlas zusammengefügt. Vergrößern und verkleinern Sie das Dropdown-Menü und passen Sie Kontrast und Helligkeit an. Verwenden Sie die Bildlaufleisten , um sich durch das Raster zu bewegen.
- Sobald der Atlas gesammelt ist, setzen Sie die Objektivblende ein , falls gewünscht.
- Wenn das Mikroskop über einen Energiefilter verfügt, wählen Sie ein Referenzziel in der Mitte eines gebrochenen Quadrats aus, drücken Sie die Play-Taste und fahren Sie mit der ZLP-Ausrichtung im folgenden Unterabschnitt fort. Andernfalls überspringen Sie den ZLP-Ausrichtungsschritt.
- ZLP-Ausrichtung
- Wählen Sie in den Einstellungen des Align_ZLP Knotens die Stufenpositionaus, um das Referenzziel zu verschieben, und wählen Sie den Voreinstellungsmanager als Beweger aus. Deaktivieren Sie den Bypass-Conditioner und drücken Sie dann OK.
HINWEIS: Die ZLP-Ausrichtung sollte jetzt so konfiguriert werden, dass sich das Mikroskop regelmäßig zum Referenzziel bewegt und die ZLP-Ausrichtungsroutine der Kamera ausführt. ZLP-Neuausrichtungszeiten von 30 min bzw. 60 min sind für Gatan BioQuantum- bzw. TFS Selectris X-Energiefilter in der Regel sicher. Diese Werte variieren je nach Energiefilterbedingungen, einschließlich konstanter Luftfeuchtigkeit, konstanter Temperatur, elektromagnetischer Feldisolierung und Schwingungsisolierung.
- Wählen Sie in den Einstellungen des Align_ZLP Knotens die Stufenpositionaus, um das Referenzziel zu verschieben, und wählen Sie den Voreinstellungsmanager als Beweger aus. Deaktivieren Sie den Bypass-Conditioner und drücken Sie dann OK.
- Einrichtung der Bohrungsschablonenausrichtung
- Wählen Sie im Knoten Square_Targeting mehrere Erfassungsziele aus und drücken Sie dann auf Wiedergabe.
- Stellen Sie in den Einstellungen des Hole_Targeting Knotens sicher, dass Benutzerüberprüfung ausgewählter Ziele zulassen und Ziele in die Warteschlange einreihen aktiviert sind. Überprüfen Sie auch Überspringen Sie vorerst den automatischen Lochfinder . Klicken Sie auf Übernehmen und dann auf OK.
- Verwenden Sie im Hauptfenster Strg-Umschalt-Rechtsklick , um alle Ziele zu entfernen. Wählen Sie den Erfassungscursor aus und platzieren Sie die Ziele. Wählen Sie den Fokuscursor aus und platzieren Sie ein Fokusziel zwischen den Erfassungszielen. Klicken Sie auf Wiedergabe.
- Deaktivieren Sie für das nächste Hole_Targeting Bild die Option Automatischen Lochfinder überspringen in den Einstellungen, und klicken Sie dann auf Übernehmen und OK. Entfernen Sie die automatischen Ziele mit Strg-Umschalt-Rechtsklick.
- Wählen Sie das Linealwerkzeug aus und messen Sie den Durchmesser über eine Bohrung. Ändern Sie in den Schabloneneinstellungen den endgültigen Schablonendurchmesser in den gemessenen Bohrungsdurchmesser. Ändern Sie nicht den ursprünglichen Vorlagendurchmesser. Klicken Sie auf Testen. Wenn sich keine hellen Spitzen in der Mitte jeder Bohrung befinden, erhöhen Sie den endgültigen Schablonendurchmesser. Wenn Sie fertig sind, klicken Sie auf OK.
- Wählen Sie in den Schwellenwerteinstellungen einen Wert für A aus, der die Bohrungen einzeln segmentiert, wenn auf Test geklickt wird. Klicken Sie auf OK , wenn Sie zufrieden sind.
- Geben Sie in den Blobeinstellungen die Werte ein, und klicken Sie auf Testen. Der Wert für die maximale Anzahl von Blobs ist 1, sodass nur ein Blob angezeigt wird. Klicken Sie auf OK.
- Verwenden Sie in den Gittereinstellungen das Linealwerkzeug, um den Abstand zwischen zwei Bohrungen (Mitte zu Mitte) zu messen. Geben Sie den Wert in das Feld Abstand ein und klicken Sie auf Testen. Der eine Klecks wird zu einem Gitterpunkt. Klicken Sie auf OK.
- Gehen Sie zu den Erfassungseinstellungen und optimieren Sie die Erfassungsziele mithilfe von Eisdickenschwellenwerten und der Schaltfläche Zielerfassung testen. Erhalten Sie Informationen zur Eisdicke, indem Sie den Mauszeiger über die Gitterpunkte bewegen.
- Wenn die Erfassungsziele nicht zufriedenstellend sind, verwenden Sie das Linealwerkzeug , um den Abstand und den Winkel vom Gitterpunkt zur gewünschten Position für ein Erfassungsziel zu messen. Löschen Sie die vorherigen Punkte der Akquisitionszielvorlage. Klicken Sie auf Auto Fill, setzen Sie 4 für die Anzahl der Ziele und ändern Sie den Radius und den Winkel auf die gemessenen Werte. Klicken Sie auf OK. Aktivieren Sie Eisdickenschwellenwert auf schablonengefaltete Erfassungsziele anwenden.
- Wenn Sie mit den Gitterpunkten und den Eisdickenschwellenwerten zufrieden sind, klicken Sie auf die Schaltfläche Ziele senden .
- Wiederholen Sie einen der obigen Schritte nach Bedarf für jedes ausgewählte Quadrat. Übermitteln Sie die gesamte Warteschlange mit der Schaltfläche Ziele in der Warteschlange senden , sobald alle quadratischen Ziele übermittelt wurden.
- Leginon beginnt mit der Fokussierung und Abbildung jeder Gruppe von Zielen. Stellen Sie im Z_Focus Knoten sicher, dass die euzentrische Höhe richtig gefunden wird.
- Einrichtung des Exposure-Vorlagen-Targetings
- Im Knoten Belichtungsziel werden Bilder mit Lochvergrößerung angezeigt. Verwenden Sie Strg-Umschalt-Rechtsklick , um die automatischen Ziele zu entfernen.
- Messen Sie den Durchmesser eines Lochs mit dem Linealwerkzeug. Geben Sie in den Vorlageneinstellungen den Durchmesser in Endgültiger Vorlagendurchmesser ein und klicken Sie auf Testen. Ein Peak sollte sich nun in der Mitte jedes Lochs befinden. Passen Sie die Durchmesserwerte bei Bedarf an.
- Passen Sie in den Schwellenwerteinstellungen den A-Wert an, bis das binarisierte Testbild nur dort weiße Bereiche anzeigt, wo sich Löcher befinden.
- Klicken Sie in den Blobs-Einstellungen auf Testen. Ein Blob pro segmentiertem Loch sollte angezeigt werden. Vergrößern Sie den Rahmen , um die Blobs bei Bedarf von den Rändern des Bildes zu entfernen.
- Klicken Sie in den Gittereinstellungen auf Test. Passen Sie die Parameter an, bis alle Blobs zu Gitterpunkten geworden sind. Klicken Sie auf OK.
- Klicken Sie auf das Linealwerkzeug und messen Sie den Abstand zwischen zwei Gitterpunkten. Ändern Sie in den Gittereinstellungen den Abstand auf diesen Abstand.
- Bewegen Sie den Mauszeiger über jeden Gitterpunkt, um die mittlere Intensität, die mittlere Dicke, die Standardabweichungsintensität und die Standardabweichungsdicke anzuzeigen. Notieren Sie sich die Intensitäten für jeden Gitterpunkt und stellen Sie damit die gewünschten Eisdickenparameter in den Erfassungseinstellungen ein.
- Messen Sie den Abstand und den Winkel von einem Gitterpunkt bis zur Mitte von 4 Löchern mit dem Linealwerkzeug. Löschen Sie in den Aufnahmeeinstellungen die aktuellen Fokusziele. Klicken Sie auf AutoFill, und ändern Sie den Radius und den Winkel in die gemessenen Werte. Klicken Sie auf Targeting testen, klicken Sie auf OK und dann auf Ziele übermitteln.
HINWEIS: Leginon findet den euzentrischen Fokus (Fokusknoten) und sammelt Belichtungen, die im Belichtungsknoten angezeigt werden. - Sobald alle Ziele abgebildet sind, wechseln Sie zum Knoten Exposure_Targeting , um das nächste Bohrungsbild anzuzeigen. Deaktivieren Sie in den Einstellungen die Option Benutzerüberprüfung ausgewählter Ziele zulassen. Deaktivieren Sie außerdem Ziele in die Warteschlange einreihen und Automatischen Bohrungsfinder überspringen. Klicken Sie auf OK und dann auf Ziele senden.
HINWEIS: Leginon sammelt automatisch Bilder basierend auf den oben konfigurierten Einstellungen. Sehen Sie sich die Bilder und Metadaten in Appion an.
- Änderungen können während der automatisierten Erfassung vorgenommen werden. Ändern Sie beispielsweise jederzeit den Defokussierungsbereich der Sammlung, indem Sie die enn-Voreinstellung im Preset_Manager bearbeiten.
- Wenn die Sammlung gestoppt werden muss, beenden Sie die Warteschlange, indem Sie auf die Schaltflächen Abbrechen und Warteschlange abbrechen in den Knoten Bohrung und Belichtung klicken.
- Sobald die Sammlung abgeschlossen ist, gehen Sie zu Anwendung , klicken Sie auf Beenden, gehen Sie dann zu Datei , und klicken Sie auf Beenden.
2. Smart Leginon Autoscreen Verwendung
- Erstellen einer Smart Leginon Template-Sitzung
- Befolgen Sie die Anweisungen in Abschnitt 1, um Leginon zu starten.
- Gehen Sie zu Anwendung und klicken Sie auf Ausführen. Wählen Sie im Fenster Anwendung ausführen die Ptolemäus-Anwendung aus (wählen Sie bei Bedarf Alle anzeigen ). Stellen Sie main auf den Leginon-Computer und das Oszilloskop und die Kamera auf den jeweiligen Computer ein.
- Importieren Sie im Preset_Manager Voreinstellungen wie in Schritt 1.2.3 beschrieben.
- Konfigurieren Sie die Knoteneinstellungen.
- Stellen Sie sicher, dass in den Square_Targeting Knoteneinstellungen die Optionen Ziele nach kürzestem Pfad sortieren und Automatische Zieladressierung aktivieren aktiviert sind (Ergänzende Abbildung 1A).
- Stellen Sie sicher, dass in den Einstellungen für quadratische Knoten die Option Warten auf Knoten zur Verarbeitung des Bildes aktiviert ist. Fügen Sie die Quadrat-Voreinstellung aus dem Dropdown-Menü zur Liste auf der rechten Seite hinzu, falls sie noch nicht vorhanden ist. Aktivieren Sie in den erweiterten Einstellungen die Option Diese Blenden während der Aufnahme einstellen und stellen Sie sicher, dass die Werte für die beiden Blenden korrekt sind (Ergänzende Abbildung 1B).
- Aktivieren Sie in den Hole_Targeting-Knoteneinstellungen die Option Benutzerüberprüfung ausgewählter Ziele zulassen. Deaktivieren Sie Ziele in die Warteschlange einreihen und automatischen Bohrlochfinder überspringen (Ergänzende Abbildung 2A).
- Aktivieren Sie in der Einstellung Bohrungsknoten die Option Warten, bis ein Knoten das Bild verarbeitet hat, und die Bohrungsvoreinstellung befindet sich in der Liste auf der rechten Seite. Aktivieren Sie in den erweiterten Einstellungen die Option Diese Blenden während der Aufnahme einstellen und stellen Sie sicher, dass die Werte für die beiden Blenden korrekt sind (Ergänzende Abbildung 2B).
- Aktivieren Sie in den Einstellungen des Exposure_Targeting Knotens die Option Zulassen für die Benutzerüberprüfung ausgewählter Ziele. Deaktivieren Sie Ziele in die Warteschlange und automatischen Bohrlochfinder überspringen (Ergänzende Abbildung 3A).
- Stellen Sie in den Einstellungen des Belichtungsknotens sicher, dass Warten auf einen Knoten zur Verarbeitung des Bildes deaktiviert ist, die Belichtungsvoreinstellung rechts aufgeführt ist, und aktivieren Sie in den erweiterten Einstellungen die Option Diese Blenden während der Aufnahme einstellen und stellen Sie sicher, dass die Werte für die beiden Blenden korrekt sind (Ergänzende Abbildung 3B).
- Stellen Sie sicher, dass in den Einstellungen des Fokusknotens die Option Warten auf die Verarbeitung des Bildes durch einen Knoten deaktiviert ist, die Voreinstellung Autofokus auf der rechten Seite aufgeführt ist und die gewünschte Autofokusgenauigkeit auf 4 x 10-6 m eingestellt ist (Ergänzende Abbildung 4A).
- Aktivieren Sie im Fokusknoten Fokussequenz (neben der Einstellungstaste) nur zwei Strahlneigungs-Autofokusschritte (Ergänzende Abbildung 4B,C).
- Stellen Sie in den Einstellungen für Z_Focus Knoten sicher, dass die Option Warten auf die Verarbeitung des Bildes durch einen Knoten deaktiviert ist, die Voreinstellung Bohrung auf der rechten Seite aufgeführt ist und die gewünschte Autofokusgenauigkeit 5 x 10-5 m beträgt (Ergänzende Abbildung 5A).
- Aktivieren Sie im Z_Focus Knoten Fokussequenz nur zwei Neigungsstufen mit geringer Vergrößerung (Ergänzende Abbildung 5B,C).
- Bestimmen Sie die Z-Höhe des Rasters wie in Schritt 1.2.4 beschrieben.
- Sammeln Sie einen Atlas wie in Schritt 1.2.10 beschrieben.
- Richten Sie quadratische Suchparameter ein.
- Sobald der Atlas eingesammelt wurde, lokalisiert Ptolemäus Quadrate im Square_Targeting Knoten. Jedes Quadrat zeigt einen blauen Kreis, der als Blob bezeichnet wird. Wenn Leginon mit der Maus über jeden Blob fährt, meldet er seine Größe, wie sie von Ptolemäus berechnet wurde. Notieren Sie sich die größten und kleinsten Blobs.
- Ändern Sie in den Einstellungen für Schwellenwerte den minimalen und maximalen Filterbereich , um erwünschte Quadrate einzuschließen und unerwünschte Quadrate auszuschließen.
- Klicken Sie auf die Schaltfläche Quadrate suchen in der oberen Symbolleiste. Passen Sie den Filterbereich an, bis "Quadrate suchen" gut ausgerichtet ist.
- Wählen Sie in den Akquisitionseinstellungen Werte für Max. Anzahl der Ziele und Anzahl der zu beprobenden Zielgruppe. Diese Parameter definieren, wie viele Quadrate und Gruppen von Quadraten als Ziel verwendet werden.
- Wenn Sie mit den Parametern zufrieden sind, klicken Sie auf die Schaltfläche Wiedergabe . Ein Beispiel für einen Atlas nach der Einrichtung ist in der ergänzenden Abbildung 6 dargestellt.
- Richten Sie die Parameter für den Bohrungsfinder ein.
- Verwenden Sie im Hole_Targeting Knoten das Linealwerkzeug , um den Durchmesser einer Bohrung zu messen.
- Geben Sie in den Vorlageneinstellungen den Durchmesser in Endgültiger Vorlagendurchmesser ein und klicken Sie auf Testen. Passen Sie den Durchmesser an, bis alle Löcher helle weiße Spitzen in der Mitte haben.
- Klicken Sie in den Schwellenwerteinstellungen auf Test. Passen Sie den A-Wert an, bis das binarisierte Bild weiße Bereiche nur dort anzeigt, wo sich Löcher befinden.
- Wählen Sie in den Blobs-Einstellungen aus, dass Rahmenziele ausgeschlossen werden sollen, indem Sie mit dem Lineal einen Mindestabstand von der Kante bestimmen und diesen Wert eingeben. Blobs können nach ihrer Größe, Rundheit und Anzahl gefiltert werden. Bewegen Sie den Mauszeiger über Blobs, um ihre Werte anzuzeigen. Klicken Sie auf Testen , um die aktuellen Werte zu überprüfen.
- Geben Sie in den Gittereinstellungen den Radius der Löcher und den Abstand zwischen den Löchern ein (verwenden Sie das Messwerkzeug) und klicken Sie dann auf die Schaltfläche 42 , um den Referenzintensitätswert eines Vakuumbereichs (leeres Loch oder gebrochene Stützfolie) zu messen.
- Aktivieren Sie in den Erfassungseinstellungen die Option Teilmenge der Erfassungsziele verwenden , und legen Sie den Stichprobenmaximalwert auf eine kleine Zahl fest, z. B. 2. Legen Sie einen breiten Bereich von Eisdickenmittelwerten und Standardabweichungen fest (messen Sie diese Werte, indem Sie den Mauszeiger über die Ziele bewegen). Klicken Sie auf Targeting testen , um die Zielauswahl anhand der oben genannten Werte zu randomisieren.
- Klicken Sie auf die Schaltfläche Wiedergabe , wenn Sie mit allen Einstellungen zufrieden sind. Leginon führt Stufe Z_Focus aus und sammelt das erste Ziel ein. Ein Beispielbild nach der Einrichtung ist in der ergänzenden Abbildung 7 dargestellt.
- Richten Sie Exposure-Targeting-Parameter ein.
- Stellen Sie in den Locheinstellungen das Shell-Skript auf den hl_finding.sh Skriptpfad in der Ptolemäus-Installation ein. Legen Sie die zu akzeptierende Mindestpunktzahl auf ≤0 fest. Geben Sie den Radius der Löcher ein (verwenden Sie das Messwerkzeug) und klicken Sie dann auf die Schaltfläche 42 , um den Referenzintensitätswert eines Vakuumbereichs (leeres Loch oder gebrochene Stützfolie) zu messen. Klicken Sie auf Testen , um das Gitter der Bohrungen zu finden.
- Aktivieren Sie in den Erfassungseinstellungen die Option Teilmenge der Erfassungsziele verwenden, und legen Sie den Stichprobenmaximalwert auf eine kleine Zahl fest, z. B. 4, um eine Teilmenge von Bohrungen für das Screening zu sammeln. Legen Sie einen breiten Bereich von Eisdickenmittelwerten und Standardabweichungen fest (messen Sie diese Werte, indem Sie den Mauszeiger über die Ziele bewegen).
- Klicken Sie auf die Schaltfläche Wiedergabe , wenn Sie mit allen Einstellungen zufrieden sind. Leginon führt einen euzentrischen Fokus durch und sammelt Bilder mit hoher Vergrößerung, die im Belichtungsknoten zu sehen sind. Ein Beispielbild nach der Einrichtung ist in der ergänzenden Abbildung 8 dargestellt.
- Überprüfen Sie das nächste Exposure_Targeting Bild, um zu sehen, ob die obigen Einstellungen noch ausreichend sind. Wenn Sie zufrieden sind, deaktivieren Sie die Option Benutzerüberprüfung ausgewählter Ziele zulassen in den Einstellungen für Belichtungs-Targeting und Bohrungs-Targeting.
HINWEIS: Die Überprüfung sollte jetzt für das aktuelle Raster unbeaufsichtigt ausgeführt werden. Diese Sitzung wird als Vorlagensitzung für alle Raster verwendet.
- Sobald das Raster überprüft wurde, klicken Sie auf Datei > Beenden , um Leginon zu schließen.
- Smart Leginon Autoscreen einrichten
- Führen Sie in einem Terminalfenster die autoscreen.py von Smart Leginon aus.
- Wählen Sie die GUI aus, geben Sie eine durch Kommas getrennte Liste von Raster-Slots für den Bildschirm ein, geben Sie full für den Workflow ein, geben Sie den Namen der Vorlagensitzung ein , auf der neue Sitzungen basieren sollen (diese finden Sie im Appion-Imageviewer), und geben Sie den Z-Höhenwert der Vorlagensitzung ein (Ergänzende Abbildung 9).
- Es öffnet sich eine GUI, in der Sie den Sitzungsnamen für jedes Raster eingeben und die entsprechenden Projektzuordnungen auswählen können (Ergänzende Abbildung 10).
HINWEIS: Smart Leginon Autoscreen verwendet jetzt die Vorlagensitzungseinstellungen, um jedes Raster automatisch zu überprüfen und unbeaufsichtigt zwischen den Rastern zu wechseln. - Verfolgen Sie die Sammlung in Leginon, Appion und am Mikroskopcomputer oder lassen Sie das Mikroskop völlig unbeaufsichtigt.
HINWEIS: Sobald alle Raster abgeschirmt sind, schließt Smart Leginon die Säulenventile am Mikroskop.
Ergebnisse
Gemäß dem Protokoll können KryoEM-Screening-Sitzungen für die Mehrheit (80%-90%) der löchrigen Gitter und Bedingungen automatisch und erfolgreich durchgeführt werden. Mehrere Beispiele und Experimente wurden bereits vorgestellt 8,9, um die erwarteten Ergebnisse erfolgreicher Smart Leginon Autoscreen-Sitzungen zu demonstrieren. Eine erfolgreiche Autoscreen-Sitzung beginnt mit ~10 Minuten Einrichtung und führt in der Regel zu einer vollen Kassette mit 12 Rastern, die nach etwa 6 Stunden (30 Minuten pro Raster) automatisch gerastert werden, wobei 3-5 Quadrate unterschiedlicher Größe und 3-5 Löcher pro Quadrat bei hoher Vergrößerung abgebildet werden, so dass der Benutzer die Eigenschaften der Probe auf jedem Raster schnell bestimmen und schnell durch die Proben-/Rasterbedingungen iterieren kann (Abbildung 3). Gelegentlich sind Sitzungen nicht erfolgreich, häufig weil Autoscreen auf gebrochene Quadrate abzielt, große Eisdickengradienten über das Gitter oder über Quadrate nicht richtig interpretiert oder Löcher in Kohlenstoffgittern nicht richtig identifiziert. Darüber hinaus können potenzielle Speicherlecks dazu führen, dass Leginon aufgrund übermäßiger Speicherauslastung abstürzt, was durch Freigeben von RAM oder Neustart des Computers behoben oder durch Hinzufügen von mehr RAM zum Computer verbessert werden kann.
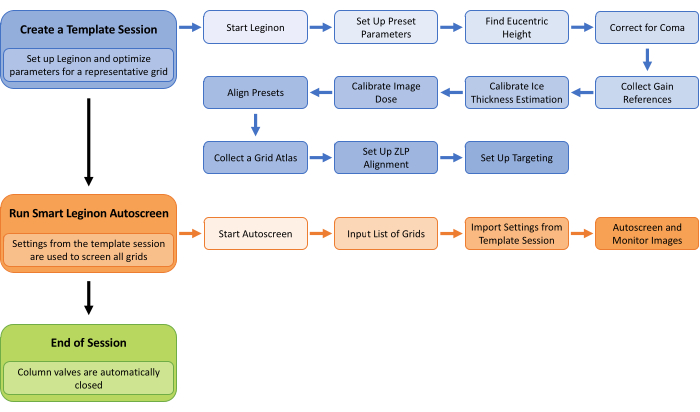
Abbildung 1: Smart Leginon Autoscreen-Workflow. Ein allgemeiner Überblick über den Smart Leginon Autoscreen-Workflow. Zunächst wird ein Vorlagenprogramm erstellt, indem Parameter für ein repräsentatives Raster im Stapel der zu prüfenden Raster ausgewählt werden. Das Einrichten von Leginon und das Erstellen einer Vorlagensitzung dauert weniger als 45 Minuten. Zweitens ist Autoscreen so eingerichtet, dass es die Template-Session-Parameter verwendet, um alle Raster in der Kassette zu screenen. Das Einrichten von Autoscreen dauert weniger als 10 Minuten. Schließlich beendet Autoscreen die Screening-Sitzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
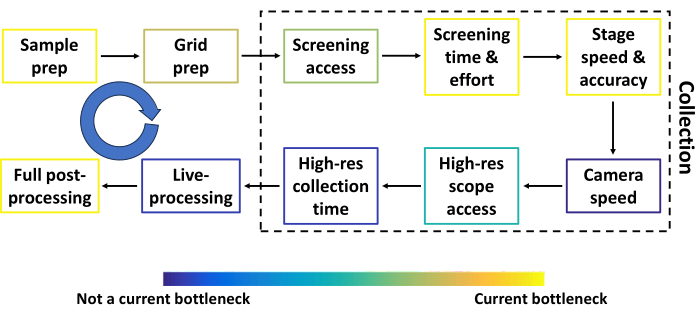
Abbildung 2: Konventionelle Einzelpartikel-Kryo-EM-Pipeline vor dem automatisierten Screening. Die häufigsten Schritte in der konventionellen Einzelpartikel-KryoEM-Pipeline vor dem automatisierten Screening, zusammen mit Komponenten, die verbessert werden können. Jeder Schritt ist eingefärbt, um ungefähr zu veranschaulichen, wie groß der Engpass des Schritts im Vergleich zu anderen ist. Der blaue kreisförmige Pfeil stellt mehrere Feedbackschleifen zwischen den meisten Schritten dar. Der Durchsatz in mehreren Schritten hängt stark von der Probe, der Finanzierung und dem Standort des Forschers ab. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Repräsentative Smart Leginon Autoscreen-Ergebnisse. Repräsentative Multi-Scale-Bilder nach dem Smart Leginon Autoscreen-Protokoll, aufgenommen auf einem TFS Krios cryoTEM mit einem BioQuantum-Energiefilter und einer K3-Kamera. (A) Ein zusammengesetztes "Atlas"-Bild, das einen Überblick über ein KryoEM-Gitter zeigt. (B-F) Bilder mit mehreren Maßstäben von den angegebenen Positionen im Gitteratlas. Bilder mit geringer Vergrößerung in der ersten Reihe, Bilder mit mittlerer Vergrößerung in der zweiten Reihe und Bilder mit hoher Vergrößerung in der dritten Reihe wurden jeweils automatisch ausgewählt, um Informationen über die Probe von dünnen bis dicken Eisquadraten zu erhalten. Die von Leginon geschätzte Eisdicke ist unten dargestellt. Die Maßstabsbalken betragen 500 μm in (A) und 10 μm für die erste Reihe, 5 μm für die zweite Reihe und 100 nm für die dritte Reihe für (B-F). Diese Abbildung wurde mit Genehmigung von Cheng et al.8 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| gr: Gitter | Quadrat: Quadrat | hln: Loch | Lüfter: Autofokus | fcn: Zentraler Fokus | enn: Belichtung | |
| Vergrößerung | 210 | 2600 | 6700 | 120000 | 120000 | 120000 |
| Defokussierung | -0.0002 | -0.00015 | -0.00015 | -2 x 10-06 cm | -7 x 10-07 | -2,5 x 10-06 cm |
| Spot-Größe | 5 | 5 | 4 | 2 | 2 | 2 |
| Intensität | 1.1 | 0.83 | 0.65 | 0.44 | 0.44 | 0.45 |
| Dimension | 1024 x 1024 cm | 1024 x 1024 cm | 1024 x 1024 cm | 1024 x 1024 cm | 1024 x 1024 cm | 4096 x 4096 cm |
| Offset | 0, 0 | 0, 0 | 0, 0 | 0, 0 | 512, 512 | 0, 0 |
| Binning | 4 x 4 Stück | 4 x 4 Stück | 4 x 4 Stück | 4 x 4 Stück | 2 x 2 | 1 x 1 |
| Belichtungszeit (ms) | 200 | 500 | 500 | 500 | 500 | 1000 |
| Vorbelichtung(en) | 0 | 0 | 0 | 0 | 0 | 0 |
| Dosis (e/Å2) | -- | -- | -- | 36.5 | 36.5 | 64.7 |
| Speichern von Rohbildern | Nein | Nein | Nein | Nein | Nein | Ja |
Tabelle 1: Voreingestellte Parameter für das KryoEM-Gitter-Screening am Simons Electron Microscopy Center (SEMC) unter Verwendung eines Glacios cryoTEM mit einer Falcon 3EC-Kamera. Parameter für jedes Preset, das üblicherweise auf einem Glacios cryoTEM mit einer Falcon 3EC-Kamera am SEMC verwendet wird, werden angezeigt. Verschiedene Mikroskope haben unterschiedliche Vergrößerungen zur Verfügung und verschiedene Experimente verwenden unterschiedliche Parameter wie Unschärfe und Belichtungszeit.
| gr: Gitter | Quadrat: Quadrat | hln: Loch | Lüfter: Autofokus | fcn: Zentraler Fokus | enn: Belichtung | |
| Vergrößerung | 64 | 1700 | 2850 | 75000 | 75000 | 75000 |
| Defokussierung | 0 | -5 x 10-05 cm | -5 x 10-05 cm | -1 x 10-06 cm | -7 x 10-07 | -2 x 10-06 cm |
| Spot-Größe | 6 | 9 | 9 | 6 | 6 | 7 |
| Intensität | 0.001 | 1,65 x 10-05 cm | 1,5 x 10-05 cm | 4,3 x 10-07 cm | 4,3 x 10-07 cm | 5,5 x 10-07 cm |
| Breite des Energiefilters | -- | -- | -- | 20 | 20 | 20 |
| Dimension | 1024 x 1024 cm | 1024 x 1024 cm | 1024 x 1024 cm | 1024 x 1024 cm | 2048 x 2048 cm | 4096 x 4096 cm |
| Offset | 0, 0 | 0, 0 | 0, 0 | 0, 0 | 0, 0 | 0, 0 |
| Binning | 4 x 4 Stück | 4 x 4 Stück | 4 x 4 Stück | 4 x 4 Stück | 2 x 2 | 1 x 1 |
| Belichtungszeit (ms) | 500 | 2000 | 1000 | 500 | 300 | 8700 |
| Vorbelichtung(en) | 0 | 0 | 0 | 0 | 0 | 0 |
| Dosis (e/Å2) | -- | -- | -- | -- | -- | 47.4 |
| Speichern von Rohbildern | Nein | Nein | Nein | Nein | Nein | Ja |
Tabelle 2: Voreingestellte Parameter für das KryoEM-Gitterscreening am SEMC mit einem Krios cryoTEM mit einer Selectris X- und Falcon 4i-Kamera. Parameter für jedes Preset, das üblicherweise auf einem Krios mit einem Selectris X-Energiefilter und einer Falcon 4i-Kamera am SEMC verwendet wird, werden angezeigt. Verschiedene Mikroskope haben unterschiedliche Vergrößerungen zur Verfügung und verschiedene Experimente verwenden unterschiedliche Parameter wie Unschärfe und Belichtungszeit.
| gr: Gitter | Quadrat: Quadrat | hln: Loch | Lüfter: Autofokus | fcn: Zentraler Fokus | enn: Belichtung | |
| Vergrößerung | 1550 | 940 | 2250 | 81000 | 81000 | 81000 |
| Defokussierung | 0 | -5 x 10-05 cm | -5 x 10-05 cm | -1 x 10-06 cm | -7 x 10-07 | -2 x 10-06 cm |
| Spot-Größe | 4 | 8 | 7 | 6 | 6 | 6 |
| Intensität | 0.0015 | 0.00017 | 7,3 x 10-05 cm | 1,3 x 10-06 cm | 1,3 x 10-06 cm | 9,2 x 10-07 cm |
| Breite des Energiefilters | -- | -- | 50 | 20 | 20 | 20 |
| Dimension | 1024 x 1024 cm | 1440 x 1024 cm | 1440 x 1024 cm | 1440 x 1024 cm | 1008 x 1008 cm | 5760 x 4092 cm |
| Offset | 0, 0 | 0, 0 | 0, 0 | 0, 0 | 936, 519 | 0, 0 |
| Binning | 4 x 4 Stück | 8 x 8 Stück | 8 x 8 Stück | 8 x 8 Stück | 4 x 4 Stück | 2 x 2 |
| Belichtungszeit (ms) | 250 | 600 | 600 | 500 | 500 | 2100 |
| Vorbelichtung(en) | 0 | 0 | 0 | 0 | 0 | 0 |
| Dosis (e/Å2) | -- | -- | -- | -- | -- | 51 |
| Speichern von Rohbildern | Nein | Nein | Nein | Nein | Nein | Ja |
Tabelle 3: Voreingestellte Parameter für das KryoEM-Grid-Screening am SEMC mit einem Krios cryoTEM mit einer BioQuantum- und K3-Kamera. Parameter für jedes Preset, das üblicherweise auf einem Krios mit einem BioQuantum-Energiefilter und einer K3-Kamera am SEMC verwendet wird, werden angezeigt. Verschiedene Mikroskope haben unterschiedliche Vergrößerungen zur Verfügung und verschiedene Experimente verwenden unterschiedliche Parameter wie Unschärfe und Belichtungszeit.
Ergänzende Abbildung 1: Quadratische Zieleinstellungen und quadratische Einstellungen für Smart Leginon. (A) Square Targeting-Einstellungen. (B) Quadratische Einstellungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Bohrungszieleinstellungen und Bohrungseinstellungen für Smart Leginon. (A) Einstellungen für das Bohrloch-Targeting. (B) Bohrungseinstellungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Einstellungen für das Belichtungsziel und die Belichtungseinstellungen für Smart Leginon. (A) Einstellungen für das Belichtungs-Targeting. (B) Belichtungseinstellungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: Fokuseinstellungen und Fokussequenzeinstellungen für Smart Leginon. (A) Fokuseinstellungen. (B) Einstellungen für die Fokussequenz (Defocus1). (C) Einstellungen für die Fokussequenz (Defokus 2). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 5: Z_Focus Einstellungen und Z_Focus Sequenzeinstellungen für Smart Leginon. (A) Z_Focus Einstellungen. (B) Z_Focus Sequenzeinstellungen (Stage_Tilt_Rough). (C) Z_Focus Sequenzeinstellungen (Stage_Tilt_Fine). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 6: Ein Beispielatlas nach der Einrichtung von Smart Leginon Square_Targeting Parametern. Blaue Kreise sind Kleckse, grüne Pluszeichen sind Erfassungsorte und das braune "x" ist der aktuelle Standort der Phase. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 7: Ein Beispielatlas nach dem Einrichten von Smart Leginon Hole_Targeting Parametern. Lila Pluszeichen sind Gitterstandorte, grüne Pluszeichen mit Kästchen sind Erfassungsorte und das blaue Pluszeichen ist der Fokusstandort. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 8: Ein Beispielatlas nach dem Einrichten von Smart Leginon Exposure_Targeting Parametern. Blaue Kreise sind Kleckse, grüne Pluszeichen sind Aufnahmeorte und das blaue Pluszeichen ist der Fokusort. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 9: Einrichtung des Smart Leginon Autoscreen-Terminals. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 10: Einrichtung der Smart Leginon Autoscreen-GUI. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Protokoll beschreiben wir die Pipeline für Smart Leginon Autoscreen und zusätzlich die grundlegende Leginon-Nutzung für diejenigen, die neu in der Erfassungssoftware sind. Die Einzelpartikel-Kryo-EM wird bis Ende 2024 die produktivste dreidimensionale (3D) Technik zur Auflösung von Proteinstrukturen sein17. Die Einzelpartikel-KryoEM-Pipeline besteht aus mehreren Schritten, die ständig optimiert werden, um die Datenqualität und den Durchsatz zu erhöhen. Abbildung 2 zeigt die häufigsten Schritte (Probenvorbereitung, Gittervorbereitung, Screening-Zeit und -Aufwand, hochauflösende Entnahmezeit, Live-Verarbeitung und vollständige Nachbearbeitung) zusammen mit anderen Komponenten der Pipeline, die verbessert werden können (Zugang zum Screening-Mikroskop, Tischgeschwindigkeit und -genauigkeit, Kamerageschwindigkeit und Zugang zum hochauflösenden Mikroskop). Die Ergebnisse der meisten Schritte werden zu Rückkopplungsschleifen in die vorherigen Schritte (blaue Pfeile in Abbildung 2), wodurch die gesamte Pipeline stark voneinander abhängig wird. Jeder Schritt in Abbildung 2 ist eingefärbt, um ungefähr zu veranschaulichen, wie groß der Engpass des Schritts im Vergleich zu anderen ist. Smart Leginon Autoscreen reduziert den Zeit- und Arbeitsaufwand für das Screening von 12 Rastern erheblich von 6 Stunden auf weniger als 10 Minuten, wodurch dieser Engpass beseitigt und eine schnellere Rückmeldung an die Proben-/Gittervorbereitung ermöglicht wird (Abbildung 3).
Das Protokoll enthält mehrere kritische Schritte, die in Abbildung 1 dargestellt sind. Es ist wichtig, dass das Raster, das zum Erstellen der Vorlagensitzung verwendet wird, repräsentativ für die verbleibenden Raster ist, die überprüft werden sollen. Wichtig ist, dass Leginon alle Einstellungen im gesamten Einrichtungsprozess zum Erstellen einer Vorlagensitzung speichert (blaue Schritte in Abbildung 1), wodurch wiederkehrende Vorlagensitzungen jedes Mal schneller eingerichtet werden können. Beim Erstellen einer Vorlagensitzung ist der wichtigste Schritt die Einrichtung des Targetings bei allen Vergrößerungen, damit die Parameter und Schwellenwerte die erwartete Streuung über die zu prüfenden Raster widerspiegeln. Die verschiedenen "Test"-Schaltflächen sorgen für Effizienz bei diesem Einrichtungsprozess. Während einer Autoscreen-Sitzung ist es wichtig, die ersten Raster in Appion zu überwachen, um Probleme schnell zu erkennen und sie so schnell wie möglich in Leginon zu beheben.
Der typische Arbeitsablauf bei SEMC besteht darin, Autoscreen-Daten in CryoSPARC Live18 einzuspeisen und diese zusätzlichen Informationen zu verwenden, um die Rückkopplungsschleifen in die Proben-/Gittervorbereitung zu informieren. Während intensiver KryoEM-Optimierungstage für Forscher und Betreiber werden Informationen über die Proben- und Gitterbedingungen in die Proben- und Gittervorbereitung zurückgeführt, während Autoscreen noch Gitter durchleuchtet. Dadurch können mehrere Dutzend Gitter pro Woche eingefroren und gesiebtwerden 8.
Smart Leginon Autoscreen funktioniert für die Mehrheit (80%-90%) der löchrigen Gitter und Bedingungen, die bei SEMC beobachtet werden. Die restlichen 10%-20% der Gitter umfassen solche, die manchmal nicht gut funktionieren - Gitter mit minimalem Kontrastunterschied zwischen Löchern und Substrat; Raster mit kleineren Löchern und Abständen (z. B. 0,6/0,8) - und Raster, bei denen das Zielen über mehrere Raster oft unpraktisch ist - Spotiton/Chamäleon 19,20-Raster, die aus Probenstreifen über das Raster bestehen; Spitzengitter. Beachten Sie, dass sich die Tilted Grid-Sammlung mit Autoscreen in der Entwicklung befindet, aber noch nicht verfügbar ist. Es kann möglich sein, das Protokoll so zu modifizieren, dass es mit Spotiton/Chamäleon-Gittern arbeitet, indem man zuerst Bereiche des Streifens manuell abbildet, um enge Parameterschwellenwerte zu bestimmen, dann versucht, größere bzw. kleinere Quadrate in Schritt 2.1.7.4 zu gruppieren, und dann Ziele aus der Gruppe mit Eis auswählt. Das Ziel dieser Modifikation ist es, dass Smart Leginon leere und nicht leere Quadrate in zwei Gruppen aufteilt. Wenn Parameter gefunden werden, erstrecken sie sich möglicherweise nicht gut auf die verbleibenden Raster, die überprüft werden sollen. Es kann auch möglich sein, das Protokoll so zu modifizieren, dass es mit Spitzengittern funktioniert, indem Sie das hl_finding.sh-Skript in Schritt 2.1.9.1 entfernen und die Parameter so konfigurieren, dass sie wie gewünscht auf hellere/dunklere Bereiche abzielen. Die Erfolgsrate dieser Modifikation kann von Gitter zu Gitter variieren, je nach Eisdicke und Gittermaterial.
Eine Fehlerbehebung während einer Autoscreen-Sitzung ist möglich und manchmal angebracht. Änderungen an voreingestellten (z. B. Defokussierung) und Zielparametern (z. B. Schwellenwerte für das Bohrlochziel) können während der automatischen Erfassung vorgenommen werden. Während eine Autoscreen-Sitzung gesammelt wird, kann eine Grid-Sitzung nicht abgebrochen werden, da sie autoscreen.py beendet. Die Abbruch-Schaltflächen in den Zielknoten können jedoch verwendet werden, um einen beliebigen Teil eines Rasters oder ein ganzes Raster zu überspringen. Gelegentlich kann autoscreen.py zu viel Speicher verbrauchen und einfrieren, was zwei Optionen bietet: "Beenden erzwingen" oder "Warten". Wenn "Beenden erzwingen" ausgewählt ist, wird das gesamte Skript beendet, sodass der Benutzer das Skript erneut ausführen muss, um es auf die verbleibenden Raster zur Überprüfung anzuwenden. Wenn "Warten" ausgewählt ist, wird das Skript fortgesetzt, und die Einstellungen können geändert werden, um zukünftiges Einfrieren zu verhindern, z. B. das Ausschalten der Bildanzeige im Belichtungsknoten, das Verringern der Pixelgröße im Atlas oder das Ausführen eines Skripts zum Löschen des Speichers. Wenn das Programm einfriert, ohne die beiden Optionen anzubieten, werden Speicherfehler möglicherweise nicht von selbst behoben, was zu einer Pause bei der Erfassung führt. Die Option "Beenden erzwingen" kann in diesem Fall nützlich sein.
Smart Leginon Autoscreen wird regelmäßig bei SEMC eingesetzt. Da die Engpässe in der Einzelpartikel-KryoEM-Pipeline weiter reduziert werden, wird die Einführung von KryoEM weiter zunehmen, um biologische Fragen zu beantworten. Dieses Protokoll ist ein Schritt in Richtung Optimierung der gesamten Pipeline, indem es einen klaren Weg zur deutlichen Reduzierung von Rückkopplungsschleifen bietet.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Einige dieser Arbeiten wurden am Simons Electron Microscopy Center am New York Structural Biology Center mit Unterstützung der Simons Foundation (SF349247), des NIH (U24 GM129539) und der NY State Assembly durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Glacios cryoTEM | Thermo Fisher Scientific | GLACIOSTEM | FEG, 200 keV, Falcon 3EC camera |
| Krios cryoTEM | Thermo Fisher Scientific | KRIOSG4TEM | XFEG, 300 keV, Gatan BioQuantum energy filter, Gatan K3 camera |
| Leginon | Simons Electron Microscopy Center | http://leginon.org | |
| Ptolemy | Simons Machine Learning Center | https://github.com/SMLC-NYSBC/ptolemy |
Referenzen
- Noble, A. J., et al. Routine single particle CryoEM sample and grid characterization by tomography. eLife. 7, e34257 (2018).
- Weissenberger, G., Henderikx, R. J. M., Peters, P. J. Understanding the invisible hands of sample preparation for cryo-EM. Nature Methods. 18 (5), 463-471 (2021).
- Carragher, B., et al. Current outcomes when optimizing 'standard' sample preparation for single-particle cryo-EM. Journal of Microscopy. 276 (1), 39-45 (2019).
- Kampjut, D., Steiner, J., Sazanov, L. A. Cryo-EM grid optimization for membrane proteins. iScience. 24 (3), 102139 (2021).
- Suloway, C., et al. Automated molecular microscopy: The new Leginon system. Journal of Structural Biology. 151 (1), 41-60 (2005).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Koh, A., et al. Routine collection of high-resolution cryo-EM datasets using 200 KV transmission electron microscope. Journal of Visualized Experiments. 181, 63519 (2022).
- Cheng, A., et al. Fully automated multi-grid cryoEM screening using Smart Leginon. IUCrJ. 10 (1), 77-89 (2023).
- Kim, P. T., Noble, A. J., Cheng, A., Bepler, T. Learning to automate cryo-electron microscopy data collection with Ptolemy. IUCrJ. 10 (1), 90-102 (2023).
- Bepler, T., et al. Smart data collection for CryoEM. Journal of Structural Biology. 214 (4), 107913 (2022).
- Bouvette, J., Huang, Q., Riccio, A. A., Copeland, W. C., Bartesaghi, A., Borgnia, M. J. Automated systematic evaluation of cryo-EM specimens with SmartScope. eLife. 11, e80047 (2022).
- Deng, Y., Grollios, F., Kohr, H., van Knippenberg, B., Janus, M., Caglar, F. Smart EPU: SPA Getting Intelligent. Microscopy and Microanalysis. 27 (S1), 454-455 (2021).
- Fan, Q., et al. CryoRL: Reinforcement learning enables efficient cryo-EM data collection. arXiv. , (2022).
- Li, Y., et al. Optimized path planning surpasses human efficiency in cryo-EM imaging. bioRxiv. Biophysics. , (2022).
- Lander, G. C., et al. Appion: An integrated, database-driven pipeline to facilitate EM image processing. Journal of Structural Biology. 166 (1), 95-102 (2009).
- Rice, W. J., et al. Routine determination of ice thickness for cryo-EM grids. Journal of Structural Biology. 204 (1), 38-44 (2018).
- Russo, C. J. The potential for seeing molecules in cells, CZ Imaging Institute's Hardware Frontiers for CryoET Workshop. CZ Imaging Institute's Hardware Frontiers for CryoET Workshop. , (2023).
- Punjani, A., Rubinstein, J. L., Fleet, D. J., Brubaker, M. A. cryoSPARC: algorithms for rapid unsupervised cryo-EM structure determination. Nature Methods. 14 (3), 290-296 (2017).
- Budell, W. C., Allegri, L., Dandey, V., Potter, C. S., Carragher, B. Cryo-electron microscopic grid preparation for time-resolved studies using a novel robotic system, Spotiton. Journal of Visualized Experiments. 168, 62271 (2021).
- Darrow, M. C., Booth, T., Moore, J. P., Doering, K., Thaw, P., King, R. S. Enabling a paradigm shift in CryoEM sample preparation with chameleon. Microscopy and Microanalysis. 27 (S1), 524-525 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten